MeJA处理对蓝莓果实采后灰霉病的影响及机理
2016-12-06黄晓杰韩媛媛高嘉悦
黄晓杰,李 婧,柴 媛,韩媛媛,高嘉悦
(锦州医科大学食品科学与工程学院,辽宁 锦州 121001)
MeJA处理对蓝莓果实采后灰霉病的影响及机理
黄晓杰,李 婧,柴 媛,韩媛媛,高嘉悦
(锦州医科大学食品科学与工程学院,辽宁 锦州 121001)
以“埃利奥特”蓝莓果实为实验材料,研究茉莉酸甲酯(methyl jasmonate,MeJA)处理对蓝莓果实灰霉病、活性氧代谢酶、防御相关酶活性和总酚、总花色苷含量的影响。50 µmol/L MeJA处理蓝莓果实后刺孔接种Botrytis cinerea孢子悬浮液,于(1±1) ℃贮藏16 d。结果表明,MeJA处理有效抑制果实发病率和过氧化氢酶、抗坏血酸过氧化物酶活性,促进贮藏初期果实H2O2的迅速积累,提高果实防御相关酶苯丙氨酸解氨酶、过氧化物酶和多酚氧化酶活性,促进酚类、木质素等植保素类物质的合成。表明MeJA处理可提高蓝莓果实抗病性,从而有效抑制了果实灰霉病的发生。
茉莉酸甲酯;活性氧代谢;防御相关酶;抗病性;灰霉病
蓝莓果实成熟于高温多雨季节,采后果实蒂痕部极易受到病原菌的侵染而发生腐败[1]。采后蓝莓果实的腐败常见由Botrytis cinerea引起的灰霉病,由Colletotrichum acutatum引起的炭疽病和由Alternaria spp.引起的黑斑病[2]。目前,对于灰霉病的防治常采用腐霉利、甲基硫菌灵和啶酰菌胺等化学杀菌剂,虽然杀菌效果好,但是有试剂残留的可能。随着人们对食品安全的不断关注,寻求绿色、环保的天然防腐剂替代化学杀菌剂已成为必然趋势[3]。
茉莉酸甲酯(methyl jasmonate,MeJA)是一种天然植物生长调节剂,可调节包括对环境胁迫响应在内的多种植物生理过程[4]。Wasternack等[5]研究认为,植物系统通过MeJA的信号作用诱导特定酶催化生成如生物碱、酚类物质、活性氧或病程相关蛋白等防御化合物,从而获得抗病性。采后适当浓度的MeJA处理可显著抑制枇杷由Penicillium citrinum引起的灰霉病[2]、草莓由Botrytis cinerea引起的灰霉病[6]。此外,外源MeJA处理还显著提
高了甜樱桃[7]和桃子[8]的抗病性。本课题组前期的研究结果显示[9],MeJA处理可显著抑制蓝莓果实腐烂,但MeJA处理对采后蓝莓果实病害的影响鲜见报道,对果实防御系统的作用模式仍不清晰,因此,本实验主要研究MeJA处理对蓝莓果实采后灰霉病及抗病相关酶活性的影响,揭示MeJA处理减轻果实病害发生率的机理,为MeJA应用于蓝莓果实的灰霉病防治提供理论参考。
1 材料与方法
1.1 材料与病原菌
实验蓝莓(Vaccinium corymbosum L.)品种为“埃利奥特”,采自辽宁省丹东市天赐花卉基地。
病原菌Botrytis cinerea的分离纯化参考曹士锋[10]的方法略有改动,从室温自然腐烂的蓝莓果实中分离纯化Botrytis cinerea,经鉴定和回接试验后,再次从发病的蓝莓果实病健交界处分离纯化Botrytis cinerea,随后挑取Botrytis cinerea的单孢于26 ℃进行扩大培养,纯化好的菌种接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)斜面4 ℃培养。接种前,将斜面菌种接种于平板PDA培养基培养基,26 ℃活化14 d,用无菌生理盐水配成1×105个/mL的孢子悬浮液(血球计数板计数),随配随用。
1.2 试剂与仪器
MeJA 美国Sigma-Aldrich公司;福林-酚试剂、过氧化氢、苯丙氨酸、乙二胺四乙酸、盐酸羟胺、核黄素、蛋氨酸、氮蓝四唑、愈创木酚、三氯乙酸 国药集团化学试剂有限公司。
5804R高速冷冻离心机 德国Eppendorf公司;UV-2700紫外-可见分光光度计 日本岛津公司;DELTA320酸度计 梅特勒-托利多有限公司;CX21FS1显微镜奥林巴斯(中国)有限公司;KQ-250E超声波清洗机昆山市超声仪器有限公司。
1.3 方法
1.3.1 实验处理
采后当天冷藏车运回实验室,剔除残次、病虫害及机械损伤的果实,在(1±1) ℃条件下预冷24 h后,挑选成熟度、颜色、大小基本一致的果实做为试材。将挑选出的果实随机分为2 组,每组果实1.44 kg,分别放入封闭的熏蒸室,0、50 µmol/L MeJA(预实验确定的适宜浓度)熏蒸处理果实12 h,熏蒸温度为20 ℃。熏蒸处理完毕后,果实取出通风冷却,24 h后开始接种。蓝莓果实用70%酒精进行表面消毒,无菌解剖针在果实腰部刺孔,孔深3 mm、直径2 mm,孔内接种配制的Botrytis cinerea孢子悬浮液50 µL后分装,每盒120 g左右,贮藏于(1±1)℃、相对湿度90%~95%的环境贮藏16 d,分别在果实处理前(0 d)和贮藏期间每隔4 d测定果实相关指标,每个指标重复测定3 次。
1.3.2 发病率的计算
蓝莓果实表面出现灰霉病病斑即视为发病果实,每组含大小一致的果实30 个,重复3 次,按下式计算发病率:
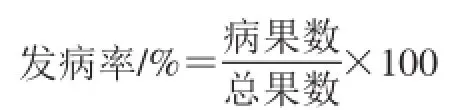
1.3.3 H2O2含量和活性氧代谢酶活性的测定
H2O2含量的测定参考曹建康等[11]的测定方法,结果以µmol/g表示,以鲜质量计。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性测定参考曹建康等[11]的方法,略有改进。随机称取10 g蓝莓果肉,加入10 mL预冷的50 mmol/L pH 7.8磷酸钠缓冲液(含1 mmol/L乙二胺四乙酸,5%聚乙烯吡咯烷酮),冰浴研磨成匀浆后,于4 ℃条件下12 000×g离心20 min,收集上清液用作酶的粗提物来测定SOD、CAT和APX的活性。以每分钟每克鲜果对NBT光化还原的抑制为50%为一个SOD活力单位(U);CAT活性活性以每克鲜果每分钟引起240 nm波长处光密度值降低0.01为一个酶活单位(U);APX活性以每克鲜果每分钟引起290 nm波长处光密度值降低0.01为一个酶活单位(U)。
1.3.4 防御相关酶活性的测定
苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、过氧化物酶(peroxidase,POD)和多酚氧化酶(polyphenoloxidase,PPO)活性的测定参考曹建康等[11]的方法,略有改动。PAL活性以每小时每克鲜果酶促反应体系290 nm波长处光密度值增加0.01为一个PAL活性单位(U);POD活性以每克鲜果每分钟引起470 nm波长处光密度值降低0.01为一个酶活单位(U);PPO活性以每克鲜果每分钟420 nm波长处光密度值变化1为一个酶活单位(U)。
1.3.5 总酚和总花色苷含量的测定
20 g蓝莓果置于预冷的研钵中,低温(4 ℃)研磨成浆,快速准确称取2.5 g匀浆,加入25 mL预冷的1%盐酸酸化的80%乙醇溶液,4 ℃浸提12 h,15 000×g低温离心10 min,收集上清液,残渣用预冷的酸化乙醇洗涤2 次,离心后合并上清液定容至100 mL,用于测定总酚和总花色苷含量。
总酚含量的测定:参照Slinkard等[12]的方法并略加改进,样品中的总酚含量以没食子酸的当量表示,单位为mg/g;总花色苷含量的测定:参照Lako等[13]的方法并略加修改,样品中的总花色苷含量以矢车菊素-3-葡萄糖苷的当量表示,单位为mg/100 g。
1.3.6 木质素含量的测定
木质素含量测定参照Morrison[14]的方法并略加修改。随机称取10 g果肉,加入20 mL预冷的95%乙醇溶液,冰浴研磨成匀浆后,于4 ℃条件下12 000×g离心20 min,
沉淀物用10 mL 95%乙醇溶液冲洗3 次,收集沉淀并干燥。干燥物加入0.5 mL 25%溴乙酰溶液溶解,70 ℃水浴保温30 min后,加0.9 mL 2 mol/L NaOH溶液终止反应,混合液转移至10 mL容量瓶,冰乙酸定容后,于280 nm波长处测定OD值,单位是∆OD280 nm/g。
1.4 数据统计分析
本实验所有数据利用SPSS 19.0进行统计分析。数据均为重复的x±s。以处理方法和贮藏时间为变量,进行方差分析,处理间的差异性多重比较采用最小显著差数法,显著性水平设置为P<0.05。采用Origin 8.0和Excel 2003软件作图。
2 结果与分析
2.1 MeJA处理对Botrytis cinerea接种的蓝莓果实发病率的影响
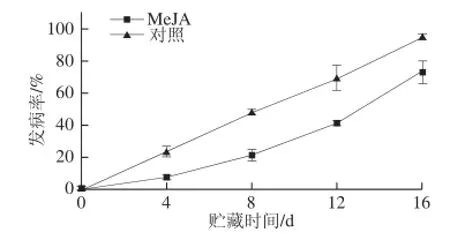
图1 MeJA处理对Botrytis cinerea接种的蓝莓果实发病率的影响Fig.1 Effect of MeJA treatment on disease incidence of blueberry inoculated with Botrytis cinerea during storage at (1 ± 1) ℃
对于不同果实不同病害的防治,MeJA作用的有效浓度有明显不同[15],经浓度筛选预实验,得到50 µmol/L MeJA处理抑制发病率的效果最佳,因此,后续实验选择50 µmol/L MeJA处理果实。由图1可以看出,随着贮藏时间的延长,Botrytis cinerea接种的蓝莓果实发病率呈逐渐上升的趋势,贮藏16 d后,对照组果实发病率达94.44%,MeJA处理组果实发病率为73.33%,MeJA处理显著抑制了果实发病率的上升(P<0.05)。
2.2 MeJA处理对Botrytis cinerea接种的蓝莓果实活性氧代谢的影响
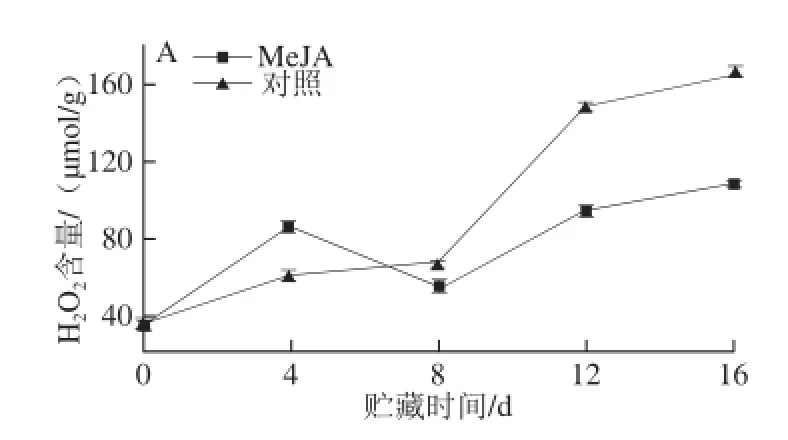
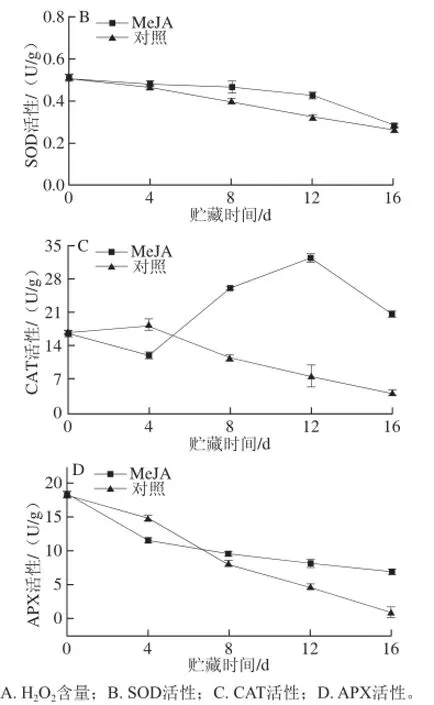
图2 MeJA处理对Botrytis cinerea接种的蓝莓果实活性氧代谢的影响Fig.2 Effect of MeJA treatment on ROS metabolism of blueberry inoculated with Botrytis cinerea during storage at (1 ± 1) ℃
由图2A可以看出,贮藏4 d时,MeJA处理显著提高了Botrytis cinerea接种果实H2O2含量(P<0.05),MeJA处理组果实H2O2含量达到85.82 µmol/g,比对照组果实高出41.66%。贮藏初期,出现了“氧化迸发”,MeJA处理组果实H2O2的迅速积累可能与其诱导Botrytis cinerea接种果实的抗病性有关[16]。贮藏8 d后,MeJA处理显著抑制果实H2O2的积累,对照组果实H2O2含量显著高于MeJA处理组(P<0.05)。
由图2B可以看出,Botrytis cinerea接种的蓝莓果实在冷藏期间SOD活性呈现逐渐下降趋势。贮藏前4 d,对照组和处理组间差异不显著。贮藏8~12 d时,MeJA处理组果实SOD活性高于对照组。
由图2C可以得出,随着贮藏时间的延长,对照组果实CAT活性呈逐渐下降趋势。贮藏前4 d,MeJA处理组果实CAT活性逐渐下降,而后CAT活性呈上升趋势,贮藏12 d后CAT活性下降。贮藏第4天时,MeJA处理组果实CAT活性显著低于对照组(P<0.05),这说明此时SOD歧化生成的H2O2没有被及时高效的清除,导致贮藏第4天时,MeJA处理组果实H2O2快速积累(图2A)。
图2D是Botrytis cinerea接种的蓝莓果实APX活性的变化。所有果实APX活性均随着贮藏时间的延长呈逐渐下降趋势,贮藏第4天时,MeJA处理组果实APX活性显著
低于对照组(P<0.05),贮藏8 d后,MeJA处理显著抑制APX活性的下降(P<0.05),MeJA处理组维持高水平APX活性。实验结果表明,MeJA处理组果实早期H2O2含量的增加可能与APX活性的下降有关,贮藏后期APX活性的维持有助于清除过量积累的H2O2,抑制贮藏末期果实发病率。
2.3 MeJA处理对Botrytis cinerea接种的蓝莓果实防御相关酶活性的影响

图3 MeJA处理对Botrytis cinerea接种的蓝莓果实防御相关酶的影响Fig.3 Effect of MeJA treatment on defense related enzymes activities of blueberry inoculated with Botrytis cinerea during storage at (1 ± 1) ℃
植物组织中存在一类防御酶,如PAL、POD、PPO等。这些防御酶可通过诱导组织中酚类物质、木质素等次生代谢产物合成,间接提高植物抗病性。由图3A可以看出,Botrytis cinerea接种的蓝莓果实PAL活性在贮藏第4天时达到最大值,MeJA处理组果实PAL活性比对照组高出82.21%,而后PAL活性逐渐下降,整个贮藏期间,MeJA处理组果实维持较高PAL活性。如图3B所示,在整个贮藏期间所有Botrytis cinerea接种的蓝莓果实POD活性均逐渐增大,这是由于Botrytis cinerea接种后果实在贮藏初期即出现衰老,膜完整性受到破坏,POD和催化底物酚类等去区域化,诱导酶活性增加。MeJA处理组果实POD活性显著高于对照组(P<0.05),这可能是因为贮藏初期MeJA处理组果实积累的H2O2诱导POD的从头合成的原因。由图3C可知,MeJA处理组果实的PPO活性在整个贮藏期间呈先上升而后下降的趋势,在贮藏第8天时,PPO活性达到最大值0.467 U/g。对照组果实PPO活性随着贮藏时间的延长而逐渐下降,整个贮藏过程中,MeJA处理组果实PPO活性显著高于对照组(P<0.05)。综上所述,MeJA处理显著提高了贮藏期间果实防御相关酶活性(P<0.05)。
2.4 MeJA处理对Botrytis cinerea接种的蓝莓果实总酚和总花色苷含量的影响
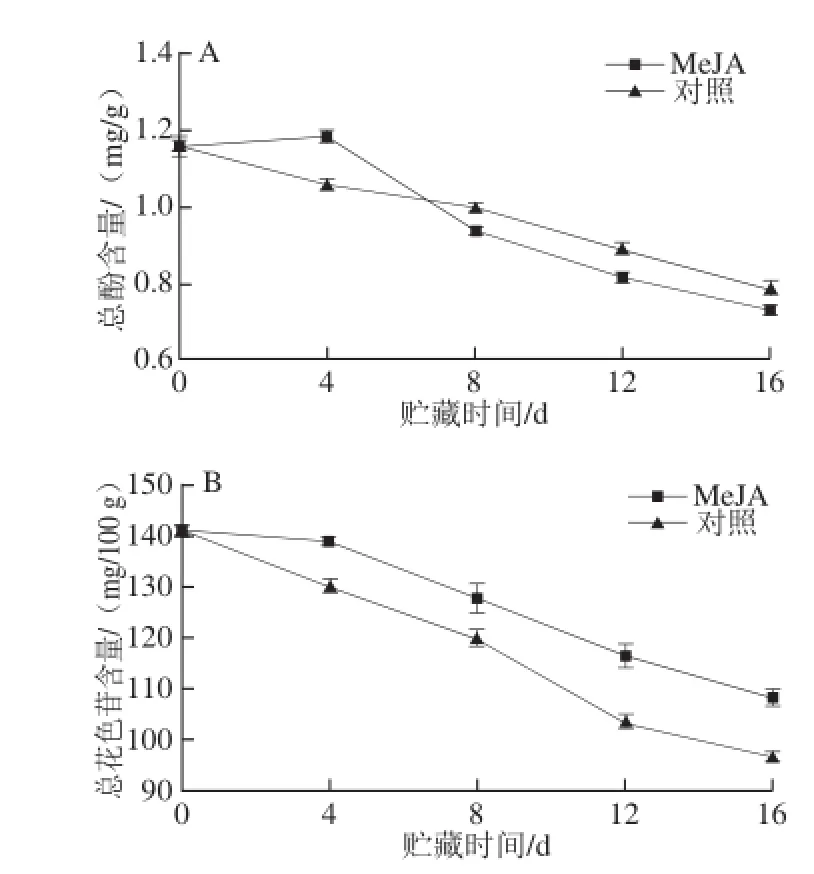
图4 MeJA处理对Botrytis cinerea接种的蓝莓果实总酚(A)和总花色苷(B)含量的影响Fig.4 Effect of MeJA treatment on total phenol (A) and total anthocyanin (B) contents of blueberry inoculated with Botrytis cinerea during storage at (1 ± 1) ℃
随着贮藏时间的延长,果实总酚和总花色苷含量整体呈下降趋势。由图4A可知,MeJA处理组果实总酚含量在贮藏第4天时出现小幅度增加而后持续下降,贮藏初期总酚含量的增加可能与提高果实抗病性有关。对照组果实总酚含量在整个贮藏期间呈现逐步下降的趋势,8 d后对照组果实总酚含量高于MeJA处理组,这可能是MeJA处理提高了PPO和POD活性,酚类物质不断氧化的结果。
由图4B可以看出,整个贮藏期间Botrytis cinerea接种的蓝莓果实花色苷含量呈逐渐下降趋势。研究结果表明,MeJA处理通过提高果实PAL活性来诱导新鲜蓝莓果实采后花色苷的合成[9],而MeJA处理Botrytis cinerea接种的蓝莓果实,贮藏初期虽然PAL活性也有提高,但是总花色苷含量却持续下降,这说明MeJA处理病原菌侵染的果实并不能诱导采后果实花色苷的继续合成,这可能与果实的衰老有关。整个贮藏期间,MeJA处理组果实总花色苷含量高于对照组,这是由于MeJA处理抑制了果实发病率,延缓果实衰老的原因。
2.5 MeJA处理对Botrytis cinerea接种的蓝莓果实木质素含量的影响
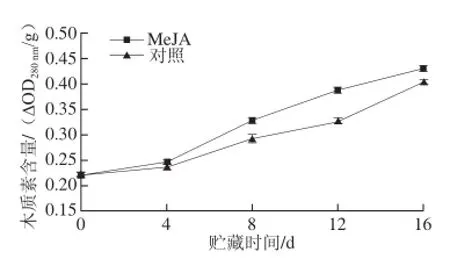
图5 MeJA处理对Botrytis cinerea接种的蓝莓果实木质素含量的影响Fig.5 Effect of MeJA treatment on lignin content of blueberry inoculated with Botrytis cinerea during storage at (1 ± 1) ℃
病原菌侵染果实后,果实细胞壁的木质化可以对病原菌的侵入形成屏障[15]。由图5可以看出,Botrytis cinerea接种的蓝莓果实木质素含量在贮藏期间持续增加,MeJA处理显著提高了果实中木质素含量的增加。
3 讨 论
大量的研究结果表明,MeJA处理可以抑制番茄[17]、樱桃[7]、杨梅[16]和桃子[18]等果实采后病害的发生。研究结果也表明,50 µmol/L MeJA处理能够显著抑制蓝莓果实灰霉病的发病率,MeJA可能是通过诱导果实组织的抗病性来降低果实发病率[16]。
植物受到病原菌侵染时,活性氧(主要是H2O2)会出现“氧化迸发”似的积累,积累的H2O2一方面对病原菌有直接毒性,另一方面H2O2还可作为第二信使调控植物防御系统[19]。H2O2的积累被认为是病原菌侵染的植物组织最早期的防御响应[20],研究发现,Colletotrichum acutatum接种的枇杷果实[21]、Rhizopus stolonife接种的桃果实[21]和Trichothecium roseum接种的甜瓜果实[22]中迅速产生的H2O2与果实抗病性显著正相关,认为是H2O2作为信号分子诱导果实的抗病性。有研究表明[15],低浓度H2O2可对细胞起保护作用,而高浓度的H2O2对植物细胞产生毒害,H2O2在植物细胞中的含量低于10 µmol/L即处于安全浓度范围,该浓度范围内的H2O2可作为信号分子参与植物的生理生化进程[23]。本实验的研究结果显示,MeJA处理显著提高了贮藏初期果实中的H2O2含量(P<0.05),这是MeJA处理抑制贮藏初期果实中CAT、APX活性的原因,MeJA处理有效抑制蓝莓灰霉病的发生。Wang Kaituo等[16]研究表明MeJA处理通过贮藏初期H2O2的快速积累提高果实抗病性,这与本研究一致。MeJA可有效诱导蓝莓果实对病原体的防御相应,当病原体侵染果实后,MeJA可能通过启动H2O2的“氧化迸发”,提高果实抗病性。
研究发现[17],MeJA可以诱导产生抗病性蛋白,主要包括PAL、POD和PPO等防御酶。PAL是苯丙烷代谢途径的关键限速酶,MeJA处理Botrytis cinerea接种的蓝莓果实,PAL活性维持较高水平,而花色苷含量持续下降,这就意味着MeJA处理并不会诱导病害果实采后花色苷的生物合成,PAL更多的参与木质素、酚类和植保素的合成,其中酚类对局部病原菌有直接杀菌作用[24]。“氧化迸发”产生的H2O2可诱导POD的合成,POD参与细胞壁的木质化,以防御病害的侵染[25]。当Botrytis cinerea接种果实后,果实开始衰老,细胞膜结构部分解体,PPO与酚类物质接触催化酚类氧化生成有毒的醌类,对病原菌有直接毒性。本实验结果证实MeJA处理诱导主要抗病性蛋白如PAL、POD和PPO活性的增加,提高了其催化产物木质素、酚类物质和醌类物质的积累,通过直接或间接作用抑制病原菌的生长。Wang Kaituo等[16]研究发现MeJA处理通过提高杨梅果实中PAL、POD活性和木质素含量,以增加果实对橘青霉的抑制,提高果实抗病性。这与本研究结果一致,本研究结果表明抗病性蛋白(PAL、POD和PPO)、木质素和酚类物质等在MeJA诱导的蓝莓果实抗病性中起着重要作用。而Cao Shifeng等[21]的研究显示,MeJA处理减少了Colletotrichum acutatum接种的枇杷果实PAL、POD活性和木质素含量,这说明抗病性蛋白和木质素并不是MeJA处理抑制枇杷采后病害的重要因素。MeJA诱导果实抗病性的原因各有不同,这可能与果实种类、病原菌种类和MeJA处理剂量等因素有关。
4 结 论
50 µmol/L MeJA处理通过抑制贮藏初期果实中CAT 和APX活性,促进贮藏初期果实H2O2的迅速积累,通过H2O2直接杀菌效应和H2O2的第二信使作用启动防御体系,提高果实抗性蛋白酶PAL、POD和PPO活性,促进酚类物质、醌类和木质素的合成,提高蓝莓果实抗病性,从而有效抑制了果实灰霉病的发生。50 µmol/L MeJA处理并没有诱导Botrytis cinerea接种的蓝莓果实中花色苷的继续合成,但是整个贮藏期间,花色苷维持较高水平。
[1] PANIAGUA A, EAST A, HEYES J. Interaction of temperature control deficiencies and atmosphere conditions during blueberry storage on quality outcomes[J]. Postharvest Biology and Technology, 2014, 95: 50-59. DOI:10.1016/j.postharvbio.2014.04.006.
[2] YANG Guiyun, YUE Jin, GONG Xincheng, et al. Blueberry leaf extracts incorporated chitosan coatings for preserving postharvest quality of fresh blueberries[J]. Postharvest Biology and Technology, 2014, 92: 46-53. DOI:10.1016/j.postharvbio.2014.01.018.
[3] ÖZTÜRK B, ALTUNTAS E, YILDIZ K, et al. Effect of methyl jasmonate treatments on the bioactive compounds and physicochemical quality of ‘Fuji’ apples[J]. Ciencia e Investigación Agraria, 2013, 40(1): 201-212. DOI:10.4067/S0718-16202013000100018.
[4] CONCHA C M, FIGUEROA N E, POBLETE L A, et al. Methyl jasmonate treatment induces changes in fruit ripening by modifying the expression of several ripening genes in Fragaria chiloensis fruit[J]. Plant Physiology and Biochemistry, 2013, 70: 433-444. DOI:10.1016/ j.plaphy.2013.06.008.
[5] WASTERNACK C, PARTHIER B. Jasmonate-signalled plant gene expression[J]. Trends in Plant Science, 1997, 2(8): 302-307. DOI:10.1016/S1360-1385(97)89952-9.
[6] MOLINE H, BUTA J, SAFTNER R, et al. Comparison of three volatile natural products for the reduction of postharvest decay in strawberries[J]. Advances in Strawberry Research, 1997, 16: 43-48.
[7] YAO Hongjie, TIAN Shiping. Effects of pre- and post-harvest application of salicylic acid or methyl jasmonate on inducing disease resistance of sweet cherry fruit in storage[J]. Postharvest Biology and Technology, 2005, 35(3): 253-262. DOI:10.1016/ j.postharvbio.2004.09.001.
[8] YAO Hongjie, TIAN Shiping. Effects of a biocontrol agent and methyl jasmonate on postharvest diseases of peach fruit and the possible mechanisms involved[J]. Journal of Applied Microbiology, 2005, 98(4): 941-950. DOI:10.1111/j.1365-2672.2004.02531.x.
[9] HUANG Xiaojie, LI Jing, SHANG Hongli, et al. Effect of methyl jasmonate on the anthocyanin content and antioxidant activity of blueberries during cold storage[J]. Journal of the Science of Food and Agriculture, 2015, 95(2): 337-343. DOI:10.1002/jsfa.6725.
[10] 曹士锋. 枇杷果实采后品质劣变调控及其机理研究[D]. 南京: 南京农业大学, 2008: 47.
[11] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007: 101-144.
[12] SLINKARD K, SINGLETON V L. Total phenol analysis: automation and comparison with manual methods[J]. American Journal of Enology and Viticulture, 1977, 28(1): 49-55.
[13] LAKO J, TRENERRY V C, WAHLQVIST M, et al. Phytochemical flavonols, carotenoids and the antioxidant properties of a wide selection of Fijian fruit, vegetables and other readily available foods[J]. Food Chemistry, 2007, 101(4): 1727-1741. DOI:10.1016/ j.foodchem.2006. 01.031.
[14] MORRISON I. A semi-micro method for the determination of lignin and its use in predicting the digestibility of forage crops[J]. Journal of the Science of Food and Agriculture, 1972, 23(4): 455-463. DOI:10.1002/jsfa.2740230405.
[15] 田世平, 罗云波, 王贵禧. 园艺产品采后生物学基础[M]. 北京: 科学出版社, 2011: 43-55; 312-318.
[16] WANG Kaituo, JIN Peng, HAN Lin, et al. Methyl jasmonate induces resistance against Penicillium citrinum in Chinese bayberry by priming of defense responses[J]. Postharvest Biology and Technology, 2014, 98: 90-97. DOI:10.1016/j.postharvbio.2014.07.009.
[17] DING C K, WANG C, GROSS K C, et al. Jasmonate and salicylate induce the expression of pathogenesis-related-protein genes and increase resistance to chilling injury in tomato fruit[J]. Planta, 2002, 214(6): 895-901. DOI:10.1007/s00425-001-0698-9.
[18] JIN P, ZHENG Y, TANG S, et al. Enhancing disease resistance in peach fruit with methyl jasmonate[J]. Journal of the Science of Food and Agriculture, 2009, 89(5): 802-808. DOI:10.1002/jsfa.3516.
[19] ZHOU Y, LI S, ZENG K. Exogenous nitric oxide-induced postharvest disease resistance in citrus fruit to Colletotrichum gloeosporioides[J]. Journal of the Science of Food and Agriculture, 2016, 96(2): 505-512. DOI:10.1002/jsfa.7117.
[20] JIANG L, JIN P, WANG L, et al. Methyl jasmonate primes defense responses against Botrytis cinerea and reduces disease development in harvested Tablegrapes[J]. Scientia Horticulturae, 2015, 192: 218-223 . DOI:10.1016/j.scienta.2015.06.015.
[21] CAO Shifeng, ZHENG Yonghua, YANG Zhenfeng, et al. Effect of methyl jasmonate on the inhibition of Colletotrichum acutatum infection in loquat fruit and the possible mechanisms[J]. Postharvest Biology and Technology, 2008, 49(2): 301-307. DOI:10.1016/ j.postharvbio.2007.12.007.
[22] REN Yalin, WANG Yunfei, BI Yang, et al. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon (Cucumis melo L.) fruit[J]. European Food Research and Technology, 2012, 234(6): 963-971. DOI:10.1007/ s00217-012-1715-x.
[23] NEILL S, DESIKAN R, HANCOCK J. Hydrogen peroxide signalling[J]. Current Opinion in Plant Biology, 2002, 5(5): 388-395. DOI:10.1016/S1369-5266(02)00282-0.
[24] REIMERS P J, LEACH J E. Race-specific resistance to Xanthomonas oryzae pv. oryzae conferred by bacterial blight resistance gene Xa-10 in rice (Oryza sativa) involves accumulation of a lignin-like substance in host tissues[J]. Physiological and Molecular Plant Pathology, 1991, 38(1): 39-55. DOI:10.1016/S0885-5765(05)80141-9.
[25] CHITTOOR J M, LEACH J E, WHITE F F. Induction of peroxidase during defense against pathogens[C]//Pathogenesis-Related Proteins in Plants, CRC Press, 1999: 171-193.
Effect and Mechanism of Methyl Jasmonate on Incidence of Grey Mould Decay in Postharvest Blueberry
HUANG Xiaojie, LI Jing, CHAI Yuan, HAN Yuanyuan, GAO Jiayue
(College of Food Science and Engineering, Jinzhou Medical University, Jinzhou 121001, China)
The effects of methyl jasmonate (MeJA) treatment on postharvest grey mould decay, the activities of enzymes involved in reactive oxygen species (ROS) metabolism, defense-related enzymes activities and total phenol and total anthocyanin contents in ‘Elliott’ blueberry were investigated. Blueberry fruits were treated with MeJA at 50 µmol/L, inoculated with Botrytis cinerea and then stored at (1 ± 1) ℃ for 16 days. MeJA treatment resulted in significantly lower disease incidence compared with control fruits. MeJA treatment significantly inhibited the activities of catalase (CAT) and ascorbate peroxidase (APX) and thus resulted in a higher level of H2O2in the early period of storage. However, MeJA treatment enhanced the activities of phenylalanine ammonialyase (PAL), polyphenoloxidase (PPO) and peroxidase (POD), and induced the synthesis of phenolics and lignin. These results suggest that MeJA treatment can reduce the incidence and severity of grey mould decay by enhancing the disease resistance of blueberry fruit.
methyl jasmonate; reactive oxygen species metabolism; defense-related enzymes; disease resistance; gray mould decay
10.7506/spkx1002-6630-201622047
TS255.3
A
1002-6630(2016)22-0307-06
黄晓杰, 李婧, 柴媛, 等. MeJA处理对蓝莓果实采后灰霉病的影响及机理[J]. 食品科学, 2016, 37(22): 307-312. DOI:10.7506/spkx1002-6630-201622047. http://www.spkx.net.cn
HUANG Xiaojie, LI Jing, CHAI Yuan, et al. Effect and mechanism of methyl jasmonate on incidence of grey mould decay in postharvest blueberry[J]. Food Science, 2016, 37(22): 307-312. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201622047. http://www.spkx.net.cn
2016-05-02
辽宁省自然科学基金项目(2015020793);辽宁省教育厅科学研究项目(L2014325)
黄晓杰(1981—),女,副教授,博士研究生,研究方向为果蔬营养与质量控制。E-mail:food_xiaojie@163.com
