响应面试验优化末水坛紫菜多糖除蛋白工艺及其抗氧化活性
2016-12-06曹纯洁陈美珍叶天文
谢 飞,曹纯洁,陈美珍*,叶天文
(汕头大学理学院,广东 汕头 515063)
响应面试验优化末水坛紫菜多糖除蛋白工艺及其抗氧化活性
谢 飞,曹纯洁,陈美珍*,叶天文
(汕头大学理学院,广东 汕头 515063)
目的:研究末水坛紫菜多糖的除蛋白方法及所制备多糖在细胞内的抗氧化作用。方法:响应面法优化末水坛紫菜多糖酶法除蛋白工艺条件;建立H2O2诱导HeLa细胞氧化损伤模型,MTT法测定细胞存活率,2′,7′-二氯荧光素二乙酸酯检测细胞内活性氧水平。结果:样品液中末水坛紫菜多糖酶法除蛋白最佳工艺条件为木瓜蛋白酶用量0.7 mg/mL、酶解温度50 ℃、酶解时间55 min,此时蛋白清除率为61.28%;在此基础上,用4%三氯乙酸继续除蛋白,蛋白清除率可达80.73%,多糖保留率为79.7%。与模型组相比,经末水坛紫菜多糖处理的损伤细胞存活率显著提高(P<0.01),且细胞内活性氧含量显著下降(P<0.01)。结论:木瓜蛋白酶-三氯乙酸联用可有效除去末水坛紫菜多糖中的蛋白。末水坛紫菜多糖有较强的抗氧化能力,能清除细胞内过剩的活性氧,修复H2O2对HeLa细胞的氧化损伤。
末水坛紫菜多糖;除蛋白;抗氧化;HeLa细胞;活性氧
坛紫菜(Porphyra haitanensis)是我国南方大规模养殖的重要经济海藻之一。紫菜可分多次采收,第一次采割收获的俗称为头水紫菜,以后依次采收的分二水、三水、四水紫菜等,四水以下的越往后口感越差因而较少食用[1]。由于末水坛紫菜(一般是六水)色泽差、口感粗糙、售价低、获利少,菜农常放弃对其采收,使之腐烂在海里,造成资源的浪费和环境的污染。因此开展对末水坛紫菜的利用研究其意义重要。
紫菜多糖作为一种天然活性物质,其抗氧化及抗肿瘤等活性已有大量报道[2-4],但针对末水坛紫菜多糖的研究鲜见报道。陈美珍等[1]的研究发现,坛紫菜藻体多糖和蛋白质含量随生长期而变化,即多糖减少,蛋白质增多,如三水坛紫菜含多糖30.56%、蛋白质30.49%,而末水坛紫菜多糖和蛋白质含量分别为20.67%和35.30%。末水坛紫菜蛋白质多于多糖,使提取的多糖采用常规方法难于清除蛋白,且多糖损失量大。因此,有必要研究末水坛紫菜多糖除蛋白工艺。此外,目前关于多糖抗氧化活性的研究,大多数以体外化学法进行,这些方法测定结果不能客观地评价活性物质在机体内的作用,其生物相关性较差。因此,以细胞为模型的抗氧化活性测试方法在生物活性物质抗氧化活性评价中受到国内外的广泛关注。
本研究以末水坛紫菜为材料提取多糖,对多糖的除蛋白工艺进行优化,并在细胞水平上探讨除蛋白后的多糖抗氧化活性,以期为末水坛紫菜多糖的深入研究提供技术支持。
1 材料与方法
1.1 材料与试剂
末水坛紫菜 广东省南澳县金山农业发展有限公司;透析袋MD16 美国Spectrum公司。
人宫颈癌HeLa细胞株 汕头大学多学科中心;正常狗肾细胞MDCK 汕头大学医学院。
三氯乙酸(trichloroacetic acid,TCA)、苯酚、无水乙醇、浓硫酸(均为分析纯) 西陇化工股份有限公司;考马斯亮蓝G-250、牛血清白蛋白(均为分析纯)美国Sigma公司;半乳糖标准品 中国食品药品检定研究院;DMEM高糖培养基 美国Hyclone公司;胎牛血清 杭州四季青科技有限公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Amresco公司;阳性药物5-氟尿嘧啶(5-Fu) 上海源叶生物科技有限公司;胰酶细胞消化液、青霉素-链霉素溶液、活性氧检测试剂盒 碧云天生物技术研究所。
1.2 仪器与设备
高速万能粉碎机 天津市泰斯特仪器有限公司;UV-2100C型紫外-可见分光光度计 美国Unico公司;DK-S22型电热恒温水浴锅 上海精宏实验设备有限公司;3111二氧化碳细胞培养箱 美国Thermo公司;CK30倒置显微镜 美国Olympus公司;倒置荧光显微镜日本Nikon公司;全波段扫描酶标仪 瑞士Tecan公司。
1.3 方法
1.3.1 末水坛紫菜精多糖的制备
末水坛紫菜用水洗净后于60 ℃条件下烘干,粉碎过40 目筛,于105 ℃条件下干燥至恒质量,置于试剂瓶中密闭保存备用。称取紫菜粉,液料比为50∶1,用80%乙醇溶液回流2 h,离心弃上清液,加入等量蒸馏水,80 ℃提取5 h,离心,取上清液,使用旋转蒸发仪浓缩至原体积1/3,得样品液,4 ℃冷藏备用。取样品液按优化后的工艺除蛋白,自来水透析2 d,蒸馏水透析1 d,浓缩透析液,冷冻干燥后得精多糖。
1.3.2 多糖含量的测定
1.3.2.1 多糖标准曲线制作
采用苯酚-硫酸法[5],以半乳糖为标准品作标准曲线。经测定得标准曲线回归方程为:y=0.007 05x+ 0.003 67,R2=0.999 17(y表示吸光度,x表示多糖质量)。
1.3.2.2 样品多糖含量测定
样品液适当稀释后,测其吸光度,代入标准曲线回归方程计算多糖含量。多糖保留率按式(1)计算:

1.3.3 蛋白质含量的测定
1.3.3.1 蛋白质标准曲线制作
采用改良考马斯亮蓝法:精密称取牛血清蛋白标准品10 mg于50 mL容量瓶中,加蒸馏水溶解并定容,配成
200 μg/mL的标准蛋白溶液。分别取标准蛋白溶液100、200、300、400、500、600 μL,并用蒸馏水补至1 mL,以同体积蒸馏水为空白,加入考马斯亮蓝溶液5.0 mL,充分振荡、混匀,然后迅速于595 nm波长处测吸光度。横坐标为蛋白质量(μg),纵坐标为吸光度,标准曲线回归方程为:y=0.004 6x-0.003 9,R²=0.999 4。
1.3.3.2 多糖液中蛋白含量的测定
取多糖液1 mL,按上述操作测吸光度,代入标准曲线回归方程计算蛋白质量。蛋白清除率按式(2)计算:

1.3.4 末水坛紫菜多糖除蛋白方法
1.3.4.1 TCA法
取适量样品液,加入4% TCA溶液,80 ℃条件下反应30 min。离心,取上清液,测其多糖及蛋白质含量[6]。
1.3.4.2 木瓜蛋白酶法
取适量样品液,加入活化的木瓜蛋白酶至终质量分数为0.05%,于80 ℃条件下反应3 h,离心,取上清液,测其多糖及蛋白质含量[7]。
1.3.4.3 木瓜蛋白酶结合TCA法
先用木瓜蛋白酶法除蛋白,然后用TCA法进一步除蛋白。
1.3.5 木瓜蛋白酶法除蛋白工艺优化
1.3.5.1 单因素试验
选择对蛋白质脱除率有显著影响的3个因素作为考察对象,实验方法如下:1)酶用量对脱蛋白效果的影响:取样品液5 mL,分别加入0.5、2.5、5、10、15 mg木瓜蛋白酶,65 ℃反应3 h,离心,取上清液测其蛋白质含量,并计算各组别蛋白清除率。2)酶解温度对脱蛋白效果的影响:取5 mL样品液,加入2.5 mg木瓜蛋白酶,分别于40、50、60、65、70、80 ℃条件下反应1 h,离心,取上清液测其蛋白质含量。3)酶解时间对脱蛋白效果的影响:取5 mL样品液,加入2.5 mg木瓜蛋白酶,溶液于60 ℃条件下,分别反应0.5、1、2、3、4、5 h,离心,取上清液测其蛋白质含量。
1.3.5.2 响应面优化试验
根据Box-Behnken试验设计原理,采用三因素三水平安排试验。因素与水平设计见表1。

表1 Box-Behnken试验因素与水平Table1 Coded levels for independent variables used in Box-Behnken design
1.3.6 HeLa细胞氧化损伤模型的建立
取对数生长期的HeLa细胞制成1×105个/mL细胞悬液,接种于96 孔板,于37 ℃、5% CO2、饱和湿度培养箱中培养18 h,吸出上清液,加入新鲜培养基继续培养24 h。吸出上清液,加入用培养基稀释的不同浓度(100、200、300、400、600、800、1 000 μmol/L)的H2O2处理细胞。阴性对照组加入相同体积的不含H2O2的培养基,培养24 h后,移除上清液加入MTT孵育4 h,吸出上清液,加入DMSO,振荡混匀。酶标仪作双波长检测,检测波长490 nm,参考波长570 nm,测其吸光度,按式(3)计算各组别的细胞抑制率。同时,倒置显微镜下观察HeLa细胞的形态变化,并拍照[8-12]。
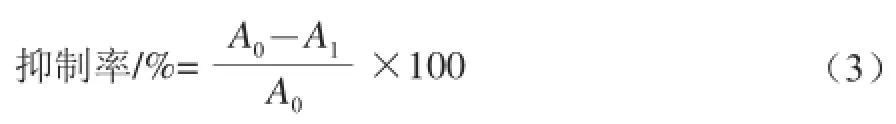
式中:A0为对阴性对照组吸光度;A1为给药组吸光度。
1.3.7 末水坛紫菜多糖给药剂量筛选
取对数生长期的HeLa细胞制成1×105个/mL细胞悬液,接种于96 孔板,于37 ℃、5% CO2、饱和湿度培养箱中培养18 h。随机分组:空白对照组(只加相同体积的完全培养基),阳性对照组(25 μg/mL 5-Fu),实验组(分别加入用完全培养基稀释的100、200、400、600、800、1 000、1 200、2 000 μg/mL的多糖作用液),按分组情况分别给予处理,培养48 h后移除上清液,MTT法测其吸光度,计算各组别的细胞抑制率。选择末水坛紫菜多糖对细胞无毒剂量范围,观察其对氧化损伤HeLa细胞是否有保护作用。
1.3.8 末水坛紫菜多糖对氧化损伤HeLa细胞的保护作用
细胞悬液贴壁18 h后,用筛选出的质量浓度范围内的末水坛紫菜多糖作用24 h,吸出上清液,加入H2O2损伤处理24 h后,MTT法测其吸光度,计算各组别的细胞抑制率。
1.3.9 细胞内活性氧的测定
本身没有荧光的2′,7′-二氯荧光素二乙酸酯(2’,7’-dic hlorodihydrofluorescin diacetate,DCFH-DA)可自由穿过细胞膜,进入细胞后被细胞内的酯酶水解生成 DCFH,而DCFH不能透过细胞膜,从而使探针很容易被装载到细胞内,在活性氧存在的条件下,DCFH被氧化生成绿色荧光物质DCF,绿色荧光的强度与细胞内的活性氧水平成正比,因此通过检测DCF荧光强度,可反映细胞内活性氧水平。
采用细胞活性氧检测试剂盒检测细胞内活性氧,具体操作按照试剂盒说明书进行,酶标仪测定其荧光值,并于倒置荧光显微镜下观察、拍照。
1.4 数据统计
实验结果采用SPSS 17.0统计软件分析。用单因素方
差分析组间差异的显著性,结果采用x±s表示,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 末水坛紫菜多糖除蛋白方法优选

表2 不同方法除蛋白效果Table2 Efficiencies of different deproteinization methods
由表2可知,木瓜蛋白酶法除蛋白效果显著优于TCA法;木瓜蛋白酶-TCA法联用其脱蛋白效果有明显提高,但多糖保留率有所下降。综合考虑,选用木瓜蛋白酶-TCA法作为多糖除蛋白质方法。同时,以蛋白清除率作为考察指标[13-16],对木瓜蛋白酶除蛋白工艺进行优化。
2.2 木瓜蛋白酶法工艺优化
2.2.1 单因素试验结果
2.2.1.1 酶用量对脱蛋白效果的影响
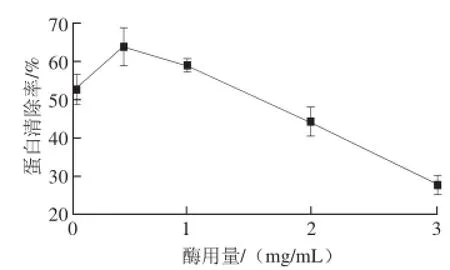
图1 酶用量对蛋白清除率的影响Fig.1 Effect of enzyme concentration on deproteinization efficiency
由图1可见,随着酶用量的增加,其蛋白清除率呈现出先增加后下降的趋势,当酶用量为0.5 mg/mL时,蛋白清除率达到最大值。这是因为,酶用量太低,反应进行的不够充分;酶用量太高时导致体系中蛋白质总体含量升高,表现出蛋白清除率下降。因此,确定酶用量以0.5 mg/mL为宜。
2.2.1.2 酶解温度对脱蛋白效果的影响
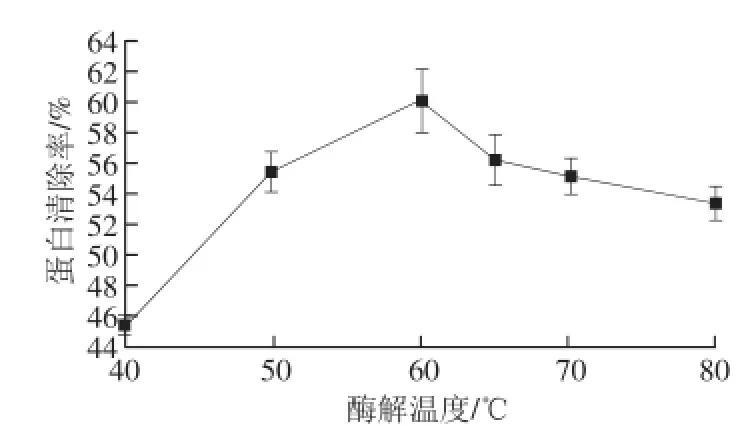
图2 酶解温度对蛋白清除率的影响Fig.2 Effect of hydrolysis temperature on deproteinization efficiency
由图2可知,随着酶解温度的升高,蛋白清除率先上升后下降,60 ℃时蛋白脱除率最高。表明60 ℃可能是木瓜蛋白酶作用的最适温度。

图3 酶解时间对蛋白清除率的影响Fig.3 Effect of hydrolysis time on deproteinization efficiency
2.2.1.3 酶解时间对脱蛋白效果的影响由图3可知,随着酶解时间的延长,蛋白清除率先增加后下降,最后趋于稳定。原因可能是,酶解时间太短反应进行不彻底导致蛋白清除率不高,时间过长使木瓜蛋白酶变性失活,导致蛋白清除率下降。因此酶解时间以1 h为宜。
2.2.2 响应面试验结果
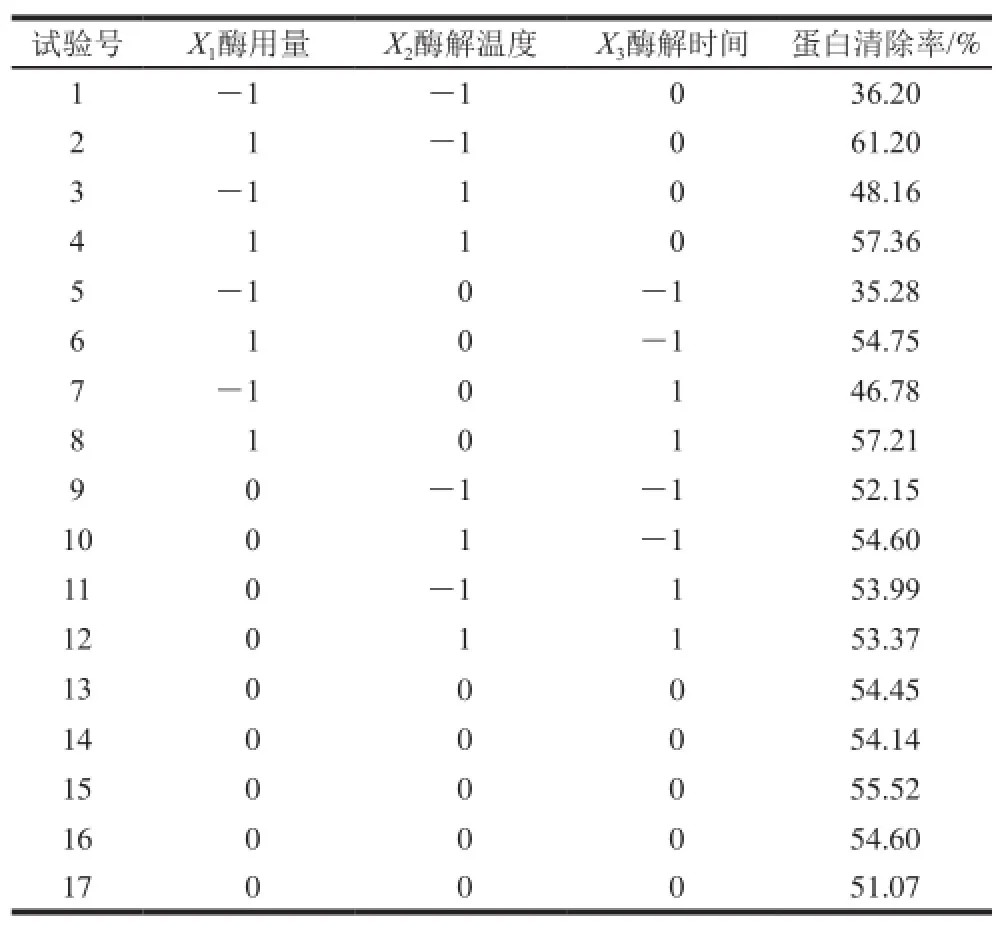
表3 Box-Behnken设计方案及结果Table3 The Box-Behnken experimental design and results for response surface analysis
响应面试验方案及结果见表3。利用Design-Exepert 8.0.5b统计软件,对试验结果进行数据分析(表4)。以蛋白清除率为响应值进行多元回归拟合,得相应回归方程。建立的数学模型为:
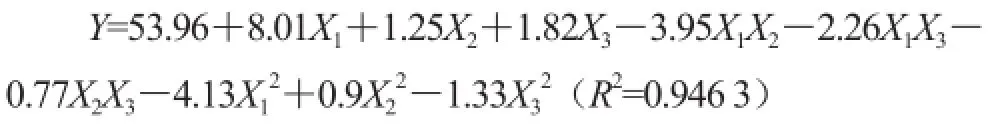
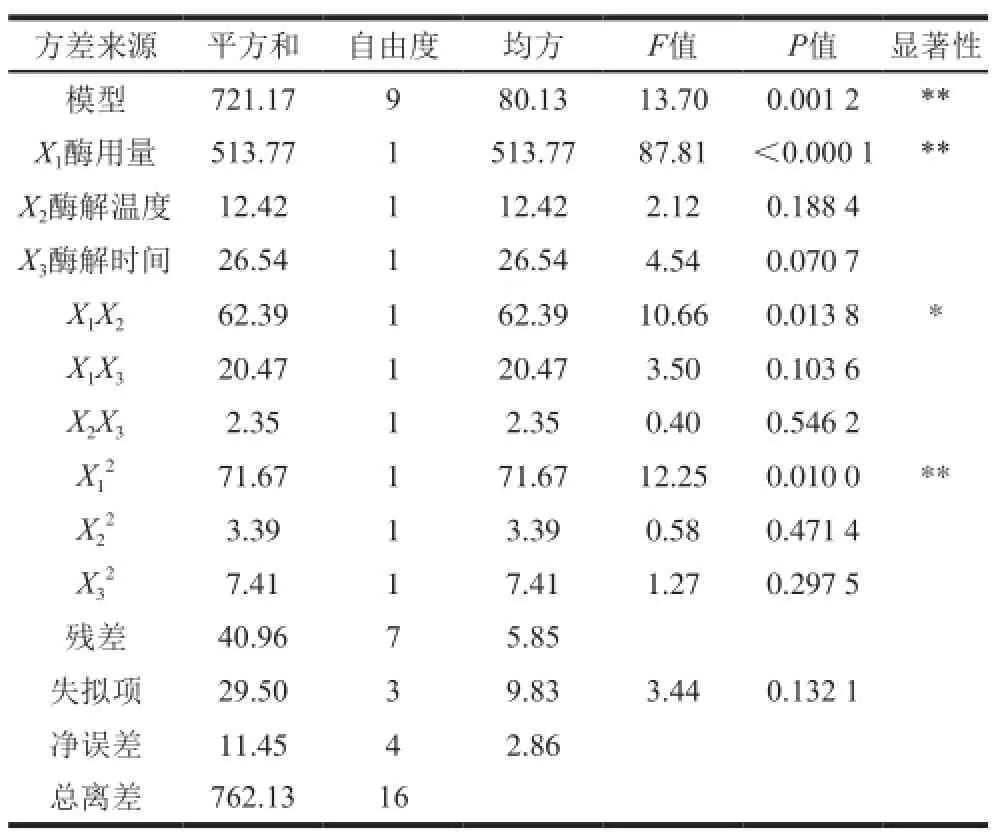
表4 回归方程方差分析Table4 Analysis of variance for the fitted regression equation
表4方差分析表明,该模型回归极显著(P=0.001 2<0.01),失拟项(P=0.132 1>0.05)不显著,表明二次多项式回归模型正确;R2=94.63%,表明响应值蛋白清除率的实际值与预测值之间具有较好的拟合度,因此该模型可用于预测响应值的实际情况。F值可以反映出各因素对试验指标影响的重要性,由表4可知,各因素的贡献率为:X1>X3>X2,即酶用量>酶解时间>酶解温度。
对模型进行回归方程系数显著性检验,得到模型一次项X1、二次项X12及交互作用项X1X2差异显著(P<0.01),表明酶用量以及酶用量与酶解温度的交互作用对蛋白清除率有显著影响,且各具体试验因素对响应值的影响不是简单的线性关系。


图4 各因素交互作用对蛋白清除率影响的响应面图Fig.4 Three-dimensional response surface diagram showing interactive effects of different factors on deproteinization efficiency
由图4可知,酶用量对蛋白清除率的影响极显著,可看出其绘制的曲线最为陡峭;酶解时间对蛋白清除率的影响次之,而影响最小的则是酶解温度,与酶解时间相比,其曲线较为平滑一些。通过响应面法预测得到的回归模型分析[17-18],可预测得到紫菜多糖的最佳除蛋白工艺条件为:酶用量0.71 mg/mL、酶解温度50.76℃、酶解时间55.8 min,预测蛋白清除率为62.01%。
根据实际情况,结合预测结果设定验证实验工艺条件为:酶用量0.7 mg/mL、酶解温度50 ℃、酶解时间55 min。在该工艺条件下,做3 组平行实验,平均蛋白清除率为(61.28±1.58)%,与预测值62.01%接近,多糖保留率为(84.4±0.78)%。实验结果表明,用响应面法优化紫菜多糖除蛋白回归模型较可靠。
2.2.3 木瓜蛋白酶结合TCA法除蛋白效果
利用相应面优化的酶法除蛋白最佳工艺条件对样品液除蛋白处理后,离心、收集上清液,再以TCA法进一步除蛋白,其蛋白清除率显著提高,达(80.73±1.82)%,多糖保留率为(79.7±0.73)%。较单纯木瓜蛋白酶法效果更佳,由此得最终蛋白清除工艺为:木瓜蛋白酶(酶用量0.7 mg/mL、酶解温度50 ℃、酶解时间55 min)与TCA(4% TCA、80 ℃、30 min)联用法。
2.3 HeLa细胞氧化损伤模型的建立
2.3.1 不同浓度H2O2对HeLa细胞的影响

表5 不同浓度H2O2对HeLa细胞抑制率的影响Table5 Inhibitory effect of different H2O2concentrations on HeLa cells
由表5可知,细胞抑制率随着H2O2浓度的增大而升高,具有明显的浓度依赖性。根据细胞半数抑制率为
633.06 μmol/L,认为诱导HeLa细胞损伤及凋亡模型的条件为:H2O2浓度633.06 μmol/L、作用时间24 h。为方便操作,选择630 μmol/L作为后续实验的损伤浓度。
2.3.2 不同浓度H2O2对HeLa细胞形态学的影响
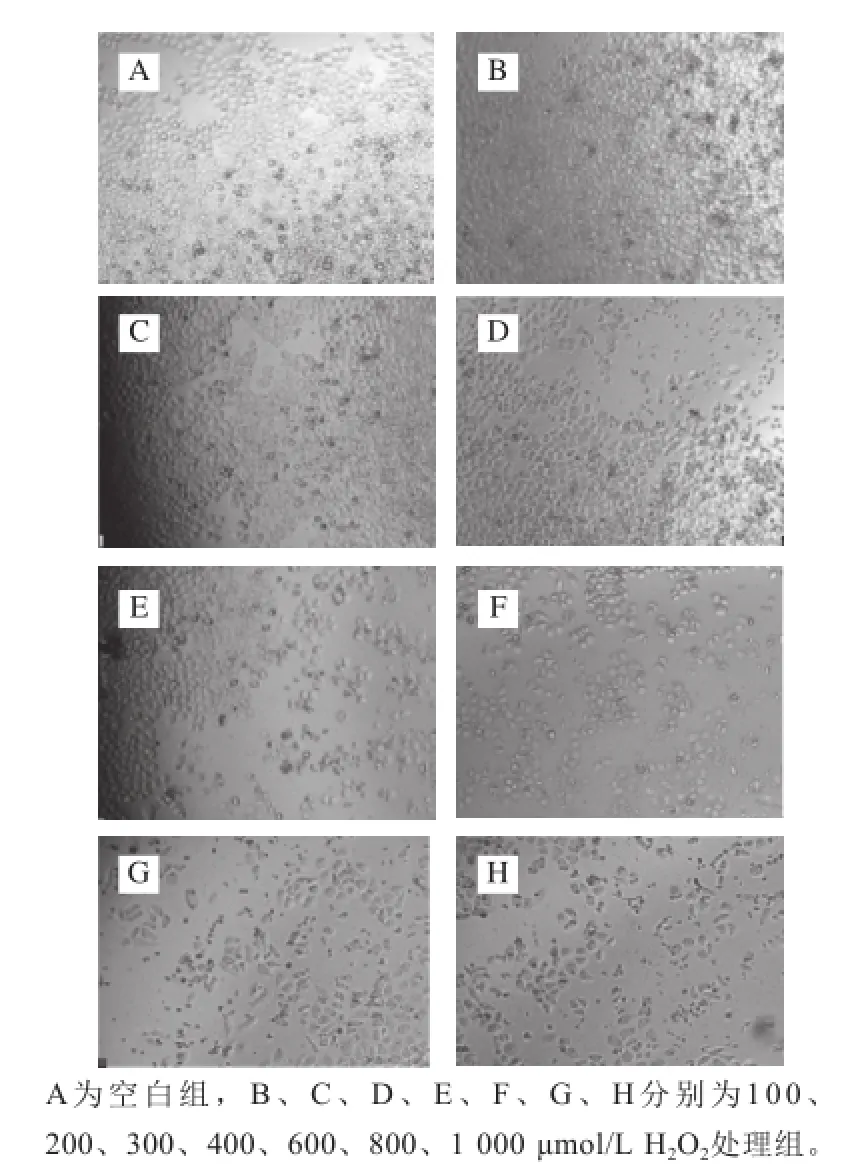
图5 H2O2处理24 h对HeLa细胞的形态学观察(10×20)Fig.5 Morphological observation of HeLa cells treated with H2O2for 24 h (10 × 20)
倒置显微镜下观察HeLa细胞形态变化,由图5可见,空白组细胞生长良好,细胞排列较紧密,胞体边缘清晰;给药组随着H2O2浓度的增大,贴壁细胞逐渐减少,当H2O2浓度超过300 μmol/L时,细胞数量急剧减少,细胞碎片大量增加。结果显示,H2O2能诱导HeLa细胞凋亡,抑制细胞生长。
2.4 末水坛紫菜多糖无毒质量浓度范围的筛选

表6 末水坛紫菜多糖对HeLa及MDCK细胞的影响Table6 Effect of PHP on HeLa and MDCK cells
由表6可知,整体来看,末水坛紫菜多糖能抑制HeLa细胞的增殖,而对正常细胞MDCK的生长具有促进作用。对两种细胞的抑制(促进)作用,均随着末水坛紫菜多糖质量浓度增加而呈现出先增加后降低的趋势,并且均在末水坛紫菜多糖质量浓度为800 μg/mL时,其作用效果最强。
当末水坛紫菜多糖质量浓度为100 μg/mL,其对HeLa的抑制率为5.70%,此时细胞生长状况良好,末水坛紫菜多糖对细胞有作用但尚未对细胞产生较大毒性。当末水坛紫菜多糖质量浓度增加至200 μg/mL,末水坛紫菜多糖对细胞有较大损伤,抑制率达14.24%。因此,选择40~200 μg/mL质量浓度范围,作为探究末水坛紫菜多糖对HeLa细胞从基本无毒变为开始有较为明显毒性时,其对由H2O2损伤的HeLa细胞修复作用的影响。
2.5 末水坛紫菜多糖对H2O2损伤的HeLa细胞的修复作用
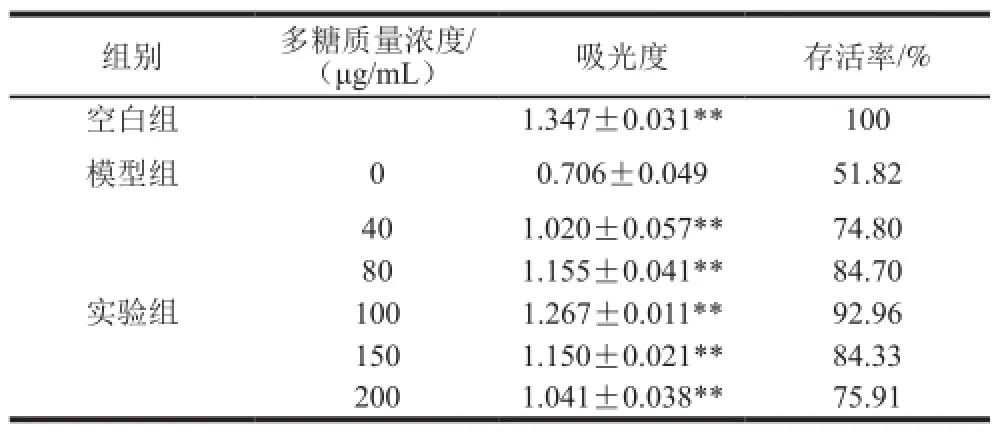
表7 末水坛紫菜多糖对H2O2损伤的HeLa细胞的修复作用Table7 Protective effects of PHP on HeLa cells against H2O2-induced injury
由表7可知,在40~100 μg/mL范围内,末水坛紫菜多糖对HeLa细胞基本无毒,其对损伤细胞的修复作用随质量浓度的增加而增强。末水坛紫菜多糖质量浓度为100 μg/mL时,HeLa细胞的存活率为92.96%,与模型组相比,其保护作用极为突出。当末水坛紫菜多糖质量浓度进一步增加时,末水坛紫菜多糖的细胞毒性开始凸显,其对损伤细胞的保护作用开始下降。
2.6 末水坛紫菜多糖对细胞内活性氧水平的影响
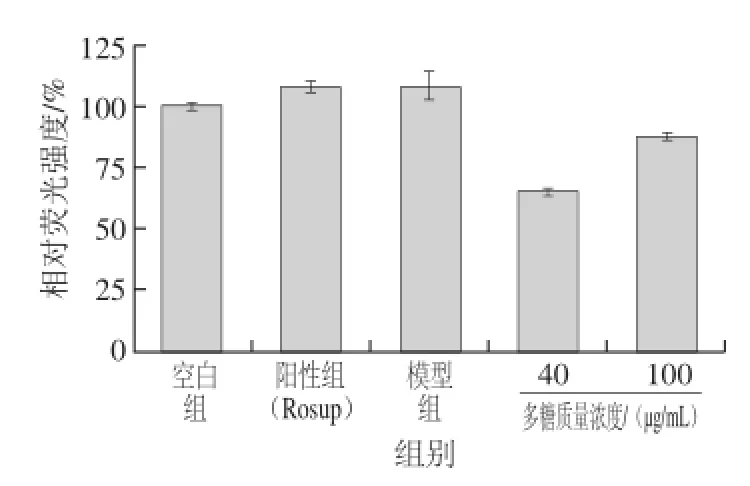
图6 末水坛紫菜多糖对H2O2损伤的HeLa细胞内活性氧水平的影响Fig.6 Effects of PHP on ROS level in HeLa cells with injury induced by H2O2
酶标仪检测DCFH-DA处理细胞内活性氧含量,与空白组相比,模型组荧光强度明显增强,说明模型组细胞内
活性氧含量增加;与模型组相比,末水坛紫菜多糖各处理组荧光强度均降低,说明末水坛紫菜多糖能降低H2O2损伤细胞内活性氧含量。末水坛紫菜多糖低剂量组荧光强度远低于高剂量组,说明低质量浓度的末水坛紫菜多糖能高效的清除细胞内过量的活性氧,随着质量浓度的增加其清除能力会降低;结合表7实验结果,表明在一定范围内较高的活性氧水平有利于HeLa细胞的生长。

图7 DCFH-DA染色观察末水坛紫菜多糖处理后H2O2损伤HeLa细胞内活性氧水平(10×40)Fig.7 Effects of PHP treatment on ROS level of HeLa cells with H2O2-induced injury observed by DCFH-DA staining (10 × 40)
由图7可知,倒置荧光显微镜观察不同处理组的荧光强度,模型组的荧光强度明显高于其他组,进一步证明末水坛紫菜多糖能清除HeLa细胞内过剩的活性氧。
3 讨 论
与传统Sevag法除蛋白相比,本研究得到的除蛋白工艺更易于操作,结合超滤技术,可进行多糖大量制备。为了简化末水坛紫菜多糖的制备工艺,本研究省略了常规多糖制备方法中的醇沉步骤,直接对多糖浓缩液进行除蛋白处理,这可能是导致蛋白清除率(80.73%)偏低的原因。本实验室前期研究发现,中等分子质量的紫菜多糖其相关生物活性最强,虽然TCA除蛋白会使部分多糖降解,但并不影响后面对多糖活性的研究。
在正常的生理状态下,细胞内的活性氧水平是不断产生和清除的,维持细胞内适合的活性氧水平对细胞生长繁殖极为重要[19]。活性氧对细胞的生长具有双重角色:一方面,活性氧能促进细胞有丝分裂,诱导细胞增殖,活性氧含量过低,不利于细胞增殖;另一方面,活性氧含量过多,则会诱发细胞凋亡或坏死[20-22]。研究显示,活性氧几乎和人类大部分常见的疾病都有关系;很多致癌物必须在体内经过代谢活化形成自由基(主要是活性氧),并攻击DNA才能致癌,而许多抗癌剂也是通过活性氧形式去杀死癌细胞,可以说活性氧介入了致癌、促癌和抗癌诸过程。
H2O2是一种重要的非自由基活性物,它可以穿透大部分细胞膜,这增加了H2O2的细胞毒性,当它穿透细胞膜后就可以与细胞内的铁反应产生·OH(Fenton反应),从而导致细胞损伤[23]。H2O2极易获得、性质稳定且容易操作,因此被广泛用于诱导不同类型的细胞凋亡和氧化损伤,是体外氧化应激模型理想的诱导剂。本研究通过H2O2刺激HeLa细胞,建立体外氧化应激模型,探究末水坛紫菜多糖对损伤HeLa细胞的影响。结果显示,对H2O2损伤的HeLa细胞,末水坛紫菜多糖能提高细胞存活率,有显著的保护作用(P<0.01);活性氧测定发现,经末水坛紫菜多糖处理后,细胞内活性氧含量显著下降(P<0.01),证明末水坛紫菜多糖能清除细胞内过剩活性氧。然而,低质量浓度(40 μg/mL)末水坛紫菜多糖对活性氧清除能力较高质量浓度(100 μg/mL)末水坛紫菜多糖更强,其原因尚待进一步探讨分析。
游如旭等[24]研究发现,香菇多糖能诱导鼠肝癌细胞H22内活性氧含量升高,从而诱导细胞凋亡。越来越多的证据表明,对比正常细胞,其对应肿瘤细胞内的活性氧水平更高[25]。结合研究发现,一个合理的推测是:末水坛紫菜多糖对活性氧的作用除了能直接清除一部分活性氧外,还能通过激活或抑制相关抗氧化机制(如提高或抑制相关抗氧化酶活力等),间接降低或提高活性氧含量。当细胞处于氧化应激状态时,末水坛紫菜多糖能激活相关抗氧化机制,表现为较强的活性氧清除能力(清除能力与末水坛紫菜多糖浓度相关);当末水坛紫菜多糖作用于非应激状态的细胞时,较高质量浓度的末水坛紫菜多糖则会抑制相关抗氧化机制,最终表现为提高活性氧含量。所以末水坛紫菜多糖作用于HeLa和MDCK细胞时,表现出明显的差异性。由于HeLa细胞内活性氧含量处于较高水平,当活性氧水平进一步提高超过其耐受能力时,会导致细胞凋亡;而正常MDCK细胞活性氧含量较低,适当提高细胞内活性氧水平有利于细胞生长繁殖。
[1] 陈美珍, 徐景燕, 潘群文, 等. 末水残次坛紫菜的营养成分及多糖组成分析[J]. 食品科学, 2011, 32(20): 230-234.
[2] 顾佳雯, 张陆曦, 徐红丽, 等. 条斑紫菜多糖的分离纯化与抗肿瘤活性[J]. 中国生物工程杂志, 2007, 27(7): 50-54. DOI:10.3969/ j.issn.1671-8135.2007.07.011.
[3] 吴琼英, 戴伟. 微波辅助提取条斑紫菜多糖及其抗氧化性研究[J]. 食品科技, 2007, 32(3): 96-99. DOI:10.3969/ j.issn.1005-9989.2007.03.026.
[4] 周小伟, 钟瑞敏. 紫菜多糖提取工艺技术及抗氧化活性研究[J]. 食品研究与开发, 2014, 35(19): 43-47. DOI:10.3969/ j.issn.1005-6521.2014.19.012.
[5] 王文平, 郭祀远, 李琳, 等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学, 2007, 28(4): 276-279. DOI:10.3321/ j.issn:1002-6630.2007.04.065.
[6] 刘凤, 陶慧卿, 何培民. 条斑紫菜多糖脱蛋白方法与条件优化[J].上海水产大学学报, 2007, 16(2): 141-143. DOI:10.3969/ j.issn.1004-7271.2007.02.009.
[7] 穆凯峰. 坛紫菜多糖的提取纯化及其理化性质研究[D]. 厦门: 集美大学, 2010.
[8] 刘琴, 宋坤, 郭杰, 等. 籽瓜多糖对H2O2致PC12细胞氧化损伤的保护作用[J]. 天然产物研究与开发, 2015, 27(2): 338-343. DOI:10.16333/ j.1001-6880.2015.02.028.
[9] 罗春丽, 王林, 李杏, 等. 紫薯花青素体外抗氧化及对H2O2诱导HepG2细胞氧化损伤的保护作用[J]. 食品科学, 2015, 36(17): 225-230. DOI:10.7506/spkx1002-6630-201517042.
[10] 韩苗苗, 王文飞, 刘铭瑶, 等. FGF-21对H2O2诱导的大鼠心肌细胞H9c2氧化应激损伤的保护作用[J]. 药学学报, 2014, 49(4): 470-475.
[11] 刘红亮, 胡磊, 王靖凯, 等. 槲皮素对H2O2损伤PC12细胞的保护效果与机制[J]. 中国药理学通报, 2014, 30(3): 373-377. DOI:10.3969/ j.issn.1001-1978.2014.03.017.
[12] 张培丽, 张帅, 陈雪香, 等. 桑葚多糖对H2O2诱导PC-12细胞氧化损伤的保护作用[J]. 现代食品科技, 2015, 31(11): 20-24. DOI:10.13982/ j.mfst.1673-9078.2015.11.004.
[13] 熊莉, 王承明. 花生粕多糖去蛋白方法的研究[J]. 食品科技, 2010, 35(9): 219-222. DOI:10.13684/j.cnki.spkj.2010.09.057.
[14] 杨斌, 杨英, 王雪飞, 等. 响应面法优化蓝刺头多糖除蛋白工艺的研究[J]. 食品工业科技, 2014, 35(10): 287-291. DOI:10.13386/ j.issn1002-0306.2014.10.055.
[15] 王海茹, 王雪飞, 姚晶. 黄柏花粉多糖除蛋白方法比较及其对抗氧化功能的影响[J]. 食品科技, 2015, 40(5): 224-228. DOI:10.13684/ j.cnki.spkj.2015.05.044.
[16] 张曜武, 王薇薇, 王超, 等. 淫羊藿多糖的酶法除蛋白工艺研究[J]. 青岛科技大学学报, 2014, 35(2): 167-173. DOI:10.3969/ j.issn.1672-6987.2014.02.013.
[17] 刘玉芬, 夏海涛, 徐芹喜. 海英菜多糖提取工艺的响应面法优化及其体外抗氧化作用[J]. 食品科学, 2012, 33(20): 138-143.
[18] CAPEK P, MACHOBA E, TURIAN J. Scavenging and antioxidant actibities of immunomodulating polysaccharids isolated form Salvia officinalis[J]. International of Biologica Macromolecules, 2009, 44(1): 75-80. DOI:10.1016/j.ijbiomac.2008.10.007.
[19] PREETA R, NAIR R. Stimulation of cardiac fibroblast proliferation by cerium: a superoxide anion-mediated response[J]. Journal of Molecular and Cellular Cardiology, 1999, 31(8): 1573-1580. DOI:10.1006/ jmcc.1999.0994.
[20] PELICANO H, CARNEY D, HUANG P. ROS stress in cancer cells and therapeutic implications[J]. Drug Resistance Updates, 2004, 7(2): 97-110. DOI:10.1016/j.drup.2004.01.004.
[21] KOHEN R, NYSKA A. Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification[J]. Journal of Toxicologic Pathology, 2002, 30(6): 620-50. DOI:10.1080/01926230290166724.
[22] RHEE S, BAE Y, LEE S, et al. Hydrogen peroxide: a key messenger that modulates protein phosphorylation through cysteine oxidation[J]. Science’s Stke, 2000, 53: 1-5. DOI:10.1126/stke.2000.53.pe1.
[23] SCHNABEL R, BLANKENBERG S. Oxidative stress in cardiovascular disease[J]. International Journal of Molecular Sciences, 2014, 15(4): 6002-6008.
[24] 游如旭, 张玉, 汪柳, 等. 香菇多糖诱导鼠肝癌H22细胞凋亡机制的初步探讨[J]. 中国医院药学杂志, 2015, 35(9): 776-781. DOI:10.13286/j.cnki.chinhosppharmacyj.2015.09.04.
[25] HILEMAN E, LIU J, ALBITAR M, et al. Intrinsic oxidative stress in cancer cells: a biochemical basis for therapeutic selectivity[J]. Cancer Chemother Pharmacol, 2004, 53(3): 209-219. DOI:10.1007/s00280-003-0726-5.
Optimization of Deproteinization Process of Polysaccharides Extracted from Abandoned Porphyra haitanensis and Their Antioxidant Activity
XIE Fei, CAO Chunjie, CHEN Meizhen*, YE Tianwen
(College of Science, Shantou University, Shantou 515063, China)
Objective: This study aimed to investigate the deproteinization process of polysaccharides extracted from abandoned Porphyra haitanensis and to evaluate their cellular antioxidant activity. Methods: Response surface methodology was used to optimize the process conditions for the enzymatic deproteinization of P. haitanensis polysaccharides with papain. An oxidative stress model was built by stimulating HeLa cells with H2O2and the methyl thiazolyl tetrazolium (MTT) method was used to determine the cell survival rate. The level of cellular reactive oxygen species (ROS) was also measured by 2’,7’-dichlorodihydrofluorescin diacetate (DCFH-DA). Results: The optimized deproteinization conditions were determined as follows: hydrolysis time, 55 min; temperature, 50 ℃; and papain concentration, 0.7 mg/mL; giving a percentage of deproteinization of 61.28%. After further deproteinization with 4% trichloroacetic acid (TCA), the deproteinization rate increased up to 80.73%, and the retention rate of polysaccharide was 79.7%. Compared with the model group, the survival rate of cells treated with the purified polysaccharides from P. haitanensis was significantly increased (P < 0.01), and the level of ROS was significantly decreased (P < 0.01). Conclusions: The combination of papain hydrolysis and TCA treatment was an effective method for the removal of protein from Porphyra haitanensis polysaccharides. Porphyra haitanensis polysaccharides had significant antioxidant activity and could relieve the H2O2-induced injury in HeLa cells by eliminating redundant ROS.
polysaccharides extracted from abandoned Porphyra haitanensis; deproteinization; antioxidant activity; HeLa; reactive oxygen species
10.7506/spkx1002-6630-201622011
R931
A
1002-6630(2016)22-0077-08
谢飞, 曹纯洁, 陈美珍, 等. 响应面试验优化末水坛紫菜多糖除蛋白工艺及其抗氧化活性[J]. 食品科学, 2016, 37(22): 77-84. DOI:10.7506/spkx1002-6630-201622011. http://www.spkx.net.cn
XIE Fei, CAO Chunjie, CHEN Meizhen, et al. Optimization of deproteinization process of polysaccharides extracted from abandoned Porphyra haitanensis and their antioxidant activity[J]. Food Science, 2016, 37(22): 77-84. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622011. http://www.spkx.net.cn
2016-04-13
广东省高水平大学重点学科建设项目
谢飞(1990—),男,硕士研究生,研究方向为活性物质研究与开发。E-mail:14fxie@stu.edu.cn
*通信作者:陈美珍(1956—),女,教授,本科,研究方向为活性物质研究与开发。E-mail:chenmz@stu.edu.cn
