经辐照杀菌的无菌袋中耐辐照微生物分离与鉴定
2016-12-06纪明淮周帼萍
纪明淮,高 雯,周帼萍*
(武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
经辐照杀菌的无菌袋中耐辐照微生物分离与鉴定
纪明淮,高 雯,周帼萍*
(武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
对某番茄酱生产企业提供的辐照杀菌(辐照剂量≥15 kGy)的5 L无菌袋进行菌落计数、分离和鉴定。3 L无菌水反复漂洗,滤膜过滤后进行平板菌落计数,分离纯化后采用16S rDNA和dnaJ序列分析分别鉴定到属和种。结果表明,5 批次的样品中均有细菌检出,数量在5~132 CFU/袋,9 个典型菌落经过16S rDNA序列分析后,分别属6 个属,其中栖水菌属(Enhydrobacter)、不动杆菌属(Acinetobacter)和考克斯菌属(Kocuria)各1 株,微球菌属(Micrococcus)、微杆菌属(Microbacterium)和芽孢杆菌属(Bacillus)各2 株;dnaJ序列分析则将一株葡萄球菌C8-3鉴定到种-表皮葡萄球菌(Staphylococcus epidermidis)。辐照杀菌的无菌袋虽然微生物数量不高,但是依然残留了一些耐辐照的细菌,它们或多或少会给内装食品带来一定的食品安全隐患或影响食品保质期。
耐辐照;辐照杀菌的无菌袋;不动杆菌属;考克斯菌属;微球菌属;微杆菌属;芽孢杆菌属;栖水菌属;表皮葡萄球菌
随着食品工业的发展和现代化,各种非热杀菌技术,如辐照、紫外、超声波、臭氧超高压、高压脉冲电场杀菌技术等迅速崛起。其中辐照杀菌具有穿透力强、杀菌有效、时间短、低能耗、不升温等特点,虽然有不少关于安全问题的争议,还是得到广泛应用[1]。
不同生物体其能耐受的辐射剂量不同,一般微生物能耐受最高剂量达3 000 Gy,而可在高剂量辐射环境下生存的微生物通常称为耐辐照微生物[2]。1956年美国科学家Anderson等[3]从经辐照灭菌的罐头里首次发现耐辐射奇球菌(Deinococcus radiodurans),该菌是地球最耐辐射的生物之一;1961年Duggan[4]从变质的辐照杀菌牛肉馅中分离出大量腐败菌——耐辐射微球菌(Micrococcus radiodurans)和Brevibacterium oregonium。
耐辐照微生物是一种重要的极端微生物资源,该类微生物对离子辐射、诱变剂和干燥环境具有极端的抗性,还能够具有厚壁、休眠结构并能高效精确的修复DNA等特点。目前已报道的耐辐射微生物包括原核微生物和真核微生物,其中原核耐辐射微生物研究最多。根据达尔文进化论可知随着辐照杀菌技术的推广,会涌现出越来越多的耐辐照菌。
前期的研究中本课题组发现经过辐照杀菌的调味料-辣椒粉和花椒粉等样品确实含菌量大幅下降,但是总有个别细菌检出,初步判断多是葡萄球菌和芽孢杆菌。2015年在某变质产气的番茄酱样品中分离到多个菌株,其中1 株经过16S rDNA序列分析与Bacillus nealsonii最为接近,而B. nealsonii是2003年NASA从太空飞船组件上分离的菌株,研究表明其芽孢能耐受γ射线辐射[5],推测辐照杀菌无菌袋极可能是该菌株的污染源。
已有一些针对辐照杀菌的食品和药物中残留微生物研究,但是鲜见对辐照后包装材料的研究,而包材能直接接触食品成品,对食品安全和质量稳定性的影响很大,有待深入研究。因此本研究收集企业库存的无菌袋进行微生物检查和16S rDNA和dnaJ序列分析,研究有哪些种类耐辐照的微生物,以及它们是否有影响食品安全和质量的能力,以期为食品包装行业的杀菌技术发展和风险评价提供参考。
1 材料与方法
1.1 材料与试剂
新疆某番茄酱生产企业送检的于2014年和2015年购进的5 个批次库存5 L无菌袋(经由辐照杀菌,辐照剂量≥15 kGy。
平板计数琼脂培养基 北京陆桥技术股份有限公司;马铃薯葡萄糖琼脂培养基 英国Oxoid公司;LB培养基 自制。
琼脂糖 西班牙Biowest公司;Premix Taq聚合酶链式反应(polymerase chain reaction,PCR)预混体系、DL2000 DNA Marker和核酸染料Goldview 日本TaKaRa公司;PCR引物合成和产物测序均由苏州金唯智科技有限公司完成。
1.2 仪器与设备
无菌过滤器及配套0.2 μm滤膜 德国Milipore公司;T100 Thermal Cycler PCR仪 美国Bio-Rad公司;GeneGenius凝胶图像分析系统 英国Syngene公司;DYY-6C型电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 样品中微生物的检测、计数和染色观察
5 L大无菌袋采用3 L无菌水反复漂洗,用0.2 μm滤膜过滤,滤膜直接贴在进口马铃薯葡萄糖琼脂培养基上,30 ℃培养3~5 d,对平板上出现的菌落按照真菌和细菌分别进行菌落计数,同时挑取单菌落分别于马铃薯葡萄糖琼脂、平板计数琼脂培养基上进行划线分离纯化;观察单菌落的形态并染色镜检显微形态。
1.3.2 菌裂解液的制备
LB平板划线分离待测菌株,30 ℃培养24 h。挑取单菌落,加入装有50 μL无菌去离子水的PCR管中,混匀,94 ℃、10 min裂解,12 000 r/min离心5 min,收集上清液即菌裂解液,4 ℃保存。
1.3.3 分离株的16S rDNA和dnaJ序列分析

表1 PCR所用引物Table1 Primers used for PCR

表2 PCR反应体系和条件Table2 PCR systems and conditions
PCR引物、体系和条件参见表1和表2,产物交苏州金唯智公司进行双向测序。对测序结果用Seqman2.0进行双向拼接、编辑后提交给GenBank和获得编号,序列比对:在http://www.ncbi.nlm.nih.gov/BLAST进行BLASTn比对。并用MEGA6.0软件(http://www.megasoftware.net)进行聚类分析。
2 结果与分析
2.1 样品总数的计数
因为样品数量有限,而且是5 L无菌袋,漂洗过滤量大,所以选用进口马铃薯葡萄糖琼脂培养基30 ℃培养,细菌和霉菌酵母都可以生长。培养后发现长出的菌落都
是细菌菌落的典型形态:细小菌落,多为表面较光滑有光泽,部分菌落表面粗糙不透明,单染色镜检也都是细菌。并未发现霉菌和酵母样菌落,显微观察也未发现霉菌和酵母形态。
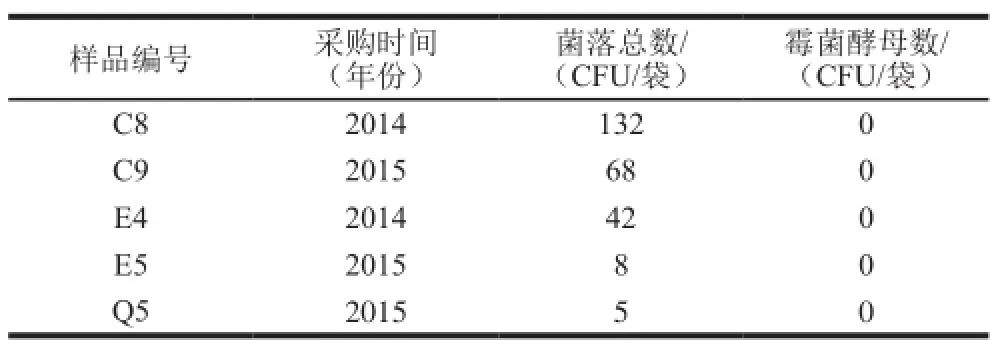
表3 样品的平板菌落计数结果Table3 Plate counts of samples
由表3可以看出,同一批次的2014年采购无菌袋都比2015年的细菌总数高,数量达到2 倍甚至更高,但是从菌落看菌落形态比较单一,尽量部分样品中菌落数量达到42~132,但是只有2~3 种不同形态的菌落,挑取不同形态的菌落进行后续分析。
2.2 污染菌的显微形态分析
这些污染菌的显微形态是杆菌和球菌,有的显微形态非常相似。根据分离平板的菌落形态和显微形态初步判断C8-3是葡萄球菌,而E5-1和Q5-2是芽孢杆菌(分离株编号前两位与样品编号对应,“-”之后的编号是从该样品分离计数皿中分离的菌株编号)。图1为部分分离株的显微形态。
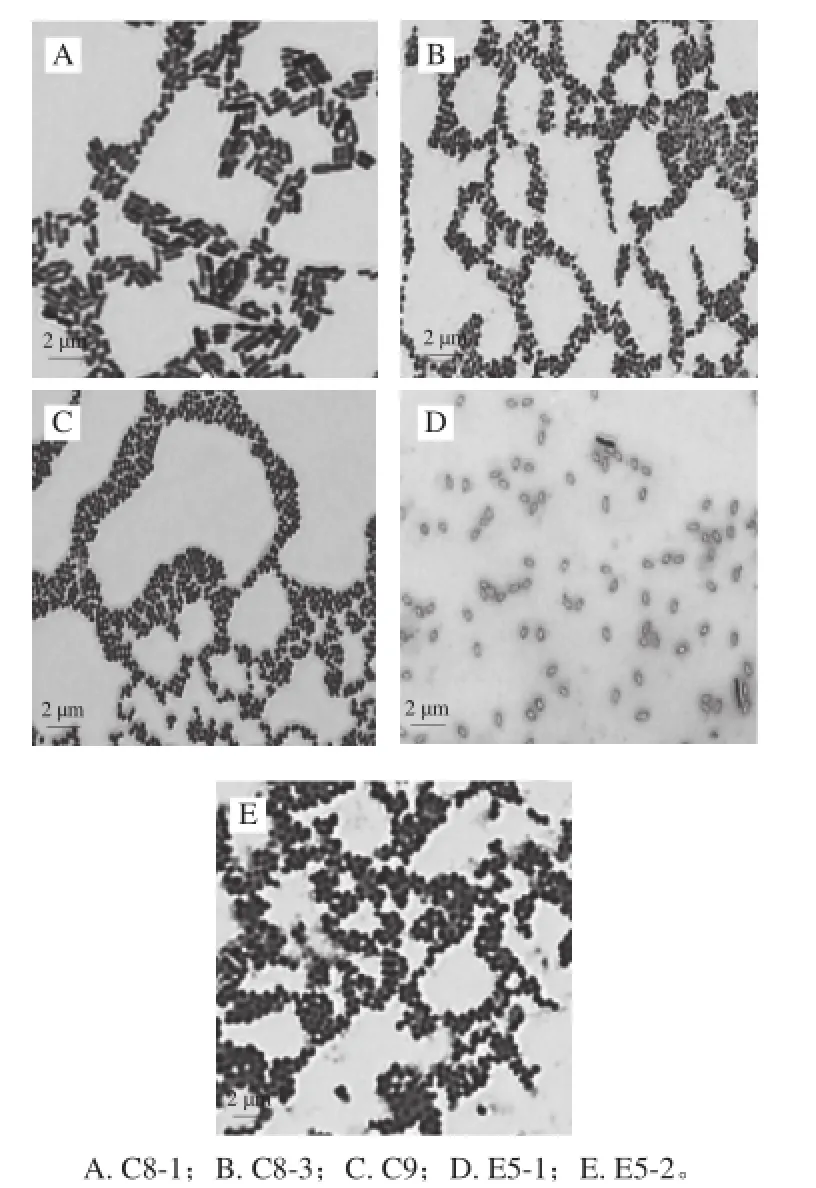
图1 部分分离株的单染色镜检Fig.1 Single staining microscopic observation of selected isolates
2.3 16S rDNA和dnaJ序列分析

图2 MEGA 6.0用邻近法基于16S rDNA基因序列构建的系统进化树Fig.2 Phylogenetic tree inferred by neighbor-joining method based on 16S rRNA gene sequences by MEGA version 6.0
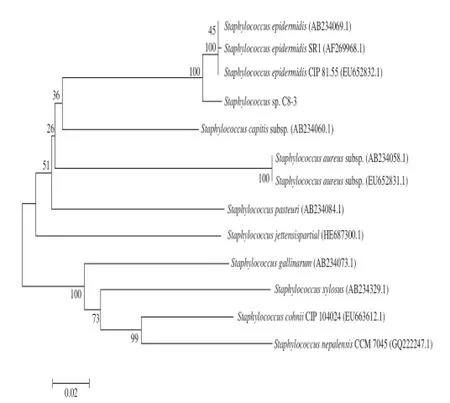
图3 MEGA 6.0用邻近法基于dnaJ基因序列构建的系统进化树Fig.3 Phylogenetic tree inferred by neighbor-joining method based on dnaJ gene sequences by MEGA version 6.0
菌株都作16S rDNA序列分析,只有C8-3因具有葡萄球菌的典型显微形态已经可以判断为葡萄球菌属细菌,所以本实验直接采用用于鉴定葡萄球菌属下种的dnaJ序列扩增和分析[7]。将所得测序结果提交于GenBank库进行BLASTN,16S rDNA序列分析鉴定到属:C8-1为栖水菌属;C8-2和Q5-1为微球菌属;C9为不动杆菌属;E4-1和E4-2为微杆菌属;E5-1和Q5-2为芽孢杆菌属;E5-2为考克斯菌属;C8-3通过dnaJ序列分析鉴定可到种-表皮葡萄球菌。它们的序列分析结果见表4。

表4 分离菌的16S rDNA和danJ序列分析Table4 Analysis of 16S rDNA and danJ sequences of 10 isolates
表4中值得关注的是3 个菌株:微球菌C8-2和Q5-1及芽孢杆菌Q5-2的最相似菌株来源都是航天器/宇宙飞船表面。比较16S rDNA和dnaJ序列,通过Mega 6.0软件邻近法构建进化树(图2、3)。
3 讨论与结论
营养体细胞耐受辐照能力强且很早就受到关注的有革兰氏阴性菌-莫拉氏菌-不动杆菌类(Moraxella-Acinetobacter group),假单胞菌(Pseudomonas radiora),革兰氏阳性菌:耐辐射微球菌(Micrococcus radiodurans)和嗜辐射微球菌(M. radiophilus)[8]。本实验中划线分离和鉴定得到的耐辐照株有栖水菌属(Enhydrobacter)、不动杆菌属(Acinetobacter)、考克斯菌属(Kocuria)、微球菌属(Micrococcus)、微杆菌属(Microbacterium)、芽孢杆菌属(Bacillus)和表皮葡萄球菌(Staphylococcus epidermidis)。一般食品腐败变质多以细菌性腐败为主,根据SN/T 2376—2009《番茄酱中主要腐败微生物的检验方法》[8]可知,芽孢杆菌和葡萄球菌等是能引起番茄酱产品腐败的主要微生物[9-10],而从本无菌袋中得到有芽孢杆菌、表皮葡萄球菌等微生物,可见辐照杀菌的无菌袋极有可能是送样企业产品的污染源之一。并且在其他类食品中,无菌袋中的检出的这些耐辐照菌株也可能导致包装食品的腐败变质,如:葡萄球菌和芽孢杆菌是肉制品的腐败菌[11];微球菌、葡萄球菌是鱼糜制品的腐败菌[12];不动杆菌是对虾的腐败菌株[13]。这无疑会对辐照杀菌的食品质量保障带来很多问题。此外食源性致病菌沙门氏菌(Salmonella)也曾在某些辐照杀菌的宠物食品中检出[14]对食品安全带来极大隐患。
从无菌袋得到的7 个属中,栖水菌属的相关研究报道甚少,目前已知的唯一种为气囊栖水菌(Enhydrobacter aerosaccus),经鉴定无菌袋中的栖水菌属与气囊栖水菌相似度为97%,具体菌种需经过生理生化特性等检验才能进一步确定,但不排除可能是一株栖水菌属新种;微球菌属广泛存在于自然界,是毒性不强的条件致病菌,一般不致病[15];不动杆菌属主要分布在水体和土壤中,易感染老年人和婴幼儿,重症者甚至死亡[16];微杆菌属一般发现于乳制品、污水和昆虫等;考克氏菌是分布广泛且适应力极强的微生物,可以从哺乳动物表皮、土壤、淡水等多种自然环境中分离得到。而另外的葡萄球菌属和芽孢杆菌属则是目前人们较为关注的。葡萄球菌属分布广泛,于空气、水、人和动物的体表及腔道都可能存在,某些种的葡萄球菌更是医学上是非常重要的病原菌之一[17],同时也是人们非常关注的致病菌(例如产生肠毒素引起食物中毒[18]的金黄色葡萄球菌)。无菌袋分离的一株葡萄球菌经dnaJ序列分析鉴定,确认为表皮葡萄球菌,该菌因细菌间的多糖黏附素作用,易于异物表面黏附和形成生物膜[19-22],且随着导尿管、人工关节等医疗器械的推广使用,表皮葡萄球菌已成为医院感染的主要病原菌[23],一旦感染致病,常难以治愈,对其存在的危险性不容轻视。芽孢杆菌属分布广泛,耐辐照性强,尤其是该属的枯草芽孢杆菌黑色变种,较之普通枯草芽孢杆菌对辐照的耐受性都有不同程度的提高[24]。在辐照处理过的中药中还曾分离出过该属中的弯曲芽孢杆菌(Bacillus flexus)[25-26],此外该属中的特里希芽孢杆菌(Bacillus tequilensis)还能高产多糖[27]。而由于耐辐照的枯草芽孢杆菌一般对人畜无害,在工业上有作为工业酶的主要生产菌,国内外也允许用于饲养添加剂内服[28]。
虽说一些耐辐照微生物具有危险性,但随着对耐辐照微生物的进一步探索,它们的潜在价值也是不可忽视的。例如芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paneibacillus)、欧文菌属(Erwinia)等属均有较高的耐重金属特性[29];葡萄球菌和芽孢杆菌能溶解念珠藻、铜绿微囊藻等多种蓝藻[30];微杆菌属不但具有耐辐照特性,还能对柴油进行降解[31]等,这些研究都表明深入探索耐辐照微生物,发掘它们的潜在价值,具有重要意义。
综上所述,经过15 kGy以上的辐照杀菌后的无菌袋上有多达7 种不同细菌存活,数量在5~132 CFU/袋,其中有番茄酱中常见的污染菌芽孢杆菌和葡萄球菌,也有
其他食品中常见的腐败菌微杆菌属、微球菌属、不动杆菌属和食品中较为少见的栖水菌属及考克氏菌属。它们的存在及对无菌袋包装的食品带来的质量风险值得食品包装材料行业重视。
[1] 吴雅静. 非热杀菌技术在食品加工中的应用研究[J]. 安徽农业科学, 2015(1): 242-243. DOI:10.3969/j.issn.0517-6611.2015.01.084.
[2] 王玮, 朱静, 张志东, 等. 原核耐辐射微生物资源研究及其应用前景[J]. 核农学报, 2013, 27(2): 177-182. DOI:10.11869/ hnxb.2013.02.0177.
[3] 何军. 我国科学家取得耐辐射微生物研究重大突破[N/OL]. (2010-05-04)[2016-01-06]. http://www.cas.cn/xw/kjsm/gndt/201005/ t20100504_2836554.shtml.
[4] DUGGAN D E. Physiological studies on radiation resistant bacteria occurring in food[D]. Corvallis: Oregon State University, 1961.
[5] VENKATESWARAN K, KEMPF M, CHEN F, et al. Bacillus nealsonii sp. nov., isolated from a spacecraft-assembly facility, whose spores are gamma-radiation resistant[J]. International Journal of Systematicand Evolutionary Microbiology, 2003, 53(1): 165-172.
[6] ALM E W, OERTHER D B, LARSEN N, et al. The oligonucleotide probe database[J]. Applied and Environmental Microbiology, 1996, 62(10): 3557-3559.
[7] SHAH M M, IIHARA H, NODA M, et al. dnaJ gene sequencebased assay for species identification and phylogenetic grouping in the genus Staphylococcus[J]. International Journal of Systematicand Evolutionary Microbiology, 2007, 57(1): 25-30. DOI:10.1099/ ijs.0.64205-0.
[8] 国家质量监督检验检疫总局. 番茄酱中主要腐败微生物的检验方法: SN/T 2376—2009[S]. 北京: 中国标准出版社, 2010.
[9] 杨红红, 陈国刚, 刘娅, 等. 桶装胀罐番茄酱中腐败菌分离纯化及鉴定研究[J]. 食品工业科技, 2014, 35(1): 164-167.
[10] 刘勤华, 黄明, 潘润淑, 等. 真空包装酱牛肉中腐败细菌的分离、初步鉴定与菌相变化分析[J].食品科学, 2009, 30(23): 297-300. DOI:10.3321/j.issn:1002-6630.2009.23.067.
[11] 仪淑敏, 王雪琦, 励建荣, 等. 市售鱼糜制品微生物菌相的初步分析[J].食品工业科技, 2013, 34(9): 183-185.
[12] 刘尊英, 郭红, 朱素芹, 等. 凡纳滨对虾优势腐败菌鉴定及其群体感应现象[J]. 微生物学通报, 2011, 38(12): 1807-1812.
[13] 王建玲, 张朝正, 张艺, 等. 宠物食品中耐辐照沙门氏菌的筛选与鉴定[J]. 中国酿造, 2011, 30(6): 48-50. DOI:10.3969/ j.issn.0254-5071.2011.06.013.
[14] 李钧, 杜生祥. 小儿微球菌败血症36 例临床分析[J]. 新乡医学院学报, 1989(4): 264-265.
[15] 翁心华, 四郎多吉. 不动杆菌属败血症38 例临床分析[J]. 中国实用内科杂志, 1992(9): 474-476.
[16] SANDERS S W, MAXCY R B. Patterns of cell division, DNA base compositions, and fine structures of some radiation-resistant vegetative bacteria found in food[J]. Applied and Environmental Microbiology, 1979, 37(1): 159-168.
[17] KLOOS W E, BANNERMAN T L. Update on elinical significance of coagulase-negative staphylococci[J]. Clinical Microbiology Reviews, 1994, 7: 117-140.
[18] 郭新梅, 康冀川, 焦彦朝. 葡萄球菌属的鉴定及分类方法研究[D]. 贵阳: 贵州大学, 2006. DOI:10.7666/d.y960246.
[19] THYLEFORS J D, HARBAARTH S, PITTET D. Increasing bacteremia due to coagulase-negative staphylococci: fiction or reality?[J]. Infect Control Hospital Epidemiology, 1998, 19(8): 581-589. DOI:10.1086/647878.
[20] CHRISTENSEN G D, SIMPSON W A, BISON A L, et al. Adherence of slime-pro-ducing Staphylococcus epodermidis to smooth surfaces[J]. Infection and Immunity, 1982, 37: 318-326.
[21] HEILMANN C, SCHWEITZER O, GERKE C, et al. Molecular basis of intercellular adhesion in the biofilm-forming Staphylococcus epodermidis[J]. Molicular Microbiology 1996, 20(5): 1083-1091.
[22] 王勇翔, 华林, 李平洋, 等. 表皮葡萄球菌生物膜形成与ica操纵子的相关性研究[J]. 中华微生物学和免疫学杂志, 2003, 23(6): 428-431. DOI:10.3760/j:issn:0254-5101.2003.06.007.
[23] 郭蓓宁, 施耀国. 表皮葡萄球菌纤维蛋白原结合基因的致病作用研究[D]. 上海: 复旦大学, 2004. DOI:10.7666/d.y960246.
[24] 陈晓明, 曹以诚, 萧主先, 等. 一株耐辐射枯草芽孢杆菌的辐照抗性研究[J]. 环境科学与技术, 2011, 34(9): 1-4. DOI:10.3969/ j.issn.1003-6504.2011.09.001.
[25] 邹朝晖, 邓钢桥, 赵军旗, 等. 中药中耐辐射微生物的分离及其耐辐射特性的研究[J]. 核农学报, 2007, 21(3): 261-263. DOI:10.3969/ j.issn.1000-8551.2007.03.014.
[26] 邹朝晖. 中药中一种耐辐射微生物分离、鉴定及理化性状研究[D].长沙: 湖南农业大学, 2007.
[27] 宋素琴, 楚敏, 王玮, 等. 一株高产多糖耐辐射菌的分离鉴定及其多糖的相关性质研究[J]. 新疆农业科学, 2014, 51(12): 2262-2268. DOI:10.6048/j.issn.1001-4330.2014.12.018.
[28] 陈晓明, 张建国, 柳芳, 等. 中子和γ射线辐射灭菌后残留菌的生物安全性初步研究[J]. 安全与环境学报, 2009, 9(5): 1-4. DOI:10.3969/ j.issn.1009-6094.2009.05.001.
[29] 朱静, 张志东, 宋素琴, 等. 辐射污染区土壤中耐重金属细菌的分离及其多样性[J]. 环境科学与技术, 2013, 36(12): 29-32.
[30] 彭超, 吴刚, 席宇, 等. 3 株溶藻细菌的分离鉴定及其溶藻效应[J]. 环境科学研究, 2003, 16(1): 37-40. DOI:10.3321/ j.issn:1001-6929.2003.01.010.
[31] 杨金凤. 砂箱中柴油降解菌株的分离鉴定[J]. 桂林理工大学学报, 2011, 31(3): 450-453. DOI:10.3969/j.issn.1674-9057.2011.03.022.
Isolation and Identification of Radiation Resistant Microorganisms Detected in Radiation Sterilize Pouches
JI Minghuai, GAO Wen, ZHOU Guoping*
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Objective: To count, isolate and identify the radiation-resistant microorganisms present in 5 L sterile pouches provided by a tomato paste producer, sterilized by radiation at doses equal to or greater than 15 kGy. Methods: The pouches were washed repeatedly with 3 L of sterile water. The water was filtrated through a membrane and then spread on medium plates for counting microbial colonies. Finally, the microorganisms were isolated, purified and identified at the genus and species levels by analysis of their 16S rDNA sequences and dnaJ sequences. Results: All 5 batches of samples were found to contain detecTablelevels of bacteria, varying from 5 to 132 CFU/pouch. After analysis of the 16S rDNA sequences of 9 typical colonies, a total of 6 genera were found, namely, Enhydrobacter, Acinetobacter, Kocuria, Micrococcus, Microbacterium and Bacillus. Among these, strain C8-3 was identified as Staphylococcus epidermidis by dnaJ sequence analysis. Conclusion: Although the quantity of the radiation resistant bacteria in sterile pouches is sparse, some of them survive the radiation. Those bacteria may cause more or less effects on food safety and the stability of food quality.
radiation resistant bacteria; radiation sterilized pouches; Acinetobacter sp.; Kocuria sp.; Micrococcus spp.; Microbacterium spp.; Bacillus spp.; Enhydrobacter sp.; Staphylococcus epidermidis
10.7506/spkx1002-6630-201622031
Q939.97
A
1002-6630(2016)22-0205-05
纪明淮, 高雯, 周帼萍. 经辐照杀菌的无菌袋中耐辐照微生物分离与鉴定[J]. 食品科学, 2016, 37(22): 205-209. DOI:10.7506/spkx1002-6630-201622031. http://www.spkx.net.cn
JI Minghuai, GAO Wen, ZHOU Guoping. Isolation and identification of radiation resistant microorganisms detected in radiation sterilize pouches[J]. Food Science, 2016, 37(22): 205-209. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201622031. http://www.spkx.net.cn
2016-01-14
武汉轻工大学大学生科研项目
纪明淮(1993—),男,本科生,研究方向为生物工程。E-mail:1056204780@qq.com
*通信作者:周帼萍(1971—),女,教授,博士,研究方向为食品微生物安全。E-mail:wjczgp@163.com
