SPME-GC-MS法分析草鱼汤烹制过程中挥发性成分变化
2016-12-06李金林涂宗财沙小梅庞娟娟唐平平
李金林,涂宗财*,张 露,沙小梅,王 辉,庞娟娟,唐平平
(1.江西师范大学化学化工学院,江西 南昌 330022;2.江西师范大学生命科学学院,功能有机小分子教育部重点实验室,江西 南昌 330022;3.南昌市食品药品检验所,江西 南昌 330012;4.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330045)
SPME-GC-MS法分析草鱼汤烹制过程中挥发性成分变化
李金林1,2,3,涂宗财1,2,4,*,张 露2,沙小梅2,王 辉4,庞娟娟2,唐平平2
(1.江西师范大学化学化工学院,江西 南昌 330022;2.江西师范大学生命科学学院,功能有机小分子教育部重点实验室,江西 南昌 330022;3.南昌市食品药品检验所,江西 南昌 330012;4.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330045)
采用固相微萃取和气相色谱-质谱联用技术,研究传统鱼汤烹制过程中挥发性成分的变化。草鱼肉块经油煎后与生姜、大蒜混合水煮制作鱼汤,煮制分为3 个时间段,0~10 min鉴定出挥发性化合物46 种,其中萜类20 种、芳香族9 种、醛类5 种、酮类2 种、醇类3 种、呋喃类3 种、含硫化合物3 种、其他1 种;11~20 min鉴定出挥发性化合物43 种,其中萜类22 种、芳香族3 种、醛类4 种、酮类1 种、醇类5 种、呋喃类2 种、含硫化合物4 种、其他2 种;21~30 min鉴定出挥发性化合物53 种,其中萜类21 种、芳香族5 种、醛类11 种、酮类3 种、醇类5 种、呋喃类2 种、含硫化合物3 种、其他3 种。这些化合物当中,萜和含硫化合物来源于生姜和大蒜,主要形成于煮制的初始阶段且含量在煮制过程中不断下降;醛、醇、酮等化合物主要由脂肪酸氧化形成,且在煮制过程中种类不断丰富,含量逐渐增加。油煎和调料添加是鱼汤风味化合物形成的主要原因,煮制是挥发性风味化合物种类不断丰富和含量平衡的过程。
草鱼汤;烹煮;固相微萃取;气相色谱-质谱联用;挥发性成分变化
草鱼(Ctenopharyngodon idella)又称白鲩,生长在我国平原地区的江湖中,是典型的草食性鱼类,也是我国“四大家鱼”中产量最大的鱼类[1]。据统计,2014年我国草鱼产量达537.68万 t,约占全国淡水养殖鱼产量的四分之一[2]。中国饮食文化源远流长,鱼的烹饪方法多种多样,包括煎、炸、煮、熏、烤、蒸等,不同的方法烹制的鱼制品风味不同。草鱼经油煎后与生姜、大蒜一起烹煮制作鱼汤是我国最传统方法之一。受国内风味成分鉴定技术落后的影响,国内对食品风味成分研究起步较晚,对草鱼及制品挥发性风味成分研究也较少,已开展的研究多集中在生鲜鱼肉及制品的挥发性成分分析,如施文正等[3]对比研究了野生草鱼和养殖草鱼、草鱼不同部位[4]及不同养殖时期[5]挥发性成分变化,极少数研究了熟制鱼肉及其制品挥发性成分[6],而鲜见对传统鱼汤烹煮过程中挥发性成分变化的研究,导致草鱼的烹饪完全凭个人经验,人为因素影响较大,这不利于我国草鱼的工业化加工与利用,也不利于我国风味化学理论的丰富与发展。
固相微萃取(solid phase micro-extraction,SPME)技术是一种高效、快捷、绿色的挥发性成分萃取与富集技术[7],气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用是应用最广泛的挥发性成分鉴定方法[8]。本实验以草鱼为研究对象,采用中国传统方法进行烹饪,应用SPME进行挥发性成分萃取,应用GC-MS进行挥发性成分的分离鉴定,通过实时在线研究挥发性成分的变化过程,探索鱼汤的主要风味成分及其形成过程,为我国草鱼的工业化利用,丰富我国“烹饪”的风味化学理论提供科学依据。
1 材料与方法
1.1 材料与试剂
草鱼(产于江西)、生姜、大蒜 市购;大豆油益海嘉里(南昌)粮油食品有限公司。
香精标品 美国Sigma-Aldrich公司;DRH-008S-R2 C8~C40正烷烃混标 美国AccuStandard公司;二氯甲烷(色谱纯) 天津大茂化学试剂厂;无水硫酸钠(分析纯) 广东西陇化工有限公司。
1.2 仪器与设备
SPME装置、75 μm碳分子筛/聚二甲基硅氧烷(carboxen/polydimethylsiloxane,CAR/PDMS)萃取头美国Supelco公司;7890A/5975 GC-MS联用仪 美国Agilent公司;C21-DC005型电磁炉 九阳股份有限公司;ZQ02CJ2不黏锅 浙江爱仕达电器股份有限公司。1.3 方法
1.3.1 草鱼汤烹制过程
新鲜草鱼两条,每条约1 kg,经宰杀、去头、去内脏、去鳞、清洗后,沿鱼背部两侧剖开,将鱼肉切成125 g鱼块,将鱼块均匀搭配保证鱼肉成分基本一致,每份样品250 g,共4 份,取3 份用于实验,结果取平均值。
将23 g大豆油倒入锅中,采用电磁炉在1 400 W条件下加热2 min,随后将鱼块放入锅中煎2 min(正反面各1 min),加入约80 ℃水1 000 mL,继续加热,待水沸腾后加入8.75 g生姜和4.5 g大蒜,盖上带出气孔锅盖后继续烹煮30 min,烹煮过程中进行挥发性成分萃取。
1.3.2 挥发性成分萃取
采用SPME装置进行挥发性成分的萃取,3 根萃取头按照说明书事先进行老化。在鱼汤烹煮过程中,将装有萃取头的SPME装置置于锅盖出气孔上方,将萃取头推出伸进出气孔中进行挥发性成分的吸附萃取,每10 min换一次萃取头,萃取结束后按吸附的顺序依次将萃取头插入GC-MS联用仪进行萃取物的解吸、分离和鉴定。
1.3.3 GC-MS条件
GC条件:DB-wax GC毛细管柱(30 m×0.25 mm,0.25 µm);进样口温度250 ℃;载气He;流速1.0 mL/min;采用不分流模式;升温程序:起始温度40 ℃,保持3 min,以5 ℃/min速率升至240 ℃,保持15 min[9]。
MS条件:电子电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃。
1.3.4 挥发性成分的鉴定与含量计算
将提取的各组分质谱信息与NIST 08质谱库进行对照,同时将各组分实测线性保留指数(linear retention indice,LRI)[10-11]与文献的相对保留指数进行比较初步确定各组分的成分,部分组分采用香精标品进一步确认[12],以MS解析所得峰面积代表各组分的含量。
2 结果与分析
2.1 鱼汤中挥发性成分的鉴定
鱼汤挥发性成分经SPME萃取后经GC-MS分析,不同阶段萃取的挥发性成分GC-MS总离子流图见图1。


图1 不同阶段挥发性成分GC-MS总离子流图Fig.1 GC-MS total ion chromatogram of volatile compounds formed during three periods of fish soup preparation
由表1可知,在0~10 min之间,共鉴定出46 种挥发性化合物,其中萜类20 种、芳香族9 种、醛类5 种、酮类2 种、醇类3 种、呋喃类3 种、含硫化合物3 种、其他1 种。在11~20 min之间,共鉴定出43 种挥发性化合
物,其中萜类22 种、芳香族3 种、醛类4 种、酮类1 种、醇类5 种、呋喃类2 种、含硫化合物4 种、其他2 种。在21~30 min之间,共鉴定出53 种挥发性化合物,其中萜类21 种、芳香族5 种、醛类11 种、酮类3 种、醇类5 种、呋喃类2 种、含硫化合物3 种、其他3 种。
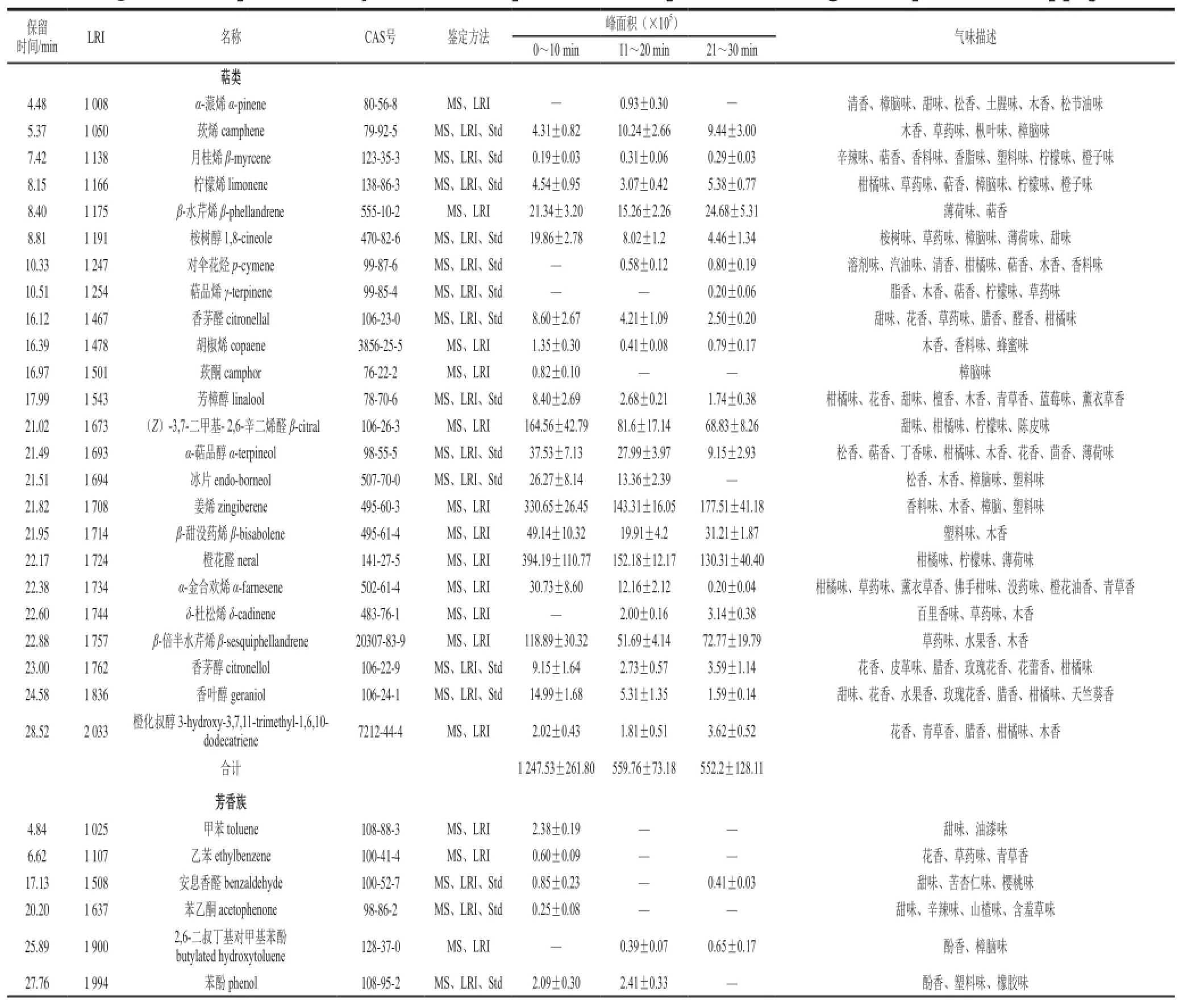
表1 鱼汤烹制过程中不同阶段形成的挥发性成分Table1 Qualitative and quantitative analysis and odor description of volatile compounds formed during different periods of fish soup preparation
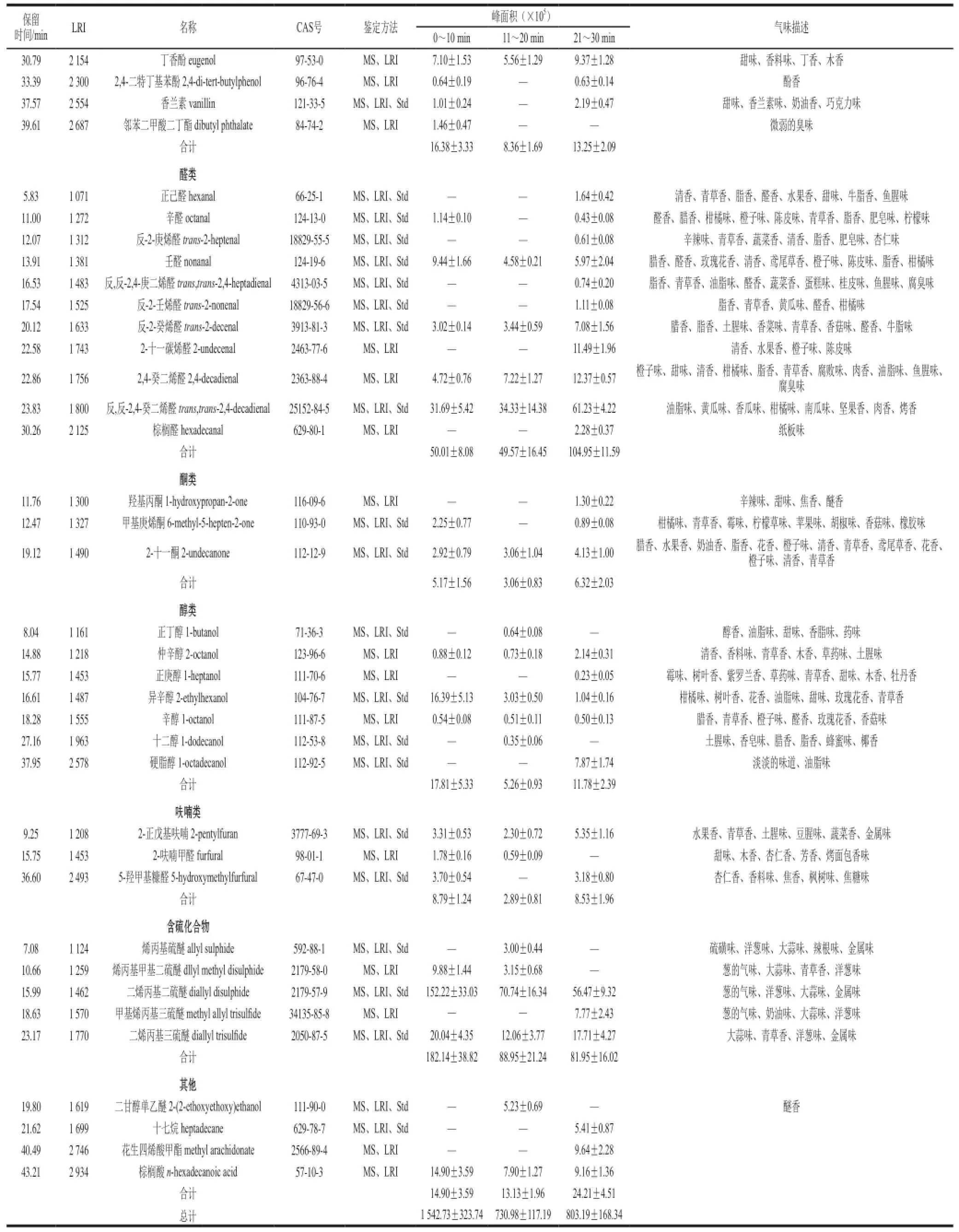
续表1
2.2 烹制过程挥发性成分的变化
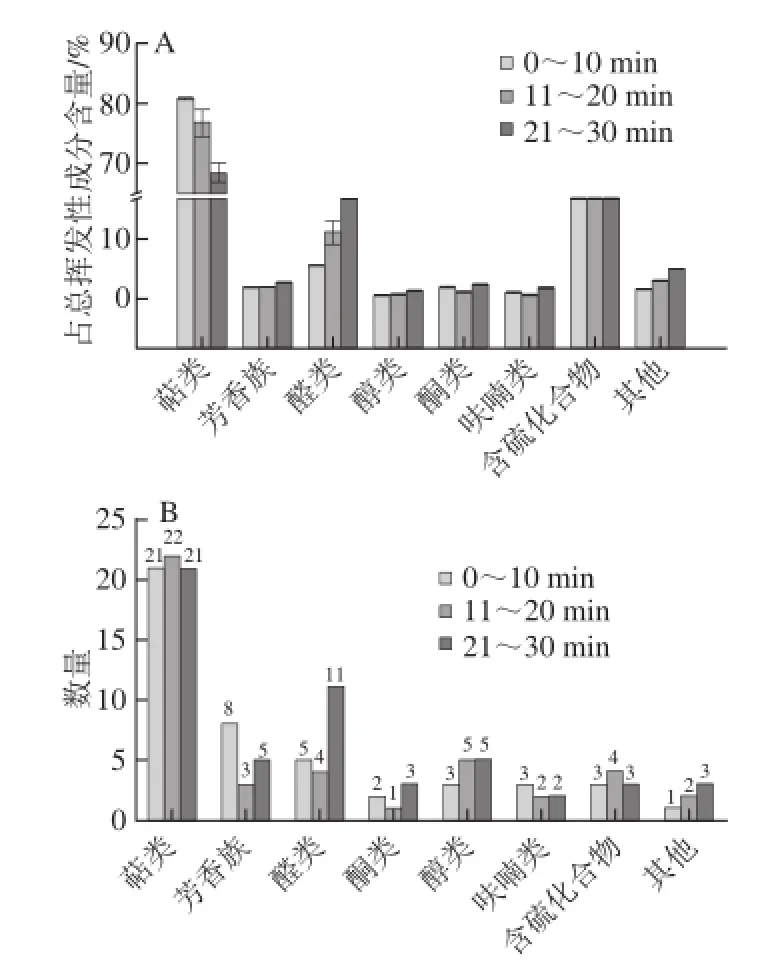
图2 不同阶段各类挥发性成分占总挥发性成分含量(A)及数量(B)Fig.2 Contents of different types of volatiles relative to total volatiles (expressed as peak area) (A) and numbers of volatiles belonging to different chemical classes (B) formed during three periods of fish soup preparation
新鲜鱼肉具有淡淡的清香味,鱼腥味甚至有土腥味,而经过烹煮后的鱼肉或鱼汤具有浓郁的香味[13]。油煎、水煮及调料添加是鱼汤产生浓郁香味重要的原因,且不同的阶段形成的挥发性风味成分往往不同,各成分对鱼汤整体风味的贡献也存在差异[14]。如表1和图2所示,第1阶段形成的挥发性物质主要为萜类和含硫化合物,占总挥发性物质含量分别达80.9%和11.8%,其他类别挥发性物质按含量高低依次是醛、醇、芳香族化合物、其他(醚、酯、烷、酸)、呋喃及酮。研究表明,萜类化合物是生姜的主要挥发性成分,Ge Lihong等[15]研究发现α-蒎烯、莰烯、月桂烯、柠檬烯、β-水芹烯、桉树醇、对伞花烃、芳樟醇、β-甜没药烯、姜烯、β-倍半水芹烯和α-金合欢烯是生姜精油的主要成分。Bartley等[16]从干生姜中鉴定出大量的萜类化合物,包括α-蒎烯、莰烯、月桂烯、柠檬烯、β-水芹烯、萜品烯、香茅醛、芳樟醇、冰片、姜烯、β-甜没药烯、α-金合欢烯、β-倍半水芹烯、香茅醇和香叶醇等。因此,鱼汤中的萜类化合物主要是生姜中的萜类化合物在煮制过程中不断的溶解而来。萜类主要赋予鱼汤花香、香菜味、樟脑味、青草味和草药味[17],这些香味能有效的掩盖鱼汤的鱼腥味并丰富鱼汤的风味。烯丙基甲基二硫醚、二烯丙基二硫醚、二烯丙基三硫醚含硫化合物是一类重要的香味物质,其存在于大蒜、洋葱、藠头等原材料中,具有硫磺味、大蒜味、洋葱味和辣根味,且含硫化物的风味阀值低,是烹饪时采用这类物质进行去腥、脱臭和调味的主要原因[18],鱼汤中的含硫化合物主要来源于大蒜。因此,调料是鱼汤香味成分的主要来源之一。
一般来讲,鱼及鱼制品中的醇和羰基化合物(醛、酮、醇)由鱼脂肪酸的氧化形成,有研究表明鱼油多不饱和脂肪酸的酶解氧化可形成5-、6-、8-、9-和11-碳醇及羰基化合物,而鱼油多不饱和脂肪酸的自动氧化则产生6-、7-、8-、9-和10-碳醇及羰基化合物,5-、11-、10-碳醇及羰基化合物是区别自动氧化和酶解氧化产物的主要标志物[19-20]。由于鱼汤中同时鉴定出了10-碳(反-2-癸烯醛、2,4-癸二烯醛和反-2,4-癸二烯醛)和11-碳(2-十一碳烯醛和2-十一酮)羰基化合物,表明鱼油在油煎或水煮过程中同时发生了脂肪酸的酶解氧化和自动氧化,脂肪酸的氧化是鱼汤形成挥发性风味物质的重要反应。醇和羰基化合物具有脂香、清香、瓜果香、醇香、甜味等(表1),醇和羰基化合物的形成是鱼汤具有浓郁香味的重要原因。考虑到不经油煎的草鱼煮制后仅一股浓浓的鱼腥味,而很难闻出脂香、清香、瓜果香、醇香、甜味等令人愉悦的香味,表明油煎是启动脂肪氧化形成风味化合物的重要条件[21]。
值得注意的是,在第1阶段的鱼汤中还检测出呋喃类化合物,呋喃是一类重要的风味化合物,其产生的途径有脂肪的氧化、美拉德反应、碳水化合物的降解[22]。2-正戊基呋喃被证明可通过豆油热解氧化产生,第1阶段鱼汤中的2-正戊基呋喃很有可能是由油煎时大豆植物油氧化产生[23]。
进入第2阶段和第3阶段,挥发性成分总量及主要挥发性成分总量出现急剧下降,挥发性成分总峰面积由第1阶段的(1 542.73±323.74)×105下降至第2阶段的(730.98±117.19)×105和第3阶段的(803.19±168.34)× 105;萜类总峰面积由第1阶段的(1 247.53±261.80)× 105下降至第2阶段的(559.76±73.18)×105和第3阶段的(552.20±128.11)×105;含硫化合物总峰面积由第1阶段的(182.14±38.82)×105条件下降至第2阶段的(88.95±21.24)×105和第3阶段的(81.95±16.02)× 105,萜类占总挥发性成分的含量下降明显。结果表明,煮制容易引起挥发性成分的蒸发或氧化甚至其他的化学反应,这与Raghavan[24]和Schweiggert[25]等总结的一致。与第1阶段相比,第2阶段鱼汤中醛类化合物的数量基本保持不变但其占总挥发物质的含量上升,而第3阶段检测出的醛类化合物总量及其占总挥发物质的含量呈上升
趋势。其他类别挥发性成分总量变化不大,但总体呈先下降后上升。如图2B所示,与第1阶段相比,第2阶段挥发性物质数量变化不明显但挥发物的种类变化较大,新鉴定出了8 种化合物,包括α-蒎烯、对伞花烃、δ-杜松烯、2,6-二叔丁基对甲基苯酚、正丁醇、十二醇、烯丙基硫醚、二甘醇单乙醚,同时有11 种物质在水煮过程中挥发或发生反应被消耗。α-蒎烯、对伞花烃、δ-杜松烯也是生姜中的挥发性成分,烯丙基硫醚是大蒜氧化的产物,表明调料中挥发性物质的溶出或形成渐进的过程。第3 阶段共鉴定出53 种挥发性物质,与第2阶段相比增加了10 种,其中19 种为新鉴定出物质,包括萜品烯、安息香醛、2,4-二特丁基苯酚、香兰素、正己醛、辛醛、反-2-庚烯醛、反,反-2,4-庚二烯醛、反-2-壬烯醛、2-十一碳烯醛、棕榈醛、羟基丙酮、甲基庚烯酮、正庚醇、硬脂醇、5-羟甲基糠醛、甲基烯丙基三硫醚、十七烷和花生四烯酸甲酯,其中大量的羰基化合物如己醛、反-2-庚烯醛、反-2,4-庚二烯醛等仅在第3阶段被检测出,表明在第3阶段形成了大量的新挥发性风味物质,这进一步丰富了鱼汤的风味。
由于第1阶段鱼汤挥发性物质主要是萜类和含硫化合物,其含量过高,造成鱼汤的香味单一,呈现较重的生姜和大蒜味。到了第2阶段随着萜类和含硫化合物的挥发以及部分新物质的形成,鱼汤风味得到了一定的改善,到了第3阶段,鱼汤大量的挥发性醇及羰基化合物形成,萜类及含硫化合物达到了平衡,鱼汤风味变得丰富而浓郁。因此,煮制是鱼汤风味物质形成以及风味平衡的必备条件。
3 结 论
SPME-GC-MS是一种快速、有效挥发性成分分析鉴定的方法。应用SPME-GC-MS方法从中国传统方法烹制得到的鱼汤中鉴定出大量挥发性风味成分,包括萜类、含硫化合物、醛类、醇类、酮类、芳香族化合物、呋喃类等。油煎后煮制的初始阶段形成了大量的萜和含硫化合物以及少量的醛类、醇类、酮类、呋喃类、芳香族化合物等,萜类和含硫化合物分别来源于生姜和大蒜,在煮制过程中萜类和含硫化合物的种类基本保持不变但含量下降明显;醛类、醇类、酮类、呋喃类主要由脂肪酸氧化形成,在煮制过程中醇类及羰基化合物尤其是醛类化合物的种类及含量增加。油煎和调料添加是鱼汤风味化合物形成的主要原因,煮制是挥发性风味化合物种类不断丰富和含量平衡的过程。
[1] 孔丽娜. 电子鼻技术在草鱼鲜度及风味分析的应用研究[D]. 上海:华东理工大学, 2015: 2.
[2] 农业部渔业渔政管理局. 2015中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2015: 21-52.
[3] 施文正, 王锡昌, 陶宁萍, 等. 野生草鱼与养殖草鱼的挥发性成分[J]. 江苏农业学报, 2011, 27(1): 177-182. DOI:10.3969/ j.issn.1000-4440.2011.01.032.
[4] 施文正, 王锡昌, 杨薇, 等. 基于电子鼻的养殖草鱼不同部位挥发性成分分析[J]. 江苏农业科学, 2011, 39(6): 505-507. DOI:10.3969/ j.issn.1002-1302.2011.06.200.
[5] 施文正, 王锡昌, 刘源, 等. 养殖草鱼不同生长期挥发性成分的比较[J].食品科学, 2010, 31(20): 342-347.
[6] 付娜, 李小定, 熊善柏, 等. 顶空固相微萃取-气质联用法分析辅料对熟制草鱼鱼糜挥发性组分的影响[J]. 食品科学, 2011, 32(12): 264-268.
[7] 朱楠, 陶晨, 任竹君, 等. SPME-GC/MS分析都匀毛尖茶挥发性成分[J].云南大学学报(自然科学版), 2016, 38(1): 116-126.
[8] 牛远洋, 罗安伟, 刘焕军, 等. 番茄果实成熟突变体的研究进展[J].现代食品科技, 2016, 32(5): 95-100. DOI:10.13523/j.cb.20160113.
[9] 郭贝贝, 张兴, 李萌, 等. SPME-GC-MS和SDE-GC-MS分析无锡酱排骨的挥发性风味成分[J]. 精细化工, 2014, 31(6): 733-738.
[10] 李玲, 吕磊, 董昕, 等. 顶空气相色谱-质谱联用技术结合保留指数鉴别猫人参中的挥发性成分[J]. 药学实践杂志, 2016, 34(1): 52-55. DOI:10.3969/j.issn.1006-0111.2016.01.014.
[11] van den DOOL H, KRATZ P D. A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography[J]. Journal of Chromatography A, 1963, 11: 463-471. DOI:10.1016/S0021-9673(01)80947-X.
[12] 刘南南, 郑福平, 张玉玉, 等. SAFE-GC-MS分析酸牛奶挥发性成分[J]. 食品科学, 2014, 35(22): 150-153. DOI:107506/spkx1002-6630-201422028.
[13] ZENG M, ZHANG L, HE Z, et al. Determination of flavor components of rice bran by GC-MS and chemometrics[J]. Analytical Methods, 2012, 4(2): 539-545. DOI:10.1039/c2ay05671b.
[14] LI J L, TU Z C, ZHANG L, et al. Characterization of volatile compounds in grass carp (Ctenopharyngodon idellus) soup cooked using a traditional Chinese method by GC-MS[J]. Journal of Food Processing and Preservation, 2016. DOI:10.1111/jfpp.12995.
[15] GE Lihong, XU Yanshun, XIA Wenshui. The function of endogenous cathepsin in quality deterioration of grass carp (Ctenopharyngodon idella) fllets stored in chilling conditions[J]. International Journal of Food Science and Technology, 2015, 50(3): 797-803. DOI:10.1111/ ijfs.12713.
[16] BARTLEY J P, JACOBS A L. Effects of drying on favour compounds in Australian-grown ginger (Zingiber officinale)[J]. Journal of the Science of Food and Agriculture, 2000, 80(2): 209-215. DOI:10.1002/ (SICI)1097-0010(20000115)80:2<209::AID-JSFA516>3.0.CO;2-8.
[17] VARIYAR P S, GHOLAP A, THOMAS P. Effect of γ-irradiation on the volatile oil constituents of fresh ginger (Zingiber officinale) rhizome[J]. Food Research International, 1997, 30(1): 41-43. DOI:10.1016/S0963-9969(97)00010-0.
[18] GUILHON M S P G, SILVA E S D, SANTOS L D S, et al. Volatile and non-volatile compounds and antimicrobial activity of Mansoa difficilis (Cham.) Bureau & K. Schum: (Bignoniaceae)[J]. Química Nova, 2012, 35(11): 2249-2253. DOI:10.1590/S0100-40422012001100030.
[19] SHI W Z, CHEN Q Y, WANG X C, et al. Research on predominant volatile compounds of grass carp meat[J]. Advanced Materials Research, 2013, 781: 1852-1855. DOI:10.4028/www.scientific.net/ AMR.781-784.1852.
[20] SHI W Z, YING M M, WANG X C. Effect of seasons on volatile compounds in grass carp meat[J]. Advanced Materials Research, 2012, 554: 1565-1571. DOI:10.4028/www.scientifc.net/AMR.554-556.1565.
[21] ÖZYURT G, KAFKAS E, ETYEMEZ M. Effect of the type of frying oil on volatile compounds of goatfish (Upeneus pori) during cold storage[J]. International Journal of Food Science and Technology, 2011, 46(12): 2598-2602. DOI:10.1111/j.1365-2621.2011.02789.x.
[22] MESÍAS M, MORALES F J. Analysis of furan in coffee[J]. Coffee in Health and Disease Prevention, 2015, 110: 1005-1011. DOI:10.13140/2.1.2109.6009.
[23] KRISHNAMURTHY R, SMOUSE T, MOOKHERJEE B, et al. Identifcation of 2-pentyl furan in fats and oils and its relationship to the reversion favor of soybean oil[J]. Journal of Food Science, 1967, 32(4): 372-374. DOI:10.1111/j.1365-2621.1967.tb09687.x.
[24] RAGHAVAN S. Handbook of spices, seasonings, and flavorings[M]. 2nd ed. CRC Press, 2006.
[25] SCHWEIGGERT U, CARLE R, SCHIEBER A. Conventional and alternative processes for spice production: a review[J]. Trends in Food Science and Technology, 2007, 18(5): 260-268. DOI:10.1016/ j.tifs.2007.01.005.
SPME-GC-MS Analysis of Changes in Volatile Compounds during Preparation of Grass Carp Soup
LI Jinlin1,2,3, TU Zongcai1,2,4,*, ZHANG Lu2, SHA Xiaomei2, WANG Hui4, PANG Juanjuan2, TANG Pingping2
(1. College of Chemistry and Chemical Engineering, Jiangxi Normal University, Nanchang 330022, China;
2. Key Laboratory of Functional Small Organic Molecules, Ministry of Education, College of Life Science, Jiangxi Normal University, Nanchang 330022, China; 3. Nanchang Institute for Food and Drug Control, Nanchang 330012, China; 4. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330045, China)
Changes in volatile compounds during the preparation of traditional Chinese grass carp soup were analyzed by solid phase micro-extraction coupled with gas chromatography-mass spectrometry (SPME-GC-MS). Grass carp soup was prepared by cooking fried-fish-fillets with ginger and garlic. A total of 46 volatile compounds, including 20 terpenes, 9 aromatic compounds, 5 aldehydes, 2 ketones, 3 alcohols, 3 furans, 3 sulphur-containing compounds, and one other compound, were identified by GC-MS during the first 10 min of cooking, 43 volatiles (22 terpenes, 3 aromatic compounds, 4 aldehydes, 1 ketones, 5 alcohols, 2 furans, 4 sulphur-containing compounds, and 2 other compounds) were detected during 11–20 min, and 53 volatiles, including 21 terpenes, 5 aromatic compounds, 11 aldehydes, 3 ketones, 5 alcohols, 2 furans, 3 sulphur compounds, and 3 other compounds, were found during 21–30 min. Among these, terpene and sulphurcontaining compounds, which were derived from ginger and garlic, respectively, were formed during 0–10 min of cooking and decreased during 11–30 min, while aldehydes, ketones, and alcohols were resulted from the oxidation of lipids and their concentrations were increased during cooking. It could be concluded that flavor volatile compounds in fish soup were formed after frying or derived from spices, and were enriched and balanced during cooking.
grass carp soup; cooking; solid phase micro-extraction (SPME); gas chromatography-mass spectrometry (GCMS); volatile compound changes
10.7506/spkx1002-6630-201622022
TS254.1
A
1002-6630(2016)22-0149-06
李金林, 涂宗财, 张露, 等. SPME-GC-MS法分析草鱼汤烹制过程中挥发性成分变化[J]. 食品科学, 2016, 37(22): 149-154. DOI:10.7506/spkx1002-6630-201622022. http://www.spkx.net.cn
LI Jinlin, TU Zongcai, ZHANG Lu, et al. SPME-GC-MS analysis of changes in volatile compounds during preparation of grass carp soup[J]. Food Science, 2016, 37(22): 149-154. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622022. http://www.spkx.net.cn
2016-05-20
江西省重大生态安全问题监控协同创新中心资助项目(JXS-EW-00);
江西省现代农业产业技术体系建设专项(JXARS-04)
李金林(1983—),男,高级工程师,博士研究生,研究方向为风味化学。E-mail:lijinlin405@126.com
*通信作者:涂宗财(1965—),男,教授,博士,研究方向为食物资源开发与高效利用。E-mail:tuzc_mail@aliyun.com
