高效液相色谱法同时测定人参制剂中20 种人参皂苷方法的建立
2016-12-06杨艳文孟凡双郜玉钢张连学
杨艳文,孟凡双,郜玉钢*,张连学*
(吉林农业大学中药材学院,吉林 长春 130118)
高效液相色谱法同时测定人参制剂中20 种人参皂苷方法的建立
杨艳文,孟凡双,郜玉钢*,张连学*
(吉林农业大学中药材学院,吉林 长春 130118)
为了更加有效评价人参制剂生产质量,建立了一种同时测定人参制剂中20 种人参皂苷的高效液相色谱方法。结果表明,20 种人参皂苷Rg1、Re、Rg2、Rg3、Rg5、Rf、F1、F2、Rc、Rd、Rb1、Rb2、Rb3、Rh2、compound K、20(R)-Rh1、Rk3、Rh4、原人参二醇及原人参三醇均得到良好分离,线性关系良好(R≥0.999 2)。该方法快捷简便、稳定可靠,能够精确全面检测分析人参皂苷含量,对于人参加工品及其制剂的质量控制更为全面准确可行。
人参;人参皂苷;高效液相色谱;含量测定
人参皂苷是人参、西洋参及人参制剂中的主要活性成分[1-8],主要包括人参皂苷Rg1、Re、Rf、Rb1、Rb2等[9-10],对皂苷类成分的质量控制,是人参质量标准的核心内容。针对人参皂苷含量测定方法的研究报道比较多,如郜玉钢[11]、胥秀英[12]、刘志[13]、郭冲[14]、Wang Hongping[15]等分别报道了用高效液相色谱法测定人参及其制剂中9、12、14、16 种和19 种人参皂苷含量方法,但至今鲜见有用高效液相色谱法同时测定人参制剂中20 种人参皂苷的报道。人参样品在加工炮制过程中,人参皂苷受温度、酸碱度的影响,会发生转化,形成稀有人参皂苷[16];对于人参制剂,由于中药制剂处方复杂,在制备过程中,皂苷类物质则更容易发生结构转化形成次级皂苷[17-18]。因此,仅对人参炮制加工品及人参制剂所含的常见主要人参皂苷进行含量测定来控制产品质
量显然是不够的[19],本实验建立了用高效液相色谱-紫外检测方法同时测定包括常见主要人参皂苷、稀有皂苷在内的20 种人参皂苷(苷元)含量的方法,以求对人参加工品及其制剂的质量控制提供强有力的理论支持。
1 材料与方法
1.1 材料与试剂
人参生晒参;西洋参生晒参;生脉饮(生产批号1407001) 吉林敖东延边药业股份有限公司;人参健脾丸(生产批号4015661) 中国北京同仁堂(集团)有限责任公司。
人参皂苷对照品Rg1、Re、Rg2、Rg3、Rg5、Rf、F1、F2、Rc、Rd、Rb1、Rb2、Rb3、Rh2、compound K、20(R)-Rh1、Rk3、Rh4、原人参二醇及原人参三醇质量分数均在98%以上,批号分别为(201511、201523、201545、201506、201524、201537、201549、201521、201536、201579、201501、201551、201518、201543、201520、201515、201562、201571、201519、201513) 吉林大学天然药物化学实验室;甲醇、乙腈(均为色谱纯) 德国默克公司;纯净水 杭州娃哈哈公司;其余试剂为分析纯。
1.2 仪器与设备
LC-2010A高效液相色谱仪(配有LC-2010A型液相色谱泵、LC-2010A型自动进样器、BDS C18(250 mm×4.6 mm,5 μm)色谱柱、CLASS-vP色谱工作站)、AUY22电子分析天平 日本岛津公司;Anke TGL-16B型台式离心机 上海安亭科学仪器厂;KQ-250DV超声波清洗器 昆山舒美超声仪器有限公司。
1.3 方法
1.3.1 溶液配制
1.3.1.1 标准溶液
分别精密称取20 种人参皂苷Rg1、Re、Rg2、Rg3、Rg5、Rf、F1、F2、Rc、Rd、Rb1、Rb2、Rb3、Rh2、compound K、20(R)-Rh1、Rk3、Rh4、原人参二醇及原人参三醇对照品各5 mg,加甲醇配制成上述20 种人参皂苷的质量浓度分别为1.04、1.02、0.98、1.00、1.00、1.02、1.00、1.00、1.00、1.02、1.00、1.00、1.04、1.00、1.00、0.98、1.00、1.00、1.00、1.02 mg/mL的对照品溶液,经0.45 μm滤膜滤过,备用。
1.3.1.2 样品溶液
精密称取人参生晒参粉末1 g,加5 mL色谱甲醇,密封,超声提取45 min,静置过夜,再超声45 min,离心,取上清液,用0.45 μm滤膜滤过,备用。精密称取西洋参生晒参粉末1 g,加5 mL色谱甲醇,密封,超声提取45 min,静置过夜,再超声45 min,离心,取上清液,用0.45 μm滤膜滤过,备用。取生脉饮口服液,用0.45 μm滤膜滤过,备用。精密称取人参健脾丸大蜜丸1 丸(6 g),加10 mL色谱甲醇,超声提取45 min,过夜,再超声45 min,补足体积,混匀,静置,取上清液,离心,经0.45 μm滤膜滤过,备用。
1.3.2 色谱条件
色谱柱为C18柱(250 mm×4.6 mm,5 μm);柱温35 ℃,检测波长203 nm,流动相乙腈(A)-水(B)梯度洗脱(0~40 min,18%~21% A;40~42 min,21%~26% A;42~46 min,26%~32% A;46~66 min,32%~33.8% A;66~71 min,33.8%~38% A;71~77.7 min,38%~49.08 A;77.7~78 min,49.08%~49.1% A;78~82 min,49.1% A;82~83 min,49.1%~50.6% A;83~88 min,50.6%~59.6% A;88~89.8 min,59.6%~64.96% A;89.8~92 min,64.96%~65% A;92~97 min,65% A;97~102 min,65%~85% A;102~109 min,85% A;109~111 min,85%~18% A);流速1.0 mL/min,进样量20 μL。
2 结果与分析
2.1 色谱条件的优化
本实验以甲醇为空白对照,对照品进行全波长扫描(190~400 nm),结果人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rk3、F2、Rh4、Rg3、原人参三醇、compound K、Rg5、Rh2、原人参二醇对照品在203 nm处均有最大吸收,故选择该波长为检测波长。比较了20 种人参皂苷在不同色谱柱(Nucleosil C18(4.6 mm×150 mm,5 μm)、Hypersil ODS2(4.6 mm×250 mm,5 μm)、BDS C18(4.6 mm×l50 mm,5 μm))中的分离效果,结果表明BDS C18柱分离效果好,保留时间适中;在流动相的选择过程中,分别考察了甲醇-水、乙腈-水梯度洗脱等不同洗脱系统,结果表明乙腈-水梯度洗脱时20 种人参皂苷分离度好,故选择乙腈-水梯度洗脱为流动相。本实验还考察了不同洗脱流速的影响,结果表明当流速为1 mL/min时分离效果最好。
2.2 色谱峰归属
按1.3.2节色谱条件,对照品与样品高效液相色谱图,如图1所示。
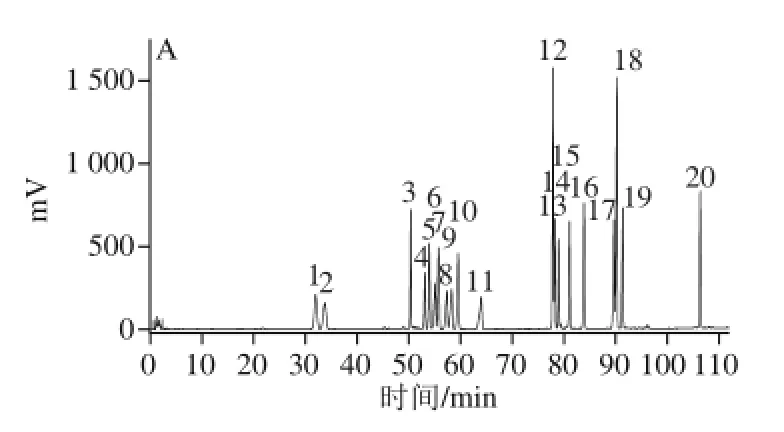

图1 混标和样品色谱图Fig.1 Chromatograms of mixed standard solution of ginsenosides and samples
2.3 线性关系考察
由图1可知,20 种人参皂苷得到良好地分离,按1.3.1节方法制备对照品溶液,分别精密吸取对照品溶液2、4、8、12、16、18、20 μL进行进样,以进样标准品溶液中人参皂苷的质量(Y)对峰面积积分值(X)作图,绘制20 个标准曲线,计算出20 个线性回归方程,得到相关系数r≥0.999 2,且呈良好的线性关系,见表1。
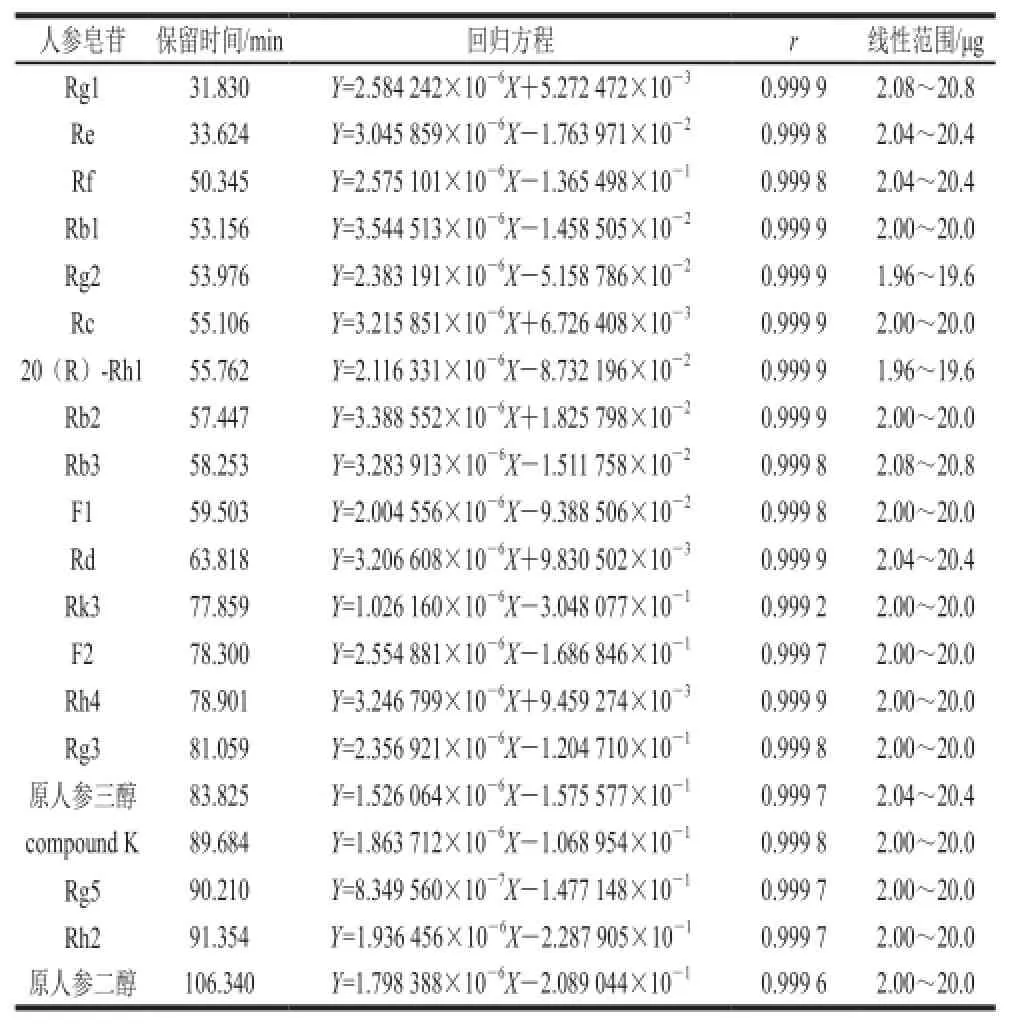
表1 人参皂苷的回归方程Table1 Regression equations with correlation coefficients for ginsenosides
2.4 检测限与定量限测定结果
在选定的色谱条件下,当信噪比为3时,测得人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rk3、F2、Rh4、Rg3、原人参三醇、compound K、Rg5、Rh2、原人参二醇的检测限分别为0.25、0.15、0.10、0.20、0.10、0.28、0.25、0.31、0.25、0.29、0.31、0.24、0.31、0.10、0.079、0.20、0.21、0.11、0.32、0.21 μg;当信噪比为10时,测得人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rk3、F2、Rh4、Rg3、原人参三醇、compound K、Rg5、Rh2、原人参二醇的定量限分别为0.70、0.40、0.23、0.23、0.65、0.71、0.78、0.82、0.71、0.72、0.67、0.76、0.70、0.35、0.155、0.65、0.48、0.64、0.71、0.82 μg。
2.5 精密度实验结果
按照2.1节优化的色谱条件,精密吸取对照品溶液20 μL,重复进样6次,人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rk3、F2、Rh4、Rg3、原人参三醇、compound K、Rg5、Rh2、原人参二醇峰面积的相对标准偏差分别为1.21%、1.13%、1.31%、0.63%、1.56%、1.25%、0.76%、1.05%、0.88%、0.98%、0.65%、1.16%、0.98%、1.26%、0.81%、0.69%、1.29%、1.58%、1.05%、0.86%,结果表明仪器的精密度良好。
2.6 稳定性实验结果
精密吸取人参健脾丸样品溶液,按1.3.2节色谱条件,在0、2、4、8、16、24 h进样20 μL,人参健脾丸
中人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rh4、Rg3、原人参三醇、compound K、Rg5、Rh2、原人参二醇峰面积的相对标准偏差分别为1.39%、1.72%、1.63%、1.76%、1.56%、1.98%、1.27%、1.79%、1.52%、1.48%、1.38%、1.87%、1.54%、2.01%、1.35%、1.67%、1.83%、1.41%,说明人参健脾丸溶液在24 h内稳定。
2.7 重复性实验结果
精密称取6 份同一厂家同一批号人参健脾丸,按供试品溶液制备方法制得供试品溶液,按1.3.2节色谱条件,分别进样20 μL,进行重复性实验,人参健脾丸中人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rh4、Rg3、原人参三醇、compound K、Rg5、Rh2、原人参二醇质量分数的相对标准偏差分别为1.88%、1.51%、1.35%、1.56%、1.75%、2.16%、2.39%、1.58%、1.83%、0.54%、1.26%、2.34%、0.31%、1.82%、0.18%、2.57%、1.07%、2.58%。
2.8 加样回收率实验结果
精密称取3 份已知人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rh4、Rg3、原人参三醇、compound K、Rg5、Rh2、原人参二醇含量(0.522 8、0.472 4、0.019 23、0.328 4、0.302 1、0.201 3、0.328 4、0.164 3、0.233 4、1.134 6、0.123 5、0.043 5、0.204 2、3.427 8、0.468 6、0.542 3、1.426 7、1.673 8%)的同一厂家同一批号人参健脾丸1丸,分别精确加入人参皂苷对照品Rg1(0.16、0.30、0.63 mg)、Re(0.13、0.25、0.54 mg)、Rf(0.007、0.012、0.025 mg)、Rb1(0.10、0.17、0.45 mg)、Rg2(0.08、0.16、0.34 mg)、Rc(0.06、0.11、0.25 mg)、20 (R)-Rh1(0.10、0.18、0.38 mg)、Rb2(0.06、0.10、0.24 mg)、Rb3(0.11、0.19、0.41 mg)、F1(0.40、0.68、1.32 mg)、Rd(0.042、0.07、0.16 mg)、Rh4(0.01、0.02、0.05 mg)、Rg3(0.07、0.15、0.34 mg)、原人参三醇(0.96、1.73、3.45 mg)、compound K(0.17、0.30、0.65 mg)、Rg5(0.15、0.28、0.60 mg)、Rh2(0.33、0.79、1.51 mg)、原人参二醇(0.51、0.89、1.73 mg),按供试品溶液的制备方法制备,按1.3.2节色谱条件测定,进行加样回收率实验,人参健脾丸中人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rh4、Rg3、原人参三醇、compound K、Rg5、Rh2、原人参二醇的平均回收率(相对标准偏差)分别为100.60%(1.21%)、102.42%(0.73%)、100.31%(1.52%)、99.47% (1.48%)、97.13%(1.59%)、102.03%(1.07%)、100.63%(0.79%)、101.57%(1.22%)、98.97% (0.92%)、100.79%(0.95%)、101.00%(1.49%)、97.33%(1.09%)、99.56%(0.98%)、99.91% (0.59%)、100.63%(0.85%)、98.91%(1.22%)、99.03%(1.42%)、100.69%(0.93%)。
2.9 样品测定结果
精密称取人参生晒参、西洋参生晒参、生脉饮、人参健脾丸按供试品溶液的制备方法制备出样品溶液,按1.3.2节色谱条件进样分析,根据上述线性回归方程计算样品中20 种人参皂苷的含量,见表2。
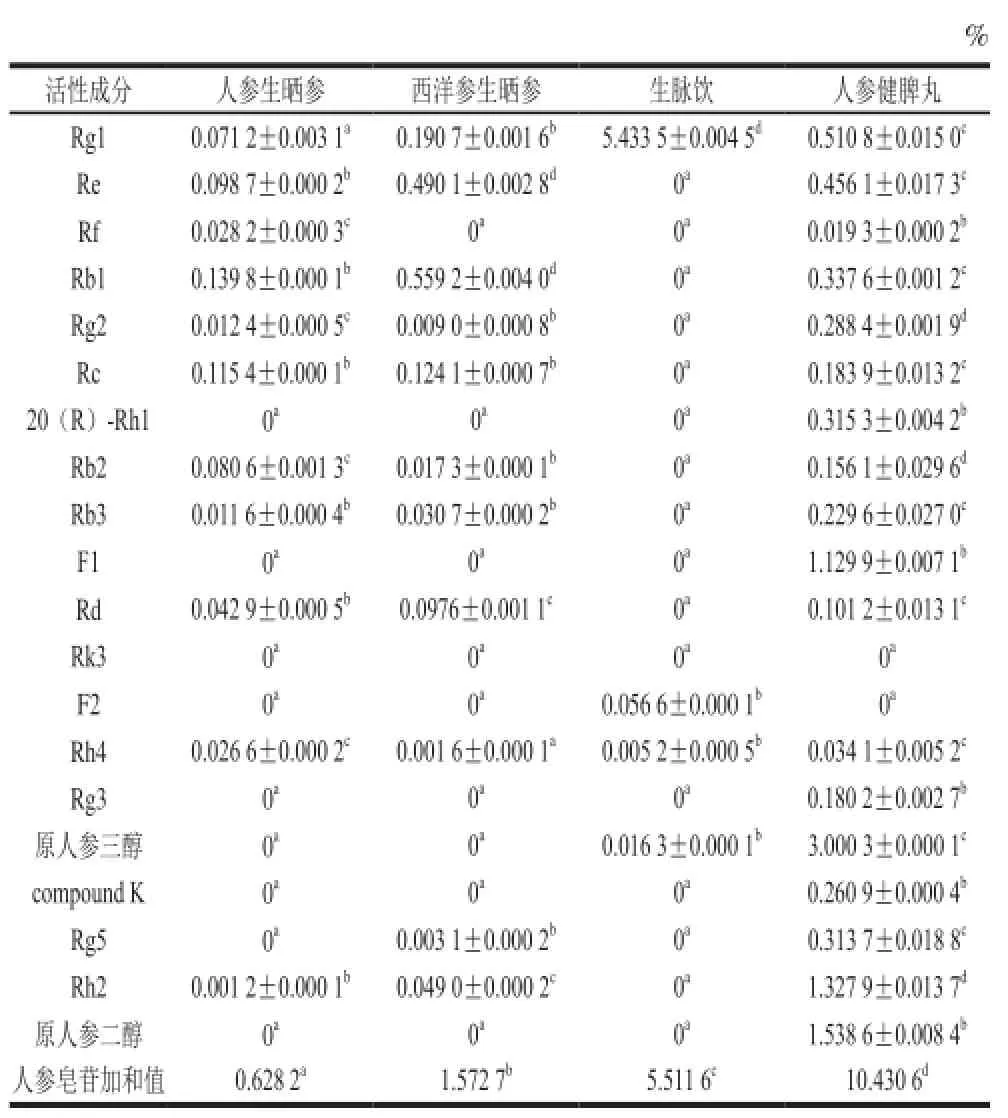
表2 人参及其制剂中20 种人参皂苷含量Table2 Contents of 20 ginsenosides in ginseng and ginseng preparations
表2表明,人参生晒参中,以人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、Rb2、Rb3、Rd、Rh4为主,少量存在的稀有皂苷Rh2可能是生晒参加工过程中产生的,未检测到人参皂苷20(R)-Rh1、F1、Rk3、F2、Rg3、原人参三醇、compound K、Rg5和原人参二醇。西洋参中以人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd、Rh2为主,还存在少量的Rg2、Rh4、Rg5,未检测到人参皂苷Rf、20(R)-Rh1、F1、Rk3、F2、Rg3、原人参三醇、compound K和原人参二醇。生脉饮中含有大量的人参皂苷Rg1,另外还含有少量的Re、Rb1、Rc、Rb2、Rd、F2、Rh4、原人参三醇,未检测到人参皂苷Rf、Rg2、20 (R)-Rh1、Rb3、F1、Rk3、Rg3、compound K、Rg5、Rh2、原人参二醇。人参健脾丸中含有大量的原人参二醇、原人参三醇和人参皂苷Rh2、F1,还含有人参皂苷Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、Rd、Rh4、Rg3、compound K、Rg5,未检测到人
参皂苷Rk3、F2。由实验结果可见人参生晒参、西洋参生晒参、生脉饮和人参归脾丸所含人参皂苷(苷元)无论是在组成,还是在含量方面都有着很大的差别,即使生脉饮和人参归脾丸是由人参生晒参入药制成,但这两种制剂与人参生晒参及两种制剂之间在人参皂苷组成和含量方面都有着很大的差异,这也说明人参中所含的人参皂苷类成分在人参制剂制备过程中受制备工艺及制剂处方中其他药材的影响,皂苷的结构发生了转化,致使人参皂苷的组成及含量发生了显著地变化[20]。
3 讨 论
人参、西洋参是大宗药材,除了以简单加工形成生晒参、红参等加工品销售使用外,更主要的是以原料的形式参与到中成药的制备中。人参的加工品在加工炮制过程中,人参皂苷受温度、酸碱度的影响,会发生转化,形成稀有人参皂苷[21],不同的加工工艺,皂苷转化程度和种类都会有很大差异[22-24];对于人参制剂,由于中药制剂处方非常复杂,在制剂制备过程中,皂苷类物质则更容易受到其他中药材化学成分的影响而发生结构转化形成次级皂苷。在样品测定部分,有的样品中未检测出该种人参皂苷,是样品中该种人参皂苷含量过低,低于定量限,所以未检测到。
本实验采用高效液相色谱-紫外检测器,其具有造价低、应用广泛等优点;流动相仅为乙腈和水,操作方便,并且解决了磷酸盐对色谱柱损耗大,系统清洗麻烦等问题;所用C18色谱柱(150 mm×4.6 mm,5μm)为普通色谱柱,便于购买。
本实验采用梯度洗脱程序,建立了一种同时测定人参制剂中20 种人参皂苷含量的分析方法,提高了效率;方法学考察表明,精密度、最低检测限、加样回收率的范围均符合相关标准,20 种人参皂苷分离完全,线性关系良好,所建立的方法快速简便,准确性、重复性好,稳定可靠。
采用本实验方法检测的人参生晒参、西洋参生晒参、生脉饮、人参归脾丸人参皂苷组成及含量结果也充分说明了人参中所含的人参皂苷类成分在人参制剂制备过程中受制备工艺及制剂处方中其他药材的影响,皂苷的结构发生了转化,致使人参皂苷的组成及含量发生了显著地变化[25]。因此,本实验建立的采用高效液相色谱-紫外检测方法同时测定包括常见主要人参皂苷、稀有皂苷在内的20 种人参皂苷(苷元)含量的方法,本方法还检测到人参茎叶特有皂苷F1和F2,可鉴别人参产品中是否掺入人参茎叶,这对于人参加工品及其制剂的质量控制相对于现有的人参皂苷含量测定法更为全面准确可行。
[1] 黎阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164-166. DOI:10.3321/j.issn:0253-2670.2009.01.049.
[2] 张萍, 张南平, 肖新月, 等. 人参皂苷类成分的化学分析[J].药物分析杂志, 2004, 24(3): 229-237. DOI:10.16155/j.0254-1793.2004.03.003.
[3] 徐静, 贾力, 赵余庆, 等. 人参的化学成分与人参产品的质量评价[J].药学评价研究, 2011, 34(3): 199-201.
[4] KIM H J, KIM P, SHIN C Y. A comprehensive review of the therapeutic and pharmacological effects of ginseng and ginsenosides in central nervous system[J]. Journal of Ginseng Research, 2013, 37(1): 8-29. DOI:10.5142/j.jgr.2013.37.8.
[5] SUN B. Repetitious steaming-induced chemical transformations and global quality of black ginseng derived from Panax ginseng by HPLCESI-MS/MSnbased chemical profling approach[J]. Biotechnology and Bioprocess Engineering, 2011, 16(5): 956-965. DOI:10.1007/s12257-011-0079-6.
[6] 郭秀丽, 高淑莲. 人参化学成分和药理研究进展[J]. 中医临床研究, 2012(14): 26-27. DOI:10.3969/j.issn.1674-7860.2012.14.013.
[7] 张前进. 人参的化学成分和药理活性[J]. 光明中医, 2011(2): 368-369. DOI:10.3969/j.issn.1003-8914.2011.02.118.
[8] 孙娜, 徐钢, 徐珊, 等. 人参炮制对其化学成分和药理作用的影响[J]. 中国药房, 2016(6): 857-859. DOI:10.6039/ j.issn.1001-0408.2016.06.45.
[9] 曹智, 张燕娣, 许永华, 等. 人参有效成分及其药理作用研究新进展[J]. 人参研究, 2012, 24(2): 39-43. DOI:10.3969/ j.issn.1671-1521.2012.02.014.
[10] ZHANG K, WANG X, DING L, et al. Determination of seven major ginsenosides in different parts of Panax quinquefolius L. (American Ginseng) with different ages[J]. Chemical Research China University, 2008, 24(6): 707-711.
[11] 郜玉钢, 郝建勋, 臧埔, 等. 高效液相色谱法测定农田人参中9 种人参皂苷单体含量[J]. 食品科学, 2012, 33(2): 189-192.
[12] 胥秀英, 郑一敏, 傅善权, 等. HPLC同时测定人参药材中12 种人参皂昔的含量[J]. 中国中药杂志, 2011, 36(11): 1463-1465.
[13] 刘志, 阮长春, 刘天志, 等. HPLC法同时测定林下参、鲜人参、生晒参和红参中14 种人参皂苷[J]. 中草药, 2012, 43(12): 2431-2434.
[14] 郭冲, 郜玉钢, 臧埔, 等. HPLC法同时测定人参及其制剂中16 种人参皂苷[J]. 中草药, 2014, 45(14): 2009-2013.
[15] WANG Hongping, ZHANG Youbo , YANG Xiuwei, et al. Rapid characterization of ginsenosides in the roots and rhizomes of Panax ginseng by UPLCDAD-QTOF-MS/MS and simultaneous determination of 19 ginsenosides by HPLC-ESI-MS[J]. Journal of Ginseng Research, 2015, 149: 1-13. DOI:10.1016/j.jgr.2015.12.001.
[16] 张伟云, 陈全成, 郑毅男, 等. RP-HPLC测定人参各部位人参皂苷Compound K的含量[J]. 药物分析杂志, 2007, 27(1): 1-3. DOI:10.16155/j.0254-1793.2007.01.003.
[17] 华国栋, 巩颖, 刘文亚, 等. 不同炮制方法对人参皂苷及农药残留的影响[J]. 北京中医药, 2014, 33(8): 627-631. DOI:10.16025/j.1674-1307.2014.08.030.
[18] WANA J Y, FANA Y, YUB Q T, et al. Integrated evaluation of malonyl ginsenosides, amino acids and polysaccharides in fresh and processed ginseng[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 107: 89-97. DOI:10.1016/j.jpba.2014.11.014.
[19] 陈振. 人参饮品类食品加工过程中人参皂普的变化规律研究[D].长春: 吉林农业大学, 2014.
[20] 胡振宁. 炮制对于中药化学成分的影响[J]. 中医临床研究, 2013, 5(3): 99-100.
[21] 张乐, 宋凤瑞, 王琦. 人参稀有皂苷的研究[J]. 长春中医药大学学报, 2010, 6(2): 275-277. DOI:10.13463/j.cnki.cczyy.2010.02.061.
[22] 刘忠英. 中药化学成分在炮制、配伍和提取过程中的化学变化及其转运机制的研究[D]. 长春: 吉林大学, 2005.
[23] 张淼, 秦昆明, 李伟东, 等. 人参炮制过程中化学成分变化及机制研究[J]. 中国中药杂志, 2014(19): 3701-3706.
[24] 蔡宝昌, 秦昆明, 吴皓, 等. 中药炮制过程化学机理研究[J]. 化学进展, 2012(4): 637-649.
[25] 张淼, 秦昆明, 李伟东, 等. 人参炮制过程中化学成分变化及机制研究[J]. 中国中药杂志, 2014, 39(19): 3701-3706.
Simultaneous Determination of Twenty Ginsenosides in Ginseng Preparations by HPLC
YANG Yanwen, MENG Fanshuang, GAO Yugang*, ZHANG Lianxue*
(College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China)
In order to evaluate the quality of ginseng preparations, a simple and accurate HPLC method for determining the contents of twenty ginsenosides was established. The results suggested that twenty ginsenosides (ginsenoside Rg1, Re, Rf, Rb1, Rg2, Rc, 20(R)-Rh1, Rb2, Rb3, F1, Rd, Rk3, F2, Rh4, Rg3, protopanaxatriol, compound K, Rg5, Rh2 and protopanaxadiol) were separated at baseline with good linearity (R ≥ 0.999 2). The method is simple, fast, accurate, and could be applied in the quality control of ginseng preparations.
Panax ginseng; ginsenoside; HPLC; determination
10.7506/spkx1002-6630-201622019
R917
A
1002-6630(2016)22-0131-05
杨艳文, 孟凡双, 郜玉钢, 等. 高效液相色谱法同时测定人参制剂中20 种人参皂苷方法的建立[J]. 食品科学, 2016, 37(22): 131-135. DOI:10.7506/spkx1002-6630-201622019. http://www.spkx.net.cn
YANG Yanwen, MENG Fanshuang, GAO Yugang, et al. Simultaneous determination of twenty ginsenosides in ginseng preparations by HPLC[J]. Food Science, 2016, 37(22): 131-135. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622019. http://www.spkx.net.cn
2016-04-07
国家重点研发计划项目(2016YFC0500303);国家公益性行业(农业)科研专项(201303111);
吉林省基础研究项目(20130102075JC);吉林省重点科技成果转化项目(20160307005YY;20140311050YY;20140307012YY)
杨艳文(1979—),男,讲师,博士,研究方向为药用植物栽培与加工。E-mail:yanwen_79@163.com
*通信作者:郜玉钢(1969—),男,教授,博士,研究方向为生药学。E-mail:gaoyugang_2006@163.com
张连学(1955—),男,教授,博士,研究方向为中药学。E-mail:zlx863@163.com
