高效液相色谱法定量测定果蔬中甲醛含量
2016-12-06刘永翔阚建全
李 俊,刘永翔,王 辉,刘 嘉,刘 辉,阚建全*
(1.西南大学食品科学学院,重庆 400715;2.贵州省生物技术研究所,贵州 贵阳 550006)
高效液相色谱法定量测定果蔬中甲醛含量
李 俊1,2,刘永翔2,王 辉1,2,刘 嘉1,2,刘 辉2,阚建全1,*
(1.西南大学食品科学学院,重庆 400715;2.贵州省生物技术研究所,贵州 贵阳 550006)
通过五氟苯肼与甲醛进行衍生,建立高效液相色谱法定量测定果蔬中甲醛含量的分析方法。样品在温度为60 ℃超声波条件下直接提取衍生30 min,离心纯化后高效液相色谱检测,外标法定量。优化的色谱条件为:XDB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相:乙腈-水(70∶30,V/V),流速1.0 mL/min,柱温40 ℃,检测波长258 nm。结果表明,该方法的定量检测限可达到0.114 mg/kg,在0.114~57 mg/L范围内呈良好的线性关系,当甲醛添加量分别为1.14、8.55、17.10 mg/kg时,平均回收率为81.4%~101.8%,相对标准偏差为2.6%~5.0% (n=6)。该方法样品前处理简便、稳定性好、检测限低,适合果蔬中甲醛含量的快速检测。
果蔬;甲醛;高效液相色谱;五氟苯肼
甲醛,俗称蚁醛,分子式为HCHO,在常温条件下是一种无色具有强烈刺激性气味的气体[1]。甲醛是原生质毒物,能与蛋白质结合,吸入高浓度甲醛后,会出现呼吸道的严重刺激,引发支气管哮喘,孕妇长期吸入甲醛可导致新生婴儿畸形甚至死亡,男子长期吸入甲醛可导致精子畸形和死亡,甲醛还有遗传毒性和致癌性[2-4]。甲醛具有防腐、延长保质期、增加持水性、韧性等功效[5],在一些树脂成型的包装材料(如三聚氰胺、脲醛树脂、酚醛树脂等)中,存在一定量的游离甲醛,做为食品贮运的容器长期使用,或者受到酸、碱的侵蚀,就易老化
分解,造成甲醛溶出,对食品造成污染[6-7]。
甲醛在果蔬组织中主要以游离状态存在于组织液中,有极少部分会以结合态形式存在,要检测果蔬中的甲醛含量,首先要把甲醛从果蔬组织中提取出来才行[8-9]。目前,在甲醛检测中应用较多的提取方法是水蒸气蒸馏法和直接蒸馏法,蒸馏法的优点是获得的甲醛提取液样品中杂质较少,干扰较小,但蒸馏过程中经高温加热会导致食品中的某些成分发生如美拉德反应、氧化分解、Strecker降解反应、糖类的脱水和热解反应等化学反应[10-11],可能会生成甲醛和其他挥发性物质,同时本身的甲醛因加热蒸馏也会损失,从而使甲醛含量发生变化,不能真实反映样品中的甲醛含量,而且蒸馏装置复杂、费时、效率低下,不适合批量样品的处理[12-13]。超声波提取法是现在提取技术中应用比较多的提取方法,具有操作简便等优点,但是否适合果蔬中甲醛的提取,国内外还鲜见研究报道。
目前测定食品中甲醛含量的方法主要有分光光度法[14-15]、高效液相色谱法[16]、气相色谱法[17-18]等。甲醛检测常用的方法是首先使甲醛与衍生剂X在一定条件下反应生成一种稳定的甲醛-X衍生物后进行检测,不同的衍生剂反应条件不一,与甲醛结合生成的衍生物性状也不同,因此不同衍生剂适用的检测方法也不一样[19-20]。现有甲醛检测标准方法中常用的衍生剂有乙酰丙酮和2,4-二硝基苯肼,前者主要用于分光光度法检测时衍生,后者主要用于色谱法检测时衍生,由于果蔬样品大多含有不同颜色,超声波提取法所得样品溶液对乙酰丙酮分光光度法检测造成一定的干扰,而2,4-二硝基苯肼与甲醛的衍生物在水中溶解度低,稳定性差,通过有机溶剂萃取溶解可以提高其稳定性,但操作繁琐,处理过程中会造成甲醛损耗[21-23]。因此,本实验通过超声波提取结合五氟苯肼与甲醛衍生[24],建立了一种新的更适用于果蔬中甲醛检测的高效液相色谱法,并且与现有标准SNT 1547—2011《进出口食品中甲醛的测定:液相色谱法》2,4-二硝基苯肼液相色谱法进行对比,确定一种稳定性好、简便高效的果蔬中甲醛含量的定量分析方法。
1 材料与方法
1.1 材料与试剂
苹果、橘子、白菜、萝卜、辣椒、西兰花、姜 重庆市购。
五氟苯肼标准品(37.0%~40.0%甲醛溶液,用碘量法[25]标定其精确质量浓度为1.14 mg/mL,配制甲醛标准使用液质量浓度为114 μg/mL) 美国Sigma公司;乙腈为色谱纯,其他试剂均为分析纯;所用水为超纯水。
1.2 仪器与设备
1290超高效液相色谱仪、Eelipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm) 美国Agilent公司;DK-8D型三孔电热恒温水槽 上海齐欣科学仪器有限公司;FA2004型分析天平 上海精密科学仪器有限公司;KQ3200DB型数控超声波清洗器 昆山市超声仪器有限公司;722-P型紫外-可见分光光度计 上海现代仪器有限公司。
1.3 方法
1.3.1 色谱条件的优化
取200 μL 114 μg/mL甲醛标准使用液于10 mL容量瓶中,加入1.0 mL 3.0 mg/mL五氟苯肼衍生剂,用蒸馏水定容至10 mL,在温度60 ℃条件下水浴加热30 min,然后在高效液相色谱仪上用二极管阵列检测器做全波长扫描,确定最佳吸收波长。选取乙腈和水作为流动相,流速1.0 mL/min,柱温40 ℃,使流动相比例分别为乙腈-水(60∶40、70∶30、75∶25、80∶20、90∶10,V/V)来确定最佳流动相比例。同时根据最佳流动相比例调节柱温分别为30、35、40 ℃来确定最佳柱温。
1.3.2 衍生反应条件的单因素试验
1.3.2.1 反应温度对衍生反应的影响
取6 个10 mL容量瓶,分别加入200 μL 114 μg/mL甲醛标准使用液,加入1.0 mL 3.0 mg/mL五氟苯肼衍生剂,用蒸馏水定容至10 mL,在水浴温度分别为30、40、50、60、70、80 ℃的条件下衍生30 min,取出后在流水中快速冷却,取少许溶液过0.22 μm混合相滤膜,高效液相色谱检测。重复3 次。
1.3.2.2 反应时间对衍生反应的影响
取6 个10 mL容量瓶,分别加入200 μL 114 μg/mL甲醛标准使用液,加入1.0 mL 3.0 mg/mL五氟苯肼衍生剂,用蒸馏水定容至10 mL,在水浴温度60 ℃的条件下分别反应10、20、30、40、50 min,然后按照1.3.2.1节方法处理。
1.3.2.3 五氟苯肼衍生剂加入量对衍生反应的影响
取10 个10 mL容量瓶,分作A、B两组,每组5 个,A、B两组分别加入200、500 μL 114 μg/mL甲醛标准使用液,然后每组中依次加入0.6、0.8、1.0、1.2、1.4 mL 3.0 mg/mL的五氟苯肼衍生剂,用蒸馏水定容至10 mL,在水浴温度为60 ℃的条件下反应30 min,然后按照1.3.2.1节方法处理。
1.3.3 衍生反应条件的正交试验

表1 衍生反应条件的正交试验因素水平Table1 Factors and levels used in orthogonal array design for the optimization of derivative reaction conditions
根据单因素试验结果,选择对衍生反应有影响的3 个因素:衍生剂加入量、反应温度、反应时间,进行正交优化试验,分别测定每组的峰面积。
1.3.4 超声波提取法中甲醛提取剂用量的确定
准确称取打碎后的白菜样品10.00 g,置于100 mL具塞离心管中,每份样品中分别加入2.0、3.0、4.0、5.0、6.0、7.0、8.0 mL 3.0 mg/mL的五氟苯肼衍生剂,分别补足蒸馏水至20、30、40、50、60、70、80 mL,设定超声波功率100 W、提取温度60 ℃、提取时间30 min,然后在离心机上8 000 r/min离心5 min,过0.22 μm混合相滤膜,液相色谱检测。重复3 次。并做空白对照。
1.3.5 超声波提取法其他提取条件的单因素试验
1.3.5.1 超声波提取时间对果蔬中甲醛提取效果的影响
准确称取打碎后的西兰花、白萝卜、白菜样品各10.00 g,置于100 mL具塞离心管中,依次加入35 mL蒸馏水,5.0 mL 3.0 mg/mL的五氟苯肼衍生剂,在超声波功率100 W、提取温度50 ℃条件下分别超声提取10、20、30、40、50、60 min,然后依次加入2.5 mL 21.9%的乙酸锌溶液,2.5 mL 106 g/L的亚铁氰化钾溶液,在离心机上8 000 r/min离心5 min,将上清液转移入50 mL容量瓶中,用少量蒸馏水(约5 mL)清洗残渣1 次,在离心机上8 000 r/min离心5 min,合并上清液并用蒸馏水定容至50 mL,即为样品待测液。取少许溶液过0.22 μm混合相滤膜,液相色谱检测。重复3 次。
1.3.5.2 超声波提取功率对果蔬中甲醛提取效果的影响
设定超声波功率分别为50、60、70、80、90、100 W,在温度50 ℃条件下超声提取30 min,其他处理同1.3.5.1节。
1.3.5.3 超声波提取温度对果蔬中甲醛提取效果的影响
设定水浴温度分别为40、50、60、70、80、90、100 ℃,在超声波功率100 W条件下超声提取30 min,其他处理同同1.3.5.1节。
1.3.5.4 超声波提取次数对果蔬中甲醛提取效果的影响
准确称取打碎后的西兰花、白萝卜、白菜样品各3 份,每份10.00 g,共9 份,分为A、B、C 3 组,A、B、C 3 组均置于100 mL具塞离心管中,依次加入35 mL蒸馏水,5.0 mL 3.0 mg/mL的五氟苯肼衍生剂,设定超声波功率100 W、温度50 ℃条件下超声提取30 min,然后依次加入2.5 mL 21.9%的乙酸锌溶液,2.5 mL 106 g/L的亚铁氰化钾溶液,在离心机上8 000 r/min离心5 min,将上清液转移入50 mL容量瓶中,用少量蒸馏水(约5 mL)清洗残渣1 次,在离心机上8 000 r/min离心5 min,合并上清液并用蒸馏水定容至50 mL,A组提取液最终定容体积为50 mL。将经一次提取的B、C两组剩余残渣按上述步骤再超声提取一次,合并提取液,B组提取液最终定容体积为100 mL。将经二次提取的C组剩余残渣按上述步骤再超声提取一次,合并提取液,C组提取液最终定容体积为150 mL,然后同1.3.5.1节处理。根据每组提取液最终定容体积计算提取出的甲醛含量。
1.3.6 超声波提取法其他提取条件的正交优化试验
根据单因素试验结果,选择对超声波提取有较大影响的3 个因素:提取时间、超声波功率、提取温度,进行正交优化试验。选择西兰花作为样品。
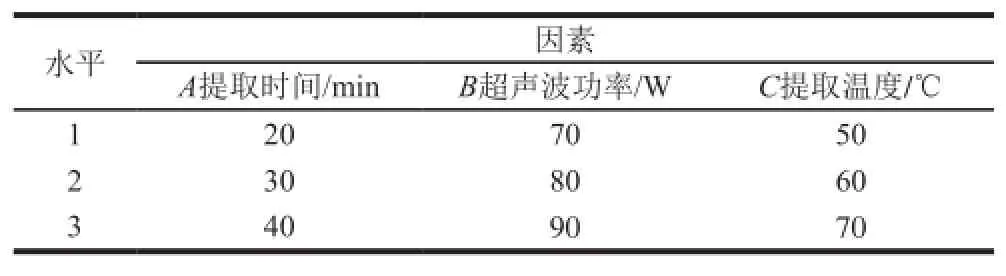
表2 超声波提取条件的正交试验因素水平Table2 Factors and levels used in orthogonal array design for the optimization of ultrasound extraction conditions
1.3.7 颜色干扰试验和衍生物显色稳定性实验
通过将少量苋菜红、肼黄、靛蓝3 种颜色分别加入2.28 μg/mL的甲醛标准品中和白萝卜样品中,测定其峰面积变化,确定果蔬样品颜色对甲醛检测过程是否产生干扰。
准确移取50、200、500 μL 114 μg/mL的甲醛标准使用液于10 mL容量瓶中,加入1.0 mL 3.0 mg/mL的五氟苯肼衍生剂,用蒸馏水定容至10 mL,置于60 ℃水浴中衍生20 min,取出后在流水中快速冷却,取少许溶液过0.22 μm混合相滤膜,然后分别放置0、2、4、6、8、10、12、18、24 h,液相色谱法测定每个时间点时溶液的峰面积,确定甲醛-五氟苯肼衍生物的显色稳定时间。
1.3.8 标准曲线的绘制
准确移取0、20、50、100、200、500、1 000 μL甲醛标准使用液于10 mL容量瓶中,加入1.0 mL 3.0 mg/mL的五氟苯肼衍生剂,用蒸馏水定容至10 mL,此时溶液中的甲醛质量浓度分别为0、0.228、0.570、1.140、2.280、5.700、11.400 μg/mL,置于60 ℃水浴中衍生20 min,取出后在流水中快速冷却,取少许溶液过0.22 μm混合相滤膜,液相色谱检测。重复6 次。样品中甲醛含量计算方法如公式(1)所示:

式中:M为样品中甲醛含量/(mg/kg);C为从标准工作曲线得到的样液中甲醛的质量浓度/(mg/L);m为称取试样质量/g;50为提取液最终定容体积/mL。
1.3.9 五氟苯肼法和SN/T 1547—2011方法的回收率和精密度对比实验
将试验原料中7 种样品打碎,每种样品分别称取4 份,每份10.00 g,置于100 mL具塞离心管中,每种样品中甲醛的添加量分别为0、1.14、8.55、17.10 mg/kg,然后在每份样品中依次加入5.0 mL 3.0 mg/mL的五氟
苯肼衍生剂,加入35 mL蒸馏水,设定超声波功率80 W,温度60 ℃条件下超声提取30 min,然后依次加入2.5 mL 21.9%的乙酸锌溶液,2.5 mL 106 g/L的亚铁氰化钾溶液,搅拌均匀,在离心机上8 000 r/min离心5 min,将上清液移入50 mL容量瓶中,再用少量蒸馏水(约5 mL)清洗残渣1 次,在离心机上8 000 r/min离心5 min,合并上清液并用蒸馏水定容至50 mL,即为样品待测液。取少许样品待测液过0.22 μm混合相滤膜,液相色谱检测。重复6 次。
同时参照SN/T 1547—2011液相色谱法测定苹果、橘子、白菜、萝卜、辣椒、西兰花、姜7 种果蔬中甲醛的加标回收率和精密度。对比两种检测方法的回收率和精密度。
1.4 数据处理
采用Origin(Version 8.6)进行作图,采用SPSS (Version 17.0)进行统计学分析,P<0.05认为有统计学显著性差异,P<0.01认为有统计学极显著性差异。
2 结果与分析
2.1 高效液相色谱条件的选择
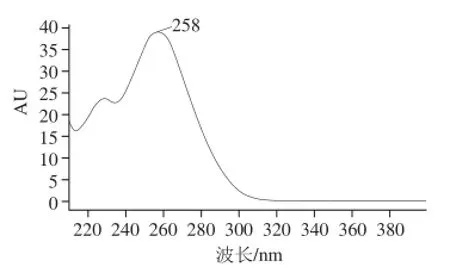
图1 五氟苯肼-甲醛衍生物全波长扫描图Fig.1 UV Absorption spectrum of PFPH-formaldehyde derivatives

图2 甲醛标准品色谱图Fig.2 Chromatogram of formaldehyde standard
由图1可知,五氟苯肼衍生液相色谱法检测的最佳波长为258 nm。通过实验发现流动相比例乙腈-水(70∶30,V/V),柱温40 ℃时分离效果最佳,甲醛衍生物的峰形较好,完成一个样品的分析耗时7 min,甲醛衍生物保留时间在3.9 min(图2)。因此高效液相色谱法色谱条件为流速1.0 mL/min、流动相乙腈-水(70∶30,V/V)、柱温40 ℃、进样量20 μL、二极管列阵检测器,检测波长258 nm;色谱柱为C18柱。
2.2 衍生反应条件的确定
由单因素试验结果可得,当衍生反应温度达到60 ℃后,甲醛-五氟苯肼衍生物的峰面积不再随温度升高而变化,说明60 ℃时衍生反应基本完全,所以选择60 ℃为较佳衍生温度(图3A)。随着衍生反应时间延长,甲醛-五氟苯肼衍生物的峰面积不断增加,在20 min时达到最大值,之后衍生物的峰面积不再随时间增加而变化,所以选择20 min为较佳衍生时间(图3B)。随着衍生剂用量的增加,两种浓度下甲醛-五氟苯肼衍生物的峰面积均逐渐增加,当衍生剂加入量达到1.0 mL后,衍生物生成量不再随衍生剂加入量增加而变化,所以选择每10 mL样品甲醛提取液中加入1.0 mL 3.0 mg/mL的五氟苯肼衍生剂为较佳的加入量(图3C)。
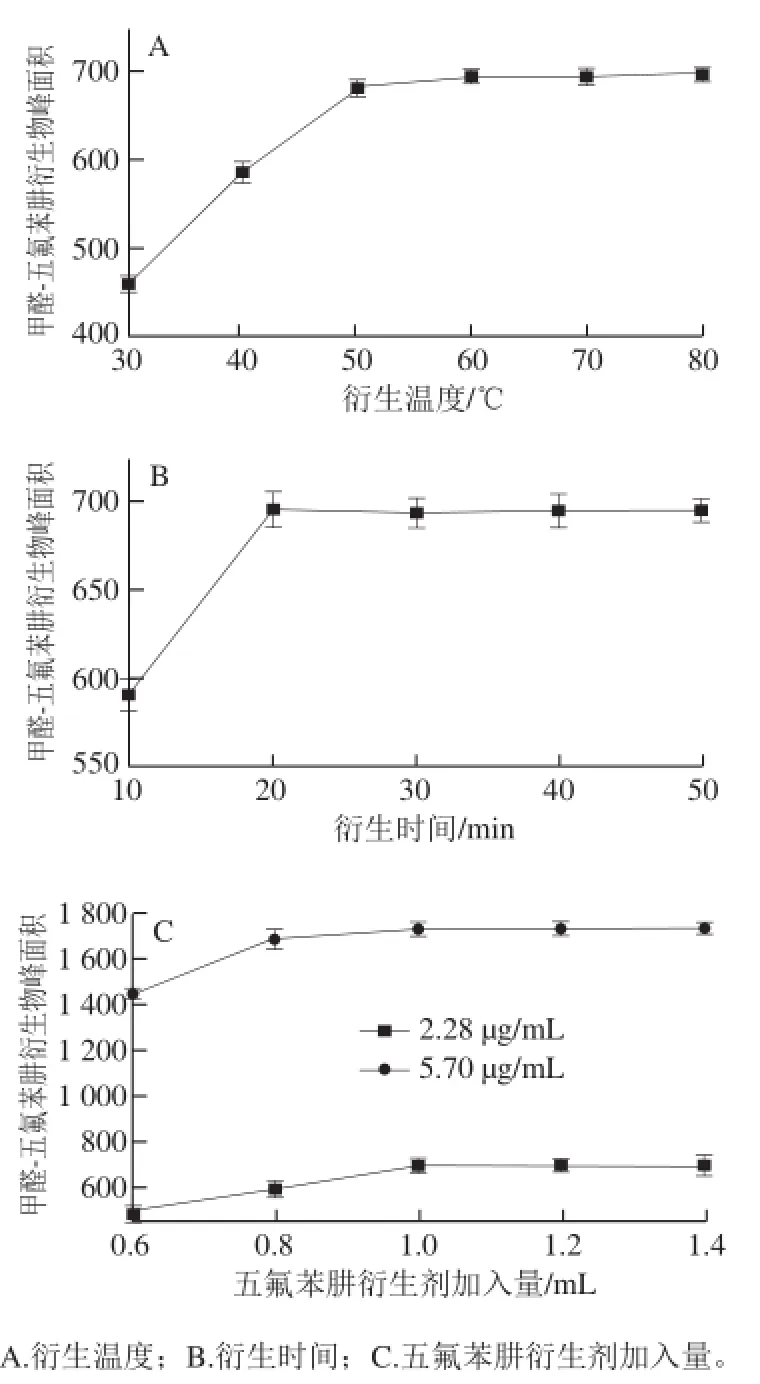
图3 衍生反应条件对衍生反应的影响Fig.3 Effect of reaction conditions on the derivative reaction
由表3可得,五氟苯肼衍生高效液相色谱法最佳衍生反应条件为A2B2C2,即反应温度60 ℃、3.0 mg/mL五氟苯肼衍生剂加入量1.0 mL、反应时间20 min。观察表中3 个因素的极差R大小,发现衍生剂加入量和反应温
度为主要影响因素,反应时间为次要影响因素,由于试验组中没有A2B2C2,所以补充验证实验,测定的峰面积为695.7,比表中所有试验组测得的峰面积都高,所以高效液相色谱法最佳衍生反应条件为反应温度60 ℃、反应时间20 min,每10 mL样品甲醛提取液中加入1.0 mL 3.0 mg/mL的五氟苯肼衍生剂。

表3 衍生条件的正交优化试验结果L9(34)Table3 Orthogonal array design L9(34) with experimental results for the optimization of derivative reaction conditions
2.3 提取条件的确定
2.3.1 提取过程中甲醛提取剂用量的确定
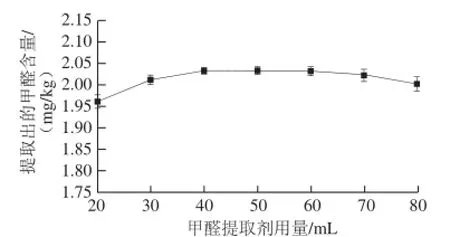
图4 甲醛提取剂用量对提取效果的影响Fig.4 Effect of water addition on the extraction efficiency of formaldehyde
由图4可知,随着甲醛提取剂蒸馏水用量的增加,样品中甲醛的检出量有少许增加,当提取剂用量达到40 mL时,样品中的甲醛检出量达到最大,当提取剂用量继续增加到60 mL后,检出的甲醛含量有减少的趋势,这可能是因为提取剂用量过大,导致提取液中甲醛稀释倍数过大,吸光度变小,仪器检测结果准确度降低。所以综合考虑选择甲醛提取剂蒸馏水用量为40~60 mL范围内为宜,即料液比为1∶4~1∶6(g/mL)。
2.3.2 超声波提取条件的确定
由单因素试验结果可得,随着提取时间的延长,3 种样品中提取出的甲醛含量均不断升高,当提取时间延长至30 min时,提取出的甲醛含量达到最大值,之后不再随提取时间的延长而升高,所以为了保证样品中的甲醛能够提取充分,选择30 min为较佳提取时间(图5A)。当超声波功率较低时,3 种样品中提取出的甲醛含量随着超声波功率的增加呈缓慢上升趋势,在80 W左右达到最大值,随着超声波提取功率继续增加,提取出的甲醛含量有减少的趋势,所以选择超声波功率80 W为较佳提取功率(图5B)。在40~60 ℃范围内,随着超声波提取温度的升高,3 种样品中提取出的甲醛含量不断增加,在60 ℃时达到最大值,随着提取温度继续升高,提取出的甲醛含量不断减少,可能是温度升高导致部分甲醛随水蒸气挥发而损失,所以选择60 ℃为较佳提取温度(图5C)。随着超声波提取次数的增加,3 种样品中提取出的甲醛含量基本保持恒定,但测得结果的相对标准偏差逐渐增大,原因是提取液稀释倍数过大导致仪器检测结果不稳定,所以超声波提取次数对提取效果没有影响,超声波提取1 次即可有效提取出样品中的甲醛(图5D)。
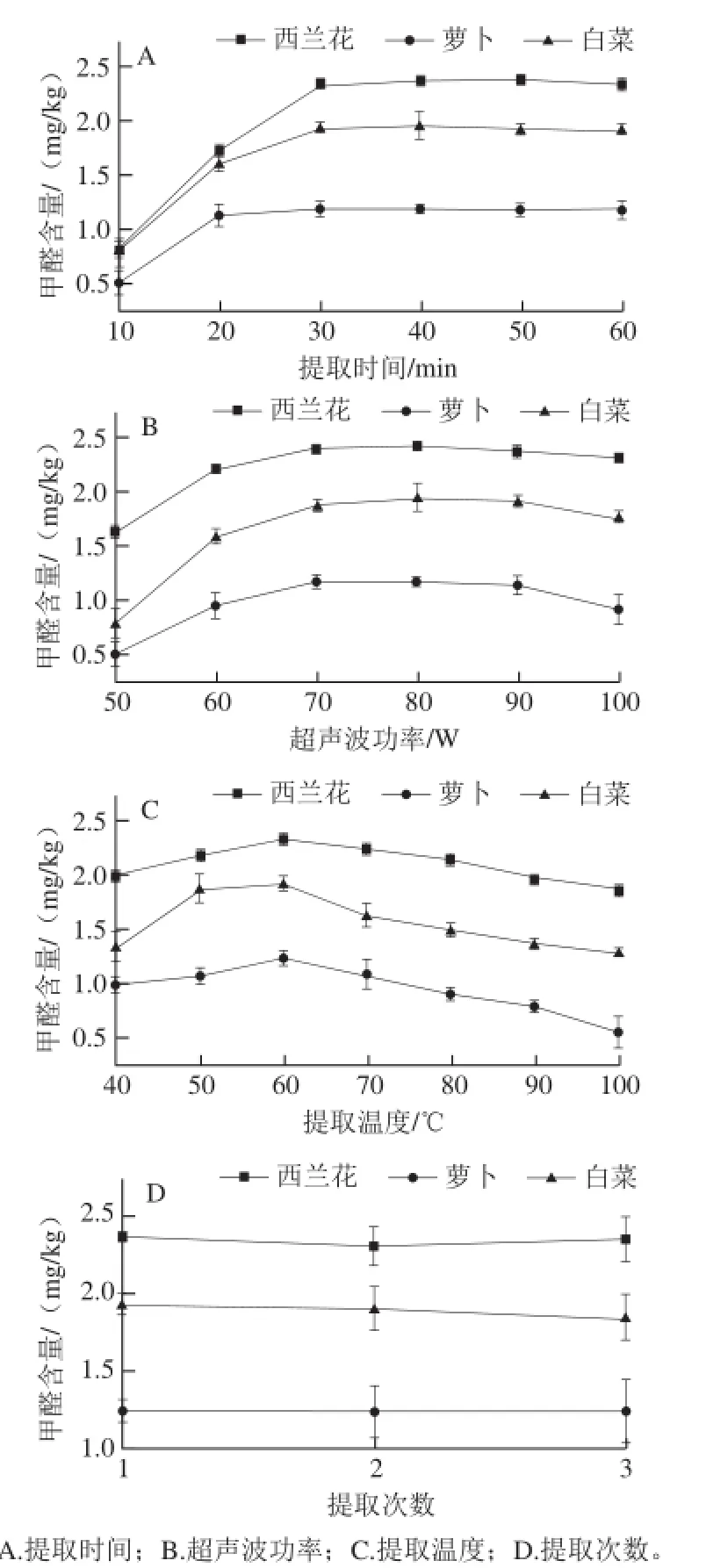
图5 超声波条件对甲醛提取效果的影响Fig.5 Effect of ultrasonic extraction conditions on the extraction efficiency of formaldehyde
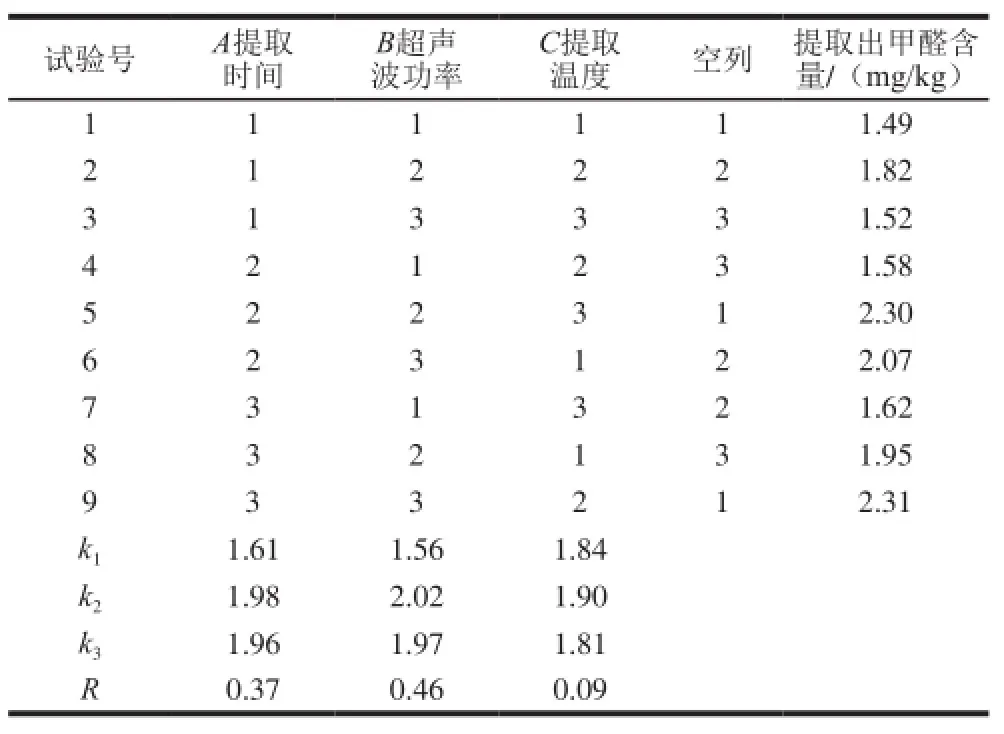
表4 超声波提取条件的正交优化试验结果L9(34)Table4 Orthogonal array design L9(34) with experimental results for the optimization of ultrasound extraction conditions
由表4可得,超声波提取法的最优提取条件为A2B2C2,即提取时间30 min、超声波功率80 W、提取温度60 ℃。观察表中3 个因素的极差大小,提取时间和超声波功率为主要影响因素,提取温度为次要影响因素。由于正交试验中并未设置A2B2C2这个条件,所以做一组验证试验,测得该条件下甲醛含量为2.40 mg/kg,比表中所有试验组测得的甲醛含量都高,所以超声波提取法最佳提取条件为提取温度60 ℃、超声波功率80 W、提取时间30 min。
2.4 方法学评价
2.4.1 颜色干扰实验
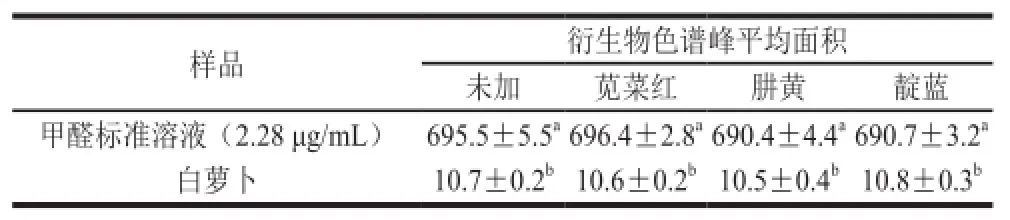
表5 不同颜色对甲醛-五氟苯肼衍生液相色谱法检测结果的影响Table5 Effect of different colorants on the results of determination of pentafluorophenylhydrazine-formaldehyde derivative by HPLC
由表5可知,经过添加苋菜红、肼黄和靛蓝3 种颜色,甲醛标准溶液和白萝卜样品溶液中测得的衍生物峰面积与未加色素测得的衍生物峰面积均无显著差异(P>0.05),说明颜色对衍生物的生成量没有影响,即果蔬样品的颜色对检测结果无影响,所以用五氟苯肼衍生液相色谱法前处理过程中不需要进行脱色处理。
2.4.2 衍生物稳定性实验结果
由图6可知,当甲醛-五氟苯肼衍生物放置10 h后,测得3 种质量浓度条件下的峰面积有少许减少,随着放置时间继续延长,减少的趋势更为明显,说明放置10 h后,甲醛-五氟苯肼衍生物会发生少量分解,所以显色处理过后的样品需在10 h以内完成检测,以确保检测结果的准确性。

图6 衍生物稳定性随时间变化曲线Fig.6 Temporal stability of entafluorophenylhydrazineformaldehyde derivative
2.4.3 标准曲线以及方法的检测限
按1.3.8节步骤处理,得到方法的标准曲线回归方程为y=302.96x+4.755 9,相关系数(R2)为0.999 8,在0.114~57 mg/L范围内线性关系良好。根据标准曲线测定推算样品的定量检测限为0.114 mg/kg。
2.4.4 五氟苯肼法和SN/T 1547—2011法的回收率和精密度对比实验结果

表6 不同样品中甲醛的回收率和精密度(n=6)Table6 Recovery rates and precision of formaldehyde in different samples (n= 6)
由表6可知,当样品中甲醛的添加量为1.14 mg/kg时,回收率为82.6%~101.8%,相对标准偏差为4.0%~5.0%,添加量为8.55 mg/kg时,回收率为81.5%~100.2%,相对标准偏差为3.3%~4.9%,添加量为17.10 mg/kg时,回收率为81.4%~97.1%,相对标准偏差为2.6%~4.4%。在3 个不同添加水平下,回收率平均为81.4%~101.8%,平均相对标准偏差为2.6%~5.0%。而SN/T 1547—2011中的2,4-二硝基苯肼衍生液相色谱法在3 个不同添加水平下的
回收率为74.8%~96.1%,相对标准偏差为3.6%~8.8%。实验过程中发现衍生剂2,4-二硝基苯肼与甲醛的衍生物2,4-二硝基苯腙易溶于极性较小的二氯甲烷等有机溶剂,在水中会结晶析出,SNT 1547—2011法通过加入乙腈和改变溶液pH值可以在一定程度上增加其在水中的溶解度,但稳定性差,而甲醛-五氟苯肼的衍生物在水中不会结晶,可以将提取和衍生同时进行,进一步缩短前处理的时间,优化前处理步骤,提高方法的精密度。
3 结 论
通过实验验证,甲醛-五氟苯肼衍生物可以通过液相色谱法检测,优化的色谱条件为XDB-C18色谱柱(4.6 mm×250 mm,5 μm)、流动相乙腈-水(70∶30,V/V),流速1.0 mL/min、柱温40 ℃,检测波长258 nm。最佳提取衍生条件为反应温度60 ℃,五氟苯肼衍生剂加入量0.3 mg/mL,超声波提取30 min。该方法的定量检测限为0.114 mg/kg,在0.114~57 mg/L范围内呈良好的线性关系。当甲醛添加量分别为1.14、8.55、17.10 mg/kg时,平均回收率为81.4%~101.8%,相对标准偏差为2.6%~5.0%(n=6)。
[1] TONG Z Q, HAN C S, MIAO J Y, et al. Excess endogenous formaldehyde induces memory decline[J]. Progress in Biochemistry and Biophysics, 2011, 38(6): 575-579. DOI:10.3724/ SP.J.1206.2011.00241.
[2] SONGUR A, OZEN O A, SARSILMAZ M. The toxic effects of formaldehyde on the nervous system[J]. Reviews of Environmental Contamination and Toxicology, 2010, 203: 105-118. DOI:10.1007/978-1-4419-1352-4_3.
[3] ANDERSEN M E, CLEWELL H J, BERMUDEZ E, et a1. Formaldehyde: integrating dosimetry, cytotoxicity, and genomics to understand dose-dependent transitions for an endogenous compound[J]. Toxicological Sciences, 2010, 118(2): 716-731. DOI:10.1093/toxsci/kfq303.
[4] LI W W, GUO H, FAN G W, et al. Advance in study on endogenous formaldehyde and pathogenesis of Alzheimer’s disease[J]. China Journal of Chinese Materia Medica, 2012, 37(20): 3071-3020. DOI:10.4268/cjcmm20122004.
[5] 俞其林, 励建荣. 食品中甲醛的来源与控制[J]. 现代食品科技, 2007(10): 55-59. DOI:10.3969/j.issn.1673-9078.2007.10.024.
[6] 励建荣, 朱军莉. 食品中内源性甲醛的研究进展[J]. 中国食品学报, 2011, 11(9): 247-256. DOI:10.3969/j.issn.1009-7848.2011.09.027.
[7] LIU Y, YE Z, YANG H, et al. Disturbances of soluble N-ethylmaleimide-sensitive factor attachment proteins in hippocampal synaptosomes contribute to cognitive impairment after repetitive formaldehyde inhalation in male rats[J]. Neuroscience, 2010, 169(3): 1248-1254. DOI:10.1016/j.neuroscience.2010.05.061.
[8] 周福林, 宋少飞, 张稳婵, 等. 催化动力学光度法测定腐竹中的痕量甲醛[J]. 食品科学, 2009, 30(10): 191-193. DOI:10.3321/ j.issn:1002-6630.2009.10.042.
[9] ZHU J L, LI J R, JIA J. Effects of thermal processing and various chemical substances on formaldehyde and dimethylamine formation in squid Dasidicas gigas[J]. Journal of the Science of Food and Agriculture, 2012, 92(12): 2436-2442. DOI:10.1002/jsfa.5649.
[10] 杜永芳, 柳淑芳, 马敬军, 等. 测定水产品中甲醛含量的分光光度法研究[J]. 中国食品学报, 2005, 5(3): 91-96. DOI:10.3969/ j.issn.1009-7848.2005.03.017.
[11] LI J R, ZHU J L, YE L F. Determination of formaldehyde in squid by highperformance liquid chromatography[J]. Asia Pacific Clinical Nutrition, 2007, 16(1): 127-130. DOI:10.6133/apjcn.2007.16.s1.24.
[12] ZHU Y, PENG Z Q, WANG M, et al. Optimization of extraction procedure for formaldehyde assay in smoked meat products[J]. Journal of Food Composition and Analysis, 2012, 28(1): 1-7. DOI:10.1016/ j.jfca.2012.07.002.
[13] 杨娟, 秦樱瑞, 曾艺涛, 等. 内源性甲醛、甲醛毒性及甲醛抑制物的研究进展[J]. 食品科学, 2014, 35(1): 294-297. DOI:10.7506/ spkx1002-6630-201401058.
[14] WENG X, CHON C H, JIANG H, et al. Rapid detection of formaldehyde concentration in food on a polydimethylsiloxane (PDMS) microfluidic chip[J]. Food Chemistry, 2009, 114(3): 1079-1082. DOI:10.1016/j.foodchem.2008.10.027.
[15] 王小波, 李国强, 孟建新, 等. 甲基橙-溴酸钾体系催化光度法测定微量甲醛[J]. 分析科学学报, 2004, 20(3): 335-336. DOI:10.3969/ j.issn.1006-6144.2004.03.035.
[16] WANG T, GAO X L, TONG J, et al. Determination of formaldehyde in beer based on cloud point extraction using 2,4-dinitrophenylhydrazine as derivative reagent[J]. Food Chemistry, 2012, 131(4): 1577-1582. DOI:10.1016/j.foodchem.2011.10.021.
[17] BIANCHI F, CARERI M, MUSCI M, et al. Fish and food safety: Determination of formaldehyde in 12 fish species by SPME extraction and GC-MS analysis[J]. Food Chemistry, 2007, 100(3): 1049-1053. DOI:10.1016/j.foodchem.2005.09.089.
[18] 芮露明, 彭增起, 汪敏, 等. GC-MS法测定烟熏腊肉中的甲醛含量[J]. 食品科学, 2014, 35(8): 142-146. DOI:10.7506/spkx1002-6630-201408028.
[19] 王术皓, 牛学丽, 杜凌云, 等. 溴酸钾氧化中性红动力学光度法测定甲醛[J]. 分析科学学报, 2004, 20(2): 215-216. DOI:10.3969/ j.issn.1006-6144.2004.02.031.
[20] LI Z W, MA H B, LU H H, et al. Determination of formaldehyde in foodstuffs by flow injection spectrophotometry using phloroglucinol as chromogenic agent[J]. Talanta, 2008, 74(4): 788-792. DOI:10.1016/ j.talanta.2007.07.011.
[21] 邵仕萍, 相大鹏, 李华斌, 等. 乙酰丙酮衍生化高效液相色谱-荧光检测法测定食品中的甲醛[J]. 食品科学, 2015, 36(16): 241-245. DOI:10.7506/spkx1002-6630-201516046.
[22] WANG H, DING J, DU X B, et al. Determination of formaldehyde in fruit juice based on magnetic strong cation-exchange resin modified with 2,4-dinitrophenylhydrazine[J]. Food Chemistry, 2012, 131(1): 380-385. DOI:10.1016/j.foodchem.2011.08.056.
[23] XU X, SU R, ZHAO X, et al. Determination of formaldehyde in beverages using microwave-assisted derivatization and ionic liquidbased dispersive liquid-liquid microextraction followed by highperformance liquid chromatography[J]. Talanta, 2011, 85(5): 2632-2638. DOI:10.1016/j.talanta.2011.08.037.
[24] REBECCA A, TRENHOLM, FEMANDO L. Analysis of formaldehyde formation in wastewater using on-fiber derivatization-solidphase microextraction-gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2008, 25(29): 26-29. DOI:10.1016/ j.chroma.2008.09.044.
[25] 尤铁学. 碘量法标定二氧化硫和甲醛标准贮备溶液的改进[J]. 化学试剂, 2008, 30(6): 447-448. DOI:10.3969/j.issn.0258-3283.2008.06.016.
Determination of Formaldehyde in Fruits and Vegetables by HPLC
LI Jun1,2, LIU Yongxiang2, WANG Hui1,2, LIU Jia1,2, LIU Hui2, KAN Jianquan1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Biological Technology Institute of Guizhou Province, Guiyang 550006, China)
A high performance liquid chromatography (HPLC) method was used to determine formaldehyde in fruits and vegetables by formaldehyde derivation with pentafluorophenylhydrazine (PFPH). Samples were extracted and derived at 70 ℃ with ultrasonicaction for 30 min. After completion of the reaction, centrifugation was carried out and the supernatant was purified and analyzed by HPLC. The quantitation was performed using the external standard method. The separation was performed on an XDB-C18column (4.6 mm × 250 mm, 5 μm) in an isocratic elution mode using a mobile phase consisting of acetonitrile and water (70:30, V/V) at a flow rate of 1.0 mL/min. The column temperature was 40 ℃ and detection wavelength was 258 nm. The results showed that the limit of quantification (LOQ) of the presented method was 0.114 mg/kg, with a good linear relationship in the range of 0.114–57 mg/L. The average recovery rates at three spiked levels were 81.4%–101.8%, with relative standard derivation (RSD) of 2.6%–5.0% (n = 6). The method was simple, sTableand suiTablefor the determination of formaldehyde in fruits and vegetables with a low limit of detection (LOD).
fruits and vegetables; formaldehyde; HPLC; pentafluorophenylhydrazine
10.7506/spkx1002-6630-201622030
TS255.7
A
1002-6630(2016)22-0198-07
李俊, 刘永翔, 王辉, 等. 高效液相色谱法定量测定果蔬中甲醛含量[J]. 食品科学, 2016, 37(22): 198-204. DOI:10.7506/ spkx1002-6630-201622030. http://www.spkx.net.cn
LI Jun, LIU Yongxiang,WANG Hui, et al. Determination of formaldehyde in fruits and vegetables by HPLC[J]. Food Science, 2016, 37(22): 198-204. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622030. http://www.spkx.net.cn
2016-04-10
中华人民共和国农业部财政专项(GJFP201501201)
李俊(1990—),男,研究实习员,硕士,研究方向为食品质量与安全。E-mail:lijunsjs2015@163.com
*通信作者:阚建全(1965—),男,教授,博士,研究方向为食品化学与营养学。E-mail:kanjianquan@163.com
