水酶法水解液中大豆多肽的吸附纯化及其氨基酸组成分析
2016-12-06张巧智马文君隋晓楠江连洲
张巧智,毕 爽,马文君,李 杨,隋晓楠,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
水酶法水解液中大豆多肽的吸附纯化及其氨基酸组成分析
张巧智,毕 爽,马文君,李 杨,隋晓楠,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
考察大孔吸附树脂对水酶法水解液中大豆多肽的吸附性能和纯化效果,通过静态吸附和解吸实验对8种树脂进行了初步筛选,并进一步研究了上样体积、上样流速、解吸剂体积分数等条件对大孔吸附树脂纯化能力的影响。结果表明:DA201-C大孔吸附树脂对水酶法大豆多肽的吸附性能优于其他7 种树脂,其最佳动态吸附工艺为:上样体积140 mL、上样流速1.5 mL/min、水洗体积350 mL,体积分数25%、50%、75%、100%乙醇溶液分级洗脱,每次80 mL,流速2 mL/min。经纯化后各大豆多肽组分纯度均在80%以上,总回收率为95.65%,树脂吸附量为13.32 mg/g,糖类及盐类杂质分别降低51%及90%以上;乙醇分级洗脱可分离4 个大豆多肽组分,其中75%体积分数组分SP-DA75氧自由基清除能力最强,肽段的抗氧化性与其疏水性氨基酸含量及酸性氨基酸含量具有一定相关性。
水酶法;大豆多肽;大孔吸附树脂;纯化;氨基酸组成
传统的大豆油制取方法主要有压榨法和浸出法,这些方法虽然可制得95%以上的油脂,但易导致蛋白质变性,难以进一步利用,造成蛋白质资源的巨大浪费,而且存在设备复杂、有害溶剂残留、生产安全性差等问题[1-2]。水酶法作为一种新兴的绿色提油技术,它以机械破碎和酶解为手段,萃取条件温和,所制油品质高,同时分离得到的蛋白可进行深加工,进一步应用于多种食品体系[3-5]。与此同时,提油过程中酶的作用会伴随大豆蛋白的有限水解,释放短链多肽,大豆多肽已被证明具有调节免疫、抗病毒、抗氧化、降低血压、降低胆固醇等多种生理功能[6-7],虽活性稍低,但来源广泛,廉价易得,食用安全性高,前景十分广阔。水酶法工艺中低分子大豆多肽主要存在于酶解离心后的水相——水解液中,水解液中同时还存在着不完全水解的大分子蛋白、可溶性低聚糖及少量细小油滴[8-9],此外,为中和酶解过程中肽键断裂产生的H+维持体系pH值而持续加入的碱液,也增加了酶解物中的盐分含量[7,10],这些物质的存在影响了产品感官特性以及后续生物活性肽的效用发挥,也极大地限制了其在食品等领域的应用,因此,对水解液中杂质的去除以及潜在功能性大豆多肽的分离纯化研究对水酶法副产物增值及产业化推广具有重要意义。
大孔吸附树脂作为一类新型的非离子型吸附剂,是由苯乙烯、二乙烯苯、二甲丙烯酸酯等聚合而成的具有网状孔穴结构的高聚物,兼具吸附和分子筛功能,可根据分离物分子大小及极性差异进行分离。同时由于树脂与分离物之间为物理吸附作用,被吸附物解吸容易,理化性质影响小,且具有成本低廉、操作简单、选择性好、再生容易等优点[11-12],已逐渐在生物活性物质纯化领域得到应用。如马寒冰等[12]研究发现DA201-C型大孔吸附树脂对大豆多肽的吸附和脱盐效果最佳;Zhu Kexue等[13]利用大孔吸附树脂对麦芽蛋白水解物中的锌螯合肽进行纯化处理,脱盐率和肽回收率均较理想。氧自由基清除能力(oxygen radical absorbance capacity,ORAC)是目前国内外应用较广的体外抗氧化活性判定方法,具有灵敏度高、稳定性好、与体内实验相关性强等优点,被最新推荐为抗氧化能力测定的标准方法之一[7,14]。
本研究以大豆水酶法提油后的水解液为原料,通过静态及动态吸附、解吸实验,确定纯化大豆多肽的最佳吸附条件,进一步利用不同体积分数乙醇溶液对大豆多肽分级洗脱,以ORAC值为指标评价不同洗脱组分的抗氧化能力,并与氨基酸组成相联系,探讨不同的氨基酸种类对其抗氧化活性的贡献,为后续水酶法大豆多肽的富集纯化、活性研究以及工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
东北大豆(水分含量9.83%,脂肪含量21.54%,蛋白含量39.12%,灰分含量4.20%) 黑龙江红兴隆农垦沃野有机食品有限公司;碱性蛋白酶Protex 6L(580 000 DU/g,适宜温度25~70 ℃,适宜pH 7.0~10.0)杰能科(中国)生物工程有限公司;D101、DA201-C、X-5、D3520、AB-8、DM130、NKA-Ⅱ、S-8大孔吸附树脂 天津浩聚树脂科技有限公司;氨基酸混合标准品、荧光素钠、自由基产生剂2,2’-偶氮二异丁基脒二盐酸盐盐酸(2,2’-azobis-2-amidinopropanedihydrochloride,AAPH)、抗氧化标准物质Trolox 美国Sigma-Aldrich公司;氢氧化钠、氯化钠、无水乙醇、磷酸二氢钠、磷酸氢二钠、石油醚等均为分析纯。
1.2 仪器与设备
T20型双螺杆挤压机 法国Clextral公司;HH-2数显恒温水浴锅 国华电器有限公司;PHS-25数显台式酸度计、DDS-11A数显电导率仪 上海雷磁仪器厂;10 kD平板聚醚砜超滤膜、MSC300杯式超滤器 上海摩速科学器材有限公司;GL-21M高速冷冻离心机 湘仪离心机仪器有限公司;RE-52CS-1旋转蒸发仪 上海亚荣生化仪器厂;FD5冷冻干燥机 美国西盟国际集团;K-436快速消解仪、K-370自动凯氏定氮仪 瑞士步琦有限公司;SX2-4-10箱式电阻炉 上海嘉展仪器设备有限公司;大孔吸附树脂层析柱(2.6 cm×30 cm) 盐城普瑞奇实验仪器有限公司;BS-1E恒温振荡培养箱 金坛市科析仪器有限公司;BT300-2J精密蠕动泵 保定兰格恒流泵有限公司;DBS-160电脑自动部分收集器 上海沪西分析仪器厂;JK-UVS-752N紫外分光光度计 上海精学科学仪器有限公司;L-8900全自动氨基酸分析仪 日本日立公司;Synergy多动能酶标仪 美国Bio-Tek公司。
1.3 方法
1.3.1 化学组成测定
水分含量依据GB/T 5497—1985《粮食、油料检验水分测定法》进行测定;粗脂肪含量依据GB/T 5512—2008《粮油检验:粮食中粗脂肪含量测定》进行测定;粗蛋白含量依据GB/T 6432—1994《饲料中粗蛋白测定方法》进行测定;灰分含量依据GB/T 5508—2008《粮油检验:灰分测定法》进行测定;总糖含量采用苯酚-硫酸法[12]进行测定;大豆多肽含量依据李艳等[11]的方法进行测定。
1.3.2 水酶法大豆粗肽的制备
水解液作为大豆水酶法提油的副产物,本研究采用的酶解条件为已有研究[15-16]优化的兼顾油脂和蛋白提取的最佳工艺,由于水解液中含有的少量油滴会影响后续对大豆多肽的超滤回收,因此对水解液进行脱脂处理,其主要流程如下:
大豆原料→粉碎→调节水分含量为18%→挤压膨化(70 ℃,300 r/min)→粉碎过60 目筛→调节固液比为1∶6(mg/mL)→调节温度为50 ℃,pH 9→酶解3 h(加酶量为1.85 mL/100 g)→灭酶(100 ℃,10 min)→离心分离(10 000 r/min,20 min)→收集水解液和乳状液于分液漏斗中,4 ℃保存10 h→水解液→冷冻干燥→脱脂(石油醚,正己烷以固液比1∶10(g/mL)各脱脂2 次,每次1 h)→低温脱溶→大豆酶解蛋白
生物活性肽分子质量一般较低,为避免未完全水解的大分子蛋白对后续纯化的影响,利用10 000 D超滤膜对上述酶解蛋白复溶液(10%干物质质量分数)在室温条件下,压力0.22 MPa超滤3 h,收集滤液,浓缩后冷冻干燥得到大豆粗肽。
1.3.3 大孔吸附树脂的预处理
将树脂用无水乙醇浸泡24 h,使其充分溶胀,然后用无水乙醇充分洗涤以除去上层漂浮的固体杂质及破碎树脂,再用去离子水洗至无乙醇味,然后分别用5% HCl溶液和2% NaOH溶液洗涤,最后用去离子水洗至中性,抽滤备用[10-11]。
1.3.4 大孔吸附树脂对水酶法大豆多肽的静态吸附
1.3.4.1 最佳吸附树脂的筛选
不同型号的树脂适用于分离物质的特性不同,为筛选出吸附水酶法大豆多肽的最佳树脂,本实验选取了极性和孔径各异的8 种树脂,分别为:D101、DA201-C、X-5、D3520、AB-8、DM130、NKA-II、S-8,其各项参数列于表1。称取上述已处理好的树脂各2 g于250 mL具塞锥形瓶中,分别加入大豆粗肽液30 mL (10 mg/mL),将锥形瓶封好后放入恒温摇床中振荡24 h(25 ℃,150 r/min),使树脂与粗肽液充分接触,振荡结束后抽滤分离出液体,测定吸附前后粗肽液中的多肽质量浓度,计算并比较不同型号大孔吸附树脂对水酶法得到大豆多肽的吸附率和吸附量,计算如式(1)、(2)所示[11-12]:
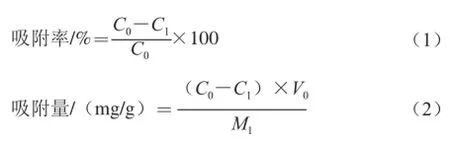
式中:C0为原溶液多肽质量浓度/(mg/mL);C1为吸附后溶液多肽质量浓度/(mg/mL);V0为原溶液体积/mL;M1为湿树脂质量/g。
1.3.4.2 静态吸附曲线的绘制
向250 mL锥形瓶中加入2 g处理好的树脂,向其中加入30 mL质量浓度为10 mg/mL超滤后的大豆粗肽液,用塞子封好后放入恒温摇床中振荡12 h(25 ℃,150 r/min),每隔1 h取液,测定吸附后溶液中的多肽质量浓度、总糖含量及电导率值,并按公式(1)、(2)计算大豆多肽的吸附率和吸附量,绘制静态吸附曲线。
1.3.5 水酶法水解液中大豆多肽的动态吸附及乙醇分级洗脱
采用湿法装柱将100 g处理后的大孔吸附树脂装入2.6 cm×30 cm层析柱中,距柱口约3~4 cm。用去离子水平衡柱子至流出液电导率保持不变时,将质量浓度为20 mg/mL的大豆粗肽液分别以0.5、1.5、2.5 mL/min流速上柱,并检测流出液的多肽质量浓度,以吸附曲线偏离基线为透过点,确定最佳上样体积及上样质量。
上样液被吸附后,先用去离子水洗涤层析柱,流速为2 mL/min,流出液每10 mL收集一管,测定其电导率值及糖含量,当二者趋于平缓时,依次用25%、50%、75%和100%体积分数乙醇各80 mL进行分级洗脱(流速2 mL/min),洗脱液每10 mL收集一管,测定其多肽质量浓度,绘制动态解吸曲线,收集各自洗脱液,浓缩冷冻干燥即得纯化后的水酶法水解液中大豆多肽,并按式(3)计算多肽回收率[7,17]:
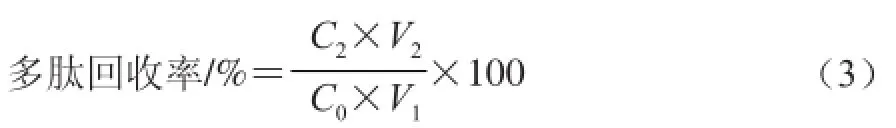
式中:C0为原溶液中多肽质量浓度/(mg/mL);C2为洗脱液中多肽质量浓度/(mg/mL);V1为上样液体积/mL;V2为洗脱液体积/mL。
1.3.6 大豆多肽乙醇分级洗脱组分的氨基酸组成测定
按照GB/T 5009.124—2003《食品中氨基酸的测定》方法,利用氨基酸分析仪测定脱脂大豆粉、水酶法水解液以及各分级洗脱大豆多肽组分的氨基酸组成。
1.3.7 ORAC值测定
对大豆多肽的ORAC值测定参照文献[18-19]的方法,并做适当调整:在96 孔酶标板中依次加入各大豆多肽样品20 μL(质量浓度为1 mg/mL,用75 mmol/L磷酸盐缓冲液配制),同时加入不同浓度Trolox作为对照,再
用多道移液器在每孔中加入20 μL 70 nmol/L荧光素钠,37 ℃反应15 min后,迅速加入140 μL 12.5 mmol/L AAPH诱发反应,并将微孔板置于酶标仪中在37 ℃、激发波长485 nm、发射波长535 nm条件下进行测定,每1 min测定一次各孔荧光强度,连续测定80 min。绘制各样品荧光强度-时间曲线即荧光衰减曲线,采用积分法计算曲线下面积(AUC样品)。将样品保护面积(AUC样品-AUC空白)与不同浓度标准物Trolox保护面积(AUCTrolox-AUC空白)相较得到ORAC值,即Trolox当量(μmol/L)。
2 结果与分析
2.1 水酶法水解液的化学组成

表1 水酶法大豆水解液的主要化学组成(占干物质质量分数)Table1 Major chemical components of soybean protein hydrolysate from aqueous enzymatic extraction of soybean oil (on a dry matter basis) %
由表1可知,水解液中约含有11.4%干物质,其中有58.98%蛋白质(17.34%为大豆多肽)、6.7%脂肪、26.42%碳水化合物以及7.89%灰分。这一结论与已有研究[8,20]报道的以类似工艺制得的水解液组分相似。若以1 kg大豆原料产生4.5 kg水解液计[20],水解液中将含有大豆中约77%的蛋白质、16%的脂肪以及54%的糖类。经脱脂和超滤处理后,水解液中的油脂及部分大分子蛋白被除去,蛋白质含量有所下降但多肽含量增加近3 倍,此外,由于水解液中的可溶性碳水化合物(主要为低聚糖)和盐类物质可透过超滤膜,因此含量均有所增加,这些物质的存在极大地限制了肽类产品在食品及保健品领域的应用,需进行进一步纯化。
2.2 水酶法水解液中大豆多肽的静态吸附
2.2.1 最佳大孔吸附树脂的筛选
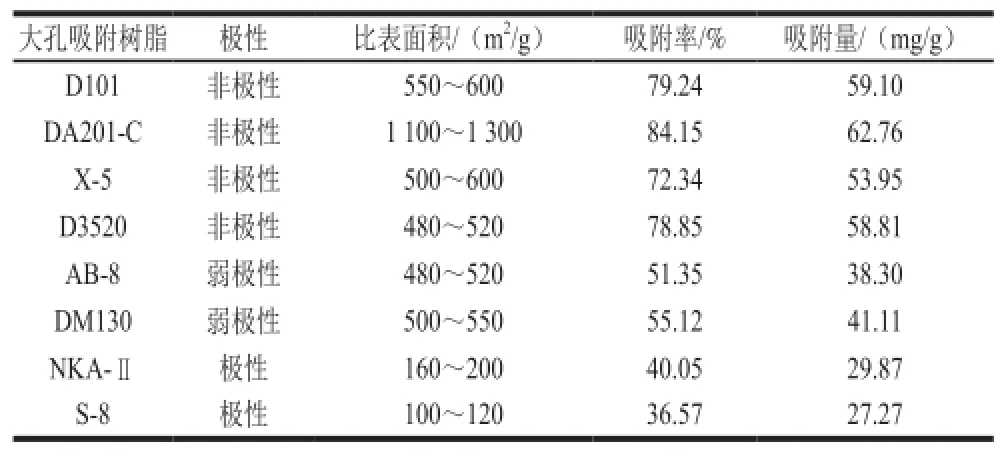
表2 不同大孔吸附树脂对水酶法水解液中大豆多肽的吸附能力Table2 Adsorption capacities of different MARs for soybean peptides
不同型号的树脂对目标物的选择吸附性不同,本研究首先考察了8 种极性、孔径和比表面积各异的树脂对水酶法水解液中大豆多肽的吸附性能,结果见表2。
由表2可知,树脂对大豆多肽的吸附能力与其极性有关,极性树脂的吸附效果较差,如S-8吸附率仅为36.57%,而弱极性和非极性树脂的吸附率较高,其中DA201-C的吸附率和吸附量均高于其他树脂,分别为84.15%和62.76 mg/g,D101和D3520的吸附能力与DA201-C较接近,其次是X-5。在水酶法提油工艺中,随着酶解时间的延长,大豆蛋白被逐渐水解,致使更多的疏水集团暴露,它们可通过疏水相互作用吸附在树脂的表面及孔径中[17]。当树脂极性相同时,树脂的吸附能力与其比表面积密切相关,如表2所示,弱极性树脂DM130 (500~550 m2/g)的吸附率和吸附量均高于同极性的AB-8(480~520 m2/g)。因树脂的表面张力随比表面积增加而增大且超滤后水酶法大豆多肽分子质量多集中于10 kD以下,因此较大比表面积的树脂吸附效果较好,本研究中DA201-C的比表面积约是其他非极性树脂的2 倍以上,对小分子大豆多肽有更强的物理吸附力,因此选择DA201-C作为水酶法大豆多肽后续纯化所用树脂,这一结果与林利美[21]、Lu Rongrong[22]等的研究一致。
2.2.2 静态吸附曲线的绘制
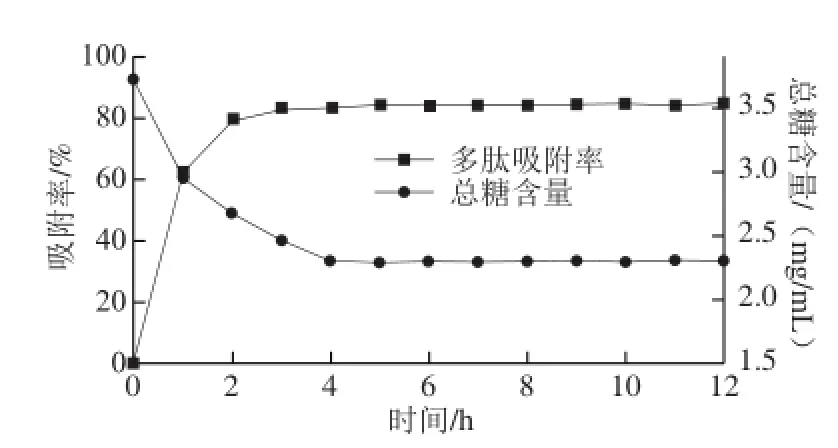
图1 DA201-C大孔吸附树脂对水酶法大豆多肽的静态吸附曲线Fig.1 Static adsorption curves of DA201-C resin for soybean peptides
由图1可知,DA201-C大孔吸附树脂对多肽的吸附属于快速平衡型,即在最初的2 h内,吸附率迅速上升,2 h时吸附率已接近80%,而3 h之后增幅明显趋缓,直至5 h后基本保持不变,此时树脂对多肽的吸附已达平衡状态,吸附率和吸附量分别为84.15%和62.76 mg/g。同时,从流出液中总糖含量的变化曲线可以看出,树脂对多肽粗液中的糖有少量吸附,但远低于对多肽的吸附能力,吸附平衡时,剩余溶液中仍含有原溶液60%以上的糖类物质,利用DA201-C树脂对水酶法大豆多肽和糖类具有不同吸附能力,且对盐类几乎不吸附的特点(吸附液电导率几乎不变),可以达到除去杂质、富集大豆多肽的目的。
2.3 水酶法水解液中大豆多肽的动态吸附及分级洗脱
2.3.1 大孔吸附树脂对水酶法水解液中大豆多肽的动态吸附
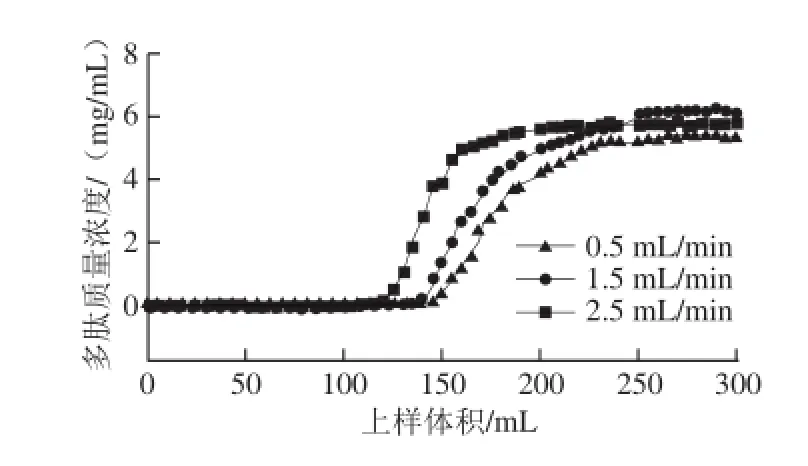
图2 不同流速对DA201-C大孔吸附树脂吸附性能的影响Fig.2 Effects of sample loading volume on the adsorption capacity of DA201-C resin for soybean peptides
样品质量浓度20 mg/mL,上样流速分别为0.5、1.5、2.5 mL/min时大豆多肽的吸附透过曲线见图2。上样流速对树脂的吸附性能有决定性作用,其原理主要是影响了被吸附物质向树脂的扩散程度。当样品流速较快时,被吸附物质来不及扩散到树脂孔隙中就被迫流下,造成吸附量下降;而当样品流速较低时,虽然样品与树脂可充分接触,但吸附时间就会延长,吸附效率随之降低[16,22-25]。因此,需综合考虑树脂的吸附能力和吸附效率确定最佳的上样流速。由图2可知,当流速从1.5 mL/min增加到2.5 mL/min,吸附曲线斜率明显增大,穿透点体积从140 mL下降到120 mL,而当流速从0.5 mL/min增加到1.5 mL/min,穿透点略有下降而吸附曲线斜率几乎保持不变,此时加快流速可缩短生产周期,因此选择1.5 mL/min为最佳上样流速,此时上样体积和上样质量分别为140 mL和2 800 mg。
2.3.2 大孔吸附树脂对水酶法大豆多肽的分级洗脱
粗肽液经吸附平衡后,先用去离子水洗涤层析柱以洗去与树脂结合较弱的无机盐和糖类物质,当流出液电导率近似于初始数值时,依次用体积分数为25%、50%、75%和100%的乙醇溶液各80 mL进行洗脱(流速2 mL/min)。图3为DA201-C大孔吸附树脂对水酶法大豆多肽的动态解吸过程中洗脱液电导率、糖含量和多肽质量浓度随洗脱体积的变化曲线。
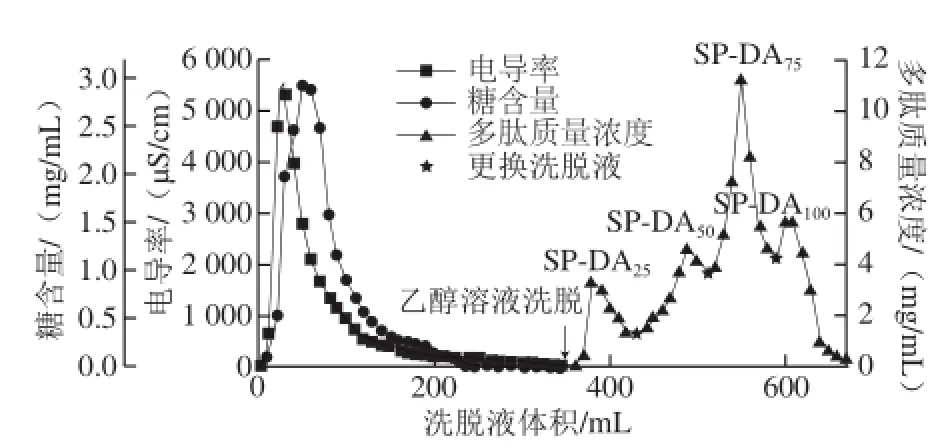
图3 DA201-C大孔吸附树脂对水酶法大豆多肽的动态解吸曲线Fig.3 Dynamic desorption curves of DA201-C resin for soybean peptides
由图3可知,最初流出液的电导率和糖含量随着水洗的进行而逐渐增大,约在30 mL和50 mL体积处达到峰值,当水洗体积超过350 mL后二者趋于稳定,说明此时层析柱中可被脱除的盐类和糖类物质已基本流出,因此可确定水洗体积为350 mL。然后换做不同体积分数乙醇溶液对大豆多肽进行分级洗脱,可被分离成SP-DA25、SP-DA50、SP-DA75、SP-DA100共4 个组分,各组分多肽回收率分别为14.14%、20.81%、39.20%和21.50%(表3),大豆多肽总回收率为95.65%,树脂吸附量为13.32 mg/g。因动态吸附时多肽粗液与树脂的接触时间较短,因此此时吸附量也低于静态吸附时的吸附量。
2.4 水酶法大豆多肽纯化效果分析
根据上述纯化实验结果,确定水酶法大豆多肽的纯化工艺条件为:上样体积140 mL(上样质量2 800 mg)、流速1.5 mL/min、水洗体积350 mL,25%、50%、75%、100%乙醇溶液依次洗脱,每次80 mL,流速为2 mL/min。在该条件下对大豆粗肽液进行吸附,分别收集洗脱液经真空旋蒸浓缩和冷冻干燥后得到水酶法大豆多肽组分,其化学组成见表3。
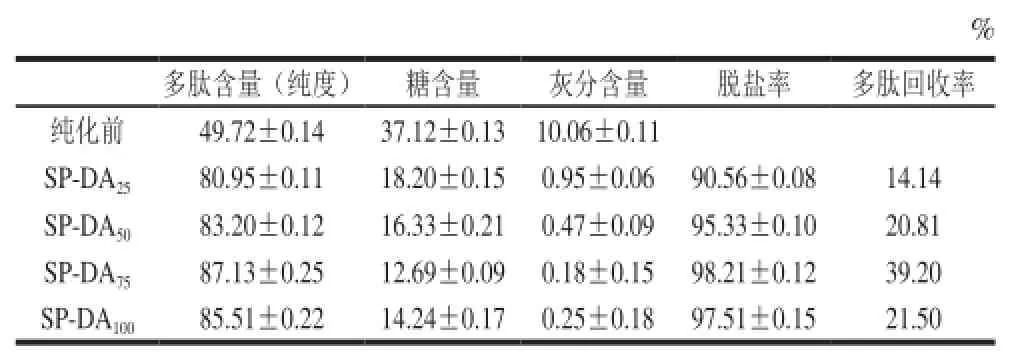
表3 DA201-C大孔吸附树脂对水酶法大豆多肽的纯化效果Table3 Purification of soybean peptides using DA201-C resin
大孔吸附树脂与被吸附物质间主要为疏水相互作用且作用力较弱,解吸剂乙醇的加入可改变体系的亲水-疏水平衡,引起多肽或杂质组分的吸附或解吸[21,26-27],因此可根据乙醇体积分数对大豆多肽进行分级洗脱。由表3可知,随着解吸剂乙醇体积分数的增加,大豆多肽组分的纯度随之上升,当乙醇体积分数为75%时,纯化效果最优,其多肽含量增加了36.31%,糖含量和灰分含量分别降低了65.81%和98.21%,这一结果与李华等[7]的研究报道一致。且不论在哪一种洗脱剂体积分数条件下,多肽组分纯度均在80%以上,脱盐率和脱糖率分别在90%和51%以上,说明采用DA201-C大孔吸附树脂对样品中的盐类、糖类等杂质成分有显著的去除效果,可有效达到富集纯化的目的。
2.5 大豆多肽组分的ORAC值
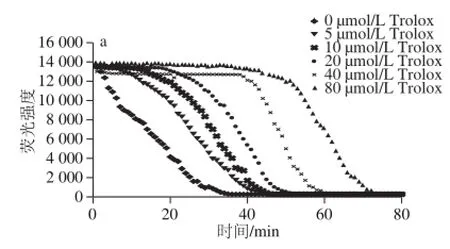
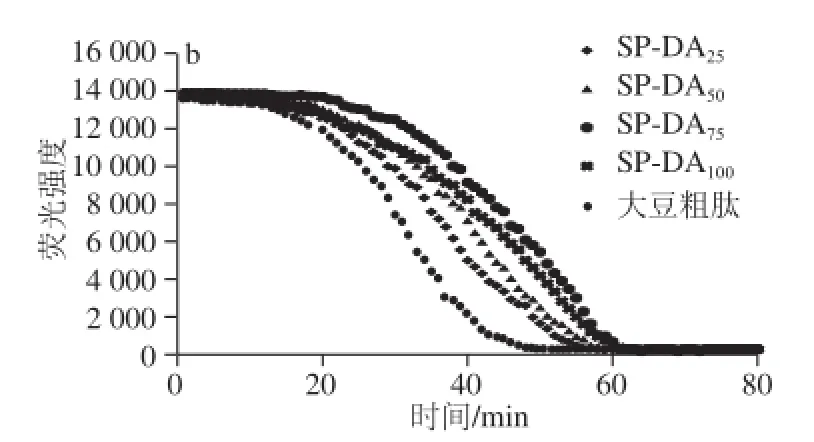
图4 Trolox(a)及大豆多肽洗脱组分(b)的荧光衰变曲线Fig.4 Fluorescence decay curves of Trolox at different concentrations and soybean peptide fractions
由图4a可知,随着Trolox浓度的增加,达到荧光衰变曲线的时间从0 μmol/L的35 min增加至80 μmol/L的73 min,且荧光衰变曲线下的面积随着Trolox浓度的增加而增大,Trolox浓度与荧光衰变曲线下的保护面积间的关系可用线性方程:y=5 360x+17 933(R2=0.993 0)表示。由图4b可知,不同体积分数乙醇洗脱组分的抗氧化活性有所不同,其中SP-DA25及SP-DA50组分ORAC值较低,分别为51.05 μmol/L和58.58 μmol/L,其次是SP-DA100组分为63.96 μmol/L,75%乙醇溶液洗脱组分SP-DA75的ORAC值最高,为72.81μmol/L,较纯化前提高了200%,说明经大孔吸附树脂纯化后大豆多肽的抗氧化性有显著提升。
2.6 水酶法水解液中大豆多肽的氨基酸组成分析
根据上述纯化工艺,对所得的大豆多肽组分进行氨基酸组成分析,并与水酶法水解液的氨基酸组成进行对比,结果见表4。
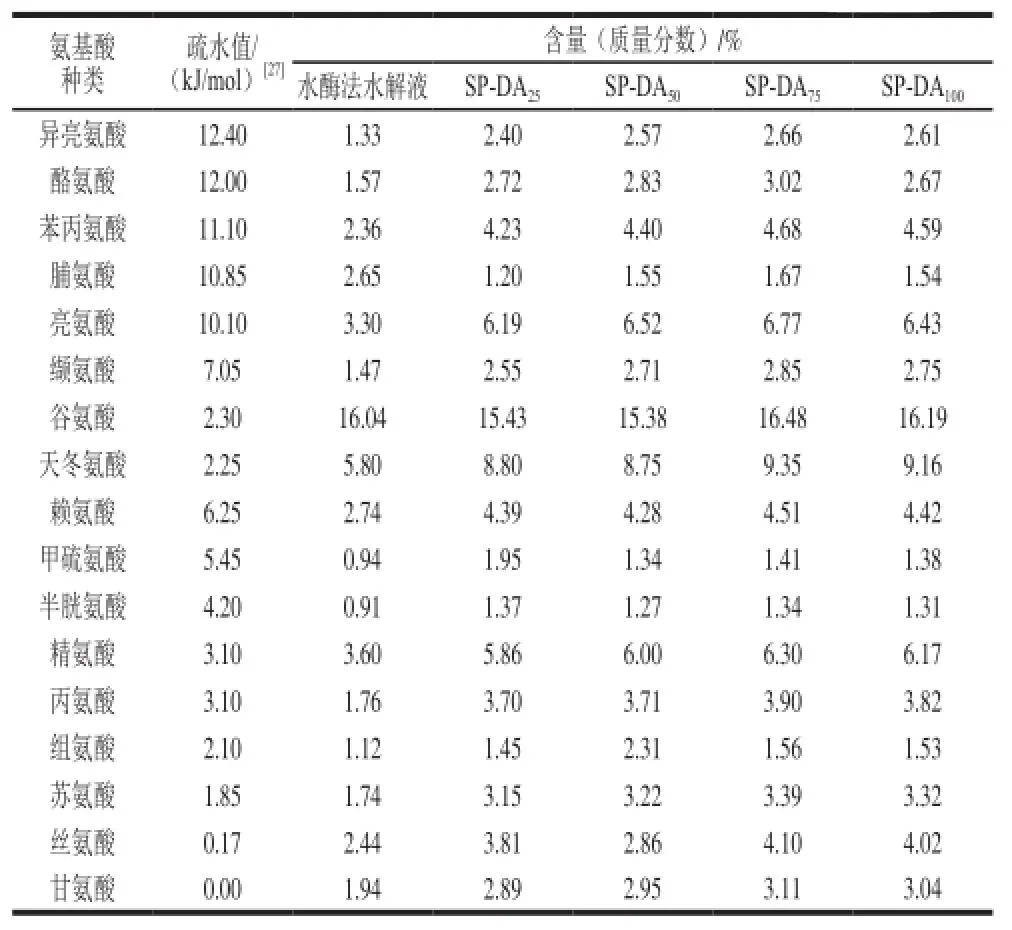
表4 水酶法大豆多肽组分的氨基酸组成Table4 Amino acid composition and ORAC of soybean peptide fractions
氨基酸组成是评定蛋白及多肽营养价值的重要指标之一[24],尤其对于肽类物质而言,其氨基酸的组成、数量及序列直接决定了其特有的生物活性[25]。由表4可知,水酶法水解液中氨基酸的分布与大豆原料相似,除甲硫氨酸(大豆的第一限制氨基酸)含量稍低外,含有其余8 种必需及半必需氨基酸(色氨酸除外)。Latif等[24]研究发现水酶法花生水解液中必需氨基酸的含量较溶剂提取和冷榨后粕中必需氨基酸的含量高,说明酶解的温和作用,对大豆蛋白的破坏较少。经过大孔吸附树脂的纯化作用,水酶法大豆多肽中各氨基酸百分含量普遍有所提升,且随着洗脱乙醇体积分数的增加,大豆多肽组分中疏水性氨基酸的含量呈显著上升趋势,75%乙醇溶液洗脱时含量最高,说明DA201-C大孔吸附树脂可通过疏水性强弱利用不同体积分数的乙醇对大豆多肽进行分离。张晓梅等[25]通过乙醇体积分数变化分离大豆降胆固醇肽,结果同样发现各分离组分具有疏水性差异且75%体积分数组分疏水性最高。
比较图4b可知,随着大豆多肽组分疏水性的增加,对氧自由基的淬灭能力呈上升趋势,75%体积分数时达到最高,说明肽链中疏水性组分的存在与其抗氧化活性有一定关联;李华等[7]在对黑豆肽抗氧化性与其氨基酸组成的关系研究中也发现随着组分疏水性的增加,其自由基清除能力总体呈现上升趋势。与此同时,75%及100%洗脱组分中含有较多的谷氨酸(16.48%、16.19%)和天冬氨酸(9.35%、9.16%),该两种为酸性氨基酸,可作为质子供体发挥抗氧化作用,如Jiang[26]、Najafian[27]、Plundrich[28]、程云辉[29]等均报道了含有酸性氨基酸的抗氧化肽。以上是从氨基酸组成出发探讨不同种类的氨基酸对水酶法大豆多肽抗氧化活性的贡献,肽的活性同样与其氨基酸序列、电荷性质、分子结构密切相关,这些均需要进一步分离纯化、结构鉴定以及体外、体内实验进行验证。
3 结 论
水解液作为水酶法工艺的主要副产物之一,含有大豆中绝大多数的可溶性成分,仅作为废弃物会造成大豆蛋白资源的巨大浪费,尤其是其中含有的低分子肽类,可作为功能性食品添加剂、保健食品的原料来源,具有可观的开发前景。本研究采用大孔吸附树脂对水酶法水解液中的大豆多肽进行吸附纯化处理:通过静态吸附试验确定DA201-C大孔吸附树脂对大豆多肽的吸附能力优于其他7种树脂,其吸附率和吸附量分别为84.15%和62.76 mg/g;通过动态吸附及分级洗脱实验,确定纯化最佳工艺为:上样体积140 mL(上样质量2 800 mg)、上样流速1.5 mL/min、水洗体积350 mL,25%、50%、75%、100%乙醇溶液各80 mL分级洗脱,流速2 mL/min。经纯化后各大豆多肽组分纯度均在80%以上,总回收率
为95.65%,树脂吸附量为13.32 mg/g,糖类及盐类杂质显著减少;乙醇分级洗脱可分离4 个大豆多肽组分,其中75%体积分数组分SP-DA75的ORAC值最强,肽段的抗氧化性与其疏水性氨基酸含量及酸性氨基酸含量有一定关联。DA201-C大孔吸附树脂综合性能较好,能有效脱除大豆多肽中的盐分等杂质成分,可作为一种纯化水酶法大豆多肽的有效方法,为后续进一步分离纯化、活性鉴定及工业化生产提供了实验依据。
[1] 江连洲, 李杨, 王妍, 等. 水酶法提取大豆油的研究进展[J]. 食品科学, 2013, 34(9): 346-350. DOI:10.7506/spkx1002-6630-201309069.
[2] 李杨, 江连洲, 杨柳. 水酶法制取植物油的国内外发展动态[J]. 食品工业科技, 2009, 30(6): 383-387. DOI:10.13386/ j.issn1002-0306.2009.06.094.
[3] 杨柳, 江连洲, 李杨, 等. 水酶法提取的大豆蛋白功能特性研究[J].食品与发酵工业, 2010, 36(6): 80-84. DOI:10.13995/j.cnki.11-1802/ ts.2010.06.013.
[4] 李杨, 张雅娜, 王欢, 等. 水酶法提取大豆油与其他不同种大豆油品质差异研究[J]. 中国粮油学报, 2014, 29(6): 46-52. DOI:10.3969/ j.issn.1003-0174.2014.06.009.
[5] CAMPBELL K A, GLATZ C E, JOHNSON L, et al. Advances in aqueous extraction processing of soybeans[J]. Journal of American Oil Chemist Society, 2011, 88: 449-465. DOI:10.1007/s11746-010-1724-5.
[6] SAMARANAYAKA A G P, LI-CHAN E C Y. Food-derived peptidic antioxidants: a review of their production, assessment, and potential applications[J]. Journal of Functional Foods, 2011, 3: 229-254. DOI:10.1016/j.jff.2011.05.006.
[7] 李华, 刘恩岐, 唐仕荣, 等. 酶法制备黑豆抗氧化肽及其分离纯化与氨基酸组成分析[J]. 食品科学, 2013, 34(9): 271-276. DOI:10.7506/ spkx1002-6630-201309055.
[8] de MOURA B J M L N, MAURER D, YAO L, et al. Characteristics of oil and skim in enzyme-assisted aqueous extraction of soybeans[J]. Journal of American Oil Chemist Society, 2013, 90: 1079-1088. DOI:10.1007/s11746-013-2248-6.
[9] CAMPBELL K A, GLATZ C E. Protein recovery from enzymeassisted aqueous extraction of soybean[J]. Biotechnology Progress, 2010, 26(2): 488-495. DOI:10.1002/btpr.341.
[10] 刘彬, 曹栋, 孟庆然. 超滤技术结合大孔吸附树脂纯化低聚果糖[J]. 食品与机械, 2016, 32(2): 133-138. DOI:10.13652/ j.issn.1003-5788.2016.02.034.
[11] 李艳, 孙海燕, 周丽珍, 等. 大孔树脂纯化血管紧张素酶抑制肽VLPVPR的工艺优化[J]. 食品工业科技, 2014, 35(6): 206-211. DOI:10.13386/j.issn1002-0306.2014.06.038.
[12] 马寒冰, 廖永红, 徐曼, 等. DA201-C大孔吸附树脂纯化大豆多肽条件优化[J]. 中国调味品, 2014, 39(9): 43-48. DOI:10.3969/ j.issn.1000-9973.2014.09.012.
[13] ZHU Kexue, WANG Xiaoping, GUO Xiaona. Isolation and characterization of zinc-chelating peptides from wheat germ protein hydrolysates[J]. Journal of Functional Foods, 2015, 12: 23-32. DOI:10.1016/j.jff.2014.10.030.
[14] ÉVA B P, SALI N, KŐSZEGI T, et al. Antioxidant potential, tannin and polyphenol contents of the seed and pericarp of three Coffea species[J]. Asian Pacifc Journal of Tropical Medicine, 2016, 4: 366-371. DOI:10.1016/j.apjtm.2016.03.014.
[15] 李杨, 江连洲, 张兆国, 等. 模糊评判优化水酶法提取膨化大豆油脂和蛋白[J]. 农业工程学报, 2010, 26(2): 375-380. DOI:10.3969/ j.issn.1002-6819.2010.02.066.
[16] LI Y, SUI X, QI B, et al. Optimization of ethanol-ultrasound-assisted destabilization of a cream recovered from enzymatic extraction of soybean oil[J]. Journal of American Oil Chemist Society, 2014, 91(1): 159-168. DOI:10.1007/s11746-013-2352-7.
[17] 李艳, 孙海燕, 周丽珍, 等. 大孔吸附树脂纯化重组降血压肽VLPVPR的研究[J]. 食品工业科技, 2014, 35(7): 284-288. DOI:10.13386/j.issn1002-0306.2014.07.015.
[18] OU B, HAMPSCH-WOODILL M, PRIOR R L. Development and validation of an improved oxygen radical absorbance capacity assay using fuorescein as the fuorescent probe[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 4619-4626. DOI:10.1021/jf010586o.
[19] CAO G, ALESSIO H M, CULTER R. Oxygen-radical absorbance capacity assay for antioxidants[J]. Free Radical Biological Medicine, 1993, 14: 303-311. DOI:10.1016/0891-5849(93)90027-R.
[20] JULIANA M L N D M, BLANCA H L, NEIVA M D A, et al. Lunasin and BowmanBirk protease inhibitor concentrations of protein extracts from enzyme-assisted aqueous extraction of soybeans[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 6940-6946. DOI:10.1021/ jf200183m.
[21] 林利美, 胡勤玲, 王申, 等. 大孔吸附树脂对草鱼肽的脱盐作用[J].食品科学, 2014, 35(5): 33-36. DOI:10.7506/spkx1002-6630-201405007.
[22] LU R, QIAN P, SUN Z, et al. Hempseed protein derived antioxidative peptides: purification, identification and protection from hydrogen peroxide-induced apoptosis in PC12 cells[J]. Food Chemistry, 2010, 123: 1210-1218. DOI:10.1016/j.foodchem.2010.05.089.
[23] LI Z, JIANG A, YUE T, et al. Purifcation and identifcation of fve novel antioxidant peptides from goat milk casein hydrolysates[J]. Journal of Dairy Science, 2013, 96(7): 4242-4251. DOI:10.3168/ jds.2012-6511.
[24] LATIF S, PFANNSTIEL J, MAKKAR H P S, et al. Amino acid composition, antinutrients and allergens in the peanut protein fraction obtained by an aqueous enzymatic process[J]. Food Chemistry, 2013, 136: 213-217. DOI:10.1016/j.foodchem.2012.07.120.
[25] 张晓梅, 钟芳, 麻建国. 大豆降胆固醇活性肽的初步分离纯化[J]. 食品与机械, 2006, 22(2): 33-36. DOI:10.3969/ j.issn.1003-5788.2006.02.010.
[26] JIANG L, WANG B, LI B, et al. Preparation and identification of peptides and their zinc complexes with antimicrobial activities from silver carp (Hypophthalmichthys molitrix) protein hydrolysates[J]. Food Research International, 2014, 64(13): 91-98. DOI:10.1016/ j.foodres.2014.06.008.
[27] NAJAFIAN L, BABJI A S. Production of bioactive peptides using enzymatic hydrolysis and identification antioxidative peptides from patin (Pangasius sutchi) sarcoplasmic protein hydolysate[J]. Journal of Functional Foods, 2014, 9(1): 280-289. DOI:10.1016/j.jff.2014.05.003.
[28] PLUNDRICH N J, WHITE B L, DEAN L L, et al. Stability and immunogenicity of hypoallergenic peanut protein-polyphenol complexes during in vitro pepsin digestion[J]. Food and Function, 2015, 6: 2145-2154. DOI:10.1039/c5fo00162e.
[29] 程云辉, 曾知音, 郭建伟, 等. 抗氧化肽的酶法制备及其构效关系的研究进展[J]. 食品与机械, 2009, 25(6): 174-180. DOI:10.13652/ j.issn.1003-5788.2009.06.003.
Purification and Amino Acid Composition of Peptides from Soybean Byproduct Protein Hydrolysate from Aqueous Enzymatic Extraction of Soybean Oil
ZHANG Qiaozhi, BI Shuang, MA Wenjun, LI Yang, SUI Xiaonan, JIANG Lianzhou*
(School of Food Science, Northeast Agricultural University, Harbin 150030, China)
In this paper, the adsorption performances and purification efficiencies of 8 macroporous adsorption resins (MARs) for peptides from soybean byproduct protein hydrolysate from aqueous enzymatic extraction of soybean oil were comparatively evaluated by static adsorption and desorption experiments in order to find the best one among these MARs. Further, the effects of feeding volume, feeding rate and desorbent concentration on the purification efficiency of MARs were investigated. Results showed that DA201-C resin had the highest adsorption capability for soybean peptides among 8 resins tested. The optimum dynamic adsorption conditions of DA201-C resin were determined as follows: sample loading volume, 140 mL; feeding flow rate, 1.5 mL/min; 350 mL of water as washing solvent; and fractional elution with 25%, 50%, 75% and 100% using 80 mL of each concentration gradient at 2 mL/min flow rate. Under these conditions, the purity of the purified soybean peptides reached above 80% with a total recovery of 95.65% and a removal rate of more than 90% and 51% for salt and sugar impurities, respectively, and the adsorption capacity of DA201-C resin was 13.32 mg/g. Four soybean peptide fractions were separated by fractional elution with ethanol. A fraction eluted with 75% ethanol, SP-DA75, showed the highest oxygen radical adsorption capacity (ORAC) among the four fractions. Moreover, there was a correlation between antioxidant activities of peptide fragments and their contents of hydrophobic amino acids and acidic amino acids. In conclusion, DA201-C resin exhibited excellent adsorption performance and could be applied as an effective method to purify soybean peptides.
aqueous enzymatic extraction; soybean peptide; macroporous adsorption resin; purification; amino acid composition
10.7506/spkx1002-6630-201622016
TS229
A
1002-6630(2016)22-0112-07
张巧智, 毕爽, 马文君, 等. 水酶法水解液中大豆多肽的吸附纯化及其氨基酸组成分析[J]. 食品科学, 2016, 37(22): 112-118. DOI:10.7506/spkx1002-6630-201622016. http://www.spkx.net.cn
ZHANG Qiaozhi, BI Shuang, MA Wenjun, et al. Purification and amino acid composition of peptides from soybean byproduct protein hydrolysate from aqueous enzymatic extraction of soybean oil[J]. Food Science, 2016, 37(22): 112-118. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622016. http://www.spkx.net.cn
2016-02-29
“十二五”国家科技支撑计划项目(2014BAD22B00);国家高技术研究发展计划(863计划)项目(2013AA102101);黑龙江省自然科学基金项目(ZD201302);高等学校博士学科点专项科研基金项目(20132325110013)
张巧智(1990—),女,博士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:miumiulovelife@163.com
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jlzname@163.com
