苹果渣中结合酚不同提取方法的研究
2016-12-06张金宏李俊娥魏新元樊明涛
张金宏,李俊娥,魏新元,樊明涛
(西北农林科技大学食品科学与工程学院,陕西杨陵 712100)
苹果渣中结合酚不同提取方法的研究
张金宏,李俊娥,魏新元,樊明涛
(西北农林科技大学食品科学与工程学院,陕西杨陵 712100)
在最优条件下,以结合态酚类物质的种类和含量为指标,比较碱法、酶法和酸法对苹果渣中结合态酚类物质的提取效果。采用单因素实验对提取条件进行优化,HPLC-DAD法分别检测游离态酚和结合态酚中单体酚的种类和含量。结果表明:在温度为40 ℃下,选择碱降解时间为4 h,NaOH浓度为3 mol/L;酸降解时间为15 h,甲醇/浓硫酸浓度为13∶1(v/v);酶降解时间为20 h,单宁酶酶活为1000 U。苹果渣中酚类物质主要是金丝桃苷、绿原酸、根皮苷、儿茶素、槲皮素、根皮素、没食子酸、原儿茶酸和咖啡酸。儿茶素、槲皮素、根皮素、没食子酸、原儿茶酸和咖啡酸主要以结合态的形式存在,没食子酸、原儿茶酸、咖啡酸和根皮素通过酶法提取的含量最高,分别为16.122、18.574、13.030、69.934 μg/g;儿茶素和槲皮素通过酸法提取的含量最高,分别为148.909、66.396 μg/g。酶法水解和酸法水解比碱法水解更适用于提取苹果渣中的结合态酚类物质。
苹果渣,游离酚,结合酚,优化,HPLC-DAD检测
苹果是蔷薇科(Rosaceae)苹果属(Malus)植物的果实[1]。苹果是我国第一大水果,是我国少有的占据国际市场竞争优势的农产品[2]。我国对苹果的加工利用主要为初加工,如浓缩苹果汁、苹果酒、果酱等,在实际生产生活中,苹果皮渣往往被扔掉或废弃,造成大量资源的浪费[3]。研究表明苹果果皮中的多酚类物质的含量远高于苹果果肉中的多酚类物质含量,苹果多酚类物质具有抗氧化、抗癌、护肝和抑制血压升高等功能[4]。目前国内外对苹果多酚的研究主要集中在果皮和果肉中的游离态酚,对于苹果渣中多酚物质的提取和测定也仅分析了游离酚,而对苹果中结合态酚类物质的研究鲜有报道[5]。已有研究证实,相对于游离态酚类物质,植物中结合态酚类物质可能会具有更多的功能特性和发挥更强的生物活性[6-7]。植物多酚是植物体内次生代谢的中间产物,由于植物酚类物质大量分布于植物的外层组织(果皮、壳等)中,通常以结合态的形式连接在细胞壁结构上而难以直接提取出来,必须通过降解的方式使它们释放出来[8]。苏东晓等分别采用酸水解法和碱水解法提取荔枝果肉中的结合酚,发现酸水解法更适合提取荔枝果肉中的结合态酚[9]。因此,有必要探索不同的方法提取苹果渣中的游离态酚和结合态酚类物质,准确地评价苹果渣中酚类物质的种类和含量,为苹果皮渣的进一步开发利用打下基础。
本研究以优质红富士苹果为原料,采用70%乙醇水溶液来提取苹果渣中的游离态酚,以提取后的皮渣为原料,分别采用碱法、酶法和酸法来提取苹果渣中的结合态酚,用HPLC-DAD检测游离态酚和结合态酚中单体酚的种类与含量,为苹果渣中苹果多酚资源的深度开发利用提供理论指导。
1 材料与方法
1.1 材料与仪器
Folin-Ciocalteu试剂 北京Solarbio科技有限公司;色谱甲醇 TEDIA;纯度98%以上的没食子酸、原儿茶酸、儿茶素、绿原酸、表儿茶素、咖啡酸、阿魏酸、金丝桃苷、根皮苷、鞣花酸、槲皮素和根皮素等12种标品 上海融禾医药科技发展有限公司;没食子酸 分析纯,天津市科密欧化学试剂有限公司;单宁酶(酶活为200 u/g)上海源叶生物科技有限公司;无水乙醇、乙酸乙酯、正己烷、NaCO3、HCl、浓硫酸、NaOH、磷酸、甲醇、冰乙酸、醋酸钠 均为国产分析纯试剂。
UVmini-1240型紫外可见分光光度计 日本京都岛津制作所;R-200旋转蒸发仪 瑞士BUCHI有限公司;SHB-Ⅲ循环水真空泵 郑州长城科工贸有限公司;YLE-2000电热恒温水浴锅 北京科伟永兴仪器有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;JA2003N电子天平 上海精密科学仪器有限公司;KQ-500DE超声波清洗器 昆山市超声仪器有限公司;Waters 600E高效液相色谱仪 美国Waters;PHS-3C型pH计 上海精密科学仪器有限公司;BCD-256KZL型-20 ℃冰箱 青岛海尔股份有限公司;BM252C榨汁机 美的集团;QYC-200摇床 上海福玛实验设备有限公司;101-1烘箱 北京科伟永兴仪器有限公司。
1.2 实验方法
1.2.1 苹果渣的制备 苹果渣:将市售的优质红富士苹果清洗、切块、榨汁(加入1%的抗坏血酸)、抽滤之后得到苹果渣,立即将其贮存于-20 ℃,备用(全程注意避光)[10]。
1.2.2 苹果渣中游离态酚的提取 苹果渣中游离态酚的提取参考汪浩明的方法,并稍作修改[10]。准确称取5.000 g苹果渣,加入70%乙醇125 mL,在30 ℃的水浴中提取3次,每次40 min,过滤,再将滤液在4000 r/min转速下离心15 min,收集合并上清液,用旋转蒸发仪在0.09 MPa下浓缩,浓缩液用甲醇定容至10 mL,于-20 ℃冰箱里密封避光保存,待测。滤渣备用以提取结合态酚。
1.2.3 碱法提取苹果渣中的结合态酚
1.2.3.1 提取方法 参照Morimura S等的方法并略有改动[11-12]。先将1.2.2中提取后的滤渣用90 mL的正己烷洗涤去脂,再将其在10000 g转速下离心10 min,去掉上清液,再向其中加入40 mL 2 mol/L NaOH溶液,充入氮气密封后分别在40 ℃下摇床消化4 h。待所得水解液冷却后用2 mol/L HCl溶液调节pH至2,再将其在10000 g转速下离心15 min,将酸性上清液转移到干净的分液漏斗里,残余物用10 mL的超纯水洗涤并在10000 g转速下离心15 min。将此上清液与酸性上清液混合,再将混合的提取液用60 mL乙酸乙酯萃取6次,混合振动10 min,再离心分离。收集萃取相,将萃取液在40 ℃下减压浓缩至干,浓缩物用甲醇定容至10 mL,得结合态酚类物质提取液,于-20 ℃冰箱里密封避光保存,测定多酚含量。
1.2.3.2 碱降解浓度的确定 采用1.2.3.1中提取方法,分别用1、2、3、4、5、6 mol/L NaOH降解后减压浓缩至干,测定多酚含量。
1.2.3.3 碱降解时间的确定 采用1.2.3.1中提取方法和1.2.3.2中所筛选的碱降解浓度,分别降解1、2、3、4、5、6 h后减压浓缩至干,测定多酚含量。
1.2.4 酸法提取苹果渣中的结合态酚
1.2.4.1 提取方法 参考Hartzfeld等建立的方法并略有改动[13]。先将1.2.2中提取后的滤渣用90 mL的正己烷洗涤去脂,再将其在10000 g转速下离心10 min,去掉上清液。再向其中加入20 mL甲醇/浓硫酸(18 mol/L)(9∶1,v/v),充入氮气密封后分别在40 ℃下摇床消化15 h。待所得水解液冷却后用6 mol/L NaOH溶液调节pH至中性,再将其在10000 g转速下离心15 min,将酸性上清液转移到干净的分液漏斗里,残余物用10 mL的超纯水洗涤并在10000 g转速下离心15 min。将此上清液与酸性上清液混合,再将混合的提取液用60 mL乙酸乙酯萃取6次,并混合振动10 min,再离心分离。收集萃取相,将萃取液在40 ℃下减压浓缩至干,浓缩物用甲醇定容至10 mL,得结合态酚类物质提取液,于-20 ℃冰箱里密封避光保存,测定多酚含量。
1.2.4.2 酸降解浓度的确定 采用1.2.4.1中提取方法,分别用浓度为5∶1、7∶1、9∶1、11∶1、13∶1、15∶1甲醇:浓硫酸(v/v)降解后减压浓缩至干,测定多酚含量。
1.2.4.3 酸降解时间的确定 采用1.2.4.1中提取方法和1.2.4.2所筛选的酸降解浓度,分别降解5、10、15、20、25 h后减压浓缩至干,测定多酚含量。
1.2.5 酶法提取苹果渣中的结合态酚
1.2.5.1 提取方法 参考S. Chamorro等的方法并略有改动[6]。先将1.2.2中提取后的滤渣用90 mL的正己烷洗涤去脂,再将其在10000 g转速下离心10 min,去掉上清液。再向其中加入2 g 200 U/g酶活的单宁酸酶,用0.2 mol/L乙酸钠缓冲液40 mL溶解单宁酸酶,在35 ℃,100 r/min的条件下分别水解24 h。待水解液冷却后再将其在6000 r/min转速下离心15 min,收集上清液,残余物用10 mL的超纯水洗涤并在10000 g转速下离心15 min。将此时的上清液与之前的上清液混合,再将混合的提取液用60 mL乙酸乙酯萃取6次,并混合振动10 min,再离心分离。收集萃取相,将萃取液在40 ℃下减压浓缩至干,浓缩物用甲醇定容至10 mL,得结合态酚类物质提取液,于-20 ℃冰箱里密封避光保存,测定多酚含量。
1.2.5.2 加酶量的确定 采用1.2.5.1中提取方法,分别用酶活为200、400、600、800、1000、1200 U单宁酶降解后减压浓缩至干,测定多酚含量。
1.2.5.3 酶降解时间的确定 采用1.2.5.1中提取方法和1.2.5.2所筛选的加酶量,分别降解12、16、20、24、28 h后减压浓缩至干,测定多酚含量。
1.2.6 多酚含量的测定 多酚含量的测定采用优化的Folin-Ciocalteu法并稍作修改[14]。用没食子酸做标准溶液,配制没食子酸溶液质量浓度为0.1 mg/mL,分别取0、1、2、3、4、5、6 mL的没食子酸标准溶液用甲醇稀释成10~60 μg/mL的标准溶液,吸取0.5 mL的标准溶液加到盛有2.5 mL蒸馏水的试管中,再加入0.5 mL Folin-Ciocalteu试剂,充分混合,再加入1.5 mL 7.5%碳酸钠溶液,摇匀后放置在避光条件下室温反应2 h。在765 nm处用紫外分光光度计测定吸光度,以含量对吸光度(A)进行直线回归,得到标准曲线。测定样品多酚含量时取多酚提取液0.5 mL代替没食子酸标准溶液进行反应,测定吸光度,再通过标准曲线方程算出样品中多酚的含量,结果以每1 kg样品中没食子酸当量(mg/kg干果渣,简写为DP)表示。
1.2.7 HPLC-DAD法测定单体酚的种类和含量
1.2.7.1 标准溶液的制备 精确地称取1 mg标品溶解于10 mL甲醇中作为储备液。使用的混标溶液是将所有的标品储备液混合至所需浓度。混标中所含有的标品有没食子酸、原儿茶酸、儿茶素、绿原酸、表儿茶素、咖啡酸、阿魏酸、金丝桃苷、根皮苷、鞣花酸、槲皮素、根皮素,所有这些标品的浓度均为8.333 μg/mL。这些储备液在4 ℃下避光保存,进样前使用0.45 μm滤膜过滤。
1.2.7.2 色谱条件 色谱柱:WondSil® C18(250 mm×4.6 mm,5 μm)。使用Empower软件获得液相的数据并对其进行处理。流动相:A是0.01%磷酸水溶液,B是色谱级甲醇。流速:0.8 mL/min。进样量:20 μL。柱温:30 ℃。采用梯度洗脱程序:流动相B在0~20 min从20%上升到50%;在20~25 min从50%上升到70%;在25~30 min从70%上升到80%;在30~35 min从80%下降到20%;35~45 min,20% B。280 nm下中性酚有最大吸收,320 nm下酸性酚有最大吸收,为使吸收效果最好,紫外检测波长采用280 nm和320 nm。
将这12种单体酚分别配成甲醇标准溶液,在上述色谱条件下进行测定,确定标品的保留时间。
分别准确称取0.0010 g 12种标品溶于甲醇中,分别定容于10 mL棕色容量瓶中,并稀释成不同的浓度梯度,在上述色谱条件下进行测定,以浓度为横坐标,峰面积为纵坐标,绘制每种单体酚的标准曲线。在上述色谱条件下对样品进行检测,对照标品的保留时间和样品的保留时间确定单体酚的种类,获得的峰面积再根据所绘制的标准曲线得到相对应单体酚的含量。
1.3 数据处理
运用Excel 2010和DPS统计软件对数据进行分析和处理。
2 结果与分析
2.1 碱法提取苹果渣中的结合态酚
2.1.1 碱降解浓度的选择 以碱降解浓度为变量,以总酚含量为指标,得到如图1所示结果:
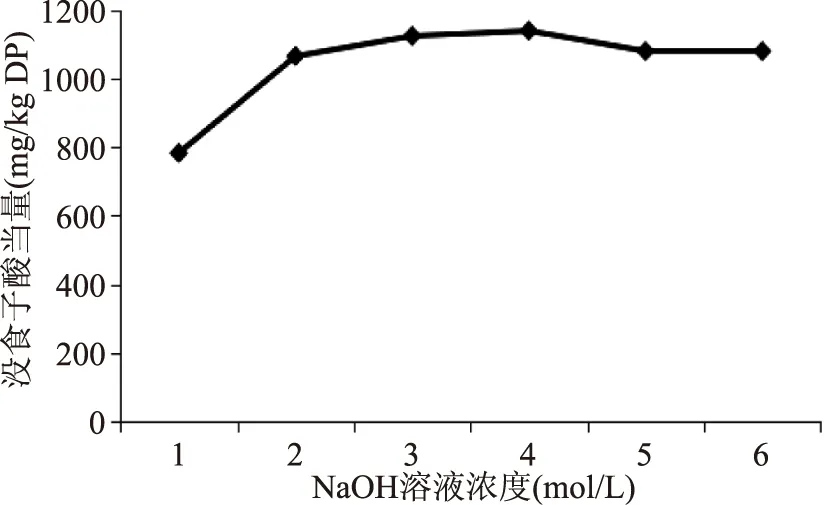
图1 不同碱降解浓度对结合酚提取效果的影响Fig.1 The extraction effect of the different degradation concentration for bound phenols
图1可见,在低浓度时,随着NaOH溶液浓度的增大,结合酚的提取量增加,在4 mol/L时达到最大,之后稍有减少并且趋于不变,但当NaOH溶液浓度为3 mol/L和4 mol/L时,结合酚的含量没有显著性差异,故最佳碱降解浓度为3 mol/L。
2.1.2 碱降解时间的选择 以碱降解时间为变量,以总酚含量为指标,得到如图2所示结果:

图2 不同碱降解时间对结合酚提取效果的影响Fig.2 The extraction effect of the different alkaline degradation time for bound phenols
图2可见,碱降解4 h所得结合酚的量要高于1~3 h的量,稍高于5 h和6 h的量,这是因为4 h时水解基本已完成,再继续水解,多酚物质会被氧化进而导致含量稍有降低,因此最佳碱降解时间确定为4 h。
2.2 酸法提取苹果渣中的结合态酚
2.2.1 酸降解浓度的选择 以酸降解浓度为变量,以总酚含量为指标,得到如图3所示结果:
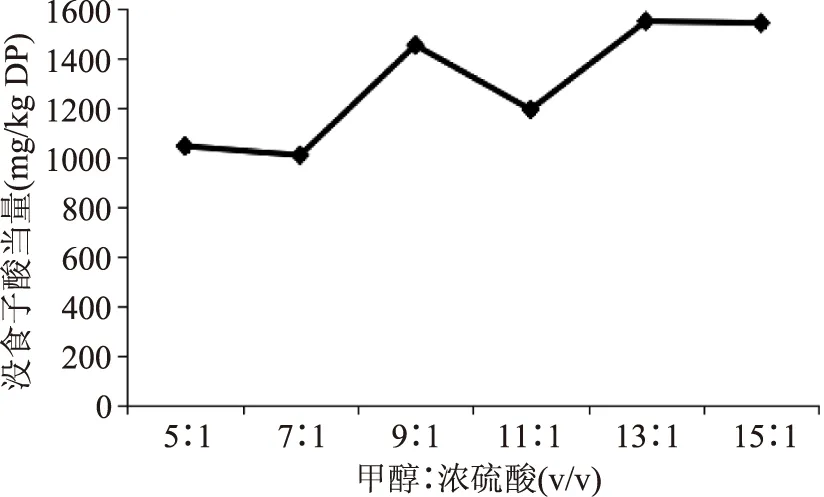
图3 不同酸降解浓度对结合酚提取效果的影响Fig.3 The extraction effect of the different degradation concentration for bound phenols
图3可见,甲醇/浓硫酸(v/v)的浓度达到13∶1时所得结合酚的量最大,浓硫酸浓度过高或过低,都不利用酯键的水解,即不利于结合酚的释放,故最佳酸降解浓度确定为13∶1。
2.2.2 酸降解时间的选择 以酸降解时间为变量,以总酚含量为指标,得到如图4所示结果:

图4 不同酸降解时间对结合酚提取效果的影响Fig.4 The extraction effect of the different acid degradation timefor bound phenols
图4可见,酸降解20 h所得结合酚的量要高于5~15 h的量,与25 h的量相同,这是因为20 h时水解基本已完成,再继续水解,多酚物质会被氧化进而导致含量稍有降低,故最佳酸降解时间确定为15 h。
2.3 酶法提取苹果渣中的结合态酚
2.3.1 酶降解加酶量的选择 以加酶量为变量,以总酚含量为指标,得到如图5所示结果:

图5 不同酶降解浓度对结合酚提取效果的影响Fig.5 The extraction effect of the different hydrolysis concentration for bound phenols
图5可见,随着酶活的逐渐增大,结合酚的提取量逐渐增加,在1000 U时达到最大且趋于不变,这是由于酶活达到一定程度时,水解作用基本趋于饱和,结合酚的量几乎无变化,故最佳酶活确定为1000 U。
2.3.2 酶降解时间的选择 以酶降解时间为变量,以总酚含量为指标,得到如图6所示结果:
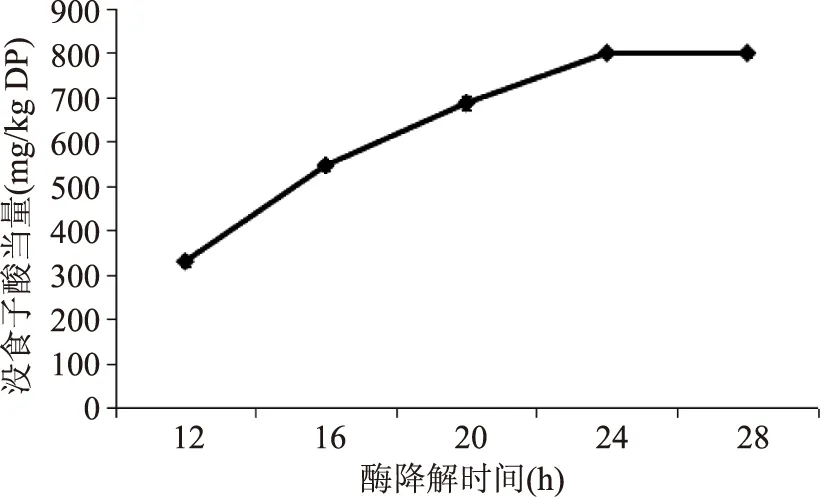
图6 不同酶降解时间对结合酚提取效果的影响Fig.6 The extraction effect of the different enzymatic hydrolysis time for bound phenols
图6可见,酶降解24 h所得结合酚的量要高于12~20 h的量,与28 h的量相同,这是因为20 h时水解基本已完成,再继续水解,多酚物质会被氧化进而导致含量稍有降低,因此最佳酶降解时间确定为20 h。
2.4 苹果渣中游离酚和结合酚中单体酚的种类和含量
HPLC-DAD法分别检测苹果渣中游离酚和结合酚的液相图如图7所示:

图7 280 nm下多酚标品(A)和苹果渣中的游离酚(A0)以及320 nm下多酚标品(B)和苹果渣中的游离酚(B0)的高效液相色谱图Fig.7 HPLC profiles at 280 nm of phenolic compounds of standards(A)and free phenols of apple pomace(A0)and at 320 nm of phenolic compounds of standards(B)and free phenols of apple pomace(B0)注:1.没食子酸;2.原儿茶酸;3.儿茶素;4.绿原酸;5.表儿茶素;6.咖啡酸;7.阿魏酸;8.金丝桃苷;9.根皮苷;10.鞣花酸;11.槲皮素;12.根皮素。
由图7可知,没食子酸、原儿茶酸、儿茶素、绿原酸、表儿茶素、咖啡酸、阿魏酸、金丝桃苷、根皮苷、鞣花酸、槲皮素和根皮素的保留时间分别为:7.347、11.785、13.770、16.000、17.598、18.819、24.788、28.356、29.567、32.610、34.178和36.151 min。图7-A是混标在280 nm条件下的色谱图,每个标品都能出峰,但只有中性酚出现最大吸收;图7-B是混标在320 nm条件下的色谱图,此波长下中性酚吸收很小或没有吸收,而酸性酚有最大吸收。因此,按照每个多酚标品的最大吸收来进行定性定量,儿茶素、表儿茶素、金丝桃苷、根皮苷、鞣花酸、槲皮素和根皮素的最大吸收波长为280 nm;没食子酸、原儿茶酸、绿原酸、咖啡酸、阿魏酸的最大吸收波长为320 nm。
根据标准品的出峰时间来确定样品中单体酚的种类,采用外标法确定其含量,游离酚和结合酚中单体酚的种类和含量如表1和表2所示:

表1 苹果渣游离酚中单体酚的种类和含量a
注:a平均值±标准差;n=3。ND:没有检测到。
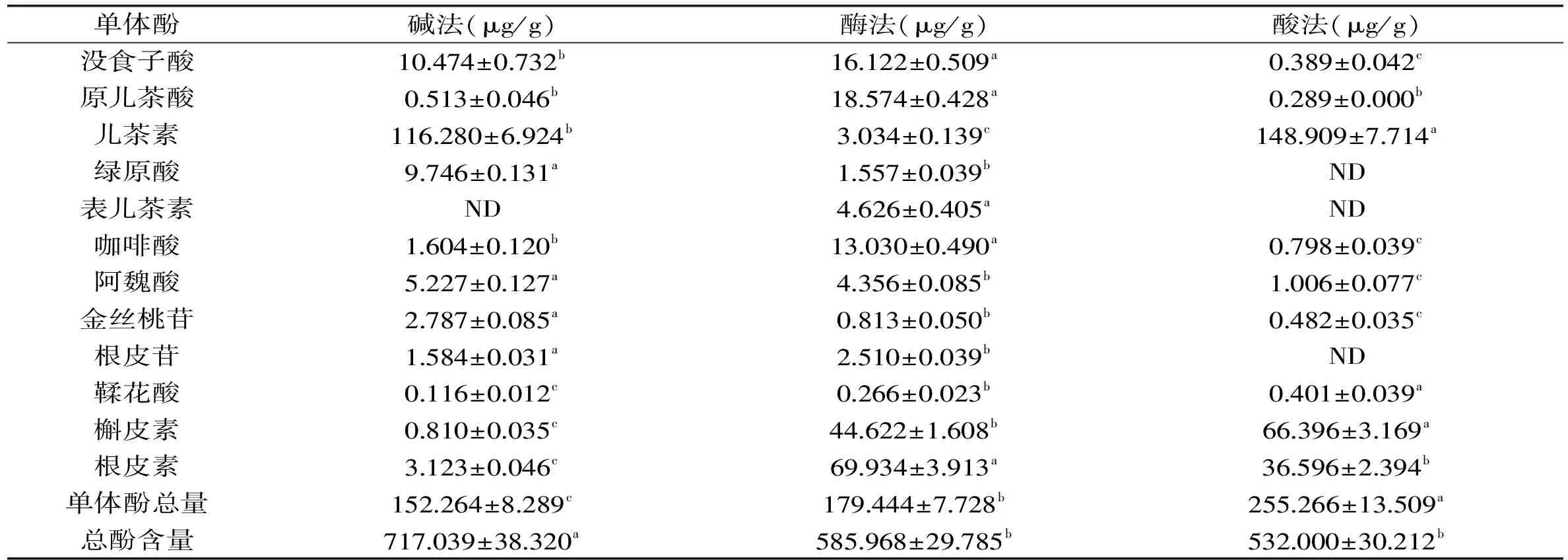
表2 3种方法提取苹果渣结合酚中单体酚的种类和含量a
注:同行不同小写字母表示差异显著(p<0.05)。 由表1可知,苹果渣里提取出的游离酚中含有的单体酚是金丝桃苷、绿原酸、根皮苷、表儿茶素、咖啡酸和槲皮素,其中金丝桃苷、绿原酸和根皮苷的含量较高,分别为209.792、128.473、71.723 μg/g;有6种单体酚未检测到,即没食子酸、原儿茶酸、儿茶素、阿魏酸、鞣花酸和根皮素,苏东晓发现9种游离酚类物质存在于荔枝果肉中[9]。
由表2可知,苹果渣结合态酚类物质主要有儿茶素、槲皮素、根皮素、没食子酸、原儿茶酸和咖啡酸。用3种不同方法提取出的苹果渣结合酚中所含单体酚的种类基本相同,碱解结合酚中检测到了11种单体酚,酶解结合酚中检测到了12种单体酚,酸解结合酚中检测到了9种单体酚,但不同方法提取的结合酚所含单体酚含量差异达到显著水平(p<0.05)。没食子酸在酶法提取的结合酚中含量最高,为16.122 μg/g。原儿茶酸通过酶法提取的含量最高,为18.574 μg/g。儿茶素通过碱法和酸法提取的含量均较高,分别为116.280、148.909 μg/g。绿原酸在结合态中也检测到了,但含量较低。表儿茶素只在酶法提取的结合酚中检测到了,但含量较低。咖啡酸通过酶法提取的含量最高,为13.030 μg/g。3种方法提取处理后阿魏酸、金丝桃苷、根皮苷和鞣花酸含量均较低。槲皮素通过酶法和酸法提取的含量较高,分别为44.622、66.396 μg/g。根皮素通过酶法和酸法提取的含量较高,分别为69.934、36.596 μg/g。苏东晓采用酸法水解和碱法水解荔枝果渣分别释放出7种和4种单体酚[9]。单体酚总量和总酚含量有较大差距,可能是由于提取液中有部分不是酚类的物质对光有吸收,或是有些物质与酚类物质的结构较相近,导致吸光度偏大。
综合表1和表2结果,苹果渣中苹果多酚的种类主要是金丝桃苷、绿原酸、根皮苷、儿茶素、槲皮素、根皮素和没食子酸,其中绿原酸、金丝桃苷和根皮苷主要以游离态的形式存在,儿茶素、槲皮素、根皮素、没食子酸、原儿茶酸和咖啡酸主要以结合态的形式存在。
果蔬中有部分多酚类物质是以结合态形式存在,结合型酚类化合物主要通过酯键、醚键和缩醛键与细胞壁构成膳食纤维,不能被直接提取出来。单宁酶可催化水解酯类和水解单宁酸或没食子酸酯中的缩酚酸键,如催化表没食子儿茶素O-没食子酸盐(ECGG)或表儿茶素O-没食子酸盐(ECG)可释放出没食子酸和表儿茶素[15-17],故3种水解方法中提取出的结合酚只有酶结合酚中检测到了表儿茶素单体酚,且没食子酸含量最高。有研究表明,碱法、酶法和酸法均用于水解结合酚,但碱法水解多用于水解谷物类的结合酚。本研究也发现酶法水解和酸法水解所提取出的苹果渣中结合酚的种类及含量优于碱法水解,这是由于单宁酶可以促进植物细胞壁的降解,释放出结合酚;酸法水解使得酸性酚更易于释放出来。因此,酶法水解和酸法水解比碱法水解更适用于提取苹果渣中的结合态酚类物质。
3 结论
本研究表明,碱法提取结合酚中最佳碱降解时间为4 h,NaOH浓度为3 mol/L;酸法提取结合酚中最佳酸降解时间为15 h,甲醇/浓硫酸浓度为13∶1(v/v);酶法提取结合酚中最佳酶降解时间为20 h,单宁酶酶活为1000 U。苹果渣中酚类物质主要由金丝桃苷、绿原酸、根皮苷、儿茶素、槲皮素、根皮素和没食子酸等组成,其中游离态酚类物质以金丝桃苷、绿原酸和根皮苷为主,结合态酚类物质以儿茶素、槲皮素、根皮素、没食子酸、原儿茶酸和咖啡酸为主。酸法和酶法比碱法更适合于提取苹果渣中的结合酚。苹果渣中含有较丰富的酚类物质,可以根据酚类物质的存在形式进行深度开发和利用,避免资源浪费。
[1]冉军舰. 苹果多酚的组分鉴定及功能特性研究[D]. 杨凌:西北农林科技大学,2013.
[2]吴茂玉,马超,王春燕,等.苹果采后产业现状及发展策略研究[J]. 中国果菜,2014,10:1-7.
[3]苹果加工副产物综合利用问题亟待解决[J]. 农业工程技术(农产品加工业),2014,10:33.
[4]白凤岐,马艳莉,李笑颜,等. 6个品种苹果品质及加工适宜性研究[J]. 食品科技,2014(9):66-71.
[5]李青,张名位,张瑞芬,等. 5种籼稻品种谷壳中游离态和结合态酚类物质含量及其抗氧化活性比较[J]. 中国农业科学,2012(6):1150-1158.
[6]S Chamorro,A Viveros,I Alvarez,et al. Changes in polyphenol and polysaccharide content of grape seed extract and grape pomace after enzymatic treatment[J]. Food Chemistry,2012,133:308-314.
[7]Shoji T,Matsumoto S,Moriichi N,et al. Apple procyanidin oligomers absorption in rats after oral administration:analysis of procyanidins in plasma using the porter method and high performance liquid chromatography/tandem mass spectrophotometry[J]. Journal of Agricultural and Food Chemistry,2006,54:509-512.
[8]刘天行,郭佳,王伟,等. 小米中结合型酚类化合物的分离与鉴定[J]. 南京农业大学学报,2014,1:138-142.
[9]苏东晓. 荔枝果肉多酚的分离鉴定及其调节脂质代谢作用机制[D]. 武汉:华中农业大学,2014.
[10]汪浩明,陈洁,黄行健,等.苹果渣中苹果多酚的提取工艺优化[J]. 化学与生物工程,2012(8):76-78,91.
[11]Morimura S,Nagata H,Uemura Y,et al. Development of an effective process for utilization of collagen from livestock and fish waste[J]. Process Biochemistry,2002,37:1403-1412.
[12]朱春秋,程代,蔡晓菲,等. 枣果皮结合酚的大鼠体内吸收及抗氧化能力研究[J]. 食品工业科技,2012(3):352-354.
[13]Hartzfeld P W,R Forkner,M D Hunter,et al. Determination of Hydrolyzable Tannins(Gallotannins and Ellagitannins)after Reaction with Potassium Iodate[J]. Journal of Agricultural and Food Chemistry,2002,50:1785-1790.
[14]Singleton V L.,Orthofer R.,Lamuela-Raventos R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin Ciocalteu reagent[J]. Methods in Enzymology,1999,299:152-178.
[15]Min-Jer Lu,Chinshuh Chen. Enzymatic modification by tannase increases the antioxidant activity of green tea[J]. Food Research International,2008,41(92):130-137.
[16]PK Lekha,BK Lonsane. Production and Application of Tannin Acyl Hydrolase:State of the Art[J]. Advances of Applied Microbiology,1997,44:215-260.
[17]Garcia-Conesa M T,Ostergaard P,Kauppinen,S,et al. Hydrolysis of diethyl diferulates by tannase from Aspergillus oryzae[J]. Carbohydrate Polymers,2001,44:319-324.
Effects of different extraction methods on bound phenols in apple pomace
ZHANG Jin-hong,LI Jun-e,WEI Xin-yuan,FAN Ming-tao*
(College of Food Science and Engineering,NWSUAF,Yangling 712100,China)
The bound phenols in the apple pomace were released by alkaline degradation,acid degradation,and enzymatic hydrolysis respectively,and the degradation conditions were optimized using single factor experiment. The HPLC-DAD method was applied to detect the types and contents of individual phenolic in free phenol and three kinds of bound phenols. The optimum alkaline degradation time was 4 h,and the NaOH concentration was 3 mol/L,and the optimum acid degradation time was 15 h,and the methanol/concentrated sulfuric acid concentration was 13∶1(v/v),and the optimum enzymatic degradation time was 20 h,and the tannase activity was 1000 U. Hyperoside,chlorogenic acid,phlorizin,catechin,quercetin,phloretin and gallic acid were the major polyphenols of apple pomace. Catechin,quercetin,phloretin,gallic acid,protocatechuic acid and caffeic acid were mainly in bound form. The highest content of gallic acid,protocatechuic acid,caffeic acid and phloretin by enzymatic hydrolysis were 16.122,18.574,13.030 and 69.934 μg/g respectively,and the highest content of catechin and quercetin by acid degradation were 148.909 μg/g and 66.396 μg/g respectively. Acid degradation and enzymatic hydrolysis were more suitable than alkaline hydrolysis for the extraction of bound phenols of apple pomace.
Apple pomace;Free phenol;Bound phenol;Optimization;HPLC-DAD detection
2016-05-06
张金宏(1991-)女,硕士研究生,研究方向:食品工程,E-mail:18789498190@163.com。
*通讯作者:樊明涛(1963-)男,教授,研究方向:食品生物技术与食品安全,E-mail:fanmt@nwsuaf.edu.cn。
陕西战略性新型产业重大产品(群)项目-农业领域。
TS255.2
A
1002-0306(2016)20-0000-00
10.13386/j.issn1002-0306.2016.20.000
