CaO或BaO与Sm2O3共掺杂CeO2体系电子结构和氧离子迁移的DFT+U研究
2016-12-06吴铜伟贾桂霄包金小刘媛媛安胜利内蒙古科技大学材料与冶金学院包头0400内蒙古自治区新型功能陶瓷与器件重点实验室包头0400内蒙古科技大学化学与化工学院包头0400
吴铜伟 贾桂霄*,, 包金小, 刘媛媛 安胜利,(内蒙古科技大学材料与冶金学院,包头0400)(内蒙古自治区新型功能陶瓷与器件重点实验室,包头0400)(内蒙古科技大学化学与化工学院,包头0400)
CaO或BaO与Sm2O3共掺杂CeO2体系电子结构和氧离子迁移的DFT+U研究
吴铜伟1贾桂霄*,1,2包金小1,2刘媛媛3安胜利1,2
(1内蒙古科技大学材料与冶金学院,包头014010)
(2内蒙古自治区新型功能陶瓷与器件重点实验室,包头014010)
(3内蒙古科技大学化学与化工学院,包头014010)
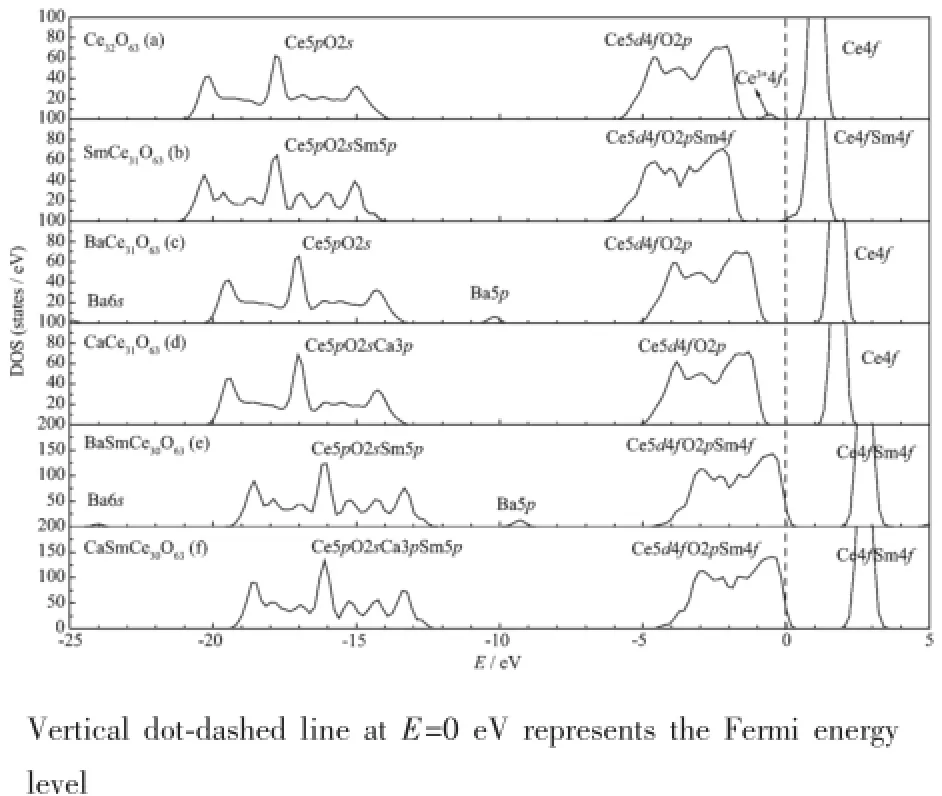
使用GGA+U方法研究了CaO或BaO与Sm2O3共掺杂CeO2体系几何和电子结构及氧离子迁移。计算结果表明,Ba和Sm均靠近氧空位时BaSmCe30O63体系最稳定;Sm靠近,Ca远离氧空位时CaSmCe30O63体系最稳定。BaSmCe30O63和CaSmCe30O63体系中均不存在Ce4+变价。对CaSmCe30O63体系氧离子迁移的研究发现,当氧离子迁移到空位时,迁移能大小顺序为Em(3→V)< Em(1→V) 二氧化铈;掺杂;电子结构;氧离子迁移;第一性原理 二氧化铈(CeO2)由于具有高的离子电导率,一直被认为最适合于作中低温(500~750℃)固体氧化物燃料电池(SOFC)的电解质材料[1-2]。但纯CeO2是一种混合型导体,氧离子、电子和空穴导电对电导率的贡献几乎相同。大量研究表明,CeO2固体电解质的掺杂,主要包括单掺[3-4]和双掺[5],可提高其离子电导率,降低电子电导及电池工作温度[3]。 对单掺CeO2(二元CeO2)体系,实验上,常加入碱土或稀土氧化物来生成具有一定氧空位浓度的CeO2固溶体,进而提高氧离子导电性[4]。在碱土氧化物中,CaO和SrO的掺杂对CeO2基固体电解质电导率提高较大,BaO和MgO则不显著[5]。由于稀土氧化物有较多的选择余地,且它们的掺杂使CeO2电导率的提高较大,因而对稀土氧化物的掺杂研究远较碱土氧化物多,如对Ce1-xRExO2-δ(RE=Y,La,Pr,Nd,Sm,Eu,Gd,Tb,Yb与Dy)体系的研究[4-17]。Yahiro[9]研究发现,Sm2O3和Gd2O3掺杂效果最佳,尤其是Sm2O3,800℃时,Sm3+掺杂CeO2的电导率达0.12 S· cm-1,Gd3+掺杂CeO2的电导率为0.10 S·cm-1。这些体系的掺杂能、电导率及离子迁移能受掺杂离子半径[18-20]、缺陷缔合(掺杂离子和氧空缺或氧空缺之间形成的缔合)[20]、掺杂离子价态[21]及其在体系中微观结构[22-23]和掺杂浓度等影响[24]。 为进一步提高CeO2离子电导率,往往还引入第三类掺杂离子,形成三元CeO2体系。Inaba等[5]研究发现,Ce0.78Sm0.2Ca0.02O2-δ体系离子电导率大于CeO2-Sm2O3体系。Dudek等[10]研究发现,CeO2-M2O3-CaO(M=Sm和Gd)体系离子电导率大于CeO2-M2O3体系,且用CaO全部或部分替换Sm2O3或Gd2O3能显著降低材料成本[25-26]。有研究发现,通过多种元素掺杂能抑制Ce4+还原[27-30],如Li、Ca、Cs掺杂的Sm0.25Ce0.75O2-δ体系[28]。此外,CeO2-BaO体系虽没表现出高离子电导率,但由于较大离子半径的Ba2+可抑制Ce4+还原成Ce3+,因此BaO的掺杂有助于整体提高CeO2电解质材料导电性能[29-30]。 理论上,对CeO2体系掺杂能及氧离子迁移能进行了大量研究[11,19-20]。Andersson等[19]使用广义梯度近似(GGA)方法研究了镧系中一系列稀土氧化物掺杂的CeO2体系,结果表明,从La到Er,对位于Pm右边的掺杂元素,在CeO2体系中氧空位易于最邻近掺杂离子,对位于Pm左边的掺杂元素,氧空位易于次邻近掺杂离子,且在这些二元CeO2体系中,Pm和Sm掺杂对应的氧离子迁移能最小。Nakayama和Martin[20]采用密度泛函理论(DFT)对CeO2-RE2O3(RE= Sc,Y,La,Nd,Sm,Gd,Dy与Lu)体系的研究发现,氧离子迁移最有利路径是两个相邻氧离子位的直线迁移,且迁移能主要依赖于掺杂离子半径大小。我们使用DFT+U(U为Hubbard参数,且U=6.0 eV)方法研究了CaO、BaO、Sm2O3与ZrO2在CeO2体系中的掺杂能、缺陷形成能和氧离子迁移能,研究发现,它们受Ca2+、Ba2+、Sm3+和Zr4+离子半径和价态的影响,其中,Ca2+、Ba2+和Sm3+的掺杂均抑制了Ce4+的变价[11]。此外,在不同压力下对掺杂CeO2体系氧离子迁移激活能[31]、Ce4+的变价[32]、不同氧空位浓度下空位形成能[33]进行的研究表明,氧空位迁移激活能随压力的增大而变小[31],变价Ce4+均围绕氧空位周围形成[32],氧空位浓度越大空位形成能越大[33]。 目前,对双掺杂的理论研究比较欠缺,基于我们以前对Ca2+、Ba2+或Sm3+的掺杂研究[11],即Ca2+和Sm3+掺杂体系对应较小掺杂能,Ba2+掺杂体系的氧离子迁移能最小,以及考虑到实验中CaO或BaO与Sm2O3共掺杂对CeO2体系具有良好的导电性,本文使用第一性原理方法研究了CaO或BaO与Sm2O3共掺杂CeO2体系的几何和电子结构及氧离子迁移。 CeO2晶胞具有面心立方的萤石结构,内含4个Ce和8个O原子。采用GGA+U计算方法(详见如下描述)优化得到的CeO2晶格常数为0.548 nm,与实验结果0.541 nm相符合。我们选取的超单胞大小为2×2×2,含有96个原子位,其中阳离子位有32个,阴离子位有64个,见图1。 图1 BaSmCe30O63或CaSmCe30O63体系的几何结构,其中M1、M2、M3、M4和M5表示Ca2+或Ba2+的掺杂位;深色球表示O,浅色球表示Ce,下面其它图类似Fig.1Geometric structure of the BaSmCe30O63or CaSm Ce30O63system,and M1,M2,M3,M4 and M5 note doped sites of Ca2+or Ba2+;spheres with dark color note O atoms,ones with light color note Ce atoms,and there are similar notation in the following figures 我们早期对SmCe31O63体系的研究发现,Sm3+与氧空位(V)最邻近时体系最稳定[11],因此,本工作基于此结构,通过考虑Ce4+与氧空位及Sm3+的位置关系来取代Ce4+引入Ca2+或Ba2+,且选取了5种可能的掺杂位置,见图1。图1中标识的M1、M2、M3、M4或M5代表掺杂的1个Ca2+或1个Ba2+,且当在M1位置掺杂1个Ca2+或1个Ba2+时,此结构表示为M1;当在M2位置掺杂1个Ca2+或1个Ba2+时,此结构表示为M2;以此类推M3、M4和M5结构。M1结构中,掺杂位与氧空位、Sm3+最邻近;M2结构中,掺杂位与氧空位次邻近,与Sm3+最邻近;M3结构中,掺杂位与氧空位次邻近,与Sm3+次邻近;M4结构中,掺杂位与氧空位较远,与Sm3+最邻近;M5结构中,掺杂位与氧空位、Sm3+均较远。 本文所有计算采用基于赝势平面波基组的VASP程序[34-35]来完成。计算中,Ce5s5p5d4f6s,O2s2p, Ba5s5p6s,Ca3s3p4s和Sm5s5p5d4f6s电子组态作为价电子。电子交换关联势采用广义梯度近似法(Generalized Gradient Approximation,GGA)中的Perdew-Burke-Ernzerhof(PBE)泛函[36]。考虑到Ce和Sm含有高角量子数4f电子而DFT方法对这些电子间相互作用描述不足的问题,本文采用引入Hubbard参数U的方法[37],其中Ce的U值取6.0 eV,其他理论研究表明,Ce的U值应大于5.0 eV[11,38],Sm的U和J值参考Feng等的工作[11,39],且U值取8.0 eV,J取0.65 eV。布里渊区采用Monkhorst-Pack方法选取k点,且k网格大小为2×2×2。原子结构优化中总能收敛性判据为10-4eV,Hell-mann-Feynman原子力收敛判据为0.2 eV·nm-1,平面波展开截止能为400 eV。对氧空位周围其它O2-向其方向的迁移,我们通过采用CI(climbing image)-NEB(nudged elastic band)方法来寻找迁移活化能[40],类似之前对Ca、Ba、Sm与Zr单掺杂CeO2体系的研究[11]。 2.1几何结构 对上述5种掺杂模型结构进行了优化,且结果表明,对BaSmCe30O63体系,当Ba2+与氧空位和Sm3+最邻近时,即M1模型,体系能量最低;对CaSmCe30O63体系,当Ca2+与氧空位和Sm3+次邻近时,即M3模型,体系能量最低。因此,在这里我们分别给出了这2个模型的优化结构,见图2。从图2(a)我们可以看出,当掺杂较大半径的Ba2+(0.142 nm)时,Ba2+附近的O2-均远离其,从以前对BaCe31O63体系的研究可知[11],这主要是由O2-受到Ba2+空间位阻引起,同理,由于O2-的空缺,在其附近产生的正电势对周围O2-产生吸引,而对周围的Ce4+和Sm3+产生排斥,因此,周围的O2-向氧空位靠拢,周围的Ce4+和Sm3+远离氧空位。对CaSmCe30O63体系,与BaSmCe30O63体系不同的是,由于Ca2+半径(0.112 nm)较小,且接近Ce4+(0.097 nm)半径,因此在其周围没有明显的空间排斥引起的原子位置移动。 2.2电子结构 图2 BaSmCe30O63(a)和CaSmCe30O63(b)体系优化的最稳定几何构型Fig.2Most stable geometric structure of the BaSmCe30O63(a)and CaSmCe30O63(b)systems 本文使用GGA+U方法计算了上述BaSmCe30O63体系中M1和CaSmCe30O63体系中M3体系态密度(DOS)和分波态密度(PDOS),并将其与SmCe31O63、BaCe31O63、CaCe31O63和Ce32O63体系态密度进行比较,见图3。对BaSmCe30O63体系,在2.0~ 3.5 eV态主要来源于Ce4+和Sm3+的4f电子,在-4.5~0.5 eV的态主要来自O2p、Ce5d4f和Sm4f电子,在更低能级-19.5~-12.5 eV态主要来自O2s、Ce5p和Sm5p的电子,类似于SmCe31O63体系,在-24.5~-23.5 eV和-10.0~-8.7 eV分别有来自Ba6s和Ba5p杂质态,类似于BaCe31O63体系。BaSmCe30O63与SmCe31O63体系相比,由于低价态Ba2+的掺杂使Fermi能级发生了下移。对CaSmCe30O63体系,与BaSmCe30O63体系能量分布类似,不同的是,在-19.5~-17.0 eV有来自Ca3p电子与周围O2s电子的相互作用态,类似于CaCe31O63体系。同理,与SmCe31O63体系相比,由于低价态Ca2+的掺杂使Fermi能级发生了下移。这些体系与还原Ce32O63体系相比,没有新态出现在Fermi能级和Ce4f之间,即-1.0~0 eV,XPS和XANES谱实验结果[41-43]及Yang等的理论模拟均发现[39],这个新态由Ce4+的变价引起,这说明与单掺杂SmCe31O63和CaCe31O63体系类似,CaO或BaO与Sm2O3双掺杂CeO2体系同样抑制了Ce4+的变价,进而将抑制电子电导产生。这也可通过电荷密度直观反映,见图4。从图4可以看出,电子均聚集在氧空位、Ca2+或Ba2+和Sm3+周围的O2-上,在阳离子上没有聚集电荷,不同于还原CeO2和Zr掺杂CeO2体系[41],在这些体系中,由于存在Ce4+向Ce3+变价,电荷聚集在氧空位周围两个变价Ce3+上。由此可见,CaO或BaO与Sm2O3的共掺杂抑制了CeO2体系中Ce4+的变价,即抑制了电子电导的产生,这将对CeO2作为固体电解质材料的导电性能是有利的,其中对氧离子的导电性,下面我们研究了氧离子迁移能。 图3 Ce32O63(a)、SmCe31O63(b)、BaCe31O63(c)、CaCe31O63(d)、BaSmCe30O63(e)和CaSmCe30O63(f)体系态密度Fig.3Density of states(DOS)of Ce32O63(a),SmCe31O63(b),BaCe31O63(c),CaCe31O63(d),BaSmCe30O63(e) and CaSmCe30O63(f)systems 2.3离子迁移能 图4 BaSmCe30O63(a)和CaSmCe30O63(b)体系电荷密度分布图Fig.4Electron density distribution for the BaSmCe30O63(a)and CaSmCe30O63(b)systems 图5 BaSmCe30O63(a)与CaSmCe30O63(b)体系迁移路径及迁移能Fig.5Possible migration routes and corresponding energies for the BaSmCe30O63(a)and CaSmCe30O63(b)systems Nakayama等[20]研究表明,较远O2-由于迁移时周围原子对其阻碍要大于靠近空位O2-迁移,因此,本文仅考虑了1个氧空位(表示为V)周围最近6个O2-向其的迁移。对BaSmCe30O63体系,根据6个O2-与Ba2+、Sm3+之间距离将其分为4类(见图5a):1与2为一类,O2-距Sm3+最近,距Ba2+较远;3与4为一类,O2-距Ba2+最近,距Sm3+较远;5为一类,O2-距Sm3+和Ba2+均最近;6为一类,O2-距Sm3+和Ba2+均较远。因此,我们以1、3、5和6原子为例研究BaSmCe30O63体系中O2-迁移。同理,对CaSmCe30O63体系,根据O2-与Ca2+、Sm3+之间距离将其分为4类(见图5b):1为一类,O2-距Sm3+最近,距Ca2+最远;2与5为一类,O2-距Sm3+最近,距Ca2+较远;3为一类,O2-距Ca2+最近,距Sm3+较远;4与6为一类,O2-距Sm3+和Ba2+均较远。因此,我们以1、2、3和4为例研究CaSmCe30O63体系中O2-迁移。 对BaSmCe30O63体系,O2-向V的迁移能Em大于或等于V向O2-的,即,Em(1→V)>Em(V→1)、Em(3→V)>Em(V→3)和Em(5→V)=Em(V→5),因此,我们重点讨论BaSmCe30O63体系中V向周围O2-迁移。对V→5迁移,V处于5位置时,其结构等价于5位于V位置,所以Em(5→V)=Em(V→5),见图5a和表1。对V→6或6→V的迁移,我们无法获得V位于6原子位结构,这可能由于此结构中具有正电势V与具有负电势Sm3+和Ba2+距离较远时,二者之间吸引作用无法平衡O2-与Sm3+和Ba2+之间排斥作用,因此,实验中将可能不存在V→6或6→V迁移。对CaSmCe30O63体系,O2-向V迁移能Em小于或等于V向O2-的,即,Em(1→V)<Em(V→1)、Em(3→V)<Em(V→3)、Em(4→V)<Em(V→4)和Em(2→V)=Em(V→2),对2→V迁移,V处于2位置时,其结构等价于2位于V位置,所以Em(2→V)=Em(V→2),见图5b和表1。因此,我们重点讨论CaSmCe30O63体系中氧空位周围O2-向其的迁移。在这些迁移路径中,O2-到V迁移几乎沿一条直线进行,与我们曾对单掺杂CeO2体系[11]和Nakayama等[20]研究结果一致。 表1 BaSmCe30O63和CaSmCe30O63体系的氧离子迁移能(Em)Table 1Migration energies(Em)of oxygen ions for the BaSmCe30O63and CaSmCe30O63systems BaSmCe30O63与CaSmCe30O63体系相比,其V向周围O2-迁移能大于CaSmCe30O63体系中氧空位周围O2-向其迁移能,且对CaSmCe30O63体系,最小迁移能仅为0.30 eV,小于SmCe31O63体系的(0.35 eV)[11],证实了CeO2-Sm2O3-CaO体系离子电导率大于CeO2-Sm2O3体系的实验结果[10]。 2.3.1BaSmCe30O63体系迁移能 对V向周围O2-迁移,迁移能大小顺序为Em(V→3)<Em(V→5)<Em(V→1)。我们知道,当低价Ba2+和Sm3+取代四价Ce4+时,在低价离子周围产生了负电势,且Ba2+产生的负电势对具有正电势的V吸引大于Sm3+的,因此,当V向周围O2-位迁移时,V更倾向于靠近Ba2+,且当具有负电势Ba2+与V越近时,它们之间的吸引越大。由图5a可知,Ba2+与位于3的V或位于5的V之间距离小于Ba2+与位于1的V之间距离,因此前者两种的吸引作用大于后者的,即Fa(Ba2+-3)>Fa(Ba2+-1),Fa(Ba2+-5)>Fa(Ba2+-1),在这里Fa表示离子之间吸引力,括号中表示相互作用的掺杂离子和V,且当V向位于1的O2-迁移时,V向远离Ba2+方向迁移,因此,V→3和V→5迁移比V→1较容易。由图5a可知,对V→3和V→5迁移,Ba2+与位于3的V和位于5的V之间距离相同,且当V向位于3或5的O2-迁移时,V向靠近Ba2+方向迁移,因此,这两种迁移中Ba2+对V吸引作用相同,故需要分析Sm3+与V相互作用。由图5a可知,Sm3+与位于3的V之间距离小于与位于5的V之间距离,因此前者之间的吸引作用大于后者的,即,Fa(Sm3+-3)>Fa(Sm3+-5),且从图5a还可知,V向远离Sm3+方向移动,进而这个吸引作用不利于V的迁移,所以Em(V→3)<Em(V→5)。 2.3.2CaSmCe30O63体系迁移能 对CaSmCe30O63体系,由于V到O2-迁移能大于或等于O2-到V的,因此,我们重点讨论后者的迁移能。对O2-向V迁移,迁移能顺序为Em(3→V)<Em(1→V)<Em(4→V)<Em(2→V)。与BaSmCe30O63体系情况类似,当低价Ca2+和Sm3+取代四价Ce4+时,在低价离子周围产生了负电势,且Ca2+产生的负电势对周围O2-排斥要大于Sm3+的,因此,当O2-向V迁移时,O2-倾向于远离Ca2+,且当具有负电势Ca2+与O2-越近时,它们之间的排斥越大。由图5b可知,Ca2+对位于3的O2-排斥Fr(Ca2+-3)最大,在这里Fr表示离子之间排斥力,括号中表示相互作用的两种离子,且当位于3的O2-向V迁移时,位于3的O2-向远离Ca2+方向迁移,二者之间的排斥力成为迁移推动力,所以,3→V迁移最容易。由图5b可知,对其它迁移,与3→V不同的是,O2-向空位迁移时O2-靠近Ca2+,从上面分析可知O2-倾向于远离Ca2+有利于其迁移,因此,离Ca2+越远的O2-越容易迁移。由图5b可知,位于1的O2-与Ca2+之间距离大于位于4的O2-与Ca2+之间距离,位于4的O2-与Ca2+之间距离大于位于2的O2-与Ca2+之间距离,因此,Fr(Ca2+-1)<Fr(Ca2+-4)<Fr(Ca2+-2),故,Em(1→V)<Em(4→V)<Em(2→V)。 本文对CaO或BaO与Sm2O3共掺杂CeO2体系几何和电子结构及氧离子迁移进行了研究。Sm靠近,Ca远离氧空位时CaSmCe30O63体系最稳定;Ba和Sm靠近氧空位时BaSmCe30O63体系最稳定。BaSmCe30O63与CaSmCe30O63体系均不存在Ce4+变价,即没有电子电导产生。CaSmCe30O63体系氧离子向空位的迁移能Em小于或等于空位向氧离子的,且氧离子迁移能顺序为Em(3→V) [1]Nam K W,Kim K B.J.Electrochem.Soc.,2002,149:A346-A354 [2]SONG Xi-Wen(宋希文),ZHAO Yong-Wang(赵永旺),PENG Jun(彭军),et al.J.Funct.Mater.(功能材料),2004,35:988-990 [3]ZHU Li-Li(朱丽丽),LIN Xiao-Min(林晓敏).Physical Experiment of College(大学物理实验),2007,20:18-22 [4]JIANG Kai(蒋凯),MENG Jian(孟建),HE Zhi-Qi(何志奇), et al.Sci.China Ser.B(中国科学:B辑),1999,25:121-125 [5]Inaba H,Tagawa H.Solid State Ionics,1996,83:1-16 [6]Gaetano C,Lorenzo M,Vincenzo M.Solid State Ionics,2005, 176:1505-1512 [7]Huang W,Shuk P,Greenblat M,et al.Chem.Mater.,1997, 9:2240-2245 [8]WEI Li(魏丽),CHEN Song-Ying(陈诵英),WANG Qin(王琴),et al.Chin.J.Rare Metals(稀有金属),2003,27:287-292 [9]Yahiro H,Eguchi K,Arai H,et al.Solid Stale Ionics,1989, 36:71-75 [10]Dudek M,Rapacz-Kmita A,Mroczkowska M,et al.Electrochim.Acta,2010,55:4387-4394 [11]JIA Gui-Xiao(贾桂霄),HAO Wen-Xing(郝文兴),PAN Fei (潘飞),et al.Acta Chim.Sinica(化学学报),2013,71:1668-1675 [12]Eguchi K,Setoquchi T,Inoue T,et al.Solid State Ionics, 1992,52:165-172 [13]Wang S R,Takehisa K,Masayuki D I,et al.J.Electrochem. Soc.,2000,147(10):3606-3609 [14]Yan D T,Liu X M,Bai X Y,et al.J.Power Sources,2010, 195:6486-6490 [15]Kuharuangrong S.J.Power Sources,2007,171:506-510 [16]Liu G,Rodriguez J A.J.Phys.Chem.B,2001,105:7762-7770 [17]Henderson M A,Perkins C L,Engelhard M H,et al.Surf. Sci.,2003,526:1-18 [18]Yoshida H,Deguchi H,Miura K,et al.Solid State Ionics, 2001,140:191-199 [19]Andersson D A,Simak S I,Skorodumova N V,et al.Proc. Natl.Acad.Sci.U.S.A.,2006,103:3518-3521 [20]Nakayama M,Martin M.Phys.Chem.Chem.Phys.,2009, 11:3241-3249 [21]Wei X,Pan W,Cheng L,et al.Solid State Ionics,2009,180: 13-17 [22]Yoshida H,Inagaki T,Miura K,et al.Solid State Ionics, 2003,160:109-116 [23]Nitani H,Nakagawa T,Yamanouchi M,et al.Mater.Lett., 2004,58:2076-2081 [24]Frayret C,Villesuzanne A,Pouchard M,et al.Int.J.Quantum Chem.,2005,101:826-839 [25]Guan X F,Zhou H P,Liu Z H,et al.Mater.Res.Bull.,2008, 43:1046-1054 [26]WangFY,Chen S Y,Cheng S F,et al.Electrochem.Commun., 2004,6:743-746 [27]Toshiyuki M,Hiroshi Y.J.Mater.Synth.Process.,1998,3: 175-182 [28]SUN Ming-Tao(孙明涛),SUN Jun-Cai(孙俊才),JI Shi-Jun (季世军),et al.Rare Earth(稀土),2006,27:78-81 [29]Pikalova E Y,Maragou V I,Demina A N,et al.J.Power Sources,2008,181:199-206 [30]Venkatasubramanian A,Gopalan P,Prasanna T R S,et al. Int.J.Hydrogen Energy,2010,35:4597-4603 [31]Hinterberg J,Zacherle T.Phys.Rev.Lett.,2013,110:205901 [32]Jan F J,Xiang S,Niklas N,et al.Phys.Rev.Lett.,2011,106: 246801 [33]Murgida G E,Ferrari V,Llois A M,et al.Phys.Rev.B, 2014,90:115120 [34]Kresse G,Hafner J.Phys.Rev.B,1994,49:14251 [35]Kresse G,Furthmüller J.Comput.Mater.Sci.,1996,6:15-50 [36]Perdew J P,Burke K,Ernzerhof M,et al.Phys.Rev.Lett., 1996,77:3865-3867 [37]Anisimov V I,Zaanen J,Andersen O K.Phys.Rev.B,1991, 44:943 [38]Yang Z X,Woo T K,Hermansson K,et al.J.Chem.Phys., 2006,124:224704 [39]Feng J,Xiao B,Wan C L,et al.Acta Mater.,2011,59:1742-1760 [40]Jónsson H,Mills G,Jacobsen K M.Classical and Quantum Dynamics in Condensed Phase Simulations.Berne B J,Ciccotti G,Coker D F Ed.Singapore:World Scientific Publishing Co.Pte.Ltd.,1998:385-404 [41]Liu G,Rodriguez J A,Hrbek J,et al.J.Phys.Chem.B, 2001,105:7762-7770 Electronic Structures and Oxygen Ion Migrations of the CaO or BaO and Sm2O3Co-doped CeO2System:A DFT+U Study WU Tong-Wei1JIA Gui-Xiao*,1,2BAO Jin-Xiao1,2LIU Yuan-Yuan3AN Sheng-Li1,2 Geometric and electronic structures and oxygen ion migrations of CaO or BaO and Sm2O3co-doped CeO2systems were studied using a GGA+U method.The calculated results showed that the BaSmCe30O63structure in which Ba and Sm were close to the oxygen vacancy was the most stable,and the CaSmCe30O63structure was the most stable when Sm was close to the oxygen vacancy and Ca was far from it.There was no the valence change of Ce4+in the CaSmCe30O63and BaSmCe30O63systems.In the CaSmCe30O63system the order for migration energies of the six oxygen ions to oxygen vacancy,Em(3→V) cerium dioxide;dope;electronic structure;oxygen ion migration;first principle O641.12+1 A 1001-4861(2016)08-1363-07 10.11862/CJIC.2016.172 2016-01-20。收修改稿日期:2016-05-30。 国家自然科学基金(No.51474133)、内蒙古自然科学基金(No.2016MS0513)和内蒙古科技大学产学研(No.PY-201502)资助项目。 *通信联系人。E-mail:guixiao.jia@163.com0 引言
1 计算模型与方法

2 结果与讨论




3 结论
(1School of Materials and Metallurgy,Inner Mongolia University of Science and Technology, Baotou,Inner Mongolia 014010,China)
(2Key Laboratory of New Functional Ceramics and Devices of Inner Mongolia Autonomous Region,Baotou,Inner Mongolia 014010,China)
(3School of Chemistry and Chemical Engineering,Inner Mongolia University of
Science and Technology,Baotou,Inner Mongolia 014010,China)
