超声提取黑果小檗中花色苷工艺研究
2016-12-06李建光刘倩芸迪娜吐尔洪
李建光, 阳 莹, 赵 军, 刘倩芸, 迪娜·吐尔洪
(1新疆医科大学药学院, 乌鲁木齐 830011; 2新疆维吾尔自治区药物研究所维吾尔药重点实验室, 乌鲁木齐 830004)
超声提取黑果小檗中花色苷工艺研究
李建光1, 阳 莹1, 赵 军2, 刘倩芸1, 迪娜·吐尔洪1
(1新疆医科大学药学院, 乌鲁木齐 830011;2新疆维吾尔自治区药物研究所维吾尔药重点实验室, 乌鲁木齐 830004)
目的 优选黑果小檗花色苷的最佳超声提取工艺。方法 以pH示差法测定花色苷含量作为评价指标,利用单因素轮转法和正交试验法确定花色苷的提取时间、提取次数、提取溶剂及花色苷稳定性等参数。结果 乙醇浓度 70 %,盐酸浓度 0.8 %,料液比1∶25(g∶mL)提取时间20 min,提取次数4次,花色苷含量最高。常温避光提取及储存提取液中花色苷的含量较常温自然光提取及储存高。冷藏避光储存条件下的黑果小檗果皮粉末在提取花色苷时,提取液中花色苷的含量较常温避光储存条件下稳定。结论 该方法提取黑果小檗中的花色苷稳定可行,提取、储存黑果小檗花色苷时应避光,储存黑果小檗果实粉末时应冷藏避光。
黑果小檗; 花色苷; 超声提取
黑果小檗(Berberis heteropoda Schrenk)是小檗科小檗属灌木,在新疆各地分布广泛,在蒙古及哈萨克斯坦也有分布[1]。黑果小檗果实中含大量的花色苷[2]。现代药理学研究表明花色苷具有抗氧化[3-4]、抗癌[5-6]、防治心血管系统疾病[7,8]、降血糖[9]、改善大脑功能[10-12]等作用。花色苷的提取方法很多,主要有机溶剂萃取法、生物酶解法、超临界CO2萃取法、超声提取法、高压脉冲电场辅助提取法等[13]。本研究采用超声提取法提取黑果小檗干果中的花色苷,确定最佳提取工艺参数并考察其稳定性,现报道如下。
1 仪器与试药
1.1 仪器 yp3002N型电子天平(上海菁海仪器有限公司),AS系列超声波清洗机(天津奥特赛恩斯仪器有限公司),754型紫外可见分光光度计(上海菁华科技仪器有限公司),TGL-16M台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司),ST-02A型二两装高速中药粉碎机(永康市帅通工具有限公司)
1.2 试药 甲醇(天津永晟精细化工有限公司,批号:20151210),无水乙醇(天津永晟精细化工有限公司,批号:20160318),盐酸(乌鲁木齐迪城化工有限公司,批号:20100324),醋酸钠(天津市福晨化学试剂厂,批号:201604 17),氯化钾(天津市盛奥化学试剂有限公司,批号:20150410)。黑果小檗采自伊犁,经新疆维吾尔自治区中药民族药研究所贾晓光研究员鉴定为小檗科小檗属黑果小檗(Berberis heteropoda Schrenk)的果实。
2 方法与结果
2.1 黑果小檗的预处理 去除黑果小檗干果的果茎及种子,果皮用粉碎机粉碎、过20目筛、混匀,-20℃冰箱内冷藏避光保存,备用。
2.2 黑果小檗花色苷提取方法 称取1.0 g黑果小檗果皮粉末至棕色容量瓶中,以80%含酸乙醇(含0.5%HCL,v/v)为溶剂,料液比1∶30,室温超声提取30 min。
2.3 黑果小檗花色苷最大吸收波长确定 按“2.2”项下方法提取黑果小檗中的花色苷,吸取3 mL提取液至离心管中,10 000 r/min离心5 min,取1 mL上清液至25 mL棕色容量瓶中,平行2份,1份用pH1.0缓冲液定容至刻度,另1份用pH4.5缓冲液定容至刻度,平衡15 min, 0~800 nm全波长扫描,结果表明黑果小檗花色苷在pH1.0缓冲液中的最大吸光度在517 nm 处,在pH4.5缓冲液中无最大吸光度,选定517 nm作为测定波长[pH1.0缓冲液:0.2 mol/L KCl-0.2 mol/L HCl(25∶67);pH4.5缓冲液:1 mol/L NaAc-1 mol/L HCl-H2O(100∶60∶90)][14]。

2.5 单因素试验
2.5.1 提取溶剂对花色苷含量的影响 称取1.0 g黑果小檗果皮粉末至100 mL棕色容量瓶中,以20%含酸乙醇、40%含酸乙醇、60%含酸乙醇、80%含酸乙醇、100%含酸乙醇、20%含酸甲醇、40%含酸甲醇、60%含酸甲醇、80%含酸甲醇、100%含酸甲醇以及含酸水溶液(含0.5%HCL,v/v)为溶剂,料液比1∶30,室温超声提取1次,30 min,提取黑果小檗花色苷。按“2.4”项下方法测定黑果小檗花色苷含量。每组试验平行重复3次,结果取平均值。实验结果表明,当提取溶剂为20%含酸乙醇、40%含酸乙醇、60%含酸乙醇、80%含酸乙醇、100%含酸乙醇、20%含酸甲醇、40%含酸甲醇、60%含酸甲醇、80%含酸甲醇、100%含酸甲醇以及含酸水溶液(含0.5%HCL,v/v),提取液中花色苷含量分别为:4.13、4.38、4.26、4.47、3.19、3.72、4.07、4.23、4.53、4.68、3.72 mg/g。随着甲醇浓度逐渐提高,花色苷的含量逐渐增加,当甲醇浓度达到 100%时,提取液中花色苷含量最高;随着乙醇浓度逐渐提高,花色苷的含量逐渐增加,当乙醇浓度达到 80%时,提取液中花色苷含量最高,考虑到溶剂价格及毒性,确定提取溶剂选择 80 %的乙醇水溶液,见图1、2。

图1 不同浓度含酸甲醇对花色苷含量的影响
2.5.2 料液比对花色苷含量的影响 称取1.0 g黑果小檗果皮粉末至棕色容量瓶中,以80%含酸乙醇(含0.5%HCL ,v/v)为溶剂,料液比1∶10、1∶20、1∶30、1∶40、1∶50(g/mL),室温超声提取1次,30 min,提取黑果小檗花色苷。按“2.4”项下方法测定黑果小檗花色苷含量,每组试验平行重复3次,结果取平均值。当料液比为1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)时,提取液中花色苷含量分别为4.57、4.87、5.05、4.92、4.39 mg/g。当料液比为 1∶30(g/m L)时,提取液中花色苷含量最高,确定 1∶30(g/m L)为最佳料液比,见图3。
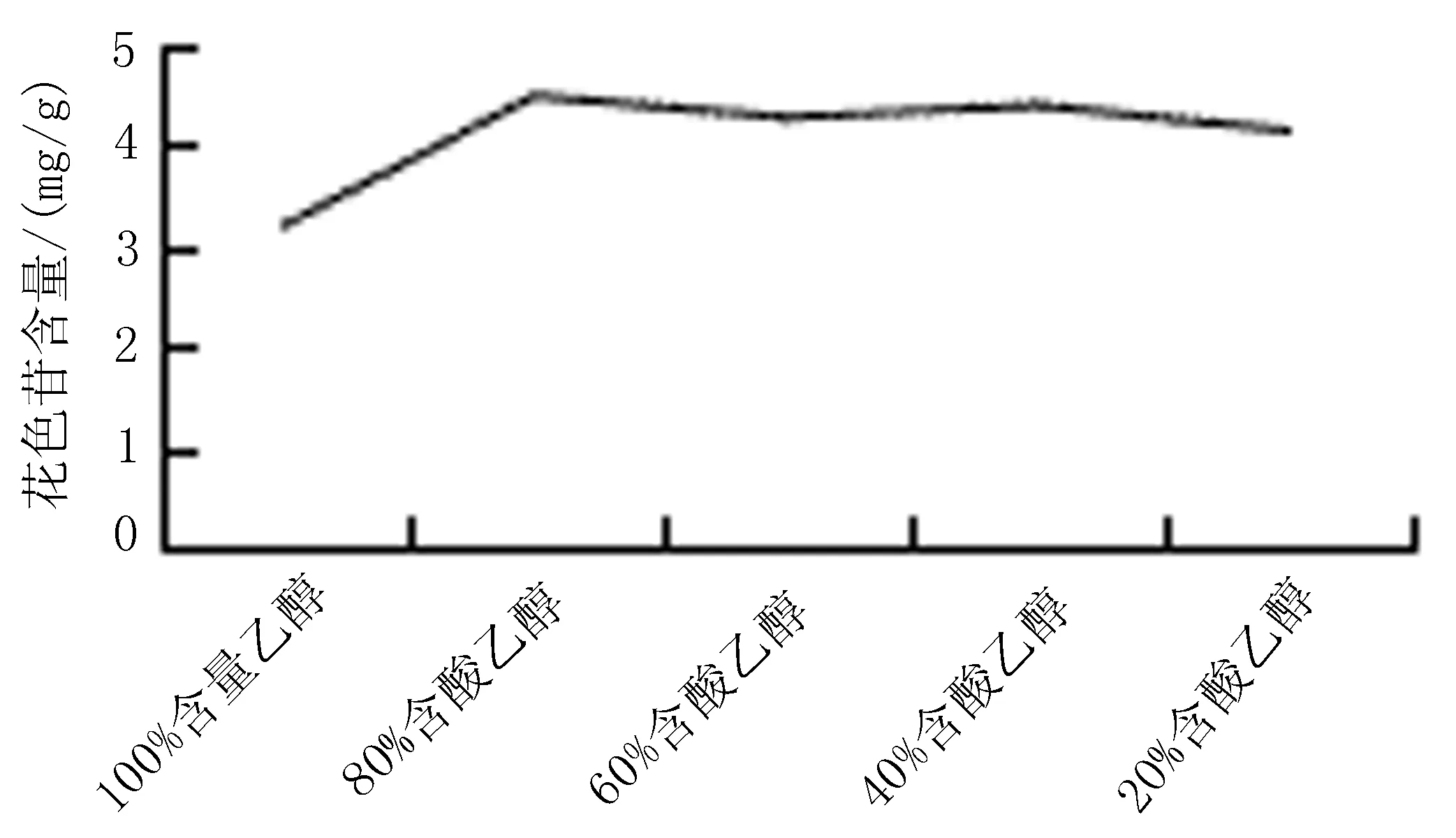
图2 不同浓度含酸乙醇对花色苷含量的影响
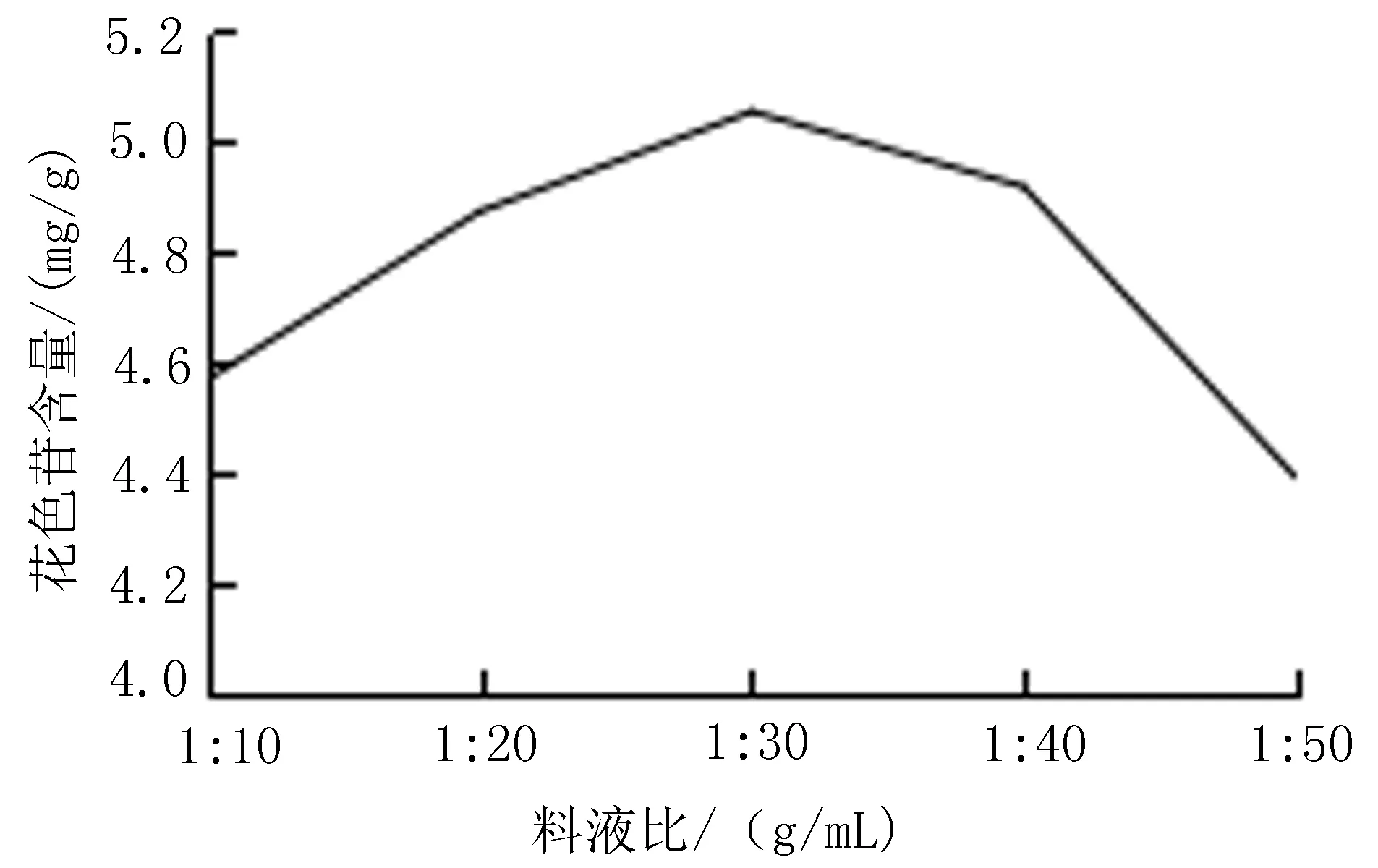
图3 料液比对花色苷含量的影响
2.5.3 盐酸含量对花色苷含量的影响 称取1.0 g黑果小檗果皮粉末至棕色容量瓶中,以80%含酸乙醇为溶剂,料液比1∶30,盐酸含量0.3%、0.5%、0.7%、0.9%、1.1%(v/v),室温超声提取1次,30 min,提取黑果小檗花色苷。按“2.4”项下方法测定黑果小檗花色苷含量,每组试验平行重复3次,结果取平均值。当盐酸含量为0.3%、0.5%、0.7%、0.9%、1.1%(v/v),提取液中花色苷含量分别为:4.70、4.95、5.11、4.99、4.79 mg/g。以盐酸含量为0.7%(v/v)的80%的酸化乙醇溶液作为提取溶剂时,提取液中花色苷含量最高,确定提取溶剂中添加盐酸的含量为0.7%(v/v),见图4。
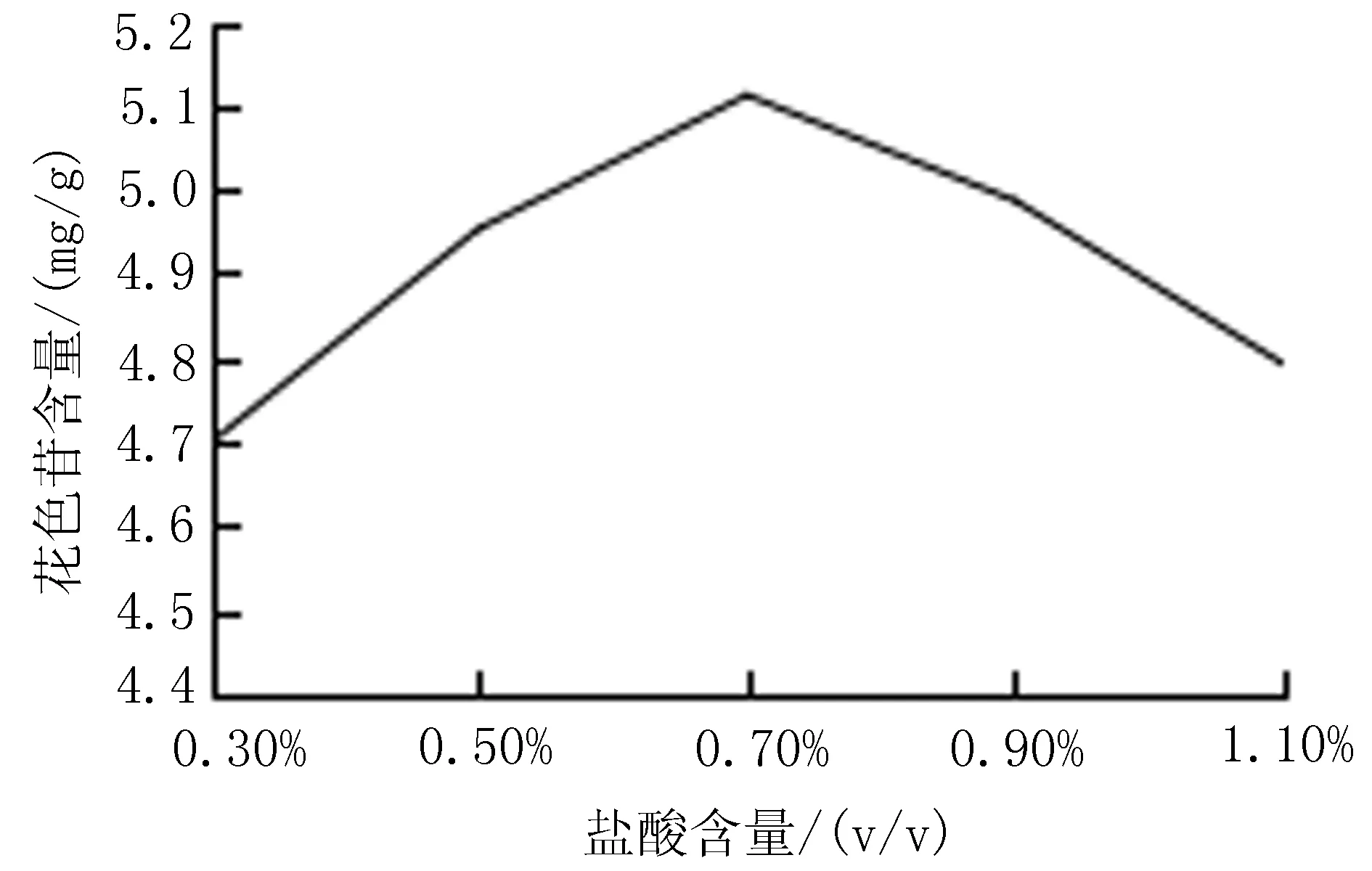
图4 盐酸含量对花色苷含量的影响
2.5.4 提取时间对花色苷含量的影响 称取1.0 g黑果小檗果皮粉末至棕色容量瓶中,以80%含酸乙醇为溶剂,料液比1∶30,盐酸含量0.7%,室温超声提取1次,10、20、30、40、50、60 min,提取黑果小檗花色苷。按“2.4”项下方法测定黑果小檗花色苷含量,每组试验平行重复3次,结果取平均值。当提取时间分别为10、20、30、40、50、60 min时,提取液中花色苷含量分别为5.02、5.55、4.88、4.93、4.91、4.29 mg/g。在提取时间为20 min时,提取液中花色苷含量最高,确定最佳提取时间为20 min,见图5。
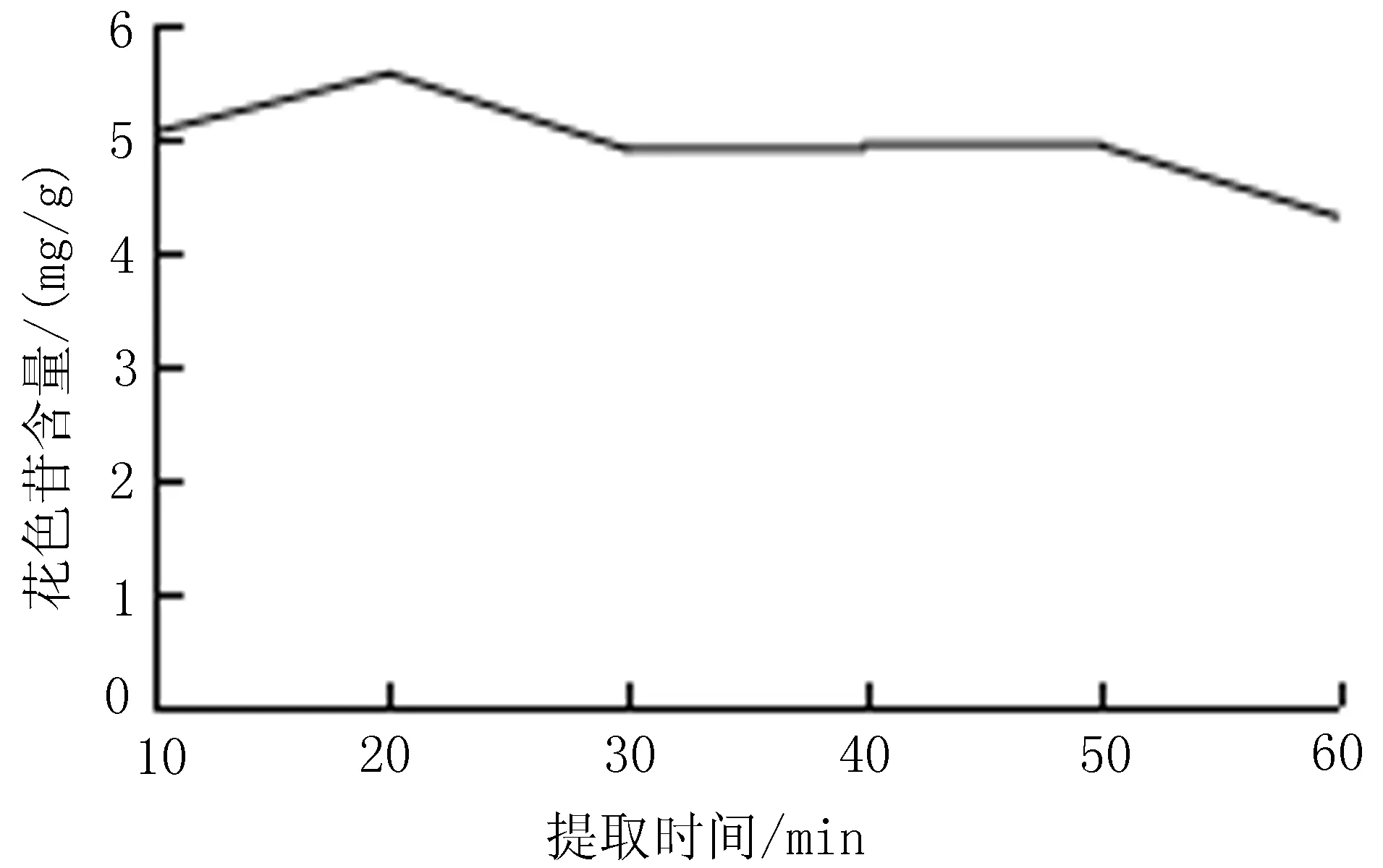
图5 提取时间对花色苷含量的影响
2.5.5 提取次数对花色苷含量的影响 称取1.0 g黑果小檗果皮粉末至棕色容量瓶中,以80%含酸乙醇为溶剂,料液比1∶30,盐酸含量0.7%,室温超声提取1、2、3、4、5次,每次20 min,提取黑果小檗花色苷。按“2.4”项下方法测定黑果小檗花色苷含量,每组试验平行重复3次,结果取平均值。当提取次数为提取1、2、3、4、5次时,提取液中花色苷含量分别为4.65、4.95、5.22、6.11、5.25 mg/g。在提取次数为4次时,提取液中花色苷含量最高,确定最佳提取次数为4次,见图6。
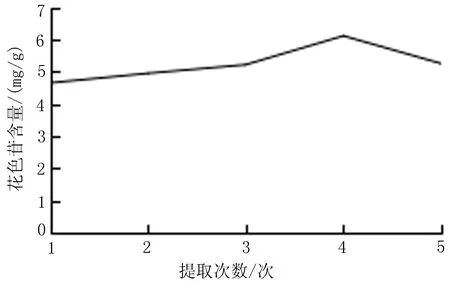
图6 提取次数对花色苷含量的影响
2.6 正交试验设计 经过单因素试验确定提取时间为20 min,提取次数为4次,以提取剂种类、盐酸体积、料液比3个因素、3个水平按L9(34)进行正交试验设计3。结果提取时间20 min、提取次数4次、料液比1∶25(g/mL)、盐酸体积0.8%(v/v)、乙醇浓度为70%为最佳提取条件,在此提取条件下,3个因素中对黑果小檗果皮花色苷提取率影响程度大小依次为乙醇浓度>盐酸体积>料液比,见表1~3。
2.7 工艺验证试验 称取1.0 g黑果小檗果皮粉末,按最佳工艺条件提取,重复3次,黑果小檗果皮中花色苷含量分别为6.266、6.368、6.696 mg/g,高于其他各组实验值,RSD= 3.48%,表明工艺重现性较好。
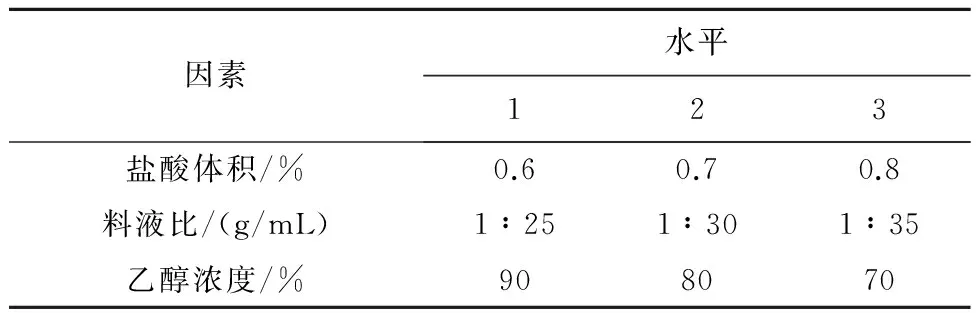
表1 黑果小檗花色苷提取正交试验设计

表2 正交试验结果
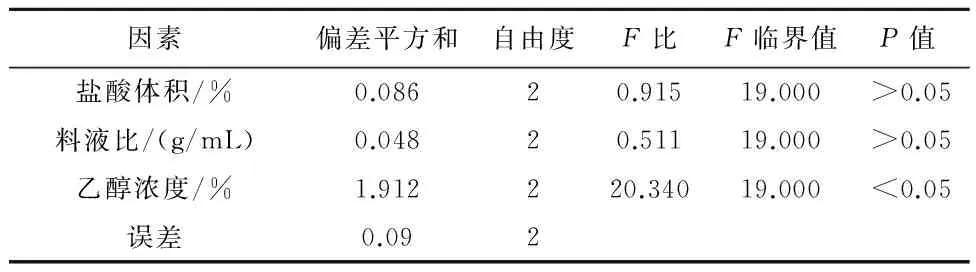
表3 方差分析结果
2.8 光照对花色苷稳定性的影响 称取6份黑果小檗果皮粉末1.0 g,将其分成两组,一组用无色透明容量瓶进行提取,另一组在其他提取参数不变的条件下改用棕色容量瓶进行提取,按“2.2”项下方法提取黑果小檗花色苷,提取完毕后收集上清,10 000 r/min离心5 min,分别吸取上清至无色/棕色小瓶中,在第0、1、2、4、6、10、14 d时,按“2.4”项下方法测定花色苷含量,花色苷在提取液中的含量会随着放置时间的增加而逐渐减少,常温避光提取及储存提取液中花色苷的含量较常温自然光提取及储存高,见图7。
2.9 果皮粉末放置时间及温度对花色苷稳定性的影响 将黑果小檗果皮粉碎,粉碎后的果皮粉末分为两组,一组常温避光储存,另一组-20℃冷藏避光储存。按“2.2”项下方法提取黑果小檗花色苷,按“2.4”项下方法分别测定在第0、2、4、8、24、36、48、60、120、192、264 h时花色苷含量,每组实验平行3份,在-20℃冷藏避光储存条件下的黑果小檗果皮粉末在提取花色苷时,提取液中花色苷的含量较常温避光储存条件下稳定,且黑果小檗果皮粉末放置时间为264 h时,-20℃冷藏避光储存条件下的黑果小檗果皮粉末中的花色苷含量明显高于常温避光储存条件下花色苷含量,见图8。
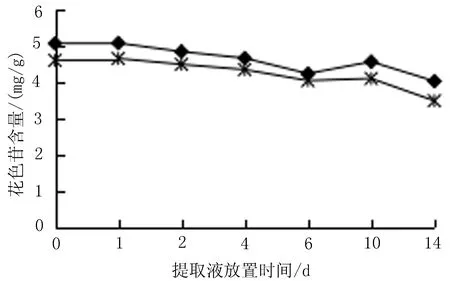
(注:“◆”示避光提取及储存; “*”示自然光提取及储存)
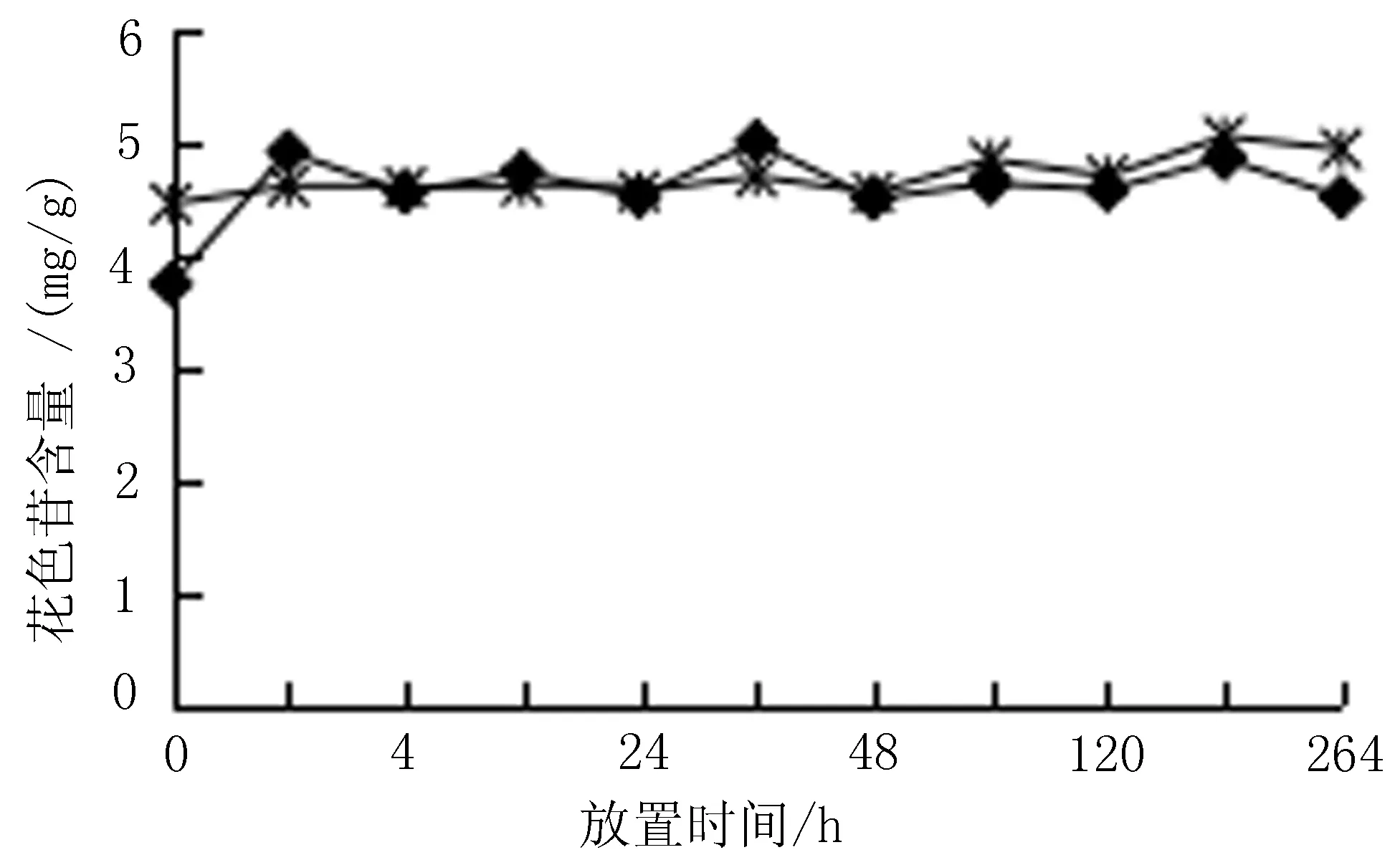
(注:“◆”示常温避光储存; “*”示-20℃冷藏避光储存)
3 讨论
花色苷类物质在天然产物中的稳定性很好,但是提取花色苷时其容易受到温度、pH、光照、金属离子的影响。花色苷在溶液介质中一般以二苯基苯丙吡喃阳离子(AH+)、醌式碱(A)、假碱(B)、查耳酮(C)形式存在,这4种形式随溶液介质的pH变化而发生可逆改变,同时溶液颜色也随着结构改变而改变,并且较低的pH有助于增强花色苷的稳定性[17],因此本研究选用酸化溶剂对黑果小檗果皮中的花色苷进行提取。本实验证明避光提取花色苷,其得率高于自然光提取时的得率,冷藏避光贮存的黑果小檗中花色苷的含量高于常温避光贮存的黑果小檗中的,因此黑果小檗粉碎后需冷藏避光贮存,提取时需避光,提取物提取后因避光放置。
[1] 侯秀云,侯秀玲.黑果小檗色素的理化性质及稳定性研究[J].食品与药品,2014,16(5):300-333.
[2] Sun LL ,Gao W,Zhang MM,et al.Composition and antioxidant activity of the anthocyanins of the fruit of Berberis heteropoda Schrenk[J].Molecules,2014,19 :51-59.
[3] Choi SW ,Chang EJ,Ha TY,etal.Antioxidative activity of acylate authocyani isolated from fruit and vegetable[J].Food Sci Nutr,1997,2(3) : 191-196.
[4] 孙梦茹,朱大伟,姚忠,等.耐盐紫甘薯花色苷组分分析和抗氧化性研究[J].天然产物研究与开发,2014,26:935-942.
[5] Dai J,Gupte A,Gates L,etal.A comprehensive studyofanthocyanin-containing extracts from selected blackberry cultivars extraction methods stability, anticancer properties and mechanisms[J]. Food Chem Toxicol, 2009, 47:837-847.
[6] 常徽,王湛,袁丽佳,等.桑葚花色苷提取物对乳腺癌细胞凋亡及线粒体膜电位的影响[J].现代生物医学进展,2012,12(22):4236-4240.
[7] 林丽,李进,李永洁,等. 黑果枸杞花色苷对氧化低密度脂蛋白损伤血管内皮细胞的保护作用[J].中国药学杂志,2013,48(8):606-611.
[8] Kalea AZ,Clark K,Schuschke DA,etal.Vascular reactivity is affected by dietary consumption of wild bluebarries in the Sprague-Dawley rat[J].J Med Food,2009,12(1):21-28.
[9] 张继曼,文汉.黑豆皮花色苷的降血糖作用及其机理研究[J].食品工业科技,2011,32(3):374-377.
[10] Harron B ,Tae HK ,Myeong OK. Protective effects of Anthocyanins against Amyloid beta-induced neurotoxicity in vivo and in vitro [J].Neurchem Int,2015,80:51-59.
[11] Belkacemi A, Ramassamy C. Innovative Anthocyanin/Anthocyanidin Formulation Protects SK-N-SH Cells Against the Amyloid-β Peptide-Induced Toxicity: Relevance to Alzheimer′s Disease[J].Cent Nerv Syst Agents Med Chem,2015,16(1):37-49.
[12] Saila V,Henna K,Elina P,etal. Anthocyanin-enriched bilberry and blackcurrant extracts modulate amyloid precursor protein processing and alleviate behavioral abnormalities in the APP/PS1 mouse model og Alzheimer’s disease [J].J Nutr Biochem,2013,24:360-370.
[13] 李颖畅.植物花色苷[M].北京:化学工业出版社,2013:231-236.
[14] 李颖畅.蓝莓花色苷提取纯化及生理功能研究[D]. 沈阳:沈阳农业大学,2008.
[15] 孙丽丽.黑果小檗果实和黑果枸杞花色苷类成分及其抗氧化活性研究[D]. 北京:中国医学科学院北京协和医学院药物研究所,2015.
[16] Cui C,Zhang SM,You LJ,etal.Antioxidant capacity of anthocyanins from Rhodomyrtus tomentosa(Ait.) and identification of the major anthocyanins [J]. Food Chem,2013,139:1-8.
[17] 凌文华.膳食花色苷与健康[M].北京:科学出版社,2014:51-54.
(本文编辑 施洋)
Optimization for extracting anthocyanins from Berberis heteropoda Schrenk and evaluation of its stability
LI Jianguang1, YANG Ying1, ZHAO Jun2, LIU Qianyun1, Dina Tuerhong1
(1CollegeofPharmacy,XinjiangMedicalUniversity,Urumqi830011,China;2XinjiangKeyLaboratoryforUighurMedicines,XinjiangInstituteofMateriaMedica,Urumqi830004,China)
Objective To ascertain the optimal ultrasound extraction condition of the anthocyanin from Berberis heteropoda Schrenk. Methods pH differential method for determination of anthocyanins content as evaluation index, using single factor rotation method and the orthogonal experiment method to establish the extraction time, extraction times, extraction solvent, anthocyanin stability and other parameters. Results Results showed that the extraction conditions were determined as follows: ethanol concentration of 70%, hydrochloric acid concentration of 0.8%, solid-to-liquid ratio 1∶25 g/mL, extraction time of 20 min, extraction times for 4 times. The anthocyanin content extracted at room temperature and dark condition was higher than that extracted at room temperature and natural light condition. The anthocyanin content in extracts from Berberis heteropoda Schrenk fruit powder stored at cold and avoid light condition was higher than that stored at room temperature and avoid light condition. Conclusion Experiments show that the method used to extract anthocyanin from Berberis heteropoda Schrenk is stable and feasible. Extraction and storage of anthocyanin from Berberis heteropoda Schrenk need to avoid light. Storage of Berberis heteropoda Schrenk fruit powder need to avoid light and at lower temperature.
BerberisheteropodaSchrenk; Anthocyanin; ultrasonic extraction
新疆医科大学研究生创新创业项目(CXCY060); 新疆地产中药民族药新药研发培育项目(2016-02-11)
李建光(1977-),男,博士,教授,博士生导师,研究方向:药物分析及天然产物药物研发,E-mail:L77117@163.com。
R943
A
1009-5551(2016)12-1568-05
10.3969/j.issn.1009-5551.2016.12.021
2016-9-1]
