新型吡唑啉化合物的合成及抑菌活性研究*
2016-12-06鹿慧燕仝水田万义梅肖孝辉
鹿慧燕, 仝水田, 张 蕴, 罗 虹,周 雷, 万义梅, 肖孝辉
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江师范大学 地理与环境科学学院,浙江 金华 321004)
新型吡唑啉化合物的合成及抑菌活性研究*
鹿慧燕1, 仝水田1, 张 蕴1, 罗 虹2,周 雷1, 万义梅1, 肖孝辉1
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江师范大学 地理与环境科学学院,浙江 金华 321004)
通过1,3-二取代苯骈三氮唑叶立德与α,β-不饱和醛、酮、腈的加成反应,合成了9个多官能团取代的吡唑啉及2个多取代的吡唑化合物;通过生长速率法测定了这些化合物对水稻稻瘟病菌、苹果树腐烂病菌、杨树溃疡病菌、苦瓜枯萎病菌、黄瓜枯萎病菌、番茄早疫病菌、水稻纹枯病菌和小麦赤霉病菌等8种植物致病真菌的抑菌活性.结果表明:当供试剂量为100 μg/mL时,1-[1-(2-乙基胺基苯基)-4,5-二苯基-4,5-二氢-1H-3-吡唑基]乙酮和1-[4-(3-甲基苯基)-1-(2-甲胺基苯基)-5-苯基-4,5-二氢-1H-3-吡唑基]乙酮对水稻稻瘟病菌具有较好的抑菌活性,抑制率分别达到100%和84%;1-(2-甲胺基苯基)-5-苯基-4-对甲苯基-4,5-二氢-1H-吡唑-3-甲醛对苹果树腐烂病菌的抑制率达到84.2%;1-[4-(2,5-二甲氧基苯基)-1-(2-甲氨基苯基)-5-苯基-4,5-二氢-1H-3-吡唑基]乙酮对苦瓜枯萎病菌和水稻稻瘟病菌的抑制率均高于75%.
吡唑;吡唑啉;真菌;抑菌活性
植物病原真菌引起的病害约占植物病害的70%~80%,如水稻稻瘟病菌、小麦赤霉病菌、苹果树腐烂病菌等.及时喷洒农药是预防这些病害的有效手段,而长期使用单一农药会导致这些病菌的抗药性增强、不良反应增加[1].因此,开发新的抑菌药物是防治农作物病害的重要途径之一.
吡唑及吡唑衍生物是一类重要的五元氮杂环化合物,是许多生物活性化合物的主要骨架.自1950年美国Rubbe公司[2]研制开发了吡唑类杀菌剂茂叶宁、绿叶宁和安种宁等以来,吡唑类化合物的合成[3-7]和应用[8-12]备受药学研究者的广泛关注,已成功开发上市的有锐劲特、茚虫威[13]等吡唑类农药.相关构效关系研究发现,吡唑啉环上乙酰基有利于提高吡唑啉的抗菌等生物活性[14-17].为进一步探究这种构效关系,本文合成了9个环上带有乙酰基或甲酰基的吡唑啉化合物和2个环上带有腈基的吡唑化合物,探讨了这些化合物对水稻稻瘟病菌、苹果树腐烂病菌等8种植物致病真菌的抑菌活性,希望能为新型抑菌药物的设计、合成提供参考.
1 实验部分
1.1 试剂与仪器
生麦芽购自亳州市中药饮片厂;琼脂粉、蔗糖、蛋白胨均购自北京博奥星生物技术有限责任公司;放线菌酮购自上海信然生物科技有限公司.其他原料及试剂均为市售分析纯化学试剂.
核磁共振谱(NMR)通过Bruker公司DRX-400核磁共振仪测定,氘代氯仿(CDCl3)为溶剂,四甲基硅烷(TMS)为内标;高分辨质谱(HRMS)通过美国安捷伦高分辨飞行时间质谱仪测定;红外光谱(IR)用美国尼高力傅里叶红外光谱仪(NEXUS670FT-IR)测定,KBr压片法.
1.2 供试菌种
水稻稻瘟病菌(Magnaporthegrisea)、杨树溃疡病菌(Dothiorellagregaria)、苹果树腐烂病菌(Valsamali)、苦瓜枯萎病菌(Fusariumoxysporumf. sp.mornordicae)、小麦赤霉病菌(Fusariumgraminearum)、番茄早疫病菌(Alternariasolani)、黄瓜枯萎病菌(Fusariumoxysporumf. sp.cucumerinum)和水稻纹枯病菌(Rhizoctoniasolani),均由浙江师范大学化学与生命科学学院微生物应用技术与产品开发实验室提供.
1.3 培养基的制备
麦芽浸汁培养基(MEA):生麦芽20 g,煮沸20 min,过滤,保留滤液,加蛋白胨1 g,蔗糖20 g,水1 L.加入20 g琼脂粉得相应的固体培养基.
1.4 化合物的合成
1.4.1 吡唑啉类化合物的合成
参照文献[18],反应式及相关结构式见图1.室温下,向25 mL圆底烧瓶中依次加入1.65 mmolα,β-不饱和醛酮、1.5 mmol溴化1,3-二取代苯骈三氮唑、2 mL二甲基亚砜(DMSO)和10 mL四氢呋喃(THF),搅拌溶解,冰水浴冷却降温至0 ℃,加入1.5 mmol(0.168 g)叔丁醇钾(t-BuOK),并逐渐搅拌至室温.用薄层色谱法(展开剂:V(乙酸乙酯)/V(石油醚)=1/15)跟踪至反应结束,减压浓缩回收溶剂,残余物中加入15 mL水,分别用20 mL乙酸乙酯萃取3次,合并有机相,再分别用20 mL饱和食盐水洗涤2次,有机相用无水硫酸钠干燥,减压浓缩回收溶剂,浓缩剩余物通过柱色谱法快速分离(洗脱剂:V(乙酸乙酯)/V(石油醚)=1/15),得到9个纯的吡唑啉类化合物.
1.4.2 吡唑类化合物的合成
参照文献[18],反应式及相关结构式见图2.室温下,向10 mL反应试管中依次加入1 mmolα,β-不饱和腈、1 mmol(0.304 g)溴化3-甲基-1-苄基苯骈三氮唑、5 mL二甲基亚砜,搅拌至物料全部溶解,加入1 mmol(0.112 g)叔丁醇钾,继续搅拌.气相色谱仪跟踪至肉桂腈消耗完全,加入10 mL水,分别用20 mL乙酸乙酯萃取3次,合并有机相,并用20 mL饱和食盐水洗涤2次,无水硫酸钠干燥,减压浓缩回收溶剂,棕红色剩余物通过柱色谱法快速分离(洗脱剂:V(乙酸乙酯)/V(石油醚)=1/15),得到2个纯的吡唑类化合物.
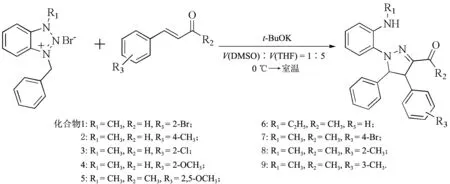
图1 9个吡唑啉类化合物的合成
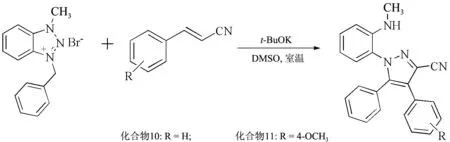
图2 2个吡唑类化合物的合成
1.5 抗菌活性的测定
利用生长速率法[19-20]测定了11个化合物对8种植物致病真菌菌丝生长的抑制活性.先将待测化合物用丙酮溶解,配得质量浓度是1 mg/mL的母液.分别吸取1 mL待测化合物母液和9 mL MEA培养基于无菌培养皿中,充分振摇使其混合均匀,使培养基中待测样品的最终质量浓度为100 μg/mL.以等量的放线菌酮作为阳性对照,等量丙酮作空白对照.将所有的液体培养基静置冷却,然后将已活化的植物致病真菌用无菌打孔器打成直径为5 mm的菌饼,置于上述培养基中.每个样品重复3次,放置在28 ℃恒温箱中培养2~6 d后,采用十字交叉法测量各供试菌的菌落直径.计算抑制率的公式如下:

吡唑啉类化合物2~4的IC50值测定:将待测吡唑啉类化合物2,3和4号分别用丙酮配制成1 000 μg/mL的溶液,然后采用梯度稀释法配制成质量浓度为1 000,500,250,100和10 μg/mL的溶液,加入培养基后化合物的最终质量浓度分别为100,50,25,10和1 μg/mL.参照文献[19-20]中生长速率法测定这些化合物对苹果树腐烂病菌的抑制活性.采用剂量对数-抑制率法计算得到化合物抑制苹果树腐烂病菌菌丝生长的IC50值.
2 实验结果与讨论
2.1 化合物的结构表征
化合物1:4-(2-溴苯基)-1-(2-甲胺基苯基)-5-苯基-4,5-二氢-1H-吡唑-3-甲醛,棕色油状液体,产率75%.1H NMR(400 MHz,CDCl3)δ:9.84(s,1H),7.60(d,J=8.1 Hz,1H),7.32~7.18(m,6H),7.13(t,J=7.8 Hz,1H),7.02(d,J=7.8 Hz,1H),6.97(t,J=7.8 Hz,1H),6.69(dd,J=8.1,3.8 Hz,2H),6.45(t,J=8.1 Hz,1H),6.35(br,1H),5.44(d,J=5.3 Hz,1H),4.88(d,J=5.3 Hz,1H),2.94(d,J=4.8 Hz,3H);13C NMR(100 MHz,CDCl3)δ:183.7,146.8,141.6,138.7,133.7,129.3,129.2,128.5,128.4,128.0,127.4,126.6,126.0,125.7,123.6,118.8,116.0,111.5,77.6,55.0,30.5;IR(KBr)σ/cm-1:3 400,3 129,2 813,1 655,1 601,1 518,1 468,1 401,1 293,1 274,1 151,1 024,739,698;高分辨质谱:计算值C23H20BrN3O[M]+为433.079 0,测量值为433.078 8.
化合物2:1-(2-甲胺基苯基)-5-苯基-4-对甲苯基-4,5-二氢-1H-吡唑-3-甲醛,棕色油状液体,产率58%.1H NMR(400 MHz,CDCl3)δ:9.78(s,1H),7.30~7.19(m,3H),7.16~7.09(m,4H),7.07~7.03(m,2H),6.95(t,J=7.8 Hz,1H),6.67(t,J=8.1 Hz,2H),6.47(q,J=4.8 Hz,1H),6.43(t,J=7.8 Hz,1H),5.46(d,J=6.1 Hz,1H),4.30(d,J=6.1 Hz,1H),2.92(d,J=5.0 Hz,3H),2.30(s,3H);13C NMR(100 MHz,CDCl3)δ:184.1,147.7,141.5,139.6,137.6,137.4,130.1,129.5,128.5,127.2,126.8,125.6,125.5,118.5,116.0,111.6,78.3,55.9,30.6,21.3;IR(KBr)σ/cm-1:3 413,3 129,2 814,2 796,1 650,1 513,1 401,1 147,743,701;高分辨质谱:计算值C24H23N3O[M]+为369.184 1,测量值为369.184 2.
化合物3:4-(2-氯苯基)-1-(2-甲胺基苯基)-5-苯基-4,5-二氢-1H-吡唑-3-甲醛,棕色油状液体,产率64%.1H NMR(400 MHz,CDCl3)δ:9.84(s,1H),7.46~7.41(m,1H),7.35~7.18(m,7H),7.07~7.02(m,1H),6.98(t,J=7.8 Hz,1H),6.69(t,J=7.6 Hz,2H),6.46(t,J=7.8 Hz,1H),6.38(br,1H),5.47(d,J=5.8 Hz,1H),4.84(d,J=5.8 Hz,1H),2.96(d,J=4.8 Hz,3H);13C NMR(100 MHz,CDCl3)δ:183.8,146.4,141.6,138.9,137.0,133.4,130.4,129.4,129.2,129.0,128.6,127.8,126.6,125.9,125.7,118.8,116.0,111.6,77.4,52.9,30.5;IR(KBr)σ/cm-1:3 401,3 130,2 813,1 654,1 601,1 521,1 401,1 294,1 275,1 151,759,738,697;高分辨质谱:计算值C23H20ClN3O[M]+为389.129 5,测量值为389.129 1.
化合物4:4-(2-甲氧基苯基)-1-(2-甲胺基苯基)-5-苯基-4,5-二氢-1H-吡唑-3-甲醛,棕色油状液体,产率62%.1H NMR(400 MHz,CDCl3)δ:9.93(s,1H),7.39~7.30(m,4H),7.26(d,J=7.2 Hz,2H),7.10(d,J=7.8 Hz,1H),7.04(t,J=8.1 Hz,1H),7.00~6.94(m,2H),6.76(d,J=7.8 Hz,2H),6.58(q,J=4.6 Hz,1H),6.52(t,J=7.8 Hz,1H),5.56(d,J=5.8 Hz,1H),4.69(d,J=5.8 Hz,1H),3.81(s,3H),3.01(d,J=4.6 Hz,3H);13C NMR(100 MHz,CDCl3)δ:184.3,157.0,146.6,141.6,140.0,129.2,129.1,128.9,128.2,127.5,127.0,125.9,125.4,121.1,118.7,116.0,111.4,111.3,76.8,55.4,51.5,30.6;IR(KBr)σ/cm-1:3 404,3 129,2 810,1 661,1 597,1 522,1 401,1 280,1 250,1 144,1 105,1 020,777,748,701;高分辨质谱:计算值C24H23N3O2[M]+为385.179 0,测量值为385.179 2.
化合物5:1-[4-(2,5-二甲氧基苯基)-1-(2-甲氨基苯基)-5-苯基-4,5-二氢-1H-3-吡唑基]乙酮,棕色油状液体,产率72%.1H NMR(400 MHz,CDCl3)δ:7.27~7.13(m,5H),6.91(t,J=8.1 Hz,1H),6.81~6.78(m,1H),6.72(dd,J=8.8,2.8 Hz,1H),6.66~6.62(m,2H),6.53(d,J=3.0 Hz,1H),6.42(t,J=7.6 Hz,1H),6.34(br,1H),5.36(d,J=6.3 Hz,1H),4.58(d,J=6.3 Hz,1H),3.68(s,3H),3.66(s,3H),2.91(d,J=4.6 Hz,3H),2.48(s,3H);13C NMR(100 MHz,CDCl3)δ:191.7,153.8,151.1,145.7,141.5,140.0,129.6,129.0,128.0,127.7,126.0,124.8,118.5,116.0,115.3,112.3,112.2,111.2,76.4,56.0,55.6,52.4,30.6,25.8;IR(KBr)σ/cm-1:3 399,3 127,2 832,1 652,1 600,1 521,1 500,1 400,1 279,1 217,1 148,740,699;高分辨质谱:计算值C26H27N3O3[M]+为429.205 2,测量值为429.205 0.
化合物6:1-[1-(2-乙基胺基苯基)-4,5-二苯基-4,5-二氢-1H-3-吡唑基]乙酮,棕色油状液体,产率41%.1H NMR(400 MHz,CDCl3)δ:7.35~7.22(m,6H),7.17(dd,J=14.0,7.2 Hz,4H),6.93(t,J=7.8 Hz,1H),6.68(dd,J=16.8,8.0 Hz,2H),6.45(t,J=7.8Hz,1H),6.37(br,1H),5.42(d,J=5.8 Hz,1H),4.36(d,J=5.8 Hz,1H),3.27~3.18(m,2H),2.47(s,3H),1.37(t,J=7.6 Hz,3H);13C NMR(100 MHz,CDCl3)δ:191.5,146.5,141.1,140.6,139.9,129.4,129.2,128.3,127.6,127.2,127.1,125.6,124.9,118.4,116.1,111.8,77.8,57.4,38.3,26.0,15.0;IR(KBr)σ/cm-1:3 381,3 129,3 035,1 655,1 600,1 521,1 453,1 401,1 275,1 146,739,698,534,518;高分辨质谱:计算值C25H25N3O[M]+为383.199 8,测量值为383.199 9.
化合物7:1-[4-(4-溴苯基)-1-(2-甲胺基苯基)-5-苯基-4,5-二氢-1H-3-吡唑基]乙酮,棕色油状液体,产率59%.1H NMR(400 MHz,CDCl3)δ:7.43(d,J=8.3 Hz,2H),7.30~7.20(m,3H),7.12~7.08(m,2H),7.03(d,J=8.3 Hz,2H),6.95(t,J=7.8 Hz,1H),6.66(dd,J=18.9,8.1 Hz,2H),6.45(t,J=7.8 Hz,1H),6.31(br,1H),5.36(d,J=6.6 Hz,1H),4.29(d,J=6.6 Hz,1H),2.93(s,3H),2.44(s,3H);13C NMR(100 MHz,CDCl3)δ:191.6,146.2,141.4,140.0,139.4,132.3,129.5,129.0,128.5,127.3,125.6,125.2,121.6,118.3,116.2,111.5,77.6,56.9,30.6,26.0;IR(KBr)σ/cm-1:3 402,3 129,3 024,2 813,1 655,1 601,1 521,1 401,1 279,1 147,741,700,522;高分辨质谱:计算值C24H22BrN3O[M]+为447.094 6,测量值为447.094 1.
化合物8:1-[4-(2-甲苯基)-1-(2-甲胺基苯基)-5-苯基-4,5-二氢-1H-3-吡唑基]乙酮,棕色油状液体,产率65%.1H NMR(400 MHz,CDCl3)δ:7.31~7.21(m,3H),7.19~7.12(m,5H),7.02~6.98(m,1H),6.95(t,J=7.8 Hz,1H),6.67(t,J=8.1 Hz,2H),6.46(t,J=7.8 Hz,1H),6.34(br,1H),5.38(d,J=5.8 Hz,1H),4.61(d,J=5.8 Hz,1H),2.93(d,J=4.6 Hz,3H),2.47(s,3H),2.29(s,3H);13C NMR(100 MHz,CDCl3)δ:191.6,147.5,141.5,140.0,139.6,135.6,130.8,129.4,128.3,127.5,127.4,127.1,126.4,125.7,124.9,53.3,30.6,26.0,20.1;IR(KBr)σ/cm-1:3 402,3 131,2 926,2 814,1 642,1 601,1 519,1 401,1 297,1 208,1 155,745,725,702;高分辨质谱:计算值C25H25N3O[M]+为383.199 8,测量值为383.199 9.
化合物9:1-[4-(3-甲基苯基)-1-(2-甲胺基苯基)-5-苯基-4,5-二氢-1H-3-吡唑基]乙酮,棕色油状液体,产率64%.1H NMR(400 MHz,CDCl3)δ:7.31~7.18(m,4H),7.16~7.12(m,2H),7.10~7.05(m,1H),7.00~6.93(m,3H),6.69(dd,J=12.4,8.1 Hz,2H),6.47(t,J=8.1 Hz,1H),6.43(br,1H),5.43(d,J=6.1 Hz,1H),4.33(d,J=6.1 Hz,1H),2.96(d,J=4.6 Hz,3H),2.48(s,3H),2.33(s,3H);13C NMR(100 MHz,CDCl3)δ:191.7,146.7,141.4,141.1,139.9,138.9,129.4,129.1,128.4,128.3,127.9,127.4,125.6,124.9,124.2,118.3,116.1,111.3,77.6,57.3,30.6,26.0,21.6;IR(KBr)σ/cm-1:3 413,3 129,3 027,2 814,1 652,1 599,1 525,1 401,1 280,1 140,934,883,790,742,699;高分辨质谱:计算值C25H25N3O[M]+为383.199 8,测量值为383.199 2.
化合物10:1-(2-甲胺基苯基)-4,5-二苯基-1H-吡唑-3-腈,白色固体,产率45%.1H NMR(400 MHz,CDCl3)δ:7.36~7.16(m,9H),7.02(d,J=7.6 Hz,2H),6.77(d,J=8.4 Hz,1H),6.71(d,J=7.6 Hz,1H),6.50(t,J=7.6 Hz,1H),4.42~4.34(br,1H),2.86(d,J=4.8 Hz,3H);13C NMR(100 MHz,CDCl3)δ:145.2,142.4,130.7,129.9,129.4,129.2,129.0,128.9,128.6,128.1,127.9,127.7,125.9,125.5,124.2,116.3,114.0,111.7,30.3;IR(KBr)σ/cm-1:3 418,3 053,2 815,2 235,1 608,1 524,1 323,1 170,975,744,695;高分辨质谱:计算值C23H18N4[M]+为350.153 1,测量值为350.153 4.
化合物11:4-(4-甲氧基苯基)-1-(2-甲胺基苯基)-5-苯基-1H-吡唑-3-腈,白色固体,产率40%.1H NMR(400 MHz,CDCl3)δ:7.32~7.18(m,6H),7.06~7.00(m,2H),6.87(d,J=8.4 Hz,2H),6.78(d,J=8.4 Hz,1H),6.71(d,J=7.6 Hz,1H),6.51(t,J=7.6 Hz,1H),4.44~4.36(br,1H),3.81(s,3H),2.88(d,J=5.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:159.4,145.2,142.0,130.7,130.2,129.9,129.1,128.6,127.8,125.8,125.4,124.3,121.6,116.3,114.3,114.2,111.6,55.3,30.3;IR(KBr)σ/cm-1:3 440,3 399,3 052,2 960,2 937,2 818,2 234,1 611,1 518,1 447,1 292,1 254,1 174,840,752,699.高分辨质谱:计算值C24H20N4O[M]+为380.163 7,测量值为380.163 9.
2.2 化合物抗植物致病真菌的检测
11个化合物对8种植物致病真菌的生长抑制作用检测结果见表1.
从表1可以看出:当供试浓度为100 μg/mL时,含有吡唑啉环的化合物1~9对水稻稻瘟病菌、苹果树腐烂病菌具有较好的抗菌活性,而含有吡唑环的化合物10和化合物11对水稻稻瘟病菌、苹果树腐烂病菌的抑制活性要低一些.相对而言:吡唑啉环上连有乙酰基的化合物对水稻稻瘟病菌的抑制率更高,如:化合物5的抑制率为76.0%,化合物6的抑制率达到了100%,化合物7的抑制率为73.3%,化合物9的抑制率为84.0%;而吡唑啉环上连有甲酰基的化合物则对苹果树腐烂病菌表现出更优的抑制活性,如:化合物1的抑制率为73.1%,化合物2的抑制率为84.2%,化合物3的抑制率为79.0%;化合物1和化合物2对小麦赤霉菌表现出了较好的抑制活性,抑制率分别达到78.4%和72.6%;含有吡唑啉环的化合物5和吡唑环的化合物10对苦瓜枯萎病菌具有较好的抑菌作用,抑制率分别达到81.1%和77.7%;化合物1~11对番茄早疫病菌、苦瓜枯萎病菌、杨树溃疡病菌和水稻纹枯病菌等菌种的抑制活性较弱,抑制率均在50%以下.基于初步的抑制活性筛选结果,本实验还测定了吡唑啉类化合物2~4(初步筛选活性较优)对苹果树腐烂病菌的半抑制浓度(IC50),测得化合物2的IC50值为98.3 μg/mL,化合物3的IC50值为22.2 μg/mL,化合物4的IC50值为41.7 μg/mL.阳性对照药放线菌酮的IC50值为0.3 μg/mL.
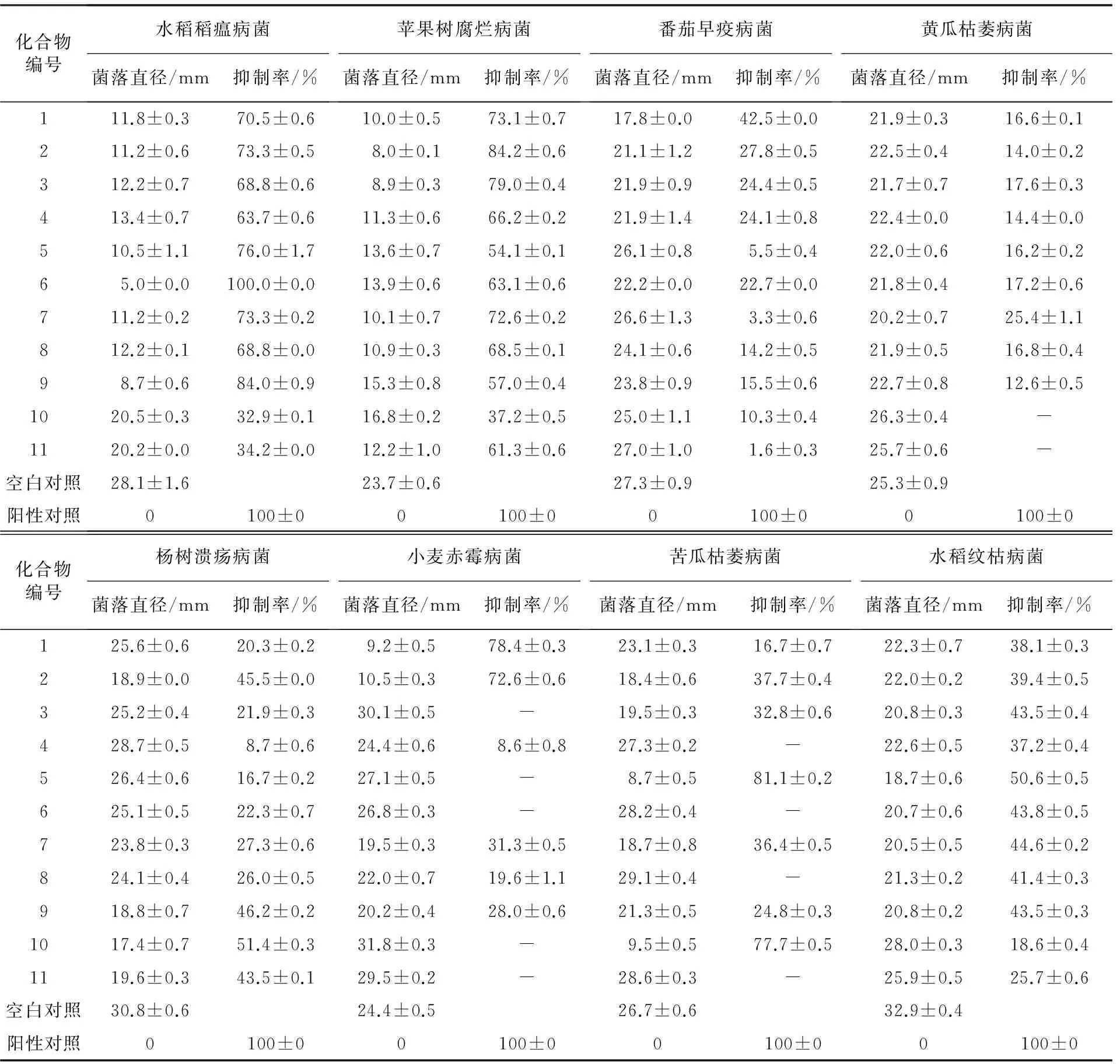
表1 化合物1~11对8种供试真菌的抑制活性
注:1)表中数据为平均抑制率±标准差;2)所有测试样品的质量浓度为100 μg/mL;3)阳性对照药为放线菌酮.
3 结 论
通过抑菌活性分析,可以看出:含有吡唑啉骨架的化合物1~9对水稻稻瘟病菌、苹果树腐烂病菌具有较好的抗菌活性;吡唑啉环上的乙酰基有利于提高对水稻稻瘟病菌的抑制活性,而吡唑啉环上的甲酰基则有利于提高对苹果树腐烂病菌的活性.
[1]曾繁典.抗生素及合成抗菌药物的滥用与危害[J].中国药物警戒,2004(1):25-27.
[2]Norman K S.Germicidal composition comprising a 3,5-dimethyl-4-nitroso pyrazole:US,2510724[P].1950-06-06.
[3]Fustero S,Barrio P,Simon-Fuentes A,et al.From 2000 to Mid-2010:A fruitful decade for the synthesis of pyrazoles[J].Chemical Reviews,2011,111(11):6984-7034.
[4]王杰,补朝阳,黎桂辉,等.吡唑啉衍生物的合成及研究进展[J].化学研究,2013,24(3):326-330.
[5]杨春文.吡唑类衍生物的合成研究进展[J].甘肃联合大学学报,2013,27(5):46-54.
[6]Schmidt A,Dreger A.Recent advances in the chemistry of pyrazoles properties,biological activities,and syntheses[J].Current Organic Chemistry,2011,15(41):1423-1463.
[7]Shaaban M R,Mayhoub A S,Farag A M.Recent advances in the therapeutic applications of pyrazolines[J].Expert Opinion on Therapeutic Patents,2012,22(3):253-291.
[8]Samshuddin S,Narayana B,Sarojini B K,et al.Antimicrobial,analgesic,DPPH scavenging activities and molecular docking study of some 1,3,5-triaryl-2-pyrazolines[J].Medicinal Chemistry Research,2013,21(8):2012-2022.
[9]Kumar A,Rout S,Panda C,et al.Synthesis and biological evaluation of 3,5-diaryl-1-phenyl-2-pyrazolines as antibacterial,anti-inflammatory and analgesic agents[J].International Journal of Current Research and Review,2011,3(2):42-54.
[10]Secci D,Bolasco A,Chimenti P,et al.The state of the art of pyrazole derivatives as monoamine oxidase inhibitors and antidepressant anticonvulsant agents[J].Current Medicinal Chemistry,2011,18(33):5114-5144.
[11]郎玉成,柏玉罗.吡唑类农药品种的研究开发进展[J].现代农药,2006,5(5):6-12.
[12]曹瑾,王岩丽,吴红辉,等.新吡唑啉类化合物的分子设计、合成及生物活性[J].农药学学报,2002,4(3):24-28.
[13]Mccann S F,Annis D G,Shapiro R,et al.The discovery of indoxacarb:oxadiazines as a new class of pyrazoline-type insecticides[J].Pest Management Science,2001,57(2):153-164.
[14]Chimenti F,Bizzarri B,Rivanera D,et al.Synthesis and in vitro selective anti-helicobacter pylori activity of pyrazoline derivatives[J].Bioorganic and Medicinal Chemistry Letters,2005,15(13):603-607.
[15]Bekhit A A,Abdel-Aziem T.Design,synthesis and biological evaluation of some pyrazole derivatives as anti-inflammatory-antimicrobial agents[J].Bioorganic and Medicinal Chemistry,2004,12(8):1935-1945.
[16]Manna F,Chimenti F,Fioravanti R,et al.Synthesis of some pyrazole derivatives and preliminary investigation of their affinity binding to P-glycoprotein[J].Bioorganic and Medicinal Chemistry Letters,2005,15(20):4632-4635.
[17]Manna F,Chimenti F,Bolasco A,et al.Inhibition of amine oxidases activity by 1-acetyl-3,5-diphenyl-4,5-dihydro-(1H)-pyrazole derivatives[J].Bioorganic & Medicinal Chemistry Letters,2002,12(24):3629-3633.
[18]仝水田.3-烷基-1-苄基苯骈三氮唑叶立德与α,β-不饱和醛、酮、腈的反应研究[D].金华:浙江师范大学,2012.
[19]Zhang Yinglao,Li Shuai,Jiang Donghua,et al.Antifungal activities of metabolites produced by a termite-associatedStreptomycescanusBYB02[J].Journal of Agricultural and Food Chemistry,2013,61(7):1521-1524.
[20]Xie Jianwu,Wu Jiashou,Zhang Xue,et al.Synthesis and antifungal activities of novel polyheterocyclic spirooxindole derivatives[J].Organic and Biomolecular Chemistry,2015,13(17):4967-4975.
(责任编辑 薛 荣)
A study on antifungal activity of novel pyrazolines
LU Huiyan1, TONG Shuitian1, ZHANG Yun1, LUO Hong2,ZHOU Lei1, WAN Yimei1, XIAO Xiaohui1
(1.CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China; 2.CollegeofGeographyandEnvironmentalSciences,ZhejiangNormalUniversity,Jinhua321004,China)
A series of novel pyrazolines and pyrazoles were prepared via the reaction of 1,3-disubstituted benzotriazolium ylide andα,β-unsaturated aldehydes, ketones or nitriles. Their antifungal bioactivities against eight kinds of phytopathogenic fungi were tested respectively by the mycelium growth rate method in vitro, and the results of separate cultivating condition showed that 1-(1-(2-(ethylamino) phenyl)-4,5-diphenyl-4,5-dihydro-1H-pyrazol-3-yl) ethanone and 1-(4-(3-(methylamino) phenyl)-5-phenyl-4-m-tolyl-4,5-dihydro-1H-pyrazol-3-yl) ethanone exhibited high activities againstMagnaporthegrisea(inhibition rate: 100% and 84% respectively) at the concentration of 100 μg/mL. At the same concentration, the inhibition rate of 1-(2-(methylamino) phenyl)-5-phenyl-4-p-tolyl-4,5-dihydro-1H-pyrazole-3-carbaldehyde was up to 84.2% againstValsamali. It was also found that 1-(4-(2,5-dimethoxyphenyl)-1-(2-(methylamino) phenyl)-5-phenyl-4,5-dihydro-1H-pyrazol-3-yl) ethanone had good antifungal properties againstMagnaporthegriseaandFusariumoxysporumf. sp.mornordicae.
pyrazole; pyrazoline; fungi; antifungal activity
10.16218/j.issn.1001-5051.2016.04.009
2015-12-22;
2016-03-02
浙江省自然科学基金资助项目(LY12B02003 )
鹿慧燕(1988-),女,河南开封人,硕士研究生.研究方向:有机化学. 通信作者:肖孝辉.E-mail: xxh@zjnu.cn
O626.21
A
1001-5051(2016)04-0412-07
