包虫囊液对体外培养小鼠NK细胞影响的研究
2016-12-06印双红陈小林张俊波吴向未陈雪玲
印双红,陈小林,张俊波,吴向未,陈雪玲*
( 1.铜仁学院 大健康学院,贵州 铜仁 554300;2.石河子大学 医学院免疫学教研室,新疆 石河子 832002;3.铜仁学院 农林工程与规划学院,贵州 铜仁 554300 )
【化学与生物科学】
包虫囊液对体外培养小鼠NK细胞影响的研究
印双红1,陈小林2,张俊波3,吴向未2,陈雪玲2*
( 1.铜仁学院 大健康学院,贵州 铜仁 554300;2.石河子大学 医学院免疫学教研室,新疆 石河子 832002;3.铜仁学院 农林工程与规划学院,贵州 铜仁 554300 )
采用流式细胞仪检测NK细胞活性受体NKG2D的表达变化,乳酸脱氢酶细胞毒性检测法(LDH)分析脾细胞的杀伤活性。通过细粒棘球蚴囊液对体外BABL/c小鼠NK细胞的检测结果的分析讨论,得到细粒棘球蚴囊液可降低NKG2D的表达水平,进而使NK细胞杀伤活性降低,从而得到有利于包虫免疫逃逸的结论。
囊液; 细粒棘球蚴; NK细胞
包虫病(Hydatid disease)是棘球蚴寄生于中间宿主引起的一种人畜共患寄生虫病[1]。在包虫病的手术治疗过程中,由于棘球蚴包囊意外破裂,部分原头节进入组织内,发生再次感染,使包虫病很难治愈[2]。包虫之所以可在宿主体内存活,依赖于对宿主的免疫逃避机制。NK细胞(Natural killer cell)是一类大颗粒淋巴细胞,存在于淋巴器官和外周组织中,具有多种重要作用,其中以防御感染和溶解破坏靶细胞为主要作用。NK细胞的杀伤作用与其表面受体相关,NKG2D是NK细胞重要的CL-SF激活性受体,与某些靶细胞识别相关[3],对于NK细胞在包虫免疫逃逸中的功能,有研究表明其NK细胞活性明显下降,但目前相关研究较少[4]。本研究主要分析细粒棘球蚴囊液对体外小鼠NK细胞的影响。
1.材料和方法
1.1.材料
1.1.1.实验材料
6周~8周雌性BALB/c小鼠购自新疆医科大学第一附属医院实验动物中心。
1.1.2.主要试剂和仪器
RPMI-1640培养基、胎牛血清均购自HYCLIONE公司;流式抗体DX5-FITC和NKG2D-PE购自ebioscience公司;流式细胞仪购自BD公司;淋巴细胞分离液购自Solarbio公司;Yac-1细胞购自上海锐聪科技公司;酶标仪购自BIO-RAD公司。
1.2.方法
1.2.1.细粒棘球蚴囊液的制备
从已感染细粒棘球蚴病的绵羊肝脏上抽取无感染、无胆瘘、无色透明的单囊型细粒棘球蚴囊液。4℃,300*g离心10min,无菌滤纸过滤,然后再用0.22μm滤器过滤,取出10mL分析囊液蛋白浓度,剩余的分装于离心管中,-80℃保存备用。
1.2.2.小鼠脾脏细胞分离
以脱颈方式处死小鼠,无菌取出脾脏,放入含PBS的器皿中冲洗,研磨后用滤膜过滤,收集细胞悬
液,200*g离心5min后弃上清液;用RPMI-1640培养基(含10%胎牛血清)将细胞稀释成3.5×106/mL浓度的悬液。
以脱颈方式处死小鼠,放入75%乙醇内3min,无菌取出脾脏,用5mL注射器在含有PBS的器皿中刮出脾细胞。用1mL注射器抽吸脾细胞,尽量分散脾细胞。向离心管加入3mL淋巴细胞分离液,再将1.5 mL细胞悬液缓慢加入(V脾细胞悬液:V分离液=1:2),2000rpm,20min离心。吸出中间的云絮层,用3 mL PBS,1000rpm,5min洗涤3次。用RPMI-1640培养基配成3×107个/mL。
1.2.3.不同浓度囊液对小鼠NK淋巴细胞的影响
(1)按每孔0.5mL将细胞悬液加入到48孔培养板,再加入囊液0.5mL、0.3mL、0.2mL、0.1mL及空白对照PBS组共5组,每组设3个重复;每孔由RPMI-1640培养基补至1.0mL,并加入ConA 10µg,37℃,5%C02培养72h后,300*g离心5min,PBS洗涤,然加入抗体孵育30min,分析NKG2D的表达。
(2)收集细胞用LDH酶法检测NK细胞活性的变化。取淋巴细胞1×107个/mL和靶细胞Yac-1 cells 1×105个/mL各0.1mL(E:T=100 :1)加入培养板中(设3复孔),同时设靶细胞自然释放孔(0.1mL靶细胞+0.1mL 10%FCS-RPMI-1640培养液)和最大释放孔(0.1mL靶细胞+0.1mL1%NP40液),1000 r/min,离心2min。置37℃,5%CO2孵育2h。1000 r/min,离心5min。各孔吸取上清0.1mL加至新96孔板中,37℃放置10min。每孔再加入0.1mL LDH底物溶液,避光室温放置10~15min。加入30µL1mol/L柠檬酸终止液终止反应。酶联检测仪在570nm波长下读取各孔A值。
根据下列公式获得NK细胞活性:

1.2.4.数据分析
用SPSS18.0软件进行统计学分析,计量资料采用x±s表示。两组间比较采用两样本均数的t参数检验,多组比较用方差分析。
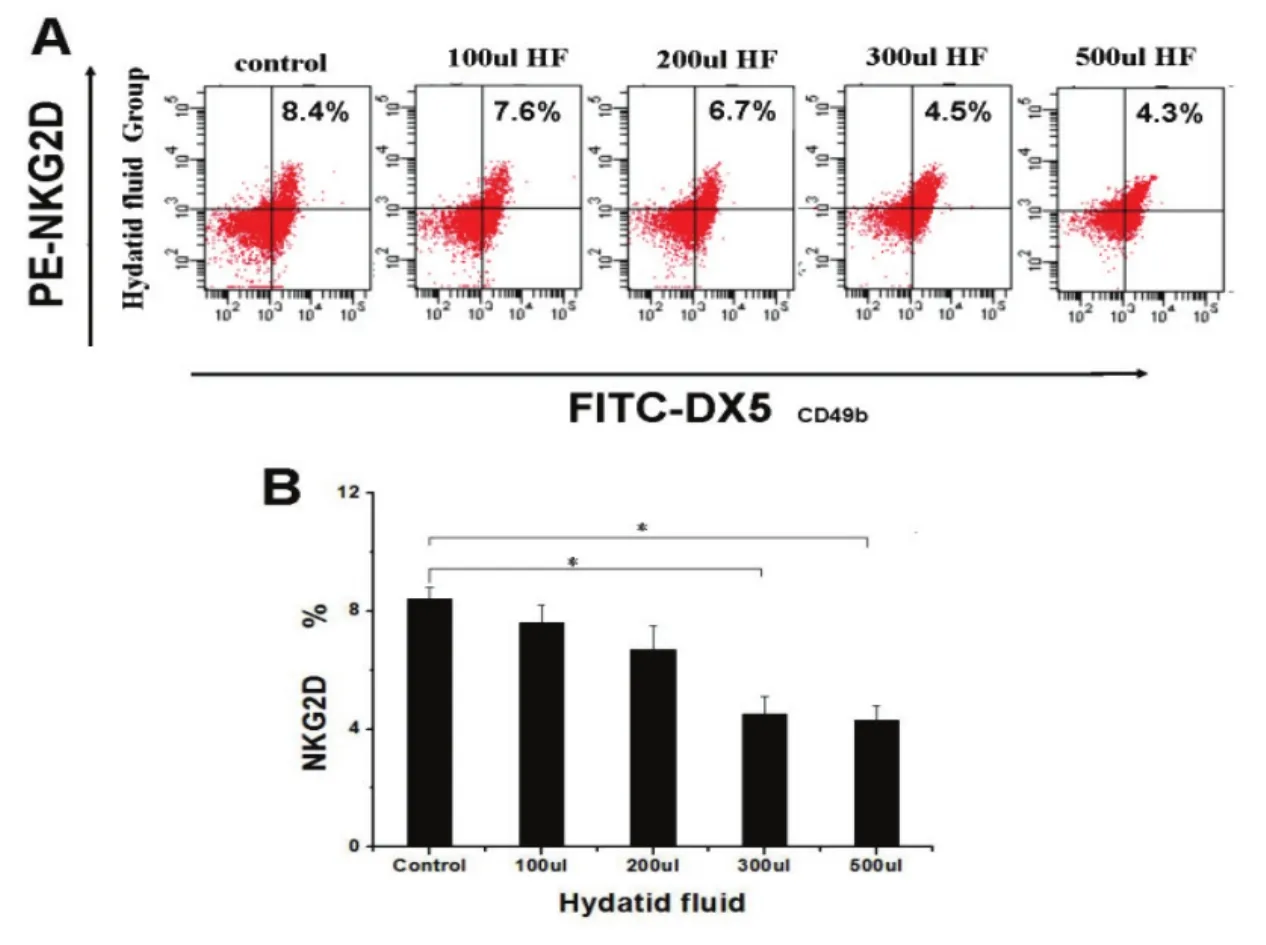
图1 不同浓度囊液对NKG2D表达的影响
2.结果与分析
2.1.囊液对小鼠NK细胞表面受体NKG2D的表达影响
分析不同浓度囊液对NK细胞表面受体NKG2D表达的影响(图1),结果表明,囊液组中NKG2D的表达水平下降;伴随囊液浓度的提高,NKG2D水平逐渐下降,在高浓度500µL组下降到最小值(4.3±0.5%),与对照组相比有统计学差异(t=3.89,p<0.05)。FCM检测不同浓度囊液组NKG2D的表达结果; 500µL组与对照相比有统计学意义,p<0.05。
2.2.不同浓度的囊液对NK细胞活性的影响
LDH酶法分析囊液对NK细胞杀伤活性的影响(表1和图2),结果表明,增加囊液浓度时,NK细胞对Yac-1的免疫杀伤活性具有下降的趋势;并在高浓度组达到最低值(8.3±1.0%),与对照组相比显著差异(t=3.45,p<0.05)。

表1 LDH酶法分析不同浓度囊液对NK细胞活性的影响

图2 不同浓度囊液对NK细胞免疫杀伤性的影响
3.讨论
细粒棘球蚴可在宿主体内长期生存,但其机制还不十分清楚,NK细胞未充分发挥天然免疫作用,应是患该病的重要原因之一[5]。对于NK细胞的研究,目前主要关于泡球蚴患者的外周血中比例降低的研究。Nicod研究表明NK细胞活性显著降低,且这与PBMC中NK细胞比例低有关。其他研究通过分析患者外周血也发现,泡球蚴患者的NK细胞比例与健康人相比降低[6],并且还发现,维吾尔族和汉族包虫病人的NK细胞比例均较健康人组水平显著降低,表明包虫感染后可能抑制了NK细胞的一些功能[7]。本研究表明,随着囊液浓度的提高NK细胞活性下降,这与人感染泡球蚴后对NK细胞活性的抑制结果相同[8]。
NKG2D是NK细胞表面的活性受体,主要分布于人NK细胞和T细胞。NKG2D可识别肿瘤细胞表面的配体分子,进而活化免疫效应细胞,从而发挥对肿瘤细胞的杀伤功能[9]。随着研究深入,发现NK细胞可识别靶细胞表面压力诱导下所表达的配体而活化信号,这种活化可不受NK细胞抑制性信号的控制,并可克服抑制性受体的强势信号。这种被称为“压力诱导”的识别模式使NK细胞可及时识别危险信号[10,11]。NK细胞杀伤活性与NKG2D受体的表达呈正相关[12]。有研究报道,HIV病毒Nef蛋白可降低细胞表面NKG2DLs表达,而降低NKG2D受体介导的NK细胞的杀伤活性[13,14]。弓形体可提高NKG2D表达和NK细胞活性,导致怀孕女性或孕鼠妊娠异常。Nicod研究泡球蚴患者表明NK细胞活性显著降低;此后,又发现泡球蚴也可通过TGF-β的持续表达而抑制NKG2D受体的表达,从而利于多房棘球绦虫的感染。结果表明,随着囊液浓度的提高和时间的延迟,NK细胞活性下降,这与人感染泡球蚴后对NK细胞活性的抑制使得棘球蚴逃避宿主的免疫应答,而可在宿主体内长期存活。
4.结论
随着细粒棘球蚴囊液浓度的提高,NKG2D的表达水平逐渐降低,因此,NK细胞活性受到抑制,使得棘球蚴逃避宿主的免疫应答在宿主体内长期存活,从而揭示棘球蚴的致病机制,为抗棘球蚴的药物研制奠定基础。
[1] D. Carmena, L. P. Sanchez-Serrano, and I. Barbero-Martinez. Echinococcus granulosus infection in Spain[J]. Zoonoses and Public Health, 2008, 55(3): 156-165.
[2] Adrian Baz, Gustavo, Sylvia Dematteis, et al. Complexity and function of cytokine responses in experimental infection by echinococcus granulosus[J]. Immunobiology, 2006, 3(9): 3-8.
[3] Groh V, Rhinehart R, Randolph-Habecker J, et al. Costimulation of CD8 alphabeta T cells by NKG2D via
engagement by MIC induced on virus-infectedcells[J]. Nat Immunol, 2001, 2(3): 255-260.
[4] Nicod L, Bresson-Hadni S, Vuitton DA, et al. Specific cellular and humoral immune responses induced by different antigen preparations of Echinococcus multilocularis metacestodes in patients with alveolar echinococcosis[J]. Parasite, 1994, 1(3): 261-270.
[5] Riganò R, Profumo E, Di Felice G, et al. In vitro production of cytokines by peripheral blood mononuclear cells from hydatid patients[J]. Clin. Exp. Immunol., 1995, 99(3): 433-439.
[6] Li FR, Shi YE, Shi DZ, et al. The significance of lymphocyte variations in alveolar echinococcosis patients[J]. Chin. J. Zoonosis, 2003, 19(3): 91-94.
[7] 张琰,温浩.细粒棘球蚴患者淋巴细胞及细胞因子变化的初步观察[J].中国寄生虫学与寄生虫病杂志,2007,25(3):209-212.
[8] Zhang S, Hüe S, Sène D, et al. Expression of major histocompatibility complex class I chain-related molecule A, NKG2D, and transforminggrowth factor-beta in the liver of humans with alveolar echinococcosis: new actors in the tolerance to parasites?[J]. J. Infect. Dis., 2008, 197(9): 1341-1349.
[9] 臧怡雯,周易明,陈宗祐.NKG2D及其配体在肿瘤免疫中的研究进展[J].复旦学报,2011,38(4):367-371.
[10] Burgess SJ, Maasho K, Masilamani M, et al. The NKG2D receptor: immunobiology and clinical implications[J]. Immunol. Res., 2008, 40(1): 18-34.
[11] 魏海明,邬鹏,田志刚.NK细胞识别的新模式:压力诱导模式[J].中国肿瘤生物治疗杂志,2005,12(2):85-88.
[12] Xu X, Zhao M, Liu X, et al. Toxoplasma gondii Infection Regulates the Balance of Activating and Inhibitory Rece ptorson Decidual Natural Killer Cells[J]. PLoS One, 2013, 8(2): e55432.
[13] Norman JM, Mashiba M, McNamara LA, et al. The antiviral factor APOBEC3G enhances the recognition of HIV-infected primary T cells by natural killer cells[J]. Nat. Immunol., 2011, 12(10): 975-983.
[14] Cerboni C, Neri F, Casartelli N, et al. Human immunodeficiency virus 1 nef protein downmodulates the ligands of the activating receptor NKG2D and inhibits natural killer cell-mediated cytotoxicity[J]. J. Gen. Virol., 2007, 88(Pt 1): 242-250.
The Pilot Study on the Influence of NK Cell From Mouse Spleen Cells Treated with Echinococcus Granulosus Fluid in Vitro
YIN Shuanghong1, CHEN Xiaolin2, ZHANG Junbo3, WU Xiangwei2, CHEN Xueling2
( 1. Big health Institute, Tongren University, Tongren, Guizhou 554300, China; 2. Department of Immunology of medical school, Shihezi University, Shihezi, Xinjiang 832000, China; 3. College of Agroforestry Engineering and Planning, Tongren University, Tongren, Guizhou 554300, China )
To observe the influence of NK cells which separated from mouse spleen cells treated with Echinococcus granulosus fluid in vitro. The spleen cells of BABL/C mouse were co-cultured with different concentration Hydatid fluid. The activity and expression of NKG2D were detected by FCM; and the killing activity of spleen cells were also detected by LDH assay. The result shows that with the increasing of the concentration of Hydatid fluid, the expression of NKG2D and NK cell activity were decreased. The expression of NKG2D was decreased, thus reducing the activity of NK cells, which may facilitate Echinococcus granulosus to evade the host's immune.
hydatid fluid, echinococcus granulosus, NK cell
R392
A
1673-9639 (2016) 04-0001-04
(责任编辑 吴思展)(责任校对 毛 志)
2016-03-22
国家自然科学基金项目(No.81360453);贵州省科技合作计划项目(黔科合LH字[2015]7238号,黔科合LH字[2015]7236号)。
印双红(1986-),女,贵州铜仁人,硕士,研究方向:感染免疫。
陈雪玲(1972-),女,新疆塔城人,博士,教授、硕士生导师,研究方向:感染免疫。
*通讯作者:陈雪玲,E-mail:xuelingch@hotmail.com。
