2010-2011年小麦条锈菌群体的温度敏感性与毒性及遗传多样性的关系
2016-12-06廉志成刘太国陈万权
廉志成, 刘 博, 刘太国, 高 利, 陈万权
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
2010-2011年小麦条锈菌群体的温度敏感性与毒性及遗传多样性的关系
廉志成, 刘 博*, 刘太国, 高 利, 陈万权*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
为了明确小麦条锈菌毒性、遗传多样性以及温度敏感性三者之间的关系,本研究利用21个已知抗条锈病基因近等基因品系对2010-2011年生长季采自6个省市78株已知温度敏感性(ET50)的小麦条锈菌群体进行毒性鉴定,并利用AFLP技术对其进行遗传多样性分析。苗期毒性鉴定结果表明,不同省市小麦条锈菌群体的毒性基因多样性存在一定差异,甘肃菌株群体毒性多样性指数H值最高,为0.269 3,云南菌株群体最低,为0.150 4。遗传多样性结果显示,6省市小麦条锈菌群体遗传多样性指数H值范围在0.125 5~0.165 3之间,遗传一致度GI为0.964 7~0.987 2,遗传距离GD为0.012 9~0.036 0。三者的相关性分析表明,条锈菌群体毒性多样性与平均ET50显著负相关,与ET50变异系数正相关,而与遗传多样性没有显著的相关关系。
小麦条锈菌; 温度敏感性; 毒性多样性; 遗传多样性
小麦条锈病由条形柄锈菌小麦专化型(PucciniastriiformisWestend. f.sp.triticiEriks.,Pst)引起,是小麦生产上危害最为严重的世界性病害之一,其发生范围广,流行成灾频率高,已成为影响小麦生产可持续性发展的限制因素[1-2]。小麦条锈病是一种典型的低温病害,温度是控制该病害发生、扩展和流行的主要非生物因素,条锈菌越夏期间(7月中下旬和8月上旬)旬平均温度以不超过20℃为宜,超过23℃则完全不能越夏[3-4]。但是近年来的调查研究发现,在最热旬旬均温度超过23℃的年份,条锈菌也能够越夏[5]。Milus和Mboup等在对美国和法国小麦条锈菌群体对温度适应性的研究中发现,美国2000年后的新菌株和法国南部的菌株都对高温具有更强的适应性,推测这些高温耐受型菌株在小麦生长季节中持续侵染时间可能会更长,从而造成病害流行及更严重的产量损失[6-7]。本研究组张静秋等[8]以病害抑制中温度(ET50)为指标,对我国不同麦区、不同年代收集的小麦条锈菌群体的温度敏感性进行了测定。研究发现不同地区、不同年代的小麦条锈菌株对温度的耐受能力有较大差异,温度低敏感型菌株对高温表现出更强的适应性,具体表现为潜育期短、扩展速度快、产孢量高等方面。本研究将选取2010-2011年生长季温度敏感性已经测定的78份条锈菌株进行毒性和遗传多样性分析,进一步研究我国小麦条锈菌群体的温度敏感性与毒性、遗传多样性的关系,以期为全球气候变暖背景下小麦条锈病的长期预测和可持续防治提供依据,也为进一步了解温度因子对小麦条锈菌群体进化发展的作用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
2010-2011年小麦生长季从甘肃、湖北、青海、四川、西藏、云南等6个省份采集78株小麦条锈菌菌株(表1),所有菌株经单孢堆分离纯化、扩繁后由本实验室保存。所有菌株的温度敏感性均以病害抑制中温度(ET50)为指标进行了测定[8]。
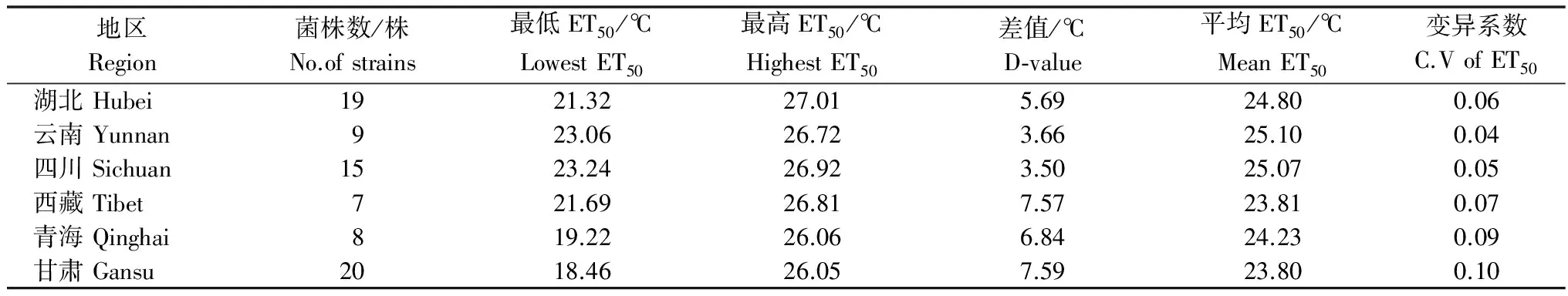
表1 供试小麦条锈菌菌株来源及病菌温度抑制中值(ET50)信息
1.1.2 供试小麦材料
毒性鉴定选用的21个已知抗条锈病基因近等基因品系,均引自澳大利亚悉尼大学植物育种研究所,由中国农业科学院植物保护研究所麦类病害课题组繁殖保存,抗病基因名称及其载体品系见表2。
1.2 菌株毒性鉴定
将鉴别寄主按顺序点播于36 cm×25 cm的塑料盆中,每穴6~10粒,于可控常温温室长至幼苗第1片叶充分展开后接种条锈菌。采用无毒轻量矿物油喷湿法将小麦条锈菌新鲜夏孢子均匀接种于鉴别寄主幼苗上,接种后幼苗于(9±1)℃黑暗保湿24 h,取出后置于低温温室中(温度13~16℃,湿度80%,光照强度10 000 lx,光照时间16 h/d)培育16 d,待对照品种叶片充分发病时开始调查,按0~9级标准[2]调查记载侵染型。
1.3 菌株遗传多样性分析
1.3.1 基因组DNA的提取
基因组DNA提取方法参照韩冰等[9]的CTAB/SDS法。
1.3.2 AFLP引物序列
本研究从12组筛选的引物中选取6组谱带清晰、多态性及重现性好的选择性引物来进行后期分析,分别为E12/M22、E12/M16、E22/M16、E20/M22、E22/M17和E20/M16(表3)。
68Ga-DOTA-TATE合成:用5.0 ml HCl(0.05 mol/L)淋洗68Ge/68Ga发生器,以5个1.5 ml EP管收集,选取68Ga浓度较高的第3管淋洗液用于标记;在EP管中加入47 μl HOAc-NaOAc缓冲液(1.25 mol/L),混匀后(pH值3.5~4.5),加入50 μl DOTA-TATE,置于100 ℃恒温金属浴加热10 min。然后取出反应管室温冷却5 min,用薄层色谱分析法测定放化纯。过无菌滤膜注入无菌密封瓶中,得到注射液。
1.3.3 AFLP分析
(1)酶切-连接 对所选样品采用EcoRⅠ/MseⅠ双酶切,酶切与连接反应同步进行。酶切与连接体系(20 μL)为:10×AFLP digest-ligation buffer 2 μL、AFLP digest-ligation enzyme mix 1.8 μL、EcoRI adaptor 1 μL(10 μmol/L)、MseI adaptor 1 μL(10 μmol/L)、模板DNA 5 μL。酶切-连接反应条件为25℃ 5 h,1%琼脂糖电泳检测。
(2)预扩增反应体系(20 μL)为:2×PCR mix 10 μL、E00 1 μL(20 μmol/L);M00 1 μL(20 μmol/L)、酶切-连接模板DNA 4 μL。PCR扩增程序为:94℃ 3 min;94℃ 30 s,50℃ 30 s,72℃ 1 min,30个循环。
(3)选择性扩增反应体系(20 μL):2×PCR mix 10 μL、E primer 1 μL(20 μmol/L)、M primer 1 μL(20 μmol/L)、模板DNA 5 μL(预扩产物稀释20倍)。PCR扩增程序为:95℃ 5 min; 95℃ 35 s,65℃ 35 s(每循环降低0.7℃),72℃ 1 min,12个循环; 94℃ 30 s,56℃ 30 s,72℃ 1 min,23个循环。将甲酰胺与分子量内标按100∶1的体积比混匀后,取15 μL加入上样板中,再加入1 μL稀释10倍的PCR产物。然后使用3730XL测序仪进行毛细管电泳。
1.4 数据统计分析
毒性鉴定中,根据供试菌系在鉴别寄主上的反应,侵染型0~5(抗病,R)和6~9(感病,S)分别记作“0”和“1”,构建毒性“0-1”矩阵。AFLP分析中参照毛细管电泳图谱,所有材料在相同迁移位置上(相同分子量片段)AFLP谱带的有和无分别记作“1”和 “0”,构建遗传多样性“0-1”矩阵。
利用Popgene 1.32软件对毒性和遗传多样性“0-1”矩阵分别进行分析,利用MEGA软件构建UPGMA聚类图。利用SAS 9.1.3软件对小麦条锈菌群体的温度敏感性与病菌群体遗传多样性、毒性多样性和毒性基因数目进行相关性分析。

表3 AFLP引物序列
2 结果与分析
从Nei’s基因多样性指数(H值)、Shannon指数(I值)及多态性位点数目(P)来看,甘肃群体毒性多样性水平最高,云南群体最低。云南的平均毒性基因数目最高为15.1,西藏最低为11.6(表4)。UPGMA聚类分析表明(图1),6省的条锈菌群体可分为3大组,甘肃、四川和青海为一组,云南与西藏为一组,湖北为一组。
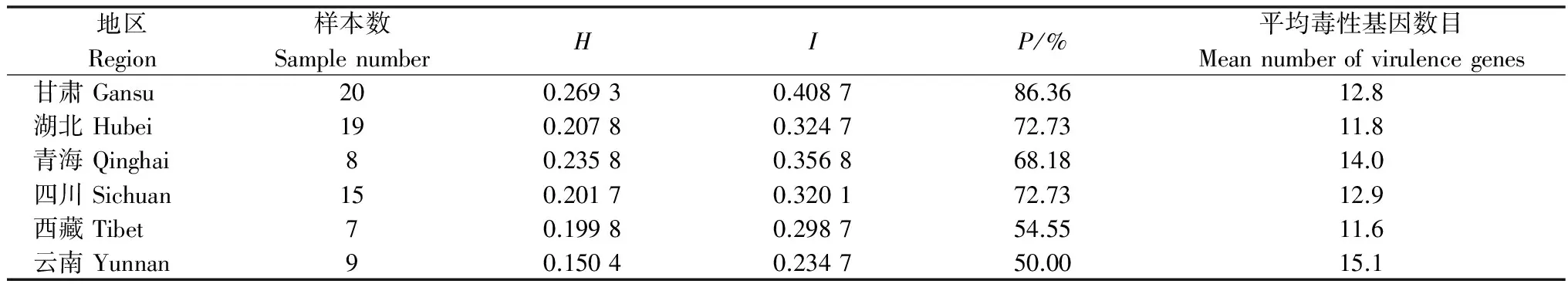
表4 6省小麦条锈菌毒性多样性和平均毒性基因数目1)
1)H: Nei’s基因多样性指数;I: Shannon信息指数;P:多态位点百分率。
H=Nei’s gene diversity;I= Shannon’s information index;P=Percentage of polymorphic loci.
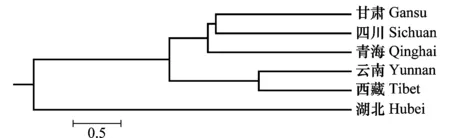
图1 基于毒性特征的小麦条锈菌聚类图Fig.1 Dendrogram of Puccinia striiformis based on virulent characters
2.2 小麦条锈菌群体的遗传多样性分析
在AFLP毛细管电泳中,筛选到的6对引物扩增出的总条带数为824条,其中多态性条带为645条,多态率为78.28%。由表5可知,6省的小麦条锈菌群体Nei’s基因多样性指数H值范围在0.125 5~0.165 3之间;Shannon指数在0.187 4~0.258 2之间,其中,青海群体的遗传多样性水平最低,四川群体的遗传多样性水平最高。由表6可知,6省(市)的小麦条锈菌群体遗传一致度GI为0.964 7~0.987 2,遗传距离GD为0.012 9~0.036 0,说明小麦条锈菌群体间的相似程度较高,遗传差异较小,其中青海和甘肃群体之间的相似性(GI=0.987 2)最高,遗传距离(GD=0.012 9)最小;云南和青海群体间的相似性(GI=0.964 7)最低,遗传距离(GD=0.036 0)最大。
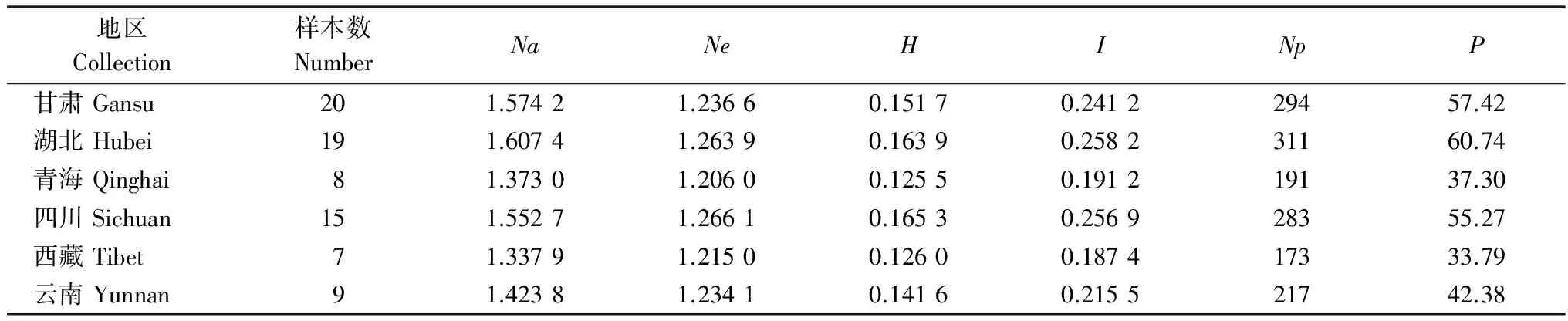
表5 不同省小麦条锈菌群体遗传多样性分析1)
1)Na:观察等位基因数;Ne:有效等位基因数;H: Nei’s基因多样性指数;I: Shannon信息指数;Np:多态性位点数;P:多态位点百分率。
Na: Observed number of alleles;Ne: Effective number of alleles;H: Nei’s gene diversity;I: Shannon’s information index;Np: Number of polymorphic loci;P: Percentage of polymorphic loci.
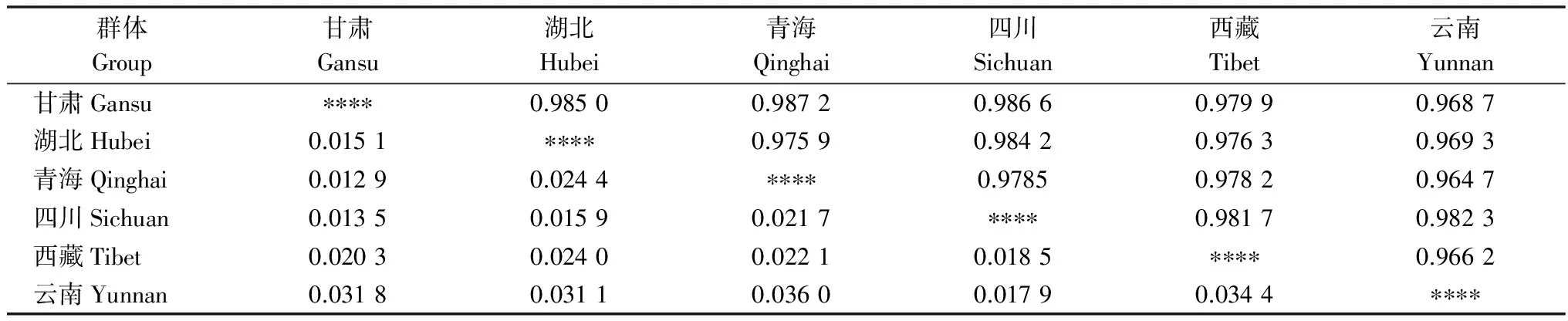
表6 遗传多样性中Nei’s无偏遗传距离和遗传一致度1)
1) 对角线上为遗传一致度,对角线下为遗传距离。
Genetic identities are above the diagonal, and genetic distances are below the diagonal.
对6个不同省78份条锈菌进行AFLP聚类分析,结果(图2)表明,6个省的菌株可以分为4个群体。甘肃和青海群体、湖北和四川群体为一组,西藏和云南各为一组。
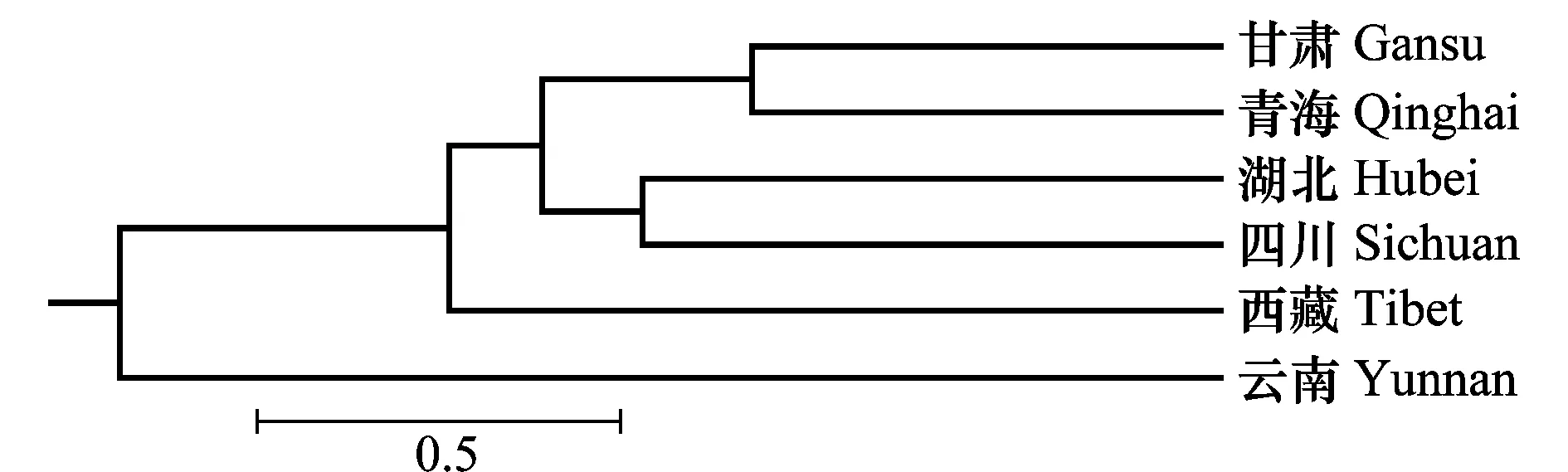
图2 基于遗传相似系数的小麦条锈菌AFLP聚类图Fig.2 AFLP dendrogram of Puccinia striiformis based on similarity coefficients
2.3 小麦条锈菌群体对温度敏感性、毒性和遗传多样性之间的相关性分析
利用SAS软件对采自6省的小麦条锈菌群体对温度的平均ET50、毒性多样性、平均毒性基因数目及遗传多样性进行相关性分析(表7),结果表明小麦条锈菌群体平均ET50值与毒性多样性存在显著的负相关关系(r=-0.871 2,p=0.023 8)、ET50变异系数与毒性多样性极显著相关(r=0.928 9,p=0.007 4),而与平均毒性基因数目(r=-0.224 9,p=0.668 3)及遗传多样性(r=-0.329 6,p=0.523 5)之间不存在显著的相关关系。小麦条锈菌毒性多样性与遗传多样性(r=0.022 0,p=0.967 0)也均没有显著的相关关系。
3 讨论
根据达尔文的进化论,物种要生存和繁衍,必须产生遗传分化形成不同的适应性表型来适应不同的自然环境,否则就会被淘汰[10]。病原菌群体的发展进化与寄主和环境均有关,即病菌群体不但受到寄主品种的选择产生适应性,同时非生物因子温度也在病菌的适应性进化中起重要作用[11]。如今在全球变暖的环境形势下,了解小麦条锈菌温度适应性特点和规律,对于病害的防治和生态环境的保护都具有重大意义。
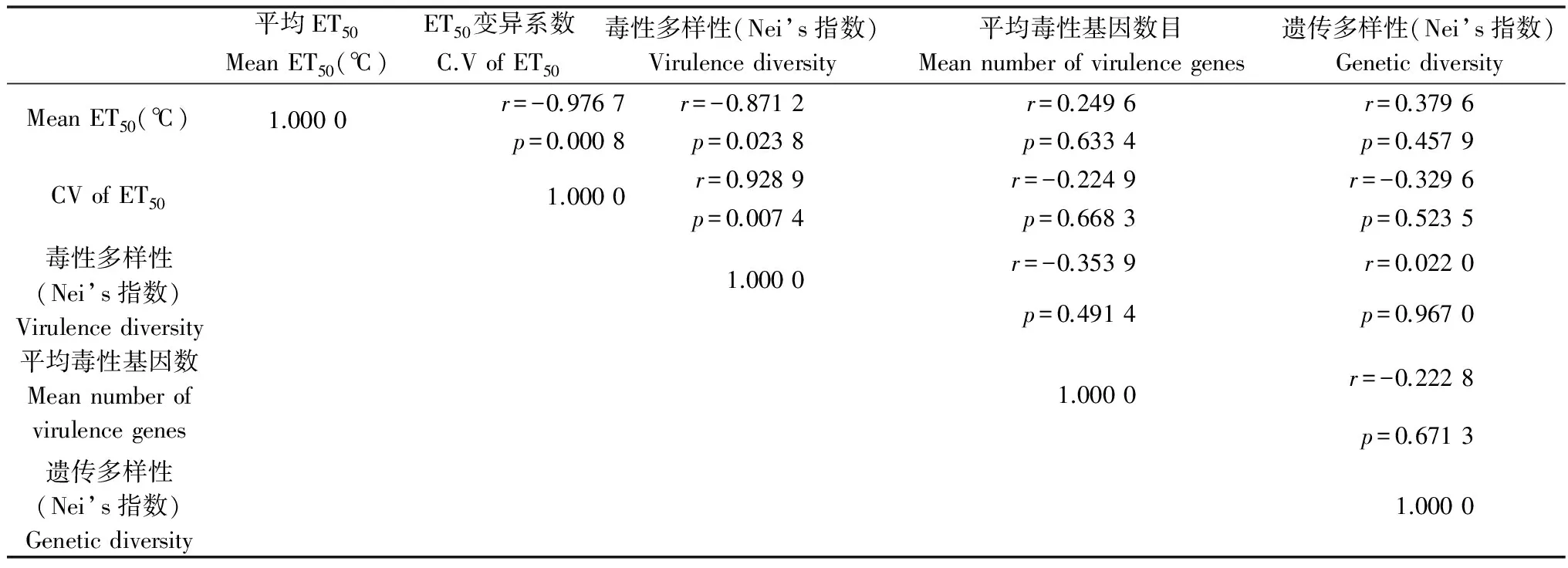
表7 小麦条锈菌温度敏感性与毒性及遗传多样性的关系
本研究中选用的2010-2011年小麦条锈菌菌株,其标样采集地区的年平均气温从高到低依次为长江中下游麦区(湖北)16.4℃、西南麦区(四川、云南、西藏)15.08℃、西北麦区(甘肃、青海)8.46℃,与各麦区小麦条锈菌群体平均ET50值排序基本一致,这表明自然条件下不同麦区小麦条锈菌群体对温度的耐受能力有所不同,总体趋势是纬度海拔越低,气候越温暖,病菌耐高温能力越强。虽然不同麦区的初始菌源可能来自相同越夏区,但通过温暖地区高温筛选或胁迫使得小麦条锈菌群体的耐高温能力增强[8]。但由此带来的代价则为该地区群体毒性多样性的下降。研究中根据我们对温度敏感性与毒性、遗传多样性的相关性分析的确发现,小麦条锈菌群体平均ET50与毒性多样性呈显著的负相关关系(r=-0.871 2,p=0.023 8),ET50变异系数与毒性多样性极显著相关(r=0.928 9,p=0.007 4),即对温度耐受性越强的菌株群体其毒性多样性越低,群体内菌株ET50离散程度越高其毒性多样性越高。而温度敏感性与遗传多样性没有显著的相关关系,这与史倩倩[12]对小麦白粉病温度敏感性研究的结果基本一致。Mboup等[7]等对法国小麦条锈菌群体的研究结果表明,对高温具有较强适应能力的南方菌株群体其携带的毒性基因数目要少于北方菌株,但是本研究发现菌株ET50与毒性基因数目没有显著的相关关系。本研究中,由于原始标样采自2010-2011年,导致有些原始标样丧失活性,从而使试验菌株群体不够大,在今后的研究中需要扩大样本量,从而使数据更可靠。
[1] Roelfs A P, Singh R P, Saari E E.Rust diseases of wheat: Concepts and methods of disease management[M]. Mexico, DF: CIMMTY, 1992.
[2] 李振岐, 曾士迈. 中国小麦锈病[M]: 北京:中国农业出版社, 2002.
[3] 曾士迈. 小麦銹病的大区流行规律和流行区系[J]. 植物保护, 1963(1): 10-13.
[4] 曾士迈. 小麦条锈病越夏过程的模拟研究[J]. 植物病理学报, 2003, 33(3): 267-278.
[5] 王新俊. 平凉市小麦条锈病越夏菌源分布区域精准勘测及主要影响因子研究[J]. 植物保护, 2009, 35(6): 130-134.
[6] Milus E A, Kristensen K, Hovmøller M S.Evidence for increased aggressiveness in a recent widespread strain ofPucciniastriiformisf. sp.triticicausing stripe rust of wheat [J]. Phytopathology, 2009, 99: 89-94.
[7] Mboup M, Bahri B, Leconte M, et al. Genetic structure and local adaptation of European wheat yellow rust populations: the role of temperature-specific adaptation[J]. Evolutionary Applications, 2012, 5: 341-352.
[8] 张静秋. 小麦条锈菌群体温度敏感性及寄生适合度研究[D]. 北京:中国农业科学院, 2012.
[9] 韩冰, 蔺瑞明, 曹远银, 等. 小麦条锈菌DNA提取方法的比较研究[J]. 中国农学通报, 2006, 22(4): 81-83.
[10]Day J P, Wattier R A M, Shaw D S, et al. Phenotypic and genotypic diversity inPhytophthorainfestanson potato in Great Britain, 1995-98 [J]. Plant Pathology, 2004, 53(3): 303-315.
[11]Santini A, Ghelardini L.Plant pathogen evolution and climate change [J]. CAB Reviews, 2015, 35(10): 1-8.
[12]史倩倩. 小麦白粉病菌群体对三唑酮和温度的敏感性与毒性及遗传多样性的关系[D]. 北京:中国农业科学院, 2014.
(责任编辑:田 喆)
Associations among temperature sensitivity, virulence and genetic diversity ofPucciniastriiformisf.sp.triticiduring 2010-2011
Lian Zhicheng, Liu Bo, Liu Taiguo, Gao Li, Chen Wanquan
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,Chinese Academy of Agricultural Sciences, Beijing 100193, China)
To define the relationships among virulence, genetic diversity and temperature sensitivity ofPucciniastriiformisf.sp.triticiisolates, 78 isolates collected from 6 provinces during growing seasons in 2010-2011 with known ET50values were analyzed for virulence and genetic diversity by using 21 differential cultivars and AFLP technique, respectively. The result of virulence diversity at seedling stage indicated that the Nei’s gene diversity (H) of virulence in Gansu was the highest (0.269 3),and the lowest was in Yunnan (0.150 4). The genetic diversity result showed that the Nei’s gene diversity (H) was between 0.125 5 and 0.165 3, the genetic identity (GI) was between 0.964 7 and 0.987 2, and the genetic distance (GD) was between 0.012 9 and 0.036 0. The correlation analysis showed that virulence diversity was significantly and negatively correlated with the average value of ET50, and positively correlated with the coefficient of ET50variation, but not significantly correlated with genetic diversity.
Pucciniastriiformisf.sp.tritici; temperature sensitivity; virulence diversity; genetic diversity
2015-11-19
2016-02-25
国家“973”计划(2013CB127704); 国家科技支撑计划(2012BAD19B04); 国家转基因生物新品种培育重大专项(2014ZX0801101B); 国家自然科学基金(31100110);国家小麦产业技术体系岗位专家专项经费(CARS-03-04B); 旱区作物逆境生物学国家重点实验室开放课题(CSBAA2016011)
S 435.121
A
10.3969/j.issn.0529-1542.2016.06.010
* 通信作者 E-mail:bliu@ippcaas.cn;wqchen@ippcaas.cn
