腱鞘巨细胞瘤致低血磷性骨软化症1例
2016-12-06胡伟龙马镇川季卫锋毛矛马霜霜
胡伟龙,马镇川,季卫锋,毛矛,马霜霜
病例报告
腱鞘巨细胞瘤致低血磷性骨软化症1例
胡伟龙1,马镇川2,季卫锋2,毛矛1,马霜霜1
低磷血症;骨软化症;巨细胞瘤
1 临床资料
患者男性,56岁。因“反复腰痛3年余,加重伴乏力半年”入院。患者无明显诱因下出现腰部疼痛伴腰部下坠感,未予重视及治疗。疼痛逐渐加重,随后全身多处关节亦逐渐出现疼痛乏力,局部无明显红肿表现,伴有活动受限,晨起关节僵硬不明显。半年前症状加重,严重影响生活质量。既往曾诊断为“T8~12椎体压缩性骨折,骨质疏松症”,行T11~12椎体成形术,口服骨化三醇及钙剂抗骨质疏松治疗,症状无明显改善。体质尚可,家族中无类似病史,发病以来饮食正常,无发热、偏食、腹泻及明显消瘦等症状,无毒物及放射性物质接触史。体格检查:蹒跚步态,淋巴结无肿大,胸廓对称,胸腹部无明显阳性体征。左手示指中节掌侧可见一约2 cm×1.5 cm大小椭圆形质软肿物,边界尚清,固定,无明显压痛。脊柱轻度侧弯,T8~12椎体棘突压痛(+),叩击痛(+)。髋、膝、肩、腕关节等全身多处均压痛明显,活动受限,双下肢无水肿。肌肉无明显萎缩,肌力IV级,生理反射存,病理征阴性。骨密度检查,正位脊柱0.933 g/m2,左侧股骨颈0.978 g/m2。X线示下胸椎及上腰椎椎体变形。腰椎MR检查示T8~12椎体压缩性骨折,T12为著,T4椎体血管瘤。全身骨骼99mTc-MDP显像示双侧肋骨、脊柱胸腰段、左侧股骨头、双侧膝关节、踝关节等多部位骨骼放射性分布不均匀,局部见放射性异常浓聚灶。全身多发性骨代谢异常增强,恶性肿瘤骨转移优先考虑(图1)。PET-CT检查示骨骼骨质密度稍低,以脊柱椎体及双侧髂骨较明显,骨小梁略稀疏,髂骨局部多发小圆型低密度影,PDG代谢不均匀。骨髓穿刺活检示红系增生活跃占29.0%,以中晚幼红细胞增生为主,形态基本正常,淋巴细胞占14.5%,形态正常,全片骨髓瘤细胞可见约占3%。血常规、肝肾功能、血气分析、血钾、甲状旁腺激素、抗O、类风湿因子、肿瘤类(男性)、ESR未见明显异常,免疫固定电泳、轻链、降钙素检测正常,人类白细胞抗原B27阴性。数次查血磷分别为0.48 mmol/L、0.34 mmol/L、0.43mmol/L、0.47 mmol/L、0.27 mmol/L(正常值0.81~1.65 mmol/ L)。碱性磷酸酶分别为213 U/L、250 U/L、377 U/L、567 U/L、495 U/L(正常值45~125 U/L)。24 h尿磷12.8 mmol/L(正常22~48 mmol/L)。于臂丛神经阻滞麻醉下行左示指中节肿瘤切除术,术中见示指中节一约2 cm×1.5 cm×1.5 cm大小肿物(图3)。切除并送病理检查,结果示左手示指腱鞘巨细胞瘤。免疫组化结果(B)P53少数(+),ki-67(3%+),CD68灶(+),CD163(+),S-100(-),CD34(-),SWA(-),Desmin(-),CK广谱(-)(图2)。最终诊断为肿瘤性低血磷骨软化症。术后2周内血磷明显回升,分别为0.80mmol/L、0.85mmol/L、0.79mmol/L、1.10 mmol/ L。术后一个半月随访,全身多处骨骼肌肉疼痛乏力症状亦较术前显著缓解。
2 讨论
低血磷性骨软化症是由低磷血症和活性维生素D产生不足造成的,以尿磷排泄增多、低1.25-(OH) 2-D3水平、骨骼矿化障碍为主要特点的罕见代谢性骨病。该病的原因除了有遗传性、散发性(磷酸盐性多尿症)、McCune Albright综合征之外,治疗I型病毒性肝炎的药物阿德福韦酯所致的低血磷性骨软化症近来也有报道,肿瘤相关性的低血磷骨软化症(tumor-induced osteomalacia,TIO)亦有相关报道[1]。TIO又称瘤源性骨软化病,是一种临床极为少见的副瘤综合征,是由肿瘤引起肾脏排泄磷增加所致的获得性低磷性骨软化症[2],1947年由McCance[3]首次提出,至今全世界报道300余例,而我国最早报道该病的是北京协和医院张孝骞[4]。起病主要临床表现为缓慢进展性全身多发骨骼疼痛伴活动障碍、疲劳、肌无力、假性骨折、应力性骨折等,实验室检查多显示低血磷、高尿磷、血清碱性磷酸酶升高,X线检查可见骨量减少、骨密度降低,骨小梁模糊,有时可见假性骨折[5]。TIO因临床少见,起病隐匿,症状发展缓慢,与一般低磷软骨症相似,但单纯补磷血磷难以恢复正常,容易被误诊为骨质疏松、脊柱关节病、多发性骨髓瘤等相关疾病,甚至行手术治疗,但治疗效果差,甚至会加重病情。
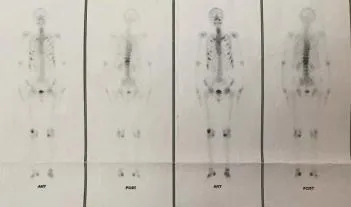
图1 全身99m Tc-MDP扫描示全身骨代谢异常增强

图2 病理检查结果为“左手示指”腱鞘巨细胞瘤
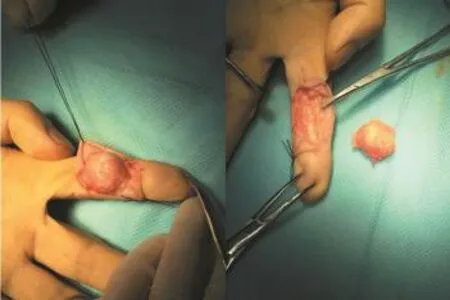
图3 术中所见左示指腱鞘巨细胞瘤,约2 cm×1.5 cm×1.5 cm大小
引起TIO的肿瘤多来源于间叶组织,体积较小且生长缓慢[6],常位于软组织或骨内,位置隐匿。肿瘤多为良性,约10%为恶性,恶性者多见于前列腺癌,部分肿瘤可发生远处转移[7]。关于肿瘤相关性低磷软骨病的发病机制尚未完全明确,目前有研究表明,某些间叶组织肿瘤细胞可以自主分泌一种或几种利磷因子,常见的是纤维生长因子23(FibroblastGrowth Factor 23,FGF23)。该因子可以促进肾小管对磷的排泄,降低血磷浓度。此外,FGF23增多还可抑制1α羟化酶的生成及活性,导致活性维生素D生成不足,也会导致血磷水平降低[8],导致低血磷、高尿磷,进而引起骨骼矿化障碍和骨质软化性改变。
本病多好发于成年人,多有数年骨骼肌肉慢性疼痛伴全身乏力病史,往往开始起病于腰骶部及下肢等负重部位,病情逐渐加重可出现骨折、假性骨折、骨骼畸形及活动受限。本例即由腰背部起病,可见多节椎体病变伴双膝活动受限。实验室检查通常表现为低血磷、高尿磷、ALP轻度或中度增高,活性维生素D生成不足,血钙多在正常范围内。骨密度测定常提示骨量减少,中度或重度骨质疏松。典型X线表现为骨密度降低、骨小梁模糊,骨盆及椎体变形,大多可见骨折或假骨折形成[9]。对于无低磷血软骨症家族病史,非药物引起而出现上述临床表现的患者,应高度怀疑为TIO。明确肿瘤的位置是本病诊断的关键点,需仔细寻找肿瘤病灶,发生于软组织及体表的肿瘤通常经过详细体格检查可发现,分段静脉采血测定FGF23水平、99mTc生长抑素受体显像、PET-CT扫描检查对于肿瘤的定位诊断具有重要意义[7]。结合B超、CT、MR等,更有助于肿瘤定位。在最近的一些研究中,Gallium-DOTATATE PET相对于FFGD PET/CT是一种比较理想且表现较好的定位肿瘤的检查方法,对于奥曲肽SPECT/CT检查未能检测到肿瘤的患者是一种更有前瞻性的诊断工具[10]。对于高度怀疑TIO者,在一种影像学检查未发现病灶时,需进行多种影像学检查,以提高诊断率。
对于明确诊断为TIO的患者,确定肿瘤病灶后完整切除肿瘤是最佳选择,预后良好。磷酸盐和维生素D代谢异常状况通常可在手术几天后消失,临床症状几周内缓解。外科手术治疗后,应考虑促进骨再生的物理疗法[11]。由于术后仍存在复发风险,即便是在被诊断为良性肿瘤的患者中,术后也应定期随访,监测血磷变化。巴建明等[12]报道12例肿瘤性骨软化症患者诊治及随访情况,其中9例1次手术治愈,1例2次手术后治愈,2例行3次手术后仍有1例血磷未恢复正常,说明手术切除肿瘤病灶可有效治疗本病。对于不能切除肿瘤或不完全切除肿瘤的患者,长期补充中性磷及活性维生素D化合物是必需的[11],同时后续放疗是避免复发和转移的一个重要选择。
[1]Bergwitz C,Collins MT,Kamath RS,et al.Case 33-2011:A 56-year-old man with hypophosphatemia[J].N Engl JMed,2011, 365(17):1625-1635.
[2]Woo VL,Landesberg R,Imel EA,et al.Phosphaturic mesenchy⁃mal tumor,mixed connective tissue variant,of the mandible:re⁃port of a case and review of the literature[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2009,108(6):925-932.
[3]Mc Cance RA.Osteomalacia with Looser's nodes(Milkman's syn⁃drome)due to a raised resistance to vitamin D acquired about the age of 15 years[J].Q JMed,1947,16(1):33-46.
[4]张孝骞,朱预,刘彤华,等.间叶瘤合并抗维生素D的低血磷骨软化病一例报告[J].中华医学杂志,1980,(3):150-152.
[5]柯耀华,章振林,张惠箴,等.肿瘤性骨软化症二例并文献复习[J].中华内分泌杂志,2009,25(4):465-467.
[6]Nusier MK,Radaideh AR,Jaradat D,et al.Resolution of severe oncogenic hypophosphatemic osteomalacia after resection of a deep⁃ly located soft-tissue tumor[J].Curr Oncol,2009,16(5):87-90.
[7]ChongWH,Molinolo AA,Chen CC,et al.Tumor-induced osteoma⁃lacia[J].Endocr Relat Cancer,2011,18(3):R53-R77.
[8]Berndt TJ,Schiavi S,Kumar R.“Phosphatonins”and the regula⁃tion of phosphorus homeostasis[J].Am J Physiol Renal Physiol, 2005,289(6):F1170-F1182.
[9]Zura RD,Minasi JS,Kahler DM.Tumor-induced osteomalacia and symptomatic looser zones secondary to mesenchymal chondrosarco⁃ma[J].JSurg Oncol,1999,71(1):58-62.
[10]Agrawal K,Bhadada S,Mittal BR,et al.Comparison of 18F-FDG and 68Ga DOTATATE PET/CT in localization of tumor causing on⁃cogenic osteomalacia[J].Clin Nucl Med,2015,40(1):e6-e10.
[11]Hautmann AH,Hautmann MG,Kölbl O,et al.Tumor-induced os⁃teomalacia:an up-to-date review[J].Curr Rheumatol Rep,2015,17 (6):1-6.
[12]巴建明,桑艳红,陆菊明,等.12例肿瘤性骨软化症的临床诊治及术后随访[J].中华内分泌代谢杂志,2011,27(1):19-23.
(收稿:2016-06-26修回:2016-08-06)
(责任编辑 韩慧)
R730.262
A
1007-6948(2016)05-0504-03
10.3969/j.issn.1007-6948.2016.05.027
1.浙江中医药大学第一临床学院(杭州310053)
2.浙江中医药大学附属第一医院骨伤科(杭州310000)
季卫锋,E-mail:jiweifeng1230@163.com
