不同极性梨多酚抗氧化性能的研究
2016-12-05张东京高贵珍张兴桃
张东京 高贵珍 张兴桃
(宿州学院,安徽 宿州 234000)
不同极性梨多酚抗氧化性能的研究
张东京 高贵珍 张兴桃
(宿州学院,安徽 宿州 234000)
按萃取溶剂的极性不同对梨多酚进行萃取分离,得到不同极性梨多酚萃取物。通过比较抗氧化值的大小,评价不同极性梨多酚的抗氧化性能。结果表明:第15天时加入水层梨多酚的大豆油样品,过氧化值为9.43 mmol/kg,抑制率为41.86%;加入正丁醇层梨多酚过氧化值为10.19 mmol/kg,抑制率为37.17%;加入乙酸乙酯层梨多酚过氧化值为11.03 mmol/kg,抑制率为34.99%。可以得出不同极性梨多酚的抗氧化性能及清除自由基能力差异显著,水层梨多酚活性最强,正丁醇层梨多酚次之,乙酸乙酯层梨多酚活性最弱,即梨多酚的抗氧化性能随着浸提溶剂极性的增强而增强。
梨;多酚;抗氧化性;水;正丁醇;乙酸乙酯
梨中含脂肪、蛋白质、粗纤维、糖、钙、铁、磷、多种维生素和多酚类物质,具有养阴清热,降血压的功效。梨是“百果之宗”,因其味道酸甜、柔嫩多汁,故又称之为“天然矿泉水”[1]。梨多酚是从梨中提取出来的一种纯天然抗氧化剂,其主要成分为黄酮类化合物。近几年,大量的研究[2-4]显示梨多酚具有多种药理功能,如抑菌、抗氧化、抗动脉硬化、生发乌发等。有机溶剂提取法是利用乙醇等易挥发的有机溶剂提取物质原料,具有重复性强等优点[5]。
目前对于梨多酚的研究多集中在提取和抗氧化活性评价等方面。孙红艳等[6]利用超声波辅助法提取刺梨多酚,发现得到的梨多酚对大肠杆菌和金黄色葡萄球菌均具有抑菌性能。徐芹等[7]对砀山梨中的多酚氧化酶进行了研究,研究得出砀山梨多酚氧化酶的最佳条件分别为pH值4.5和温度34 ℃;该酶促褐变反应动力学符合米氏方程,其反应的速率可达178.57 U/min。杨光宇等[8]研究赵州雪花梨中多酚的酶促褐变,得出该反应体系中,选择的底物是邻苯二酚,雪花梨中多酚氧化酶的最佳条件分别为pH值7.0和温度25 ℃。但关于不同极性梨多酚抗氧化性能的比较研究目前未见报道。本研究拟通过采取有机溶剂提取梨总多酚,测定不同极性梨多酚的总多酚含量,利用不同极性梨多酚对氢氧根自由基清除能力进行试验,研究不同极性梨多酚清除自由基的差异,旨在为工业化提取安全高效的天然抗氧化剂梨多酚提供一定的理论依据。
1 材料与方法
1.1 试验材料与设备
砀山酥梨:产自安徽省宿州市砀山县;
乙醇、三氯化铁、正丁醇、水杨酸、没食子酸、碘化钾、乙酸乙酯、硫代硫酸钠、碳酸钠、冰醋酸、淀粉:分析纯;
大豆油:福临门一级大豆油;
数控超声波清洗器:KQ-250DB型,昆山市超声仪器有限公司;
粉碎机:HL-20型,上海海菱电器有限公司;
可见分光光度仪:722G型,上海仪电分析仪器有限公司;
电子天平:FA2104型,上海超平科学仪器有限公司;
电热鼓风干燥箱:101型,龙口市电炉制造厂。
1.2 不同极性梨多酚的提取及分离
榨汁,称取已榨汁(含渣,不去皮)的样品230 g,按料液比1∶3(g/mL)添加浓度为70%的乙醇,然后放置在 90 ℃水浴回流情况下提取30 min,然后过滤,取滤液。梨渣再参照上面过程重复2次,聚集3次提取滤液,将滤液在50 ℃下真空浓缩,向浓缩液中添加2倍量的乙酸乙酯,搅拌10 min,于分液漏斗中分层,取上层液,重复3次,合并3次提取液,分别为乙酸乙酯层萃取物和水层萃取物,在水层中再添加2倍体积的正丁醇,摇匀10 min后,于分液漏斗中分层,取上层液,重复3次,合并3次提取液,得到正丁醇层萃取物和水层萃取物[9],将3种萃取物分别进行干燥,后取干燥产物用水溶解得到不同极性的梨多酚溶液。
1.3 酥梨中总多酚含量的计算
1.3.1 标准曲线的制作 分别向刻度试管中转移1.0 mL不同梯度的没食子酸溶液,再分别转移0.3 mL福林试剂,振荡,存放5 min,转移1.5 mL饱和碳酸钠,定容至10 mL,振摇摇匀,静置30 min,以空白作参照对比,测定在波长760 nm处的吸光值[10-11]。
1.3.2 酥梨中总多酚含量的测定 分别取不同极性的梨多酚萃取液1.0 mL放于刻度试管中,再转移0.3 mL福林试剂,混匀,存放5 min,转移1.5 mL饱和碳酸钠,定容至10 mL,振摇摇匀,静置30 min,测定在波长760 nm处的吸光值[12]。依据标准曲线回归方程和所测得的吸光值,计算试验样品中的总多酚含量。
1.4 不同极性梨多酚的抗氧化能力测定
当大豆油储存一段时间后,会有过氧化物的生成,该过氧化物可以和具有一定还原性的碘化钾发生氧化还原作用而生成碘,采用淀粉指示剂,用硫代硫酸钠滴定,通过滴定反应中所消耗的硫代硫酸钠的量来换算植物油的过氧化值,从而测定出梨多酚的抗氧化能力[13]。
分别取相同体积的乙酸乙酯层梨多酚、正丁醇层梨多酚、水层梨多酚,加入到棕色瓶中,然后向棕色瓶中加入20 g大豆油,充分搅拌混匀后放于(60±2) ℃的恒温培养箱中,间隔6 h振荡摇匀,每3 d取样1次,测其过氧化值(POV)[14],过氧化值(POV)的计算公式:
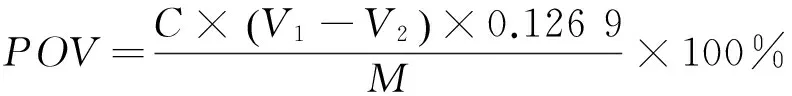
(1)
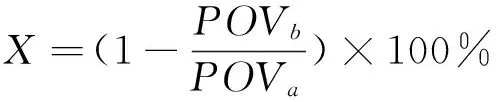
(2)
式中:
POV——抗氧化值,mmol/kg;
C——硫代硫酸钠标准溶液的浓度,mol/L;
V1——油样消耗硫代硫酸钠溶液的体积,mL;
V2——空白消耗硫代硫酸钠标准溶液的体积,mL;
M——样品的质量,g;
X——抑制率,%;
POVa——空白抗氧化值,mmol/kg;
POVb——油样抗氧化值,mmol/kg。
1.5 不同极性梨多酚对胡萝卜素的护色效果测定
β-胡萝卜素为胡萝卜汁中的主要色素物质,其波长在446 nm处有最大吸收峰。通过向胡萝卜汁中加入不同极性的梨多酚,测定其在446 nm处的吸光度,来比较不同极性梨多酚对胡萝卜汁护色效果的差异。
分别取相同体积的乙酸乙酯层梨多酚、正丁醇层梨多酚、水层梨多酚放于刻度试管中,然后向刻度试管中加入6 mL胡萝卜汁,摇匀,光照室温下放置3 h,测定在波长446 nm处的吸光值。
1.6 不同极性梨多酚对氢氧自由基清除作用
本研究通过不同极性梨多酚对氢氧自由基的清除率,来验证梨多酚对氢氧自由基有清除效果,并对比它们之间的差异[15]。
氢氧自由基具有很高的反应活性,在反应体系中加入水杨酸,可以有效地结合氢氧自由基产生有色物质,这种有色物质在510 nm处有强吸收。而加入具有清除氢氧自由基能力的被测物质时,由于被测物质与水杨酸竞争氢氧自由基,从而使有色物质的生成量减少。固定反应时间,通过与没有氢氧自由基的空白组比较,便可以测出试验组清除氢氧自由基的效果[16]。
不同极性梨多酚清除自由基试验步骤:在清洗干净的试管中加入5 mL蒸馏水,30 μL 0.02 mol/L的FeSO4,100 μL 0.01 mol/L的水杨酸,再加入25 μL 0.02 mol/L的双氧水,于37 ℃的水浴中反应30 min后,测定其在510 nm处的吸光度,即为空白值。同上试验,在清洗干净的试管中分别加入不同量的样品后,接着再加入0.02 mol/L的双氧水25 μL,于37 ℃的水浴中反应35 min后,测定在510 nm处的吸光度[17]。
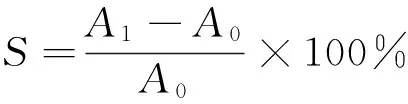
(3)
式中:
S——自由基的清除率,%;
A1——样品吸光度;
A0——空白对照的吸光度。
1.7 数据分析方法与软件
数据分析运用 SPSS 13.0 软件,采用方差分析进行分析处理,各处理组间的差异比较用 LSD 法,P<0.05有统计学意义。运用 Microsoft Excel 2010 软件绘制统计图。
2 结果与讨论
2.1 酥梨中不同极性梨多酚的含量
以没食子酸的质量浓度为横坐标,对应的吸光度为纵坐标建立标准曲线,见图1。各萃取液极性的顺序为水>正丁醇>乙酸乙酯,依据相似相溶,酥梨的提取液经过不同极性萃取剂作用,可以萃取得到不同极性的梨多酚。经测定计算,各萃取液中梨多酚含量见表1。
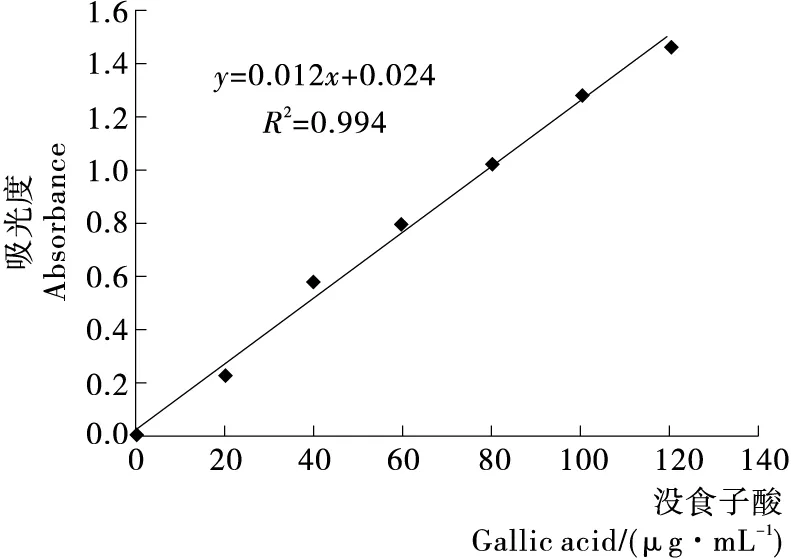
图1 没食子酸标准曲线
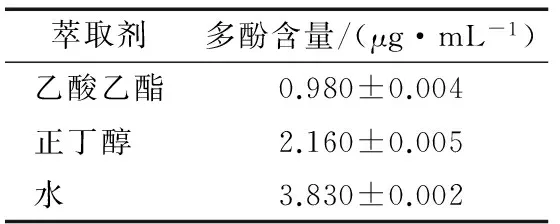
萃取剂多酚含量/(μg·mL-1)乙酸乙酯0.980±0.004正丁醇 2.160±0.005水 3.830±0.002
由表1可知,水层梨多酚含量最多,正丁醇层次之,乙酸乙酯层梨多酚含量最少。依据相似相溶原理,说明砀山酥梨中较高极性的梨多酚含量较多,而低极性梨多酚含量较少。
2.2 不同极性梨多酚的抗氧化能力
不同极性梨多酚的过氧化值见表2。
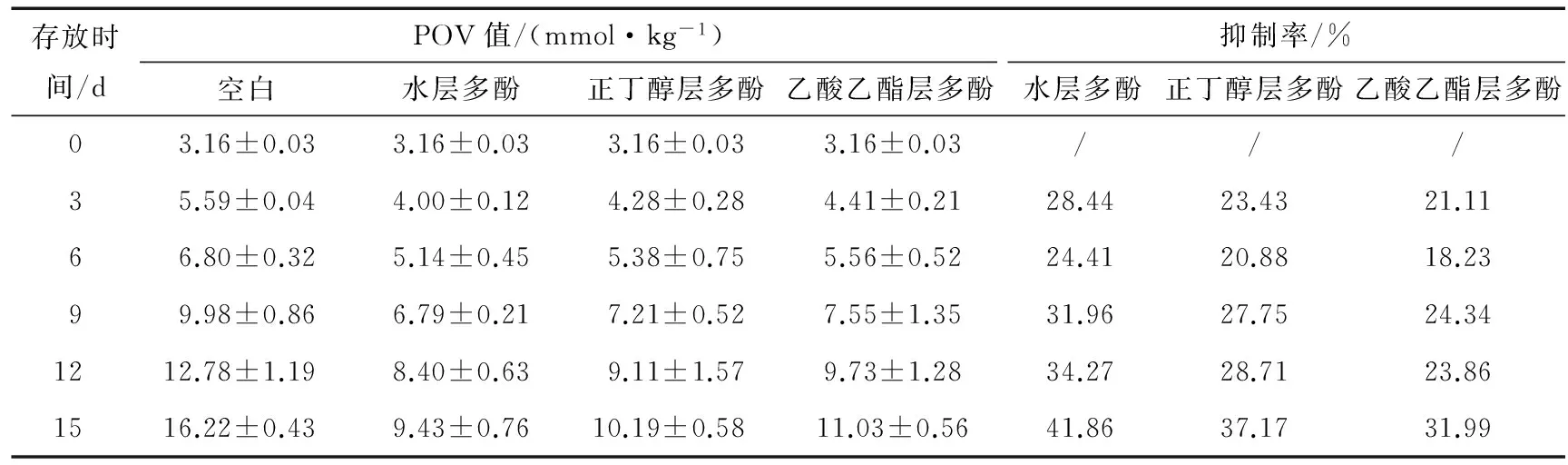
表2 不同极性梨多酚的过氧化值
由表2可知:没有添加梨多酚的空白油样,放置第9天时,POV值为9.98 mmol/kg,即接近规定值(POV≤10 mmol/kg)的出厂标准。而添加不同极性梨多酚的油样,放置到第15天时,水层多酚的POV值仍低于10 mmol/kg,而正丁醇层和乙酸乙酯层多酚的POV值略高于10 mmol/kg。由此可见梨多酚可以延缓植物油的氧化,延长其保质期。通过比较POV值及抑制率,发现极性不同梨多酚所表现出来的抗氧化性能有所差异,其抗氧化性能水层梨多酚高于正丁醇层梨多酚,正丁醇层梨多酚强于乙酸乙酯层梨多酚,得出极性较大的梨多酚其抗氧化能力较强,极性较小的梨多酚抗氧化能力相对较弱,且在短时间内3种极性梨多酚的抑制率呈波动上升状态。比较3种极性梨多酚,水层梨多酚的抗氧化性能较强,这可能是在极性较强的溶剂中,多酚类物质的溶解能力较强,处于同样状况时,水层梨多酚在反应体系中分散程度大,梨多酚分子与自由基碰撞的机会较多,清除自由基的反应速度较快。但是正丁醇和乙酸乙酯层梨多酚分散程度相对较小,在反应体系中扩散的较慢,其梨多酚分子与自由基碰撞的机会较少,抗氧化性能相对较低[18]。
2.3 不同极性梨多酚对胡萝卜素的护色效果的比较
由图2可知,梨多酚对胡萝卜汁有护色作用,且水层梨多酚的护色效果强于正丁醇层梨多酚,正丁醇层梨多酚的护色效果强于乙酸乙酯层梨多酚,得出极性较大的梨多酚其护色能力较强,极性较小的梨多酚护色效果相对较弱。在浓度<0.4 g/100 mL时,加入的梨多酚浓度越大,其护色作用越强,当梨多酚浓度>0.4 g/100 mL时,随着梨多酚浓度的增加护色作用减弱,且在试验过程中发现添加梨多酚过多时,会改变胡萝卜汁的颜色,呈浅棕色。胡罗卜汁护色作用下降,可能是梨多酚浓度增大诱导其内部自由基生成的缘故[19]。
2.4 不同极性梨多酚清除氢氧自由基的能力
由图3可知,水层梨多酚对氢氧自由基的抑制作用强于正丁醇层梨多酚,正丁醇层梨多酚的抑制作用强于乙酸乙酯层梨多酚,得出极性较大的梨多酚对氢氧自由基的抑制作用较强,极性较小的梨多酚对氢氧自由基的抑制作用相对较弱。这可能是不同溶剂提取的梨多酚种类和数量有所差异,极性强的溶剂提取的梨多酚给电子能力相对较强[20]。
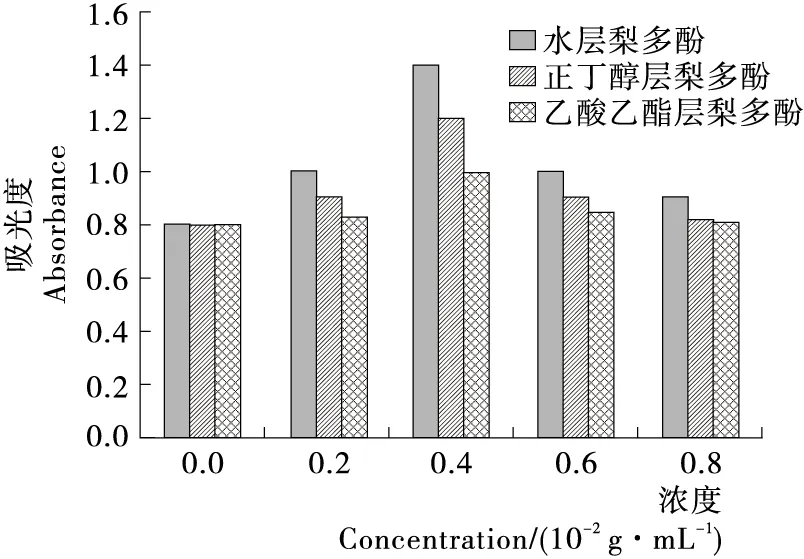
图2 不同浓度梨多酚对胡萝卜汁的护色作用
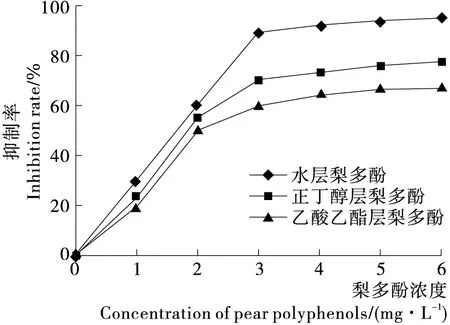
图3 不同极性梨多酚对氢氧自由基的清除作用
3 结论
梨多酚有一定的抗氧化及清除自由基性能,应用前景广阔。本研究采用水、正丁醇、乙酸乙酯3种不同极性的溶剂分离酥梨中的多酚类物质,并比较了浸提物的抗氧化性能。结果表明,水层梨多酚清除氢氧自由基的抑制作用最强,正丁醇层梨多酚次之,乙酸乙酯层梨多酚最弱,即梨多酚的极性与抗氧化活性呈正相关趋势。研究结果为高抗氧化性梨多酚的开发提供理论依据。
[1] 曹天生. 砀山酥梨文化[M]. 合肥: 安徽人民出版社, 2008: 35-41.
[2] MENG Jiang-fei, FANG Yu-lin, ZHANG Ang, et al. Phenolic content and antioxidant capacity of Chinese raisins produced in Xinjiang Province [J]. Food Research International, 2011, 44: 2 830-2 836.
[3] SAXEN A S, HAJARE S N, MORE V, et al. Antioxidant and radio protective properties of commercially grown litchi( Litchi chinensis ) from India [J]. Food Chemistry, 2011, 126(1): 39-45.
[4] BHOOPAT L, SRICHAIRATANAKOOL S, KANJANAPOTHI D, et al. Hepatoprotective effects of lychee( Litchi chinensis Sonn): a combination of antioxidantand antiapoptotic activities [J]. Journal of Ethnopharmacology, 2011, 136(1): 55-66.
[5] 唐华丽, 熊汉国, 王玮, 等. 响应面法优化葡萄籽多酚提取工艺[J]. 食品与机械, 2012, 28(6): 147-163.
[6] 孙红艳, 胡凯中, 郭志龙, 等. 超声波法提取刺梨多酚的工艺优化及体外抑菌活性研究[J]. 中国食品添加剂, 2016(2): 57-61.
[7] 徐芹, 乔勇进, 方强, 等. 砀山酥梨多酚氧化酶酶学特性及抑制效应的研究[J]. 食品科学, 2008, 29(4): 74-77.
[8] 杨光宇, 牟德华, 赵广西, 等. 赵州雪花梨多酚氧化酶酶学特性研究[J]. 食品与机械, 2010, 26(5): 10-12.
[9] 王宏. 苹果渣中多酚物质的提取、分离及其抗氧化活性研究[D]. 西安: 陕西师范大学, 2006: 16-17.
[10] 牛鹏飞, 仇农学, 杜寅. 苹果渣中不同极性多酚的分离及体外抗氧化活性研究[J]. 农业工程学报, 2008, 24(3): 238-242.
[11] 严守雷, 王清章, 彭光华. 莲藕多酚抗氧化作用研究[J]. 中国粮油学报, 2005, 20(4): 76-81.
[12] LI Wen-bin, SUN Hong-yan, ZHOU Jian-wu, et al. Antibacterial activities, antioxidant contents and antioxidant properties of three traditional Chinese medicinal extracts [J]. Bangladesh Journal of Pharmacology, 2015, 10: 131-137.
[13] 石碧, 荻莹. 植物多酚[M]. 北京: 科学技术出版社, 2000: 19-20.
[14] 田迪英, 杨荣华. 果蔬抗氧化活性与总酚含量相关性研究[J]. 化学世界, 2004, 45(2): 70-73.
[15] 刘杰超, 王思新, 焦中高, 等. 苹果多酚提取物抗氧化活性的体外试验[J]. 果树学报, 2005, 22(2): 106-110.
[16] 艾志录, 王育红, 潘治利, 等. 苹果渣中多酚物质的抗氧化活性研究[J]. 食品科学, 2006, 27(12): 160-163.
[17] 仇农学, 王宏, 李艳, 等. 苹果渣中多酚物质的体外抗氧化活性[J]. 浙江林学院学报, 2006, 23(5): 527-531.
[18] 温叶杰, 肖娟, 董丽红, 等. 荔枝果肉多酚不同极性分部的构成谱及其抗氧化活性比较[J]. 食品科学技术学报, 2016, 34(3): 31-39.
[19] 孙建霞. 苹果多酚的提取分离及其主要功能活性研究[D]. 泰安: 山东农业大学, 2005: 58-60.
[20] IRENE P, CARLES C, CHRISTOS P, et al. Evaluation of scavenging activity assessed by Co(II)/EDTA-induced luminol chemiluminescence and DPPH free radical assay[J]. Journal of Food and Agriculture, 2000, 80: 985-1 012.
Research on antioxidative activities of different polar polyphenols from pear
ZHANGDong-jingGAOGui-zhenZHANGXing-tao
(SuzhouUniversity,Suzhou,Anhui234000,China)
Polar polyphenols were extracted from pear using different polar solvents in this study. The antioxidant properties of different polar polyphenols were evaluated by comparing the antioxidant value. The results showed that the peroxide value was 9.43 mmol/kg, and the inhibition rate was 41.86%, added soybean oil with the water layers polyphenols at the fifteenth day. Moreover, the values were 10.19 mmol/kg, and 37.17%, respectively, while adding peroxide value soybean oil with n-butanol layers pear polyphenol. When ethyl acetate layer pear polyphenol was added, the values were changed to be 11.03 mmol/kg and 34.99% respectively. Significant differences of the antioxidant properties and free radical scavenging abilities of different polar polyphenols from pear could be found in the present studies. The PPO activities order of polyphenols extracted by solvents was water, n-butanol, ethyl acetate, and the PPO activities of polyphenols extracted from pear increased accordant with the solvents polarity increasing.
pear; polyphenols; antioxidant; water; n-butanol; ethyl acetate
宿州学院平台项目(编号:2015ykf01);安徽省教育厅(编号:2013zytz073)
张东京(1987—),男,宿州学院助教,硕士。
2016—08—21
10.13652/j.issn.1003-5788.2016.10.037
E-mial:zhangdongjing1987@163.com
