短期喂食转基因大豆对雄性大鼠睾丸StAR表达的影响
2016-12-05史宗勇许冬梅袁建琴
史宗勇 许冬梅 路 超 袁建琴
(山西农业大学生命科学学院,山西 太谷 030801)
短期喂食转基因大豆对雄性大鼠睾丸StAR表达的影响
史宗勇 许冬梅 路 超 袁建琴
(山西农业大学生命科学学院,山西 太谷 030801)
探讨转基因大豆对雄性大鼠睾丸类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein, StAR)mRNA水平和蛋白水平表达的影响,为转基因大豆的安全性提供科学依据。将30只健康雄性离乳SD大鼠随机分成两组,设GM组喂食含转CP4-epsps基因大豆饲料,CK组喂食含非转基因受体大豆(Soybean A5403)饲料,喂食试验饲料30,60,90 d后,各组随机处死3只大鼠,针对雄性主要生殖器官睾丸、附睾进行脏器系数分析;运用RT-PCR技术检测大鼠睾丸StAR基因表达量;蛋白酶联免疫反应分析大鼠睾丸StAR蛋白含量。喂食30,60,90 d后,解剖观察大鼠,与CK组相比GM组大鼠睾丸、附睾形态、颜色正常,大小、器官间比例协调,大鼠睾丸系数无显著性差异,附睾系数除30 d处理组(P<0.05)差异显著外,其它各处理组间t检验P值均大于0.05,无显著性差异;GM组与CK组大鼠相比,StAR基因相对表达量、蛋白含量相同处理时间组间差异不显著。短期喂食大鼠转CP4-epsps基因大豆,雄性大鼠主要生殖器官睾丸、附睾生长发育正常,喂食转基因大豆对大鼠睾丸中StAR基因表达量、StAR蛋白含量无明显影响。关键词:转基因大豆;大鼠;脏器系数;StAR
转基因作物商品化19年来种植面积不断扩大,2014年全球28个国家种植1.815亿 hm2的转基因作物,其中大豆种植面积占转基因作物总面积的一半以上[1]。自转基因生物技术诞生以来,生物安全问题引起了国际社会的激烈争论,转基因大豆的安全评价成为当前民众普遍关注的科学问题和社会问题。当前转基因生物安全评价的主要依据是国际食品法典委员会(CAC)制定的转基因食品安全评价指南,评价内容集中在营养成分、毒理效应和过敏反应三个方面[2]。关于毒理学评价的研究主要是通过动物饲喂,围绕其主要器官的生长发育进行研究,张力等[3]研究表明饲喂转基因高油酸大豆对大鼠的器官发育未出现明显的有害影响,主要脏器也未见明显病理学改变。Qi等[4]采用转基因大豆与传统大豆喂养大鼠90 d后,在体重、食物消耗量、体重增重以及食物利用率上均无显著差异。Appenzeller 等[5]以抗草甘膦大豆356Ø43为材料对大鼠进行神经系统的检测,研究表明转基因大豆对大鼠神经行为学也无显著性影响。Batista等[6]又对大豆致敏性进行了研究,发现转基因大豆和非转基因大豆组未见显著差异。此外,芦春斌等报道了转基因大豆对小鼠生殖系统[7]和雌鼠胚胎发育[8]无显著影响。但尚未见喂食转基因大豆对雄性动物性激素合成影响的研究。睾酮的合成对雄性生殖器的发育及其维持生精功能是至关重要的。在睾酮的合成过程中,胆固醇的跨膜转运是关键步骤[9]。在此过程中,类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)是调节这一过程的关键因子。Warita等[10]研究发现小鼠StAR蛋白的缺失会引起雄性不育,当Star基因过表达时,睾酮激素显著性上调,说明该基因对小鼠雄性的发育起至关重要的作用。睾丸间质细胞中StAR蛋白的表达与否及其表达量,势必影响睾酮的合成和分泌,继而影响动物的生殖生理活动。本研究拟通过比较饲喂转CP4-epsps基因大豆及其亲本大豆Soybean A5403配制饲料对大鼠睾丸组织StAR基因表达的差异,进而探讨转基因大豆对其生殖系统发育及睾丸间质细胞内分泌功能的影响,旨在为转基因大豆对雄性大鼠生殖安全提供新的科学依据。
1 材料与方法
1.1 试验材料、仪器与试剂
1.1.1 试验材料
SD大鼠:由山西医科大学实验动物中心提供;
转CP4-epsps基因大豆为孟山都GTS40-3-2大豆,非转基因大豆为其亲本Soybean A5403大豆。转基因成分经农业部转基因生物产品成分监督检验测试中心(太原)验证检测确认。
1.1.2 主要仪器和试剂
电子天平:BS124S型,德国赛多利斯集团;
实时荧光定量PCR仪:IQ5型,美国Bio-Rad公司;
移液器:0.1-200 μL系列,德国Ependorf公司;
台式高速冷冻离心机:Neofuge 25R型,香港力康发展有限公司;
酶标仪:ELx808型,美国伯腾仪器有限公司;
qRT-PCR kit:50 μL反应×120次,宝生物工程(大连)有限公司;
STAR酶联免疫分析试剂盒:上海酶联生物科技有限公司;
DEPC水:100 mL,碧云天生物技术研究所;
三氯甲烷、异丙醇、无水乙醇:分析纯,天津化学试剂三厂。
1.1.3 饲料配制 大鼠饲料委托山西医科大学实验动物中心加工,饲料成分包括玉米(58.9%)、大豆(20%)、小麦(10%)、鱼粉(6%)、骨粉(2%)、酵母(1%)、食盐(1%)、植物油(0.9%)和蛋氨酸(0.2%),其中试验组饲料用转CP4-epsps基因大豆配制,对照组饲料用Soybean A5403大豆配制,营养成分满足《实验动物配合饲料营养成分》(GB 14924.3—2010)要求。
1.1.4 试验动物分组及处理 30只健康雄性离乳SD大鼠,常规饲料喂食1周适应环境后,随机分成两组,设喂食含转基因大豆饲料大鼠为试验组(GM组),喂食含非转基因大豆饲料大鼠为对照组(CK组),按试验设计分别喂食30,60,90 d后,各组随机处死3只大鼠进行试验。
1.2 试验方法
1.2.1 脏器系数 喂食30,60,90 d后颈椎脱臼法处死大鼠,称量体重,剪开腹腔,分离摘取双侧睾丸、附睾称重(g),依公式(脏器系数=脏器重量/大鼠体重)分别计算大鼠睾丸系数和附睾系数。去除睾丸结缔组织被膜,加入一定量pH 7.4的PBS浸泡组织,用液氮迅速冷冻后移至-80 ℃冰箱冷冻保存备用。
1.2.2 RT-PCR 采用Trizol提取大鼠睾丸组织总RNA。采用RT-PCR试剂盒(TaKaRa公司)按照指南进行逆转录。Star基因PCR扩增Star-F引物序列为AGTCATCACCCATGAGCTGG;Star-R引物序列为TTCAGCTCTGATGACACCGC。内参基因选用在大鼠各组织、细胞中表达相对恒定的18SRNA基因,18S-F引物序列:GAAACGGCTACCACATCC;18S-R引物序列:ACCAGACTTGCCCTCCA。
选用25 μL qRT-PCR体系,每个体系中加入1 μL cDNA,12.5 μL SYBR Premix Ex TaqTMII,上游和下游引物各1.0 μL,ROX reference dye 0.5 μL和水9 μL。每个样本设4个平行。采用Bio-Rad公司IQ5实时荧光定量PCR仪进行扩增。反应条件为:95 ℃预变性10 min; 95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸10 s,40个循环;绘制溶解曲线,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,0.3 ℃/s。
相同条件下,内参18S基因和Star基因在不同的管内扩增,反应结束后,软件自动导出扩增动力学曲线,溶解曲线和CT值,通过溶解曲线来判定RCR反应的特异性,根据荧光曲线的CT值分析计算得出定量结果。
1.2.3 STAR蛋白酶联免疫分析 取出冷冻保存的睾丸组织,融化后仍然保持2~8 ℃。用预冷的PBS冲洗去除组织表面残留血液和杂质,剪刀剪碎组织称重,按1 g组织加入预冷的9 mL PBS,冰上3 000 r/min匀浆10 s,重复3~5次,3 000 r/min离心20 min,取上清分装(1 mL)备用。然后按大鼠类固醇合成急性调节蛋白(STAR)酶联免疫分析试剂盒说明书操作,终止反应后15 min内上酶标仪完成检测,运用GEN5CHS 2.01软件分析处理检测数据,统计记录检测结果。
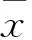
2 结果与分析
2.1 转基因大豆对大鼠睾丸、附睾脏器系数的影响
解剖观察大鼠睾丸、附睾形态、颜色正常,大小、器官间比例协调。喂食对应饲料30,60,90 d后计算脏器系数结果显示,试验组睾丸、附睾脏器系数略高于或低于对照组,经t检验发现,除30 d处理组附睾系数(P<0.05)差异显著外,其它各处理组间P值均大于0.05,无显著性差异,见表1。
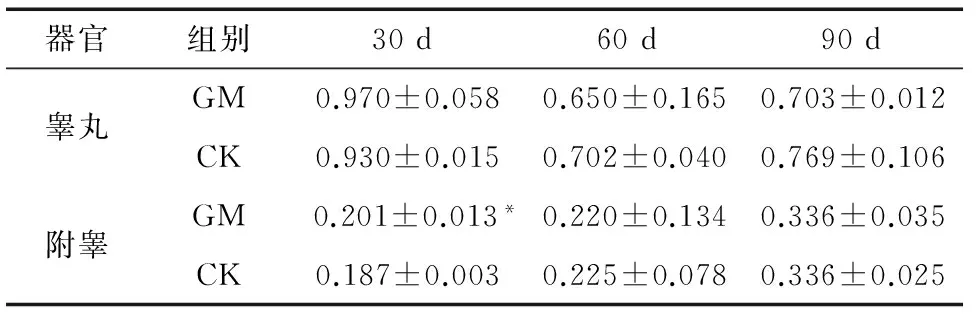
表1 转基因大豆对脏器系数的影响†
† *表示试验组与对照组间差异显著(P<0.05)。
脏器系数是毒性试验的常用指标,可以敏感反映受试物对动物脏器的毒性作用,GM组与CK组相比,仅30 d处理组附睾系数(P<0.05)差异显著,其它各组间差异均不显著。董延生等[11]研究表明SD大鼠8~12周龄脏器系数正常值参考范围:睾丸0.566~1.043,附睾0.181~0.349;12~24周龄脏器系数正常值参考范围:睾丸0.420~0.894,附睾0.169~0.366。饲喂试验饲料30 d后,大鼠处于8~12周龄期间,饲喂试验饲料60,90 d后,大鼠处于12~24周龄期间,分析试验所得脏器系数数据,所测结果全部处于正常值范围内,30 d处理组附睾系数差异显著可能是由动物个体差异造成的,且转基因大豆并未造成睾丸与附睾的增生、水肿、充血或萎缩等退行性改变。研究结果与芦春斌等[12]喂食转基因大豆对子代雄鼠睾丸脏器系数影响一致。
2.2 转基因大豆对大鼠睾丸StAR mRNA水平表达的影响
用RT-PCR方法测定大鼠相关基因的表达量,由图1可知,扩增曲线光滑平稳,基线平整没有引物二聚体产生,指数区较明显,由于多种原因影响扩增后期曲线分散,基本呈S型,符合测定要求。
RT-PCR完成后根据记录数据,在相同模板下,用扩增目的基因的CT值减去内参基因的CT值,得到目的基因的相对表达量ΔCT值,即StAR目的基因相对于内参基因18SRNA的表达量。分别计算30,60,90 d转基因饲料饲喂大鼠(GM组)和非转基因饲料饲喂大鼠(CK组)的StAR目的基因、内参基因的CT值和StAR目的基因的相对表达量,具体ΔCT值见表2。
由表2可知,大鼠内参基因18SRNA基因表达CT数值个体间有所差异,但表达量相对稳定,内参基因表达个体间差异不显著,说明内参基因选择合理。饲喂试验饲料30 d后,试验大鼠进入性成熟期,不同处理时间组内大鼠StAR 基因相对表达量有所变化,但同组内30 d/60 d、30 d/90 d、60 d/90 d基因表达t检验P值均大于0.05,表明性成熟期组内大鼠StAR 基因表达未受时间影响,差异不显著,统计分析结果见表3。
通过计算得30,60,90 d饲喂转基因饲料组和非饲喂转基因饲料组StAR 基因相对表达量的平均值分别为5.037±0.597,3.963±0.323,4.353±0.648,4.29±0.233,4.757±0.269,5.337±0.579。运用方差分析两组大鼠StAR 基因相对表达量,经t检验,P值分别为0.175,0.556,0.185,均大于0.05,不同处理时间GM组与CK组StAR 基因表达差异不显著,见图2。表明试验大鼠StAR 基因表达未受饲料成分调节影响。
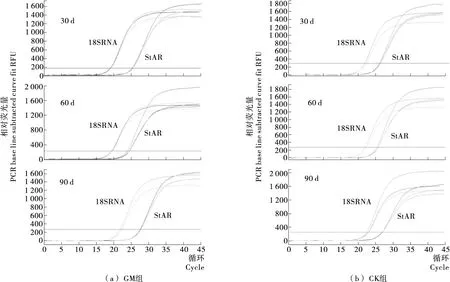
图1 荧光定量扩增曲线
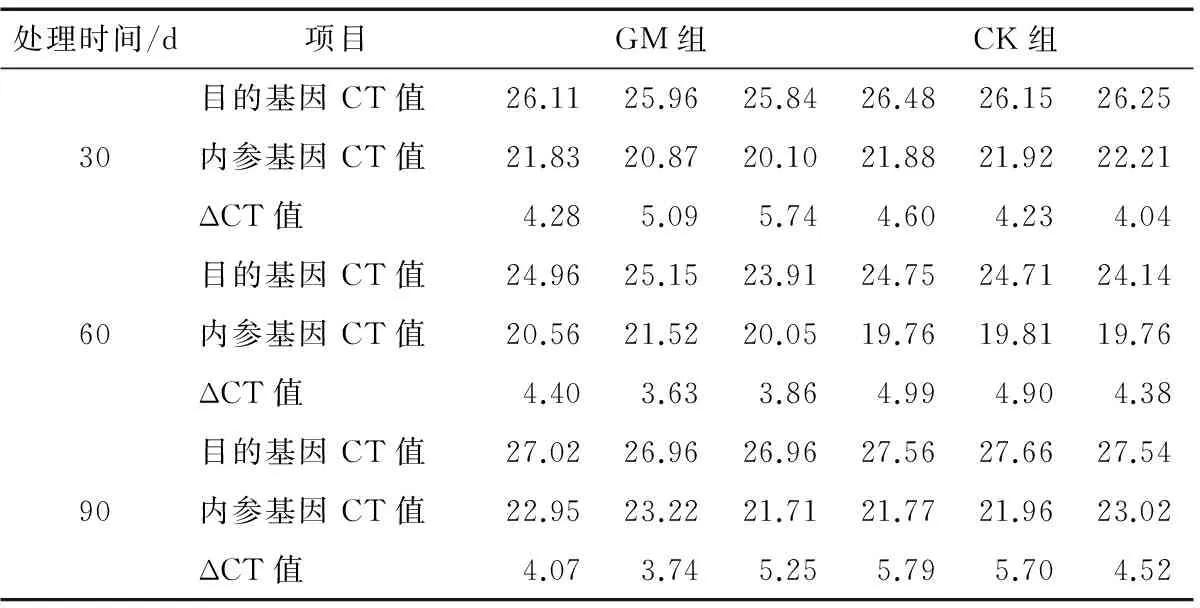
处理时间/d项目GM组CK组目的基因CT值26.1125.9625.8426.4826.1526.2530内参基因CT值21.8320.8720.1021.8821.9222.21ΔCT值4.285.095.744.604.234.04目的基因CT值24.9625.1523.9124.7524.7124.1460内参基因CT值20.5621.5220.0519.7619.8119.76ΔCT值4.403.633.864.994.904.38目的基因CT值27.0226.9626.9627.5627.6627.5490内参基因CT值22.9523.2221.7121.7721.9623.02ΔCT值4.073.745.255.795.704.52
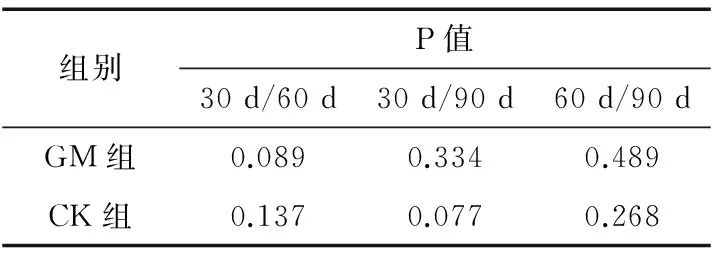
表3 组内大鼠不同处理时间StAR 基因表达量比较
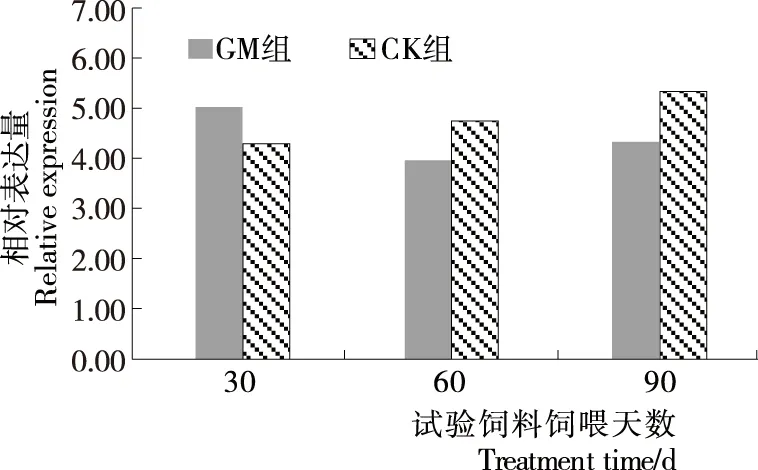
图2 目的基因相对表达水平
2.3 转基因大豆对大鼠睾丸StAR蛋白水平表达的影响
记录酶标仪检测结果,根据标准品系列数据,运行GEN5CHS 2.01软件,得到检测标准曲线(见图3),生成R2=1的曲线方程y=Y=A×X+B,其中A=0.007 33,B=-0.051 06。
根据酶标仪检测结果,依试验操作换算,结果见图4,喂食转基因大豆30,60,90 d后,GM组大鼠睾丸组织中StAR蛋白含量分别为(0.691±0.039),(0.720±0.013),(0.987±0.130) ng/g,与CK组StAR蛋白含量(0.758±0.028),(0.756±0.024),(0.742±0.094) ng/g相比,t检验P值分别为0.118,0.130,0.098,均大于0.05,表明喂食转基因大豆对大鼠睾丸中StAR蛋白含量无明显影响。
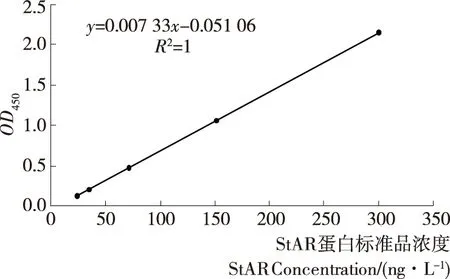
图3 StAR检测标准曲线
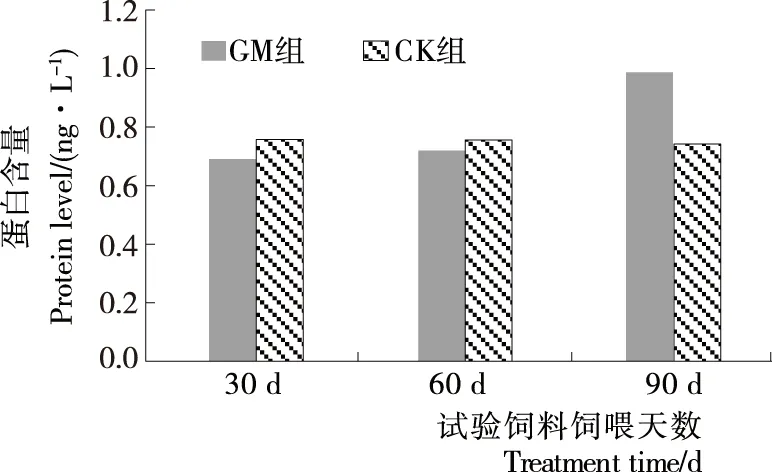
图4 喂食转基因大豆对大鼠睾丸StAR蛋白含量的影响
睾酮是雄性大鼠的主要性激素,在胚胎发育雄性化、精子生成、雄性性行为激发与维持以及性腺的发育等生理过程中起着重要的作用。睾酮合成在睾丸间质细胞线粒体内膜上进行,而合成原料胆固醇存在于线粒体外,生理条件下胆固醇从线粒体外膜向内膜的转运需要StAR蛋白作用于线粒体外膜,介导并促进胆固醇的转运,转运蛋白StAR在胆固醇转运中起限速作用[13]。研究表明在饲喂含转CP4-epsps基因大豆饮料30,60,90 d后,试验组大鼠睾丸组织中StAR基因mRNA水平的表达与对照组无显著差异,StAR基因蛋白水平的表达对应组间差异无统计学意义,可见短期喂食含转基因成份饲料不会影响动物的生长发育及其组织器官的功能。Qi等[4]认为复合性状转基因大豆35Ø423×40-3-2与非转基因大豆具有同样的安全性。刘莎莎等[14]也未发现大豆转基因成分对肉鸡生化指标、器官发育、代谢残留有不良影响,且刘斌等[15]也报道转基因豆粕对崂山奶山羊生长性能和肌肉品质无显著影响。但这类研究有其局限性,如Raffaella等[16]研究发现喂食抗草甘膦大豆的母羊所产的小羊γ-谷氨酰胺转移酶的水平较高,影响了其肝脏和肾脏的细胞代谢。
3 结论
试验研究了短期喂食转CP4-epsps基因大豆对雄性大鼠睾丸StAR表达的影响,结果表明,喂食转基因大豆未造成雄性大鼠主要生殖器官病理改变,睾丸、附睾生长发育正常;试验变量对大鼠睾丸间质细胞雄性激素合成过程固醇类原料转运蛋白表达没有明显影响。表明短期饲喂转CP4-epsps基因大豆对试验大鼠无毒害作用,但随着对转基因喂食动物的深入研究(检测更多的相关分子),或更长久地(以年为单位)喂食动物转基因饲料是否会影响动物的生长发育及其组织器官的功能还有待深入研究。本课题组正在对大鼠雄性激素合成调控的其它关键基因表达进行研究,以进一步探讨转基因大豆的食用安全性。
[1] CLIVE James. 2014年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2015, 35(1): 1-14.
[2] ANDREW C. Assuring the safety of genetically modified (GM) foods: the importance of an holistic, integrative approach[J]. Journal of Biotechnololgy, 2002, 98(1): 79-106.
[3] 张力, 程呈, 何宁, 等. 转基因高油酸大豆对大鼠的亚慢性毒性研究[J]. 毒理学杂志, 2011, 25(5): 391-394.
[4] QI Xiao-zhe, HE Xiao-yu, LUO Yun-bo, et al. Subchronic feeding study of stacked trait genetically-modified soybean(3Ø5423 x 40-3-2)in Sprague-Dawley rats[J]. Food Chem Toxicol., 2012, 50(9): 3 256-3 263.
[5] APPENZELLER L M, MUNLEY S M, HOban D, et al. Subchronic feeding study of herbicide-tolerant soybean DP-356Ø43-5 in Sprague-Daw-ley rats[J]. Food and Chemical Toxicology, 2008, 46(6): 2 201-2 213.
[6] BATISTA R, MARTINS I, JENO P, et al. A proteomic study to identify soya allergens: the human response to transgenic versus non-transgenic soya samples[J]. Int Arch Allergy Immunol, 2007, 144(1): 29-38.
[7] 芦春斌, 杨冬宇, 高忱, 等. 转基因大豆对雄性鼠生殖系统的安全性评估[J]. 扬州大学学报: 农业与生命科学版, 2012, 33(1): 23-27.
[8] 芦春斌, 郑建新, 蔡娟, 等. 转基因大豆对雌鼠胚胎发育及受精能力的影响[J]. 大豆科学, 2014, 33(4): 578-582.
[9] STOCCO D M. StAR protein and the regulation of steroid hormone biosynthesis[J]. Annu Rev Physiol, 2001, 63: 193-213.
[10] WARITA K, MITSUHASHI T, FUKUI S, et al. Immunohistochemical analysis of steroidogenic acute regulatory protein(StAR) and StAR-binding protein (SBP) expression in the testes of mice during fetal development[J]. Reproductive Biology, 2013, 13(1): 92-95.
[11] 董延生, 尹纪业, 陈长, 等. SD大鼠脏器重量及脏器系数正常参考值的确立与应用[J]. 军事医学, 2012, 36(5): 351-353.
[12] 芦春斌, 周文, 刘标. 喂食转基因大豆对子代雄鼠生殖系统的影响[J]. 大豆科学, 2013, 32(1): 119-123.
[13] STOCCO D M. Intramitochondrial cholesterol transfer[J]. Biochim Biophys Acta, 2000, 1 486(1): 184-197.
[14] 刘莎莎, 谭建庄, 孙哲, 等. 转基因成分在肉鸡体内的代谢残留及对生化指标、器官发育的影响[J]. 饲料工业, 2011, 32(9): 19-25.
[15] 刘斌, 秦志华, 黄娟, 等. 转基因豆粕对崂山奶山羊生长性能、肌肉营养成分及组织器官中外源基因转移的影响[J]. 动物营养学报, 2014, 26(4): 1 028-1 033.
[16] VINCENZO M, RAFFAELLA T, GIOVANNI M, et al. Gamma-glutamyl transferase activity in kids born from goats fed genetically modified soybean[J]. Food and Nutrition Sciences, 2013, 4(6): 50-54.
Effects of short term feeding transgenic soybean on the expression of StAR in rat testis
SHIZong-yongXUDong-meiLUChaoYUANJian-qing
(CollegeofLifeScience,ShanxiAgriculturalUniversity,Taigu,Shanxi030801,China)
The present study was conducted to discuss the effects on genetically modified soybeans on the level of mRNA and protein in StAR gene in male rat, and aimed to provide a scientific basis for the security of transgenic soybeans. Thirty male SD rats were randomly divided into GM group and CK group. The GM group were fed with transgenic Roundup Ready soybean containing CP4-EPSPS gene, and the CK group were fed with non-transgenic soybean. Three rats of every group were killed at 30 d, 60 d and 90 d, respectively. Viscera index (testes and epididymides) was calculated. RT-PCR was used to measure the expression of StAR gene, and ELISA was used to analysis the expression of StAR protein. The morphology and color of testes and epididymides of the GM group and CK group were observed. No significant differences were found in size and testis coefficient. Epididymis coefficient were no significant difference(P>0.05)except 30 d group. The average expression of StAR gene and protein in GM and CK group (30 d 60 d and 90 d) was detected, and no significant differences between the two groups at the same time were found. The results suggested that feeding transgenic soybean for 30 d showed no damages to occurrence of testes and epididymides in rat, and the expression of StAR gene and protein were no difference either.Keywords: GM soybeans; rat; visceral coefficents; StAR
山西省自然科学基金(编号:2013011028-2);山西省科技攻关基金(编号:20140311025-3)
史宗勇(1970—),男,山西农业大学副教授,硕士。
E-mail:zongyongtg@sohu.com
2016-03-01
10.13652/j.issn.1003-5788.2016.10.003
