亚硝酸盐胁迫对罗氏沼虾血细胞及其抗氧化酶活力的影响
2016-12-05冼健安张秀霞王冬梅王安利
冼健安, 张秀霞, 郭 慧, 王冬梅, 王安利
1中国热带农业科学院热带生物技术研究所,海南 海口 571101;2华南师范大学生命科学学院,广东省水产健康安全养殖重点实验室,生态与环境科学广东普通高校重点实验室,广东 广州 510631;3广东海洋大学水产学院,南海水产经济动物增养殖广东普通高校重点实验室,广东 湛江 524025
亚硝酸盐胁迫对罗氏沼虾血细胞及其抗氧化酶活力的影响
冼健安1,2, 张秀霞1, 郭 慧3, 王冬梅1, 王安利2*
1中国热带农业科学院热带生物技术研究所,海南 海口 571101;2华南师范大学生命科学学院,广东省水产健康安全养殖重点实验室,生态与环境科学广东普通高校重点实验室,广东 广州 510631;3广东海洋大学水产学院,南海水产经济动物增养殖广东普通高校重点实验室,广东 湛江 524025
【背景】亚硝酸盐是虾类集约化养殖过程中最常见的毒性污染物之一,研究亚硝酸盐胁迫对罗氏沼虾血细胞的毒性以及抗氧化酶在抗胁迫防御中的作用,能够为罗氏沼虾养殖过程中的亚硝酸盐中毒防治提供理论参考。【方法】以不同浓度(0、1、5和10 mg·L-1)的亚硝态氮(NO2--N)对罗氏沼虾进行胁迫,于胁迫后的0、6、12、24和48 h取样,应用流式细胞术检测血细胞活性氧(ROS)含量和细胞凋亡率,同时测定血细胞总数(THC)和胞内抗氧化酶活力。【结果】1 mg·L-1NO2--N在48 h内对血细胞ROS含量、凋亡率和THC均无显著影响。5 mg·L-1NO2--N胁迫24 h,血细胞ROS含量显著上升,THC显著下降,胁迫48 h凋亡率显著提高。10 mg·L-1NO2--N胁迫6 h,血细胞ROS含量和凋亡率均显著上升,胁迫12 h THC显著下降。血细胞的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)的活力均不同程度地被NO2--N胁迫所诱导,CAT活力主要在胁迫前期提高,而GPx活力在胁迫后期提高。【结论与意义】亚硝酸盐存在浓度和时间毒性效应,一定浓度的亚硝酸盐会诱导虾血细胞产生ROS,这些ROS的过量产生诱导了血细胞发生凋亡,继而导致THC下降,这一氧化胁迫过程可能是亚硝酸盐对罗氏沼虾产生细胞毒性的重要机制之一。抗氧化酶活力的诱导表明抗氧化酶在亚硝酸盐胁迫过程中发挥防御作用。
亚硝酸盐; 罗氏沼虾; 血细胞; 氧化胁迫; 抗氧化活力
水产动物主要以氨氮的形式排泄氮废物,在亚硝化细菌的作用下,氨氮会转变为毒性更强的亚硝酸盐。随着养殖周期的延长,水环境中的亚硝酸盐浓度也相应增高(寇红岩等,2014)。亚硝酸盐是水产养殖过程中最常见的环境毒性因子之一,尤其对现代的集约化高密度养殖影响更大。亚硝酸盐对虾类的毒性影响主要集中在半致死浓度、组织结构、生理生化代谢和免疫酶活性的影响等方面(胡贤德等,2009; 胡义波等,2005; 黄翔鹄等,2006; 吕晓燕等,2010; 彭自然等,2004; Tseng & Chen,2004; Wangetal.,2004)。研究显示,水体中较高含量的亚硝酸盐会趋向于在虾的血淋巴中积累(寇红岩等,2014; Chenetal.,1992)。因此,亚硝酸盐胁迫对虾血细胞会产生直接影响,但目前针对亚硝酸盐对虾类血细胞毒性影响的研究甚少。Xianetal. (2011)的研究表明,亚硝酸盐胁迫会对斑节对虾Penaeusmonodon(Fabricius)的血细胞产生氧化胁迫作用,从而诱导血细胞凋亡,并导致血细胞总数(total haemocyte count,THC)下降,因而推测亚硝酸盐胁迫对淡水虾类可能也具有相同的细胞毒性机制。因此,本研究以罗氏沼虾Macrobrachiumrosenbergii(de Man)为研究对象,分析亚硝酸盐对淡水虾类血细胞的影响;另外,为探讨虾血细胞如何通过调节抗氧化活力进行抗亚硝酸盐防御,本研究还测定了血细胞中3类主要抗氧化酶活力的变化,以期为罗氏沼虾养殖过程中的亚硝酸盐胁迫防治提供理论参考。
1 材料与方法
1.1 试验材料
罗氏沼虾购于广东省广州市黄沙水产交易市场,室内[pH 7.9~8.0,温度(24±2)℃,不间断曝气]驯养,每天7:00和17:00投喂商业罗氏沼虾成虾饵料(粗蛋白30%,粗脂肪3%)2次,试验前停食1 d。驯养1周后,选取附肢完整、无病患、活力强的个体作为试验用虾,平均体重(11.16±1.34) g。
1.2 亚硝酸盐胁迫
以NaNO2作为亚硝酸氮源,设置3个NO2--N胁迫浓度:1、5和10 mg·L-1,不添加组为对照组,每组3个平行。每个养殖桶(直径65 cm的圆形塑料桶)放水180 L,每桶放养罗氏沼虾35尾。试验水源为经曝气1周的自来水,未测出亚硝酸氮,其他水体条件与驯养时的条件一致,胁迫试验期间不投饵,为保证试验期间的亚硝酸氮浓度,每24 h换取相应NO2--N浓度的水一次,换水量为50%。在胁迫的0、6、12、24和48 h取样测定。
1.3 血细胞指标测定
1.3.1 血细胞悬液的制备与血细胞总数测定 用2.5 mL的一次性注射器吸取400 μL预冷的抗凝剂(葡萄糖20.5 g·L-1,柠檬酸钠8 g·L-1,氯化钠4.2 g·L-1,pH 7.5),从虾的围心腔抽取等量血淋巴,将血淋巴转移到离心管中,取20 μL到血细胞计数板中,用光学显微镜观察计数测定THC;剩余血淋巴用预冷的抗凝剂调整细胞浓度至1×106个·mL-1,制备的血细胞悬液用于流式细胞术指标的测定。
1.3.2 流式细胞仪 所用流式细胞仪为美国BD公司的FACSCalibur,应用CellQuest软件(Becton Dickinson Immuno-cytometry Systems, San Jose, CA)进行试验数据的获取和分析。用绿色荧光通道(第一荧光通道,FL1)获取DCF和FITC的荧光数据,用橙黄色荧光通道(第二荧光通道,FL2)获取PI的荧光数据。每个样品均获取细胞数10000个。
1.3.3 血细胞活性氧含量 以DCFH-DA为荧光标记探针测定血细胞活性氧(reactive oxygen species,ROS)含量。分别取血细胞悬液200 μL,加入10 μmol·L-1DCFH-DA避光孵育30 min,经200目筛网过滤后,上流式细胞仪检测。结果以DCF荧光强度为横坐标、细胞数量为纵坐标的单参数直方图显示,分析细胞的DCF平均荧光强度,胞内的ROS含量与DCF平均荧光强度成正比(冼健安等,2012a)。
1.3.4 血细胞凋亡率 以Annexin V-FITC/PI凋亡检测试剂盒测定血细胞凋亡率。血细胞悬液进行离心,血细胞重悬于1×Annexin V结合缓冲液中,使细胞浓度约为3×106个·mL-1,每100 μL血细胞悬液加入5 μL Annexin V-FITC和10 μL PI工作液,避光染色15 min后,加入400 μL 1×Annexin V结合缓冲液,200目筛网过滤后立即上流式细胞仪检测。以Annexin V-FITC荧光强度为横坐标,PI荧光强度为纵坐标作双参数散点图,设十字门划分细胞类群:活细胞(Annexin V-FITC-/PI-)位于左下象限,前期凋亡细胞(Annexin V-FITC+/PI-)位于右下象限,后期凋亡细胞和死细胞(Annexin V-FITC+/PI+)位于右上象限。分析各类细胞的比例,凋亡率为前期凋亡、后期凋亡和死亡细胞所占的比例,即右下象限和右上象限细胞所占的比例(冼健安等,2012b)。
1.4 胞内抗氧化酶活力测定
1.4.1 血细胞匀浆液的制备 如上述所取虾的血淋巴在4 ℃下以3000 r·min-1离心10 min,弃上清,以等量生理盐水重悬血细胞,在冰浴中进行超声波破碎(匀浆3 s,间歇8 s,次数10次),再将匀浆液离心(4 ℃、3000 r·min-1,10 min),上清液为待测液。
1.4.2 酶活力测定 采用南京建成生物工程研究所生产的试剂盒分别测定SOD、CAT和GPx活力。按照说明书步骤进行操作并计算酶活力。
1.5 统计分析
试验数据利用SPSS 13.0进行单因素方差分析,结果显示为平均值±标准差(Mean±SD),P<0.05确认为差异性显著。
2 结果与分析
2.1 血细胞总数
罗氏沼虾的初始THC为(36.41±3.48)×105个·mL-1。在试验的48 h内,1 mg·L-1NO2--N胁迫对罗氏沼虾的THC无显著影响(P>0.05)。5 mg·L-1NO2--N胁迫24和48 h,10 mg·L-1NO2--N胁迫12、24和48 h,THC均显著下降(P<0.05)。胁迫48 h,5和10 mg·L-1的THC分别下降至(27.49±1.51)×105和(25.70±2.68)×105个·mL-1(图1)。
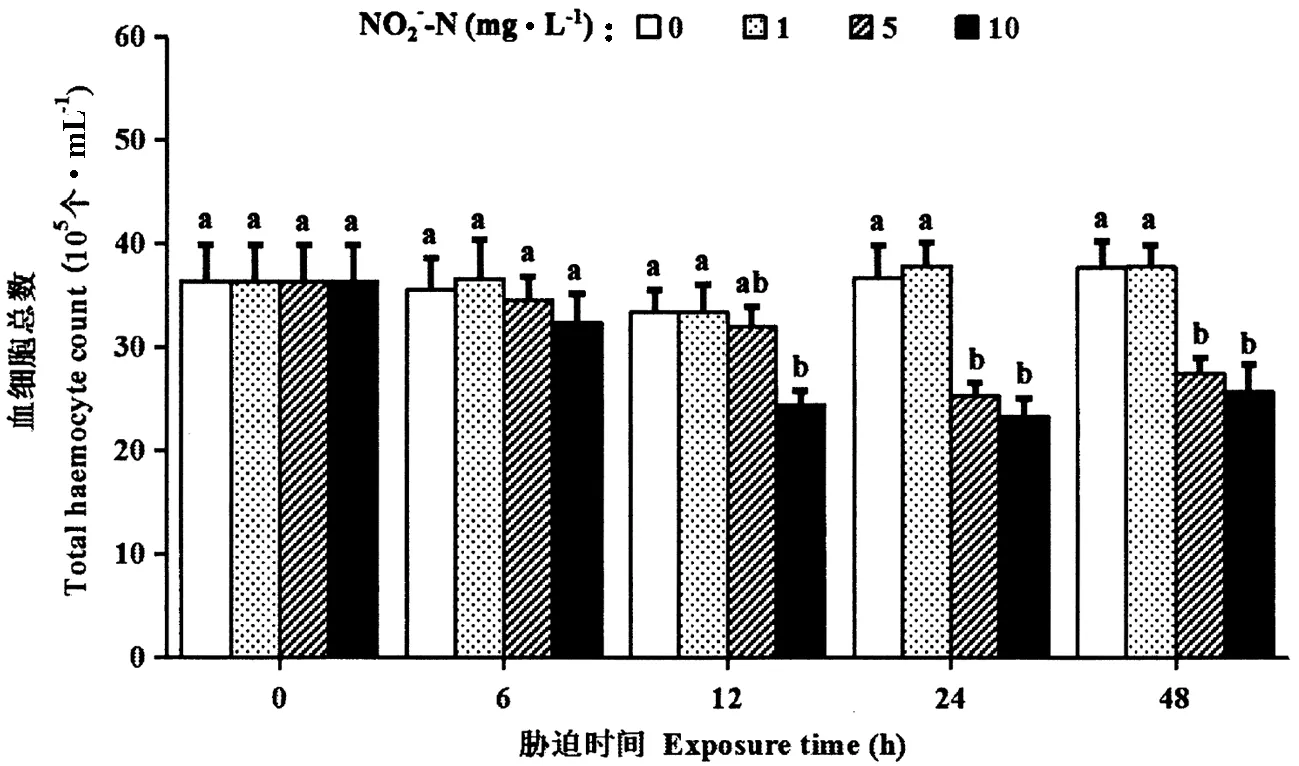
图1 亚硝酸盐胁迫下罗氏沼虾的血细胞总数
2.2 血细胞活性氧含量
在试验的48 h内,1 mg·L-1NO2--N胁迫对罗氏沼虾的ROS无显著影响(P>0.05)。5 mg·L-1NO2--N胁迫24和48 h,10 mg·L-1NO2--N胁迫6、12、24和48 h,虾血细胞ROS含量显著升高(P<0.05)(图2)。
2.3 血细胞凋亡率
罗氏沼虾的初始血细胞凋亡率为0.95%。在48 h内,1 mg·L-1NO2--N胁迫对血细胞凋亡率无显著影响(P>0.05)。5 mg·L-1NO2--N胁迫48 h,血细胞凋亡率显著升高至3.36%(P<0.05)。10 mg·L-1NO2--N胁迫6 h,血细胞凋亡率开始显著提高(P<0.05),在24 h达到最高值,为6.75%(图3)。
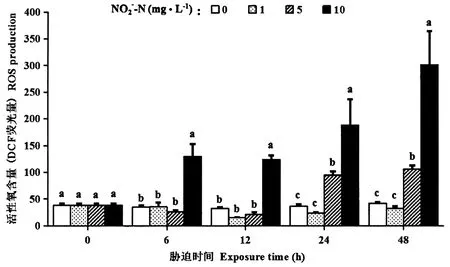
图2 亚硝酸盐胁迫下罗氏沼虾的血细胞活性氧含量
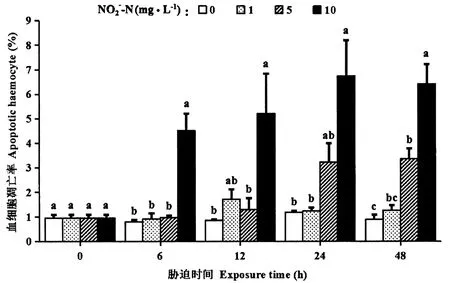
图3 亚硝酸盐胁迫下罗氏沼虾的血细胞凋亡率
2.4 血细胞SOD活力
如图4所示,1、5 mg·L-1NO2--N胁迫6 h,SOD活力显著提高(P<0.05),随后恢复至对照组水平(P>0.05)。10 mg·L-1NO2--N胁迫时,SOD活力在胁迫的12和24 h有显著提高(P<0.05),随后下降至对照组水平(P>0.05)。
2.5 血细胞CAT活力
图5所示,1 mg·L-1NO2--N胁迫12 h,5 mg·L-1NO2--N胁迫24 h,CAT活力呈现显著上升(P<0.05)。10 mg·L-1NO2--N胁迫时,CAT活力在胁迫的6、12和24 h均显著高于对照组(P<0.05),在48 h时下降至对照组水平(P>0.05)。
2.6 血细胞GPx活力
如图6所示,在胁迫的6 h时,各胁迫组的GPx活力与对照组之间均无显著差异(P>0.05)。经1 mg·L-1NO2--N胁迫后,GPx活力在48 h呈现显著上升(P<0.05);5 mg·L-1胁迫组的GPx活力在24和48 h显著上升(P<0.05);10 mg·L-1胁迫组的GPx活力在12和24 h显著上升(P<0.05),在48 h下降至对照组水平(P>0.05)。
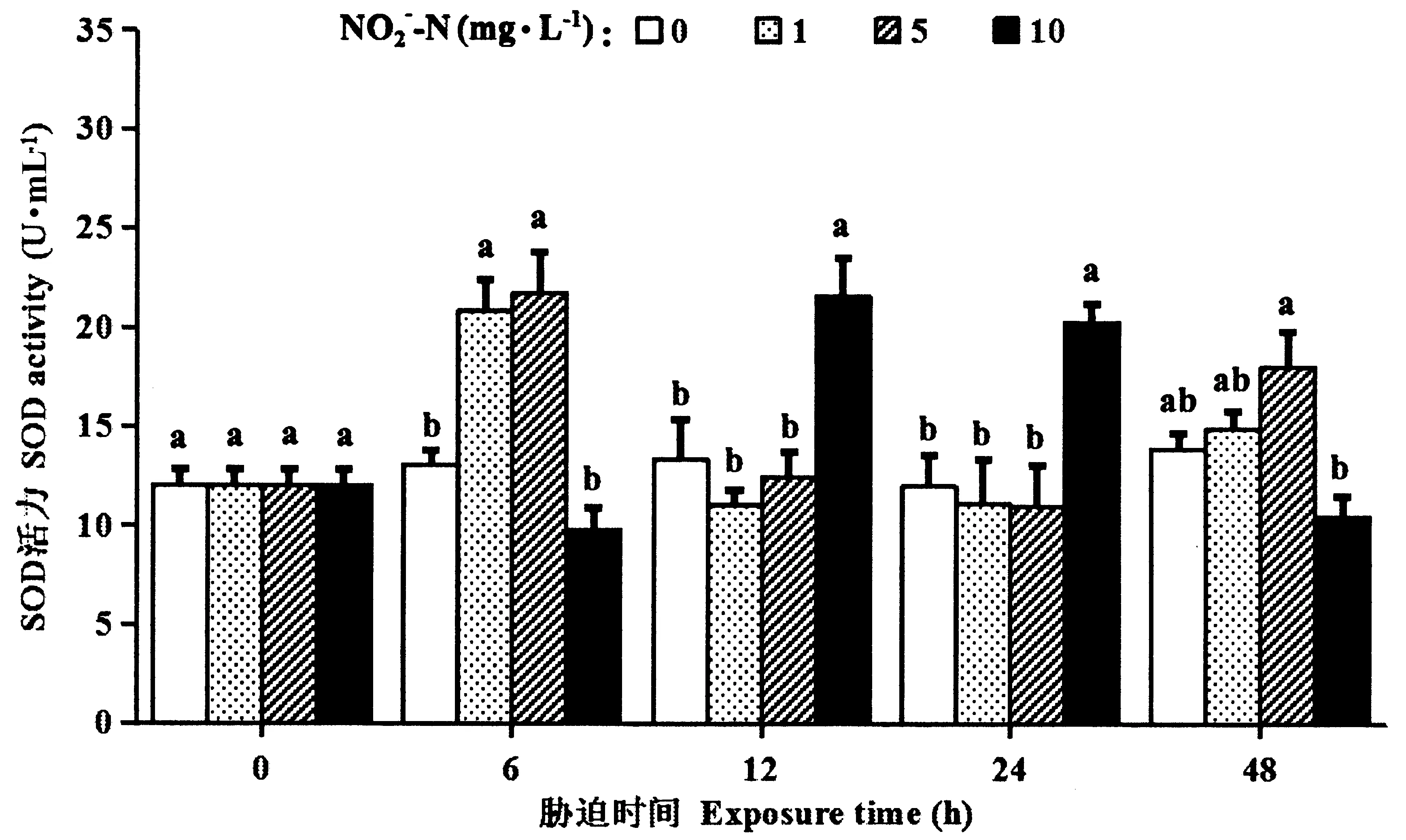
图4 亚硝酸盐胁迫下罗氏沼虾的血细胞SOD活力
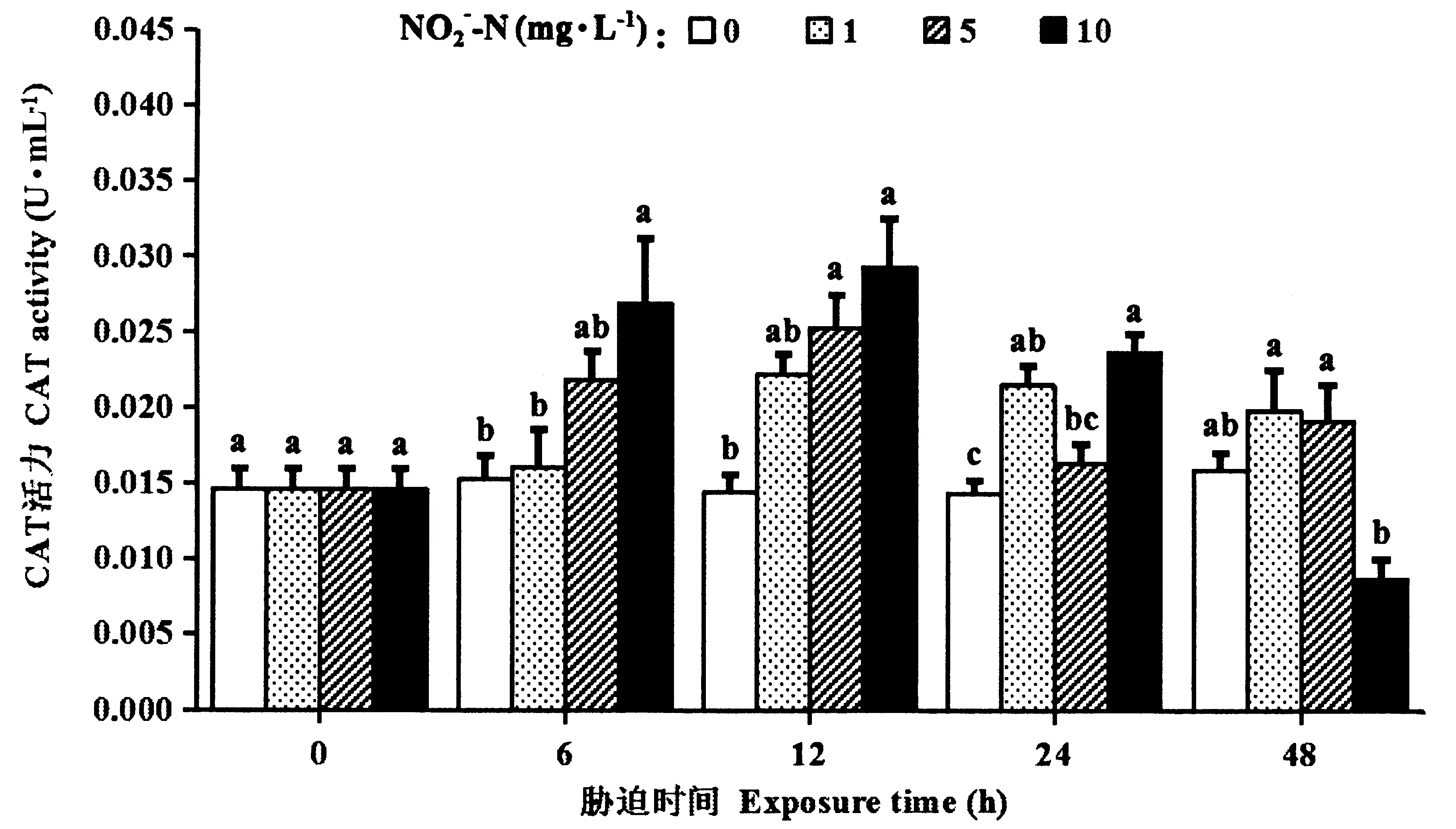
图5 亚硝酸盐胁迫下罗氏沼虾的血细胞CAT活力
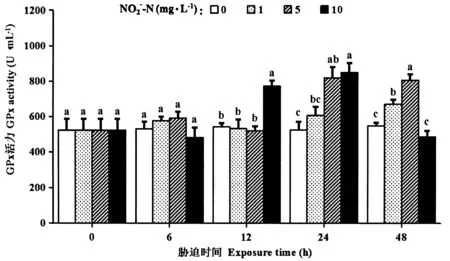
图6 亚硝酸盐胁迫下罗氏沼虾的血细胞GPx活力
3 讨论
3.1 亚硝酸盐对血细胞的影响
虾类为无脊椎动物,一般被认为仅具先天性免疫,血细胞在其生理和免疫过程中起着十分重要的作用(Johanssonetal.,2000)。虾类的循环血细胞数量,即THC,对外界环境十分敏感。研究显示,各类环境因子胁迫,如氨氮(Rodríguez-Ramosetal.,2008)、亚硝酸盐(Tseng & Chen,2004; Wangetal.,2004)、重金属(Lorenzonetal.,2001)、硫化物(Chengetal.,2007)和盐度(Wang & Chen,2006)等,均会导致THC下降,从而使虾的免疫力下降。当外界亚硝酸盐含量较高时,亚硝酸盐趋向于进入虾血淋巴中并积累(寇红岩等,2014; Chen & Chen,1992; Chengetal.,2007),此时亚硝酸盐直接接触并作用于血细胞,因此应重视亚硝酸盐的血细胞毒性影响研究。关于亚硝酸盐如何导致THC下降,Xianetal.(2011)借助FCM在斑节对虾上做了初步研究。本研究以淡水虾罗氏沼虾为研究对象,也得到了相似的结果,表明亚硝酸盐对淡水虾类的血细胞也具有相同的氧化胁迫毒性机制。另外,研究还发现,亚硝酸盐对罗氏沼虾血细胞的毒性影响具有明显的浓度和时间效应。当NO2--N浓度为1 mg·L-1时,在试验的48 h内,并未发现对细胞指标有显著的影响;浓度为5 mg·L-1时,细胞指标在胁迫后期出现显著的变化;而浓度为10 mg·L-1时,细胞指标在前期即发生显著变化。
一般认为,由于Cl-与NO2-会竞争鳃上的吸收位点,盐度越高,Cl-的含量就越高,竞争吸收进入虾体内的NO2-就越少,因此水体盐度越高,虾对亚硝酸盐的耐受能力越强(胡贤德等,2009),因而海水虾类的亚硝酸盐耐受能力普遍高于淡水虾类(寇红岩等,2014)。这在血细胞指标的变化上也有一定的体现,在斑节对虾的研究中,NO2--N浓度达到10 mg·L-1时,血细胞指标的显著变化也仅在胁迫后期才开始发生;浓度达到20 mg·L-1时,血细胞指标在前期即开始有显著变化(Xianetal.,2011)。相比较之下,罗氏沼虾血细胞对外界亚硝酸盐浓度更为敏感,耐受能力较斑节对虾低。为使罗氏沼虾的胁迫响应更为显著,根据预试验结果,本研究选定了较高的亚硝酸氮浓度。试验过程中发现,经5和10 mg·L-1胁迫24 h,罗氏沼虾的活动变得迟钝缓慢,但48 h试验过程中未出现死亡个体。
3.2 亚硝酸盐对抗氧化酶活力的影响
抗氧化酶是机体内清除过量ROS的重要工具,在正常生理状态下,ROS的产生和清除在抗氧化酶以及其他抗氧化物质的作用下处于良好的动态平衡中;当机体受到环境胁迫时,这种动态平衡往往会被打破,机体容易受到氧化损伤,此时抗氧化酶活力的调动是机体进行抗氧化防御的重要手段。研究显示,环境胁迫如温度、pH、氨氮等会诱导虾类抗氧化酶基因表达水平或酶活力提高,以进行抗氧化防御(蒋琦辰等,2013; Wangetal.,2009; Zhouetal.,2010);但当环境胁迫程度较高或胁迫时间延长时,抗氧化系统不足以控制ROS的过量产生,细胞便会受到氧化损伤,导致抗氧化体系反而受到破坏,抗氧化酶转录水平或酶活力会呈现出被抑制的状态(刘晓华等,2007; 王玥等,2005; Wangetal.,2009)。在较多的亚硝酸盐胁迫研究中,不论以肝胰腺、鳃、血清还是以肌肉为研究对象,往往都表现出对抗氧化酶活力的抑制性(黄翔鹄等,2006; 吕晓燕等,2010; 王玥等,2005),这与胁迫浓度和时间有一定关系,另外可能由于亚硝酸盐自身也具有强氧化性,相比温度、pH等环境因子,对抗氧化酶具有更强的破坏性。当凡纳滨对虾Litopenaeusvannamei(Boone)受亚硝酸盐胁迫时,其血细胞中的Mn-SOD、CAT、GPx和硫氧还蛋白的转录水平均被不同程度地诱导提高(Guoetal.,2013)。本研究中,为了探讨血细胞对亚硝酸盐胁迫作出的胞内抗氧化响应,测定了血细胞胞内的抗氧化酶活力。结果显示,胞内的SOD、CAT和GPx活力均不同程度地升高,与凡纳滨对虾的表达量研究结果相似,表明血细胞调动了胞内的抗氧化酶体系以对抗亚硝酸盐胁迫带来的氧化威胁。
如本试验所述,在1 mg·L-1最低浓度胁迫时,THC、ROS含量和凋亡率均未发生显著变化,但3类抗氧化酶的活力却有一定程度的提高,表明在此亚硝酸盐浓度下,血细胞通过调动胞内的抗氧化酶体系,维持了胞内的氧化与抗氧化动态平衡,保护血细胞免受损伤,因此在THC等细胞指标上没有体现出胁迫响应变化。随着亚硝酸盐浓度的提高,虽然抗氧化酶活力也被诱导提高,但细胞指标也出现了显著的负面变化,表明此时被激活提高的抗氧化酶体系不足以对抗高浓度亚硝酸盐造成的氧化胁迫,导致血细胞受到氧化损伤。
CAT和GPx均是清除H2O2的抗氧化酶。在本研究中,CAT和GPx活力的变化体现了一定的时间效应,CAT活力主要在胁迫前期被诱导提高,而GPx活力的提高主要出现在胁迫后期。这些结果表明,CAT和GPx具有协同作用,在亚硝酸盐胁迫时,罗氏沼虾血细胞优先调动了CAT进行H2O2的清除,而随着胁迫时间的延长,GPx成为清除H2O2的主力。关于CAT和GPx的协同作用,在其他一些环境因子胁迫过程中也有相似的体现(Wangetal.,2009; Zhouetal.,2010)。
本研究结果显示了抗氧化酶在抗亚硝酸盐胁迫过程中扮演着重要角色。营养学研究表明,在饲料中添加适量的营养素或添加剂可提高水产动物的抗氧化活力,尤其是铜、锰等与抗氧化酶组成相关的矿物元素(郭志勋等,2003; 王宏伟等,2008),以及维生素C、E等自身具有抗氧化能力的物质(秦志华等,2007; 周立斌等,2009)。因此,在饲料中添加适量的这些营养素或添加剂可能有助于提高虾类的抗亚硝酸盐胁迫能力,这在一些初步的研究中已有体现(冼健安等,2013),更广泛的证据还有待进一步研究。通过营养学角度提高虾类的抗亚硝酸盐胁迫能力,可更安全、便捷地降低养殖风险、减少用药,是发展可持续生态养殖的理想途径。
郭志勋, 陈毕生, 徐力文, 郑石轩, 湛波, 刘立鹤, 程开敏, 2003. 饲料铜的添加量对南美白对虾生长、血液免疫因子及组织铜的影响. 中国水产科学, 10(6): 526-528.
胡贤德, 孙成波, 王平, 古文光, 阮德雄, 黄海立, 2009. 不同盐度条件下亚硝酸氮对斑节对虾的毒性影响. 沈阳农业大学学报, 40(1): 103-106.
胡义波, 王玥, 姜乃澄, 2005. 氨态氮、亚硝态氮对罗氏沼虾血细胞及超微结构的影响. 浙江大学学报(理学版), 32(6): 691-697.
黄翔鹄, 李长玲, 郑莲, 刘楚吾, 周洁, 2006. 亚硝酸盐氮对凡纳滨对虾毒性和抗病相关因子影响. 水生生物学报, 30(4): 466-471.
蒋琦辰, 顾曙余, 张文逸, 张呈祥, 冯晓庆, 谭红月, 杨家新, 黄文婷, 李枫, 2013. 氨氮急性胁迫及其毒后恢复对红螯光壳螯虾幼虾相关免疫和代谢指标的影响. 水产学报, 37(7): 1066-1072.
寇红岩, 冼健安, 郭慧, 钱坤, 苗玉涛, 叶超霞, 潘训彬, 王安利, 2014. 亚硝酸盐对虾类毒性影响的研究进展. 海洋科学, 38(2): 107-115.刘晓华, 曹俊明, 杨大伟, 周萌, 赵红霞, 马力, 蓝汉冰, 谢从新, 黄志刚, 2007. 氨氮胁迫前后凡纳滨对虾组织中抗氧化酶和脂质过氧化产物的分布. 水利渔业, 27(6): 24-26.吕晓燕, 李嘉尧, 方燕, 郭占林, 赵云龙, 李恺, 2010. 亚硝酸盐对红螯光壳螯虾不同组织免疫相关酶活性及超微结构的影响. 水产学报, 34(12): 1812-1820.
彭自然, 臧维玲, 高杨, 江敏, 徐桂荣, 丁福江, 2004. 氨和亚硝酸盐对凡纳滨对虾幼虾的毒性影响. 上海水产大学学报, 13(3): 274-278.
秦志华, 李健, 王群, 刘淇, 2007. Vc-2-多聚磷酸酯对中国对虾稚虾生长、免疫及体内Vc含量的影响. 海洋水产研究, 28(4): 66-71.
王宏伟, 曹向可, 钱庆增, 王亚斌, 2008. 饲料中锰对日本沼虾抗氧化酶活性的影响. 河北大学学报(自然科学版), 28(3): 300-304.
王玥, 胡义波, 姜乃澄, 2005. 氨态氮、亚硝态氮对罗氏沼虾免疫相关酶类的影响. 浙江大学学报(理学版), 32(6): 698-705.
冼健安, 苟妮娜, 陈晓丹, 苗玉涛, 王安利, 2012a. 流式细胞术检测虾类血细胞活性氧含量方法的建立. 海洋科学, 36(2): 29-33.
冼健安, 苗玉涛, 叶超霞, 叶剑敏, 郭慧, 张胜鹏, 王安利, 2013. 饲料铜含量对亚硝酸盐胁迫下斑节对虾血细胞的影响. 水生态学杂志, 34(5): 71-75.
冼健安, 王安利, 苗玉涛, 2012b. 流式细胞术在克氏原螯虾血细胞的分类、活性和免疫功能中的应用. 淡水渔业, 42(1): 9-14, 57.
周立斌, 王安利, 张伟, 张海发, 2009. 饲料维生素E含量对美国红鱼生长和非特异性免疫的影响. 渔业科学进展, 30(1): 47-53.
Chen J C and Chen S F, 1992. Accumulation of nitrite in the haemolymph ofPenaeusmonodonexposed to ambient nitrite.ComparativeBiochemistryandPhysiologyC,Toxicology&Pharmacology, 103(3): 477-481.
Cheng S Y, Hsu S W and Chen J C, 2007. Effect of sulfide on the immune response and susceptibility toVibrioalginolyticusin the kuruma shrimpMarsupenaeusjaponicus.Fish&ShellfishImmunology, 22(1/2): 16-26.
Guo H, Xian J A, Li B, Ye C X, Wang A L, Miao Y T and Liao S A, 2013. Gene expression of apoptosis-related genes, stress protein and antioxidant enzymes in hemocytes of white shrimpLitopenaeusvannameiunder nitrite stress.ComparativeBiochemistryandPhysiologyPartC,Toxicology&Pharmacology, 157(4): 366-371.
Johansson M W, Keyser P, Sritunyalucksana K and Soderhall K, 2000. Crustacean haemocytes and haematopoiesis.Aquaculture, 191: 45-52.
Lorenzon S, Francese M, Smith V J and Ferrero E A, 2001. Heavy metals affect the circulating haemocyte number in the shrimpPalaemonelegans.FishandShellfishImmunology, 11(6): 459-472.Rodríguez-Ramos T, Espinosa G, Hernández-López J, Gollas-Galván T, Marrero J, Borrell Y, Alonso M E, Bécquer U and Alonso M, 2008. Effects ofEcherichiacolilipopolysaccharides and dissolved ammonia on immune response in southern white shrimpLitopenaeusschmitti.Aquaculture, 274(1): 118-125.
Tseng I T and Chen J C, 2004. The immune response of white shrimpLitopenaeusvannameiand its susceptibility toVibrioalginolyticusunder nitrite stress.Fish&ShellfishImmunology, 17(4): 325-333.
Wang F I and Chen J C, 2006. Effect of salinity on the immune response of tiger shrimpPenaeusmonodonand its susceptibility toPhotobacteriumdamselaesubsp. damselae.Fish&ShellfishImmunology, 20(5): 671-681.
Wang W N, Wang A L, Zhang Y J, Li Z H, Wang J X and Sun R Y, 2004. Effects of nitrite on lethal and immune response ofMacrobrachiumnipponense.Aquaculture, 232: 679-686.
Wang W N, Zhou J, Wang P, Tian T T, Zheng Y, Liu Y, Mai W J and Wang A L, 2009. Oxidative stress, DNA damage and antioxidant enzyme gene expression in the Pacific white shrimp,Litopenaeusvannameiwhen exposed to acute pH stress.ComparativeBiochemistryandPhysiologyC, 150(4): 428-435.
Xian J A, Wang A L, Chen X D, Gou N N, Miao Y T, Liao S A and Ye C X, 2011. Cytotoxicity of nitrite on haemocytes of the tiger shrimp,Penaeusmonodon, using flow cytometric analysis.Aquaculture, 317: 240-244.
Zhou J, Wang L, Xin Y, Wang W N, He W Y, Wang A L and Liu Y, 2010. Effect of temperature on antioxidant enzyme gene expression and stress protein response in white shrimp,Litopenaeusvannamei.JournalofThermalBiology, 35(6): 284-289.
(责任编辑:郭莹)
Effects of nitrite on haemocyte and antioxidant enzyme activity inMacrobrachiumrosenbergii
Jian-an XIAN1,2, Xiu-xia ZHANG1, Hui GUO3, Dong-mei WANG1, An-li WANG2*
1InstituteofTropicalBioscienceandBiotechnology,ChineseAcademyofTropicalAgriculturalSciences,Haikou,Hainan571101,China;2KeyLaboratoryofEcologyandEnvironmentalScienceofGuangdongHigherEducationInstitutes,GuangdongProvincialKeyLaboratoryforHealthyandSafeAquaculture,SchoolofLifeScience,SouthChinaNormalUniversity,Guangzhou,Guangdong510631,China;3KeyLaboratoryofAquacultureinSouthChinaSeaforAquaticEconomicAnimalofGuangdongHigherEducationInstitutes,CollegeofFisheries,GuangdongOceanUniversity,Zhanjiang,Guangdong524025,China
【Background】 Nitrite is one of the most common pollutants in intensive shrimp aquaculture. In order to provide theoretical basis of nitrite prevention and cure for culture ofMacrobrachiumrosenbergii, we investigated the toxicity effects of nitrite onM.rosenbergiihaemocytes, and the role of antioxidant enzymes in anti-nitrite defense. 【Method】 Prawns were exposed to different doses (0, 1, 5 and 10 mg·L-1) of NO2--N. Reactive oxygen species (ROS) production in haemocytes and apoptotic haemocyte ratio were determined by flow cytometry. The total haemocyte count (THC) and intracellular antioxidant enzyme activities were also analysed after 0, 6, 12, 24 and 48 h exposure. 【Result】 Results showed that 1 mg·L-1NO2--N had no significant effect on ROS production, apoptotic cell ratio and THC. Increase of ROS production and decline of THC could be observed in prawn exposed to 5 mg·L-1NO2--N after 24 h, and increase of apoptotic ratio occurred after 48 h. Increase of both ROS production and apoptotic ratio were observed in prawn exposed to 10 mg·L-1NO2--N after 6 h, and THC decreased after 12 h. Superoxide dismutase (SOD), catalase (CAT), and glutathion peroxidase (GPx) activities in haemocytes were induced by NO2--N to different levels. 【Conclusion and significance】 These results clearly demonstrate the dose- and time-dependent toxic effect of nitrite. They also indicate that nitrite could induce the ROS generation in prawn haemocytes and then the overproduction of ROS causeing haemocyte apoptosis and subsequent THC decline. This process of oxidative stress is one of the cytotoxicity mechanisms of nitrite onM.rosenbergii. The induced activities of antioxidant enzymes indicate that these antioxidant enzymes play a vital role in anti-nitrite defence.
nitrite;Macrobrachiumrosenbergii; haemocyte; oxidative stress; antioxidant activity
2016-04-25 接受日期(Accepted): 2016-05-30
广东省自然科学基金(2015A030310438、S2012040008093)
冼健安, 男, 助理研究员, 博士。 研究方向: 水产养殖生态及毒理学。 E-mail: xian-ja@163.com
*通讯作者(Author for correspondence), E-mail: wanganl@scnu.edu.cn
10. 3969/j.issn.2095-1787.2016.04.012
