血清CD64、CD54、sTREM-1在儿童细菌性肺炎早期诊断及鉴别中的价值
2016-12-05仲美凤范玉金朱科研肖月红吴晓凤陈海华
仲美凤,范玉金,朱科研,肖月红,吴晓凤,陈海华
(淮安市淮阴医院,江苏淮安 223300)
血清CD64、CD54、sTREM-1在儿童细菌性肺炎早期诊断及鉴别中的价值
仲美凤,范玉金,朱科研,肖月红,吴晓凤,陈海华
(淮安市淮阴医院,江苏淮安 223300)
目的 探讨血清CD64、CD54、可溶性髓系细胞触发受体-1(sTREM-1)在儿童细菌性肺炎早期诊断及鉴别诊断中的价值。方法 选取肺炎患儿60例,根据病原体培养和X线摄片,分为细菌性肺炎组、支原体肺炎组、病毒性肺炎组,各20例;同时选取同期健康体检儿童20例作为对照组。ELISIA法检测各组血清CD64、CD54和sTREM-1,采用受试者工作特征(ROC)曲线对各组血清CD64、CD54和sTREM-1的表达进行诊断性分析,评价单个指标以及联合指标诊断细菌性肺炎的敏感性、特异性。结果 CD64、sTREM-1表达:细菌性肺炎组均高于支原体肺炎组、病毒性肺炎组、对照组(P均<0.05);支原体肺炎组、病毒性肺炎组、对照组比较差异均无统计学意义(P均>0.05)。CD54表达:细菌性肺炎组、支原体肺炎组、病毒性肺炎组均高于对照组(P均<0.05);细菌性肺炎组、支原体肺炎组、病毒性肺炎组比较差异均无统计学意义(P均>0.05)。CD64、sTREM-1及二者联合检测诊断细菌性肺炎的ROC曲线下面积分别为0.898、0.828、0.975。CD64临界值为650.45 pg/mL时诊断细菌性肺炎的敏感性为80.29%,特异性为91.05%;sTREM-1在临界值为1 503.37 pg/mL时诊断细菌性肺炎的敏感性为75.97%,特异性为85.43%;两项指标联合诊断细菌性肺炎的敏感性为95.29%,特异性为90.14%。结论 血清CD64、sTREM-1可作为儿童细菌性肺炎的早期诊断指标,二者联合检测诊断效能更高;CD54可早期诊断儿童肺炎,但对肺炎病原学的鉴别诊断无意义。
肺炎;CD64;CD54;可溶性髓系细胞触发受体-1;鉴别诊断;儿童
支气管肺炎是小儿的一种主要常见呼吸系统疾病,是婴儿时期的主要死亡原因之一。按照感染的病原微生物,支气管肺炎可分为细菌性肺炎、病毒性肺炎和支原体肺炎;其鉴别诊断的常用指标为外周血白细胞、中性粒细胞、淋巴细胞计数及血沉等,但特异性不高。微生物培养(主要是细菌培养,病毒、原虫等培养难度较大)是儿童肺炎病原学诊断的主要依据,但培养时间长,且假阳性率高,容易导致漏诊。本研究探讨血清CD64、CD54和可溶性髓系细胞触发受体-1(sTREM-1)儿童细菌性肺炎早期诊断及鉴别诊断中的价值。
1 资料与方法
1.1 临床资料 选取2014年11月~2015年5月我院儿科住院的肺炎患儿60例,其中男32例、女28例,年龄4~8(5.8±2.0)岁,均符合《诸福棠实用儿科学》肺炎诊断标准。咳嗽时间0~4(2.2±0.5)天,体温36.5~39.3(38.3±1.0)℃。均排除真菌性肺炎及其他非感染因素引起的肺炎。根据呼吸道分泌物病原学检测结果诊断为结细菌性肺炎20例(细菌性肺炎组)、支原体肺炎20例(支原体肺炎组)、病毒性肺炎20例(病毒性肺炎组);选取同期健康体检者20例作为对照组。各组性别、年龄比较差异无统计学意义。
1.2 血清CD64、CD54、sTREM-1检测 各组采集空腹上肢静脉血2.5 mL,注入柠檬酸钠抗凝离心管,摇匀,在4 ℃条件下3 000 r/min离心10 min,取血清-80 ℃冷冻待测,采用ELISIA法检测CD64、CD54和sTREM-1。试剂盒均购自大连宝生物工程有限公司。
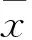
2 结果
2.1 各组血清CD64、CD54、sTREM-1表达比较 CD64、sTREM-1在细菌性肺炎组表达均明显高于支原体肺炎组、病毒性肺炎组、对照组(P均<0.05);CD64、sTREM-1在支原体肺炎组、病毒性肺炎组、对照组表达比较差异均无统计学意义(P均>0.05)。CD54在细菌性肺炎组、支原体肺炎组、病毒性肺炎组均高于对照组(P均<0.05);CD54在细菌性肺炎组、支原体肺炎组、病毒性肺炎组比较差异均无统计学意义(P均>0.05)。见表1。

表1 各组血清CD64、CD54、sTREM-1表达比较
2.2 CD64、sTREM-1在细菌性肺炎组血清中表达的ROC曲线 以灵敏度为纵坐标,以1-特异性为横坐标作ROC曲线,计算曲线下面积,CD64、sTREM-1以及二者联合诊断细菌性肺炎的ROC曲线下面积分别为0.898、0.828、0.975。见图1。
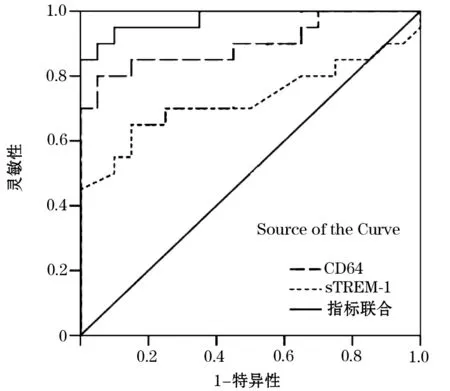
图1 细菌性肺炎组血清CD64、sTREM-1表达的ROC曲线2.3 CD64、sTREM-1单独及联合诊断细菌性肺炎的效能 CD64临界值为650.45 pg/mL时诊断细菌性肺炎的敏感性为80.29%,特异性为91.05%;sTREM-1临界值为1 503.37 pg/mL时诊断细菌性肺炎的敏感性为75.97%,特异性为85.43%;两项指标联合诊断细菌性肺炎的敏感性为95.29%,特异性为90.14%。
3 讨论
病原微生物培养是鉴别肺炎种类的最常用方法,但其培养周期长,病情危重者可能会错失对症治疗的最好时机。因此寻找一种早期敏感性、特异性高的指标鉴别不同类型的肺炎显得尤为重要。
正常细胞表面仅表达少量CD64,感染时在多种炎症因子刺激的作用下,可使CD64在中性粒细胞的表面大量表达[1]。CD64表达上调对机体的免疫防御功能十分重要。细菌感染时中性粒细胞CD64表达在4~6 h内就会增高,是白细胞产生吞噬作用的早期信号。中性粒细胞最初的吞噬作用是通过细胞、颗粒等刺激物与粒细胞表面的CD64结合,继而结合到粒细胞表面,最终被吞噬[2]。Lynema等[3]的研究表明,CD64对诊断婴幼儿感染性疾病具有较高的敏感性。江永青等[4]研究表明,儿童细菌性肺炎组CD64百分比明显高于支原体性、病毒性肺炎组和健康对照组,而支原体性和病毒性肺炎组与健康对照组相比无明显差异,提示CD64可作为小儿肺炎鉴别诊断的重要指标。研究发现,病毒性感染并不会引起CD64在中性粒细胞的表达量增加[5];CD64在细菌性肺炎组的表达明显高于病毒性肺炎组和支原体肺炎组,CD64的表达与CRP呈正相关[6];参与细菌性肺炎的主要炎症细胞是中性粒细胞。本研究CD64对儿童细菌性肺炎的诊断特异性较高,验证了上述观点。
CD54即细胞间黏附分子-1,属于黏附分子中免疫球蛋白超家族(IGSF)中的成员,是介导黏附反应重要的黏附分子之一[7]。Traub等[8]研究表明,这种黏附能够被CD54抗体所终止。细胞因子能够显著增加CD54的表达,在炎症、感染以及肿瘤等疾病中发现可溶性黏附因子在血清中的浓度显著升高。Gearing等[9]研究表明,黏附因子水平可用来监视这些疾病的进展,从而反映疾病的严重程度。CD54单克隆抗体能够在一定程度上特异性阻断病毒感染引起的细胞炎症反应和呼吸道感染,用于治疗肺部感染性疾病具有良好的效果。CD54参与了肺炎发病的过程,抑制其表达有利于肺炎的治疗[10]。鼠肺炎模型研究发现,CD54在肺炎初期中性粒细胞趋化与黏附过程中发挥重要的作用[11]。急性病毒性呼吸道感染时上皮细胞可通过自身高表达的CD54促进其与中性粒细胞和嗜酸性粒细胞的黏附,进而游走至气道发挥作用。支原体肺炎时,支原体在气道上皮细胞表面增殖并释放毒性物质导致上皮细胞损伤,引起炎症细胞浸润的同时,各种炎症因子使支气管肺泡Ⅱ型上皮细胞CD54 mRNA表达增加,导致CD54水平升高。细菌、病毒、支原体感染均可使CD54表达量增加。本研究细菌性肺炎组、病毒性肺炎组、支原体性肺炎组CD54表达比较无统计学差异,与上述结论一致,证实CD54可作为儿童肺炎的诊断依据,但无法对肺炎类型做出鉴别。
sTREM-1是一种相对分子质量为30 000的免疫球蛋白家族成员,与机体炎症反应发生、发展密切相关,可表达于CD4+单核/巨噬细胞、中性粒细胞[12]。sTREM-1明显升高常提示重症感染的存在。近年的研究表明[13,14],TREM-1在炎症发生病理过程中起着重要的作用,是机体免疫反应的泛化器。本研究结果显示,sTREM-1在细菌性肺炎组表达明显高于病毒性肺炎组、支原体性肺炎组,提示sTREM-1可鉴别诊断细菌性肺炎。但Poukoulidou等[15]研究表明,sTREM-1在重症脓毒血症的表达反而低于轻度感染症状患者,可能与潜在的感染类型和不同感染病原体有关。sTREM-1在细菌性肺炎中显著升高否与细菌种类有关,在临床实践中是否能够借此判断致病菌的大致分类等问题,本次研究中尚无数据支持,需进一步研究、探讨。
本研究表明,CD64、sTREM-1诊断细菌性肺炎的敏感性、特异性均较高;二者联合检测能进一步提高准确率。
综上所述,CD64、sTREM-1可作为儿童细菌性肺炎的鉴别诊断指标,二者联合诊断细菌性肺炎的效能更高;CD54可诊断儿童肺炎,但无法对肺炎病原体作出鉴别诊断。
[1] De Haas M. IgG-Fc receptors and the clinical relevance of their polymorphisms[J]. Wien Klin Wochenschr, 2001,113(20-21):825-831.
[2] Wagner C, Deppisch R, Denefleh B, et al. Expression patterns of the lipopolysaccharide receptor CD14, and the FCγ receptors CD16 and CD64 on polymorphonuclear neutrophils: data from patients with severe bacterial infections and lipopolysaccharide-exposed cells[J]. Shock, 2003,19(1):5-12.
[3] Lynema S, Marmer D, Hall ES, et al. Neutrophil CD64 as a diagnostic marker of sepsis: impact on neonatal care[J]. Am J Perinatol, 2015,32(4):331-336.
[4] 江永青,胡志坚,荀春华.CD64和CRP联合检测对小儿肺炎早期诊断的价值[J].实验与检验医学,2014,6(32):304-306.
[5] Allen E, Bakke AC, Purtzer MZ, et al. Neutrophil CD64 expression: distinguishing acute inflammatory autoimmune disease from systemic infections[J]. Ann Rheum Dis, 2002,61(6):522-525.
[6] Cai Q, Xu M Y. Value of neutrophil CD64 in the diagnosis of community acquired pneumonia in children[J]. Zhongguo Dang Dai Er Ke Za Zhi, 2012,14(11):819-822.
[7] Sarecka Hujar B, Zak I, Krauze J. Interactions between rs5498 polymorphismin the ICAM1 gene and traditional risk factors influence susceptibility to coronary artery disease[J].Clin Exp Med, 2009,9(2):117-124.
[8] Traub S, Nikonova A, Carruthers A, et al. An anti-human icam-1 antibody inhibits rhinovirus-induced exacerbations of lung inflammation[J]. PLoS Pathog, 2013,9(8):e1003520.
[9] Gearing AJ, Newman W. Circulating adhesion molecules indisease[J]. Immunol Today, 1993,14(10):506-512.
[10] Mendez MP, Monroy YK, Du M, et al. Overexpression of sICAM-1 in the alveolar epithelial space results in an exaggerated inflammatory response and early death in Gram negative pneumonia[J]. Respir Res, 2011(12):12.
[11] Bonten MJ, FroonAH, Gaillard CA, et al. The systemic in flammatory response in the development of ventilator-associated pneumonia[J]. Am J Respir Crit Care Med, 1997,156(4pt1):1105-1113.
[12] Chen LC, Laskin JD, Gordon MK, et al. Regulation of TREM expression in hepatic macrophages and endothelial ceils during acute endotoxemia[J]. Exp Mol Pathol, 2008,84(2):145-155.
[13] Latour-Perez J, Alcala-Lopez A, Garcia-Garcia MA, et al. Diagnostic accuracy of sTREM-1 to identify infection in critically ill patients with systemic inflammatory response syndrome[J]. Clin Biochem, 2010,43(9):720-724.
[14] Barati M, Bashar FR, Shahrami R, et al. Soluble triggering receptor expressed on myeloid cells l and the diagnosis of sepsis[J]. J Crit Care, 2010,25(2):362.
[15] Poukoulidou T, Spyridaki A, Mihailidou I, et al. TREM-1 expression on neutrophils and monocytes of septic patients: relation to the underlying infection and the implicated pathogen[J]. BMC Infect Dis, 2011(11):309.
10.3969/j.issn.1002-266X.2016.36.027
R563.1
B
1002-266X(2016)36-0078-03
2015-11-21)
