紫花牡荆素对肺癌A549细胞增殖及凋亡的影响
2016-12-05张春春轩亚茹王亚华闫荷露李霞唐辉应雪
张春春,轩亚茹,王亚华,闫荷露,李霞,唐辉,应雪
(新疆石河子大学药学院,新疆石河子 832000)
紫花牡荆素对肺癌A549细胞增殖及凋亡的影响
张春春,轩亚茹,王亚华,闫荷露,李霞,唐辉,应雪
(新疆石河子大学药学院,新疆石河子 832000)
目的 探讨紫花牡荆素对肺癌A549细胞(简称肺癌细胞)增殖及凋亡的影响,为其用于临床治疗肺癌提供依据。方法 取对数生长期的肺癌细胞,分别加入终浓度为0.1、0.5、1、5、10、25、50、100 μmol/L紫花牡荆素溶液,分别作用24、48 h,采用SRB法检测增殖抑制率,计算50%抑制浓度(IC50)。取对数生长期的肺癌细胞,分别加入最终浓度为0、5、15 μmol/L紫花牡荆素溶液,Hoechst33258染色后共聚焦显微镜下观察细胞凋亡形态;采用流式细胞术检测细胞周期时相分布。结果 随紫花牡荆素浓度升高,作用24、48 h的肺癌细胞增殖抑制率均呈上升趋势。经0.5~100 μmol/L紫花牡荆素作用48 h的肺癌细胞增殖抑制率均明显高于同一浓度作用24 h的肺癌细胞(P均<0.05)。紫花牡荆素作用24、48 h时的IC50分别为14.74、8.16 μmol/L。随紫花牡荆素浓度升高,作用24 h的肺癌细胞核染色质固缩偏向一边、核裂解和细胞碎片等细胞凋亡形态学改变越来越明显;与同浓度紫花牡荆素作用24 h比较,作用48 h的肺癌细胞凋亡形态学改变更明显。经0、5、15 μmol/L紫花牡荆素作用24、48 h的肺癌细胞凋亡率均逐渐升高,处于G1、S期的比例均逐渐降低,处于G2/M期的比例均逐渐升高(P均<0.05)。与同一浓度紫花牡荆素作用24 h的肺癌细胞比较,经5、15 μmol/L紫花牡荆素作用48 h的肺癌细胞凋亡率均升高,处于G1、S期的比例均降低,处于G2/M期的比例均升高(P均<0.05)。结论 紫花牡荆素可将肺癌细胞阻滞于G2/M期,具有增殖抑制作用和凋亡促进作用,并呈时间、浓度依赖性。
肺癌;A549细胞;紫花牡荆素;细胞凋亡;细胞增殖;细胞周期
紫花牡荆素为天然存在的多甲氧基黄酮类化合物,存在于水果、蔬菜、中草药等多种植物中[1]。国内外研究表明,紫花牡荆素对正常细胞的增殖无影响或影响很小,对人前列腺癌[2]、结肠癌[3]、白血病[4]、乳腺上皮癌[5]细胞增殖有明显的抑制作用,但其对肺癌细胞影响的报道较少。2013年8月~2015年12月,本研究观察了紫花牡荆素对人肺癌A549细胞增殖及凋亡的影响,以期为肺癌的临床治疗提供依据。
1 材料与方法
1.1 材料 肺癌A549细胞(简称肺癌细胞)购自中国科学院上海细胞生物学研究所,将其置于含10% FBS、100 U/mL青霉素、100 μg/mL链霉素的DMEM-F12培养基中,37 ℃、5% CO2饱和湿度培养箱中孵育,取对数生长期细胞进行实验。试剂及仪器:紫花牡荆素(纯度>98%,批号14111206)购自成都普瑞法科技开发有限公司。DMEM-F12培养基、0.25%胰酶均购自美国Gibco公司,DMSO、磺酰罗丹明B蛋白(SRB)均购自美国Sigma公司,PBS缓冲溶液购自上海生工生物工程有限公司,凋亡试剂盒、RNaseA和碘化丙啶(PI)均购自南京凯基生物科技发展有限公司。CO2恒温培养箱购自美国Thermo公司,酶标免疫测定仪购自美国Bio-rad公司,倒置显微镜购自日本Olympus公司,流式细胞仪购自美国BD公司。
1.2 实验方法
1.2.1 紫花牡荆素对肺癌细胞增殖影响的观察 取对数生长期肺癌细胞接种于96孔板中,调整细胞密度为5 000个/孔,设置3个复孔。将细胞培养板置于37 ℃、95%相对湿度的CO2培养箱中孵育24 h,待细胞贴壁生长后分别加入紫花牡荆素溶液使其最终浓度分别为0.1、0.5、1、5、10、25、50、100 μmol/L。另外设置3个复孔作为空白对照,将细胞培养板置于CO2培养箱中进行孵育。分别于孵育24、48 h时取出培养板,吸弃培养液,每孔加入10%三氯乙酸100 μL,-4 ℃冰箱中放置1 h进行固定。培养板各孔用去离子水洗涤,以去除三氯乙酸。在空气中干燥后,每孔加入0.4% SRB(以1%醋酸配制)100 μL,室温条件下放置15 min。弃去各孔内液体后用1%乙酸洗涤5遍,去除未结合染料。空气中干燥后加入10 mmol/L Tris碱(pH 10.5)100 μL溶解,在平板振荡器上振荡20 min,置于酶标仪中,测定540 nm波长下每孔吸收度OD值。参照应雪等[6]的方法计算增殖抑制率和50%抑制浓度(IC50)。
1.2.2 紫花牡荆素对肺癌细胞凋亡影响的观察 取对数生长期的肺癌细胞接种于6孔板中,调整细胞密度为2×105个/孔,于37 ℃、95%相对湿度的CO2培养箱中孵育24 h。待细胞贴壁生长后分别加入紫花牡荆素溶液使其最终浓度分别为0、5、15 μmol/L,将细胞培养板置于CO2培养箱中分别孵育24、48 h,收集细胞。预冷的PBS冲洗2遍,经磷脂酰丝氨酸(Annexin V-FITC)和碘化丙啶(PI)双染色,采用流式细胞仪检测细胞凋亡率,实验重复3次。取对数生长期肺癌细胞接种于12孔板中,调整细胞密度为2×104个/孔,于37 ℃、5% CO2条件下培养24 h。待细胞贴壁生长后分别加入紫花牡荆素溶液使其最终浓度分别为0、5、15 μmol/L,将细胞培养板置于CO2培养箱中分别孵育24、48 h,收集细胞。预冷的PBS 洗涤2遍,4%甲醛固定,加入浓度为10 μg/mL的Hoechst 33258,于37 ℃条件下染色10 min,PBS洗涤2遍,置于共聚焦显微镜下观察细胞凋亡形态并拍照。

2 结果
2.1 细胞增殖抑制率 随紫花牡荆素浓度升高,作用24、48 h的肺癌细胞增殖抑制率均呈上升趋势。经0.5~100 μmol/L紫花牡荆素作用48 h的肺癌细胞增殖抑制率均明显高于同一浓度作用24 h的肺癌细胞(P均<0.05)。经0.1 μmol/L紫花牡荆素作用24 h和作用48 h的肺癌细胞增殖抑制率比较差异无统计学意义(P均>0.05)。见表1。紫花牡荆素作用24、48 h时的IC50分别为14.74、8.16 μmol/L。
2.2 细胞凋亡率及形态变化 经0、5、15 μmol/L紫花牡荆素作用24、48 h的肺癌细胞凋亡率均逐渐升高,两两比较P均<0.05。经5、15 μmol/L紫花牡荆素作用48 h凋亡率均高于同一浓度作用24 h(P均<0.05)。见表2。随紫花牡荆素浓度升高,作用24 h的肺癌细胞核染色质固缩偏向一边、核裂解和细胞碎片等细胞凋亡形态学改变越来越明显。与同浓度紫花牡荆素作用24 h比较,作用48 h的肺癌细胞凋亡形态学改变更明显。见插页Ⅱ图3。
2.3 细胞周期 随紫花牡荆素浓度升高(0、5、15 μmol/L),作用24、48 h的肺癌细胞处于G1、S期的比例均逐渐降低,处于G2/M期的比例均逐渐升高(P均<0.05)。经5、15 μmol/L作用48 h,处于G1、S期的细胞比例均低于同一浓度作用24 h,处于G2/M期的比例均高于同一浓度作用24 h(P均<0.05)。见表3。
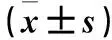
表1 不同浓度紫花牡荆素作用24、48 h肺癌细胞增殖抑制率比较
注:与同浓度紫花牡荆素作用24 h比较,*P<0.05。
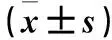
表2不同浓度紫花牡荆素对肺癌细胞作用24、48 h的细胞凋亡率比较
注:与0 μmol/L比较,*P<0.05;与5 μmol/L比较,#P<0.05;与同浓度紫花牡荆素作用24 h比较,△P<0.05。

表3 不同浓度紫花牡荆素作用24、48 h肺癌细胞周期分布比较±s)
注:与0 μmol/L比较,*P<0.05;与5 μmol/L比较,#P<0.05;与同浓度紫花牡荆素作用24 h比较,△P<0.05。
3 讨论
肿瘤形成的主要原因是细胞周期紊乱导致细胞增殖过多和凋亡减少,因此抑制细胞增殖、诱导其凋亡已经成为肿瘤治疗的重要手段之一[7]。紫花牡荆素分子式为C19H18O8,相对分子质量374.35,熔点为186~187 ℃,纯品为淡黄色晶体。紫花牡荆素学名5,3′-二羟基-3,6,7,4′ - 四甲氧基黄酮,又叫蔓荆子黄素,属于多甲氧基黄酮类化合物。本研究结果显示,随紫花牡荆素浓度升高,作用24 h和作用48 h的肺癌细胞增殖抑制率均呈上升趋势;经0.5~100 μmol/L紫花牡荆素作用48 h的肺癌细胞增殖抑制率均明显高于作用24 h;说明紫花牡荆素对肺癌细胞具有较强的抑制作用,且呈一定的时间、浓度依赖性。根据本研究中细胞增殖抑制率计算得到紫花牡荆素作用24、48 h的IC50分别为14.74、8.16 μmol/L,处于微摩尔水平,如在临床使用,该药的应用剂量较小。
研究表明,细胞凋亡细胞早期主要细胞表面磷脂酰丝氨酸(PS)发生易位[8],之后各种半胱氨酸蛋白酶的级联反应,胱天蛋白酶-3和PARP裂解而激活,细胞核核碎裂活化后,出现凋亡小体的产生和细胞体积缩小[9]。本研究结果显示,紫花牡荆素作用于肺癌细胞后可出现细胞核染色质固缩偏向一边、核裂解和细胞碎片等细胞凋亡形态学改变,且呈一定的时间、浓度依赖性,与流式细胞术检测得到的细胞凋亡率变化相符。本研究发现,紫花牡荆素将大部分肺癌细胞阻滞在G2/M期,可防止细胞形成纺锤体,抑制有丝分裂,最终达到促进细胞凋亡的目的。与长春新碱[10]、长春碱[11]和紫杉醇[12]等抗癌药物对癌细胞周期的影响类似。
研究发现,紫花牡荆素诱导肺癌细胞凋亡的机制可能与其降低肺癌细胞线粒体跨膜电位、促进线粒体细胞色素C释放、上调Bax蛋白表达水平有关[13,14],此外与活性氧和Capase介导的凋亡靶向癌细胞或通过调节凋亡相关蛋白如NF-κB抑制癌细胞的生长有关[18~21]。p53基因突变是肿瘤细胞产生药物耐药性的机制之一[22~25],但是紫花牡荆素诱导细胞凋亡是否与p53途径有关仍需进一步研究。
综上所述,紫花牡荆素可以抑制肺癌细胞增殖、促进其凋亡,并呈一定的时间和浓度依赖性。紫花牡荆素是天然存在的化合物,已经显示出了良好的抗肿瘤作用,有望成为潜在的抗癌新药。为了更好证明紫花牡荆素的抗癌潜力,还需要更多的基础研究和临床前试验,以确定其具体的作用机制及细胞内靶点。
[1] Rasul A, Zhao BJ, Liu J, et al. Molecular mechanisms of casticin action: an update on its antitumor functions[J]. Asian Pac J Cancer Prev, 2014,15(21):9049-9058.
[2] Diaz F, Chavez D, Lee D, et al. Cytotoxic flavone analogues of vitexicarpin, a constituent of the leaves of Vitexnegundo[J]. J Nat Prod, 2003,66(6):865-867.
[3] Tang SY, Zhong MZ, Yuan GJ, et al. Casticin, a flavonoid, potentiates TRAIL-induced apoptosis through modulation of anti-apoptotic proteins and death receptor 5 in colon cancer cells[J]. Oncol Rep, 2013,29(2):474-480.
[4] Shen JK, Du HP, Yang M, et al. Casticin induces leukemic cell death through apoptosis and mitotic catastrophe[J]. Ann Hema-tol, 2009,88(8):743-752.
[5] Haidara K, Zamir L, Shi QW, et al. The flavonoid casticin has multiple mechanisms of tumor cytotoxicity action[J]. Cancer Lett, 2006,242(2):180-190.
[6] 应雪,刘艳芳,袁苗苗,等.表柔比星-白藜芦醇复方脂质体的制备及体外抗肿瘤作用研究[J].中国药学杂志,2014(14):1233-1239.
[7] Seya T, Shime H, Ebihara T, et al. Pattern recognition receptors of innate immunity and their application to tumor immunotherapy[J]. Cancer Sci, 2010,101(2):313-320.
[8] Jiang L, Cao XC, Cao JG, et al. Casticin induces ovarian cancer cell apoptosis by repressing FoxM1 through the activation of FOXO3a[J].Oncol Lett, 20135(5):1605-1610.
[9] Choudhary MI, Jalil S, Nawaz SA, et al. Antiinflammatory and lipoxygenase inhibitory compounds from Vitexagnuscastus[J]. Phytother Res, 2009,23(9):1336-1339.
[10] 卢懿,侯世祥,陈彤.长春花抗癌成分长春新碱研究的进展[J].中国中药杂志,2003,28(11):1006-1008.
[11] 习利平,宋新波,张丽娟.长春碱类抗肿瘤药的研究进展[J].药物评价研究,2011,34(1):59-61.
[12] 史清文.天然药物化学史话:紫杉醇[J].中草药,2011,42(10):1878-1884.
[13] 安东建,陈周行,曹建国.活性氧在紫花牡荆素诱导人肺癌A549 细胞凋亡中的作用[J].中华临床医师杂志:电子版,2012,6(6):47-49.
[14] 胡晓楠,安东建,杨小红,等.紫花牡荆素诱导人肺腺癌A549 细胞凋亡及其机制的探讨[J].中南药学,2013,11(9):644-648.
[15] Liou CJ, Len WB, Wu SJ, et al. Casticin inhibits COX-2 and iNOS expression via suppression of NF-κB and MAPK signaling in lipopolysaccharide-stimulated mouse macrophages[J]. J Ethnopharmacol, 2014,158(2):310-316.
[16] Zhou Y, Tian L, Long L, et al. Casticin potentiates TRAIL-induced apoptosis of gastric cancer cells through endoplasmic reticulum stress[J]. PLoS One, 2013,8(3):58855.
[17] Zhou Y, Peng Y, Mao QQ, et al. Casticin induces caspase-mediated apoptosis via activation of mitochondrial pathway and upregulation of DR5 in human lung cancer cells[J]. Asian Pac J Trop Med, 2013,6(5):372-378.
[18] Di Martino A, Sedlarik V. Amphiphilic chitosan-grafted-functionalized polylactic acid based nanoparticles as a delivery system for doxorubicin and temozolomide co-therapy[J]. Int J Pharm, 2014,474(1-2):134-145.
[19] Wang K, Zhang T, Liu L, et al. Novel micelle formulation of curcumin for enhancing antitumor activity and inhibiting colorectal cancer stem cells.International [J]. Int J Nanomedicine, 2012,7 4487-4497.
[20] 王亚华,应雪,张春春,等.替莫唑胺联合姜黄素对C6胶质瘤细胞凋亡的作用[J].实用医学杂志,2016,32(10):1564-1567.
[21] 刘飞,田莉,阳云,等.紫花牡荆素抗肿瘤作用及其作用机制[J].国际病理科学与临床杂志,2009,29(5):403-406.
[22] 刘莉萍,欧阳取长,曹建国,等.紫花牡荆素抑制FOXM1诱导乳腺癌细胞凋亡的研究[J]. 中国癌症杂志,2012,22(12):898-902.
[23] 舒宝莲,曾斌,廖爱军,等.紫花牡荆素诱导人肝癌HepG2细胞凋亡的研究[J].中国现代医学杂志, 2010,9(10):3841-3844.
[24] 黄继红,游颜杰,郑坚.紫花牡荆素诱导食管癌细胞凋亡的分子机制[J].转化医学杂志,2013,2(4):197-199.
[25] 胡洁琼,谢宛玉,曹建国.紫花牡荆素对宫颈癌HeLa细胞上皮间质转化、侵袭和迁移作用的影响[J].山东医药,2013,53(45):23-25.
Influence of casticin on proliferation and apoptosis of A549 cells
ZHANGChunchun,XUANYaru,WANGYahua,YANHelu,LIXia,YINGXue
(CollegeofPharmacy,XinjiangShiheziUniveristy,Shihezi832000,China)
Objective To investigate the influence of casticin on the proliferation and apoptosis of lung cancer A549 cells (lung cancer cells for short) and to provide basis for the clinical treatment of lung cancer. Methods We chose the lung cancer cells in the logarithmic phase and separately treated them with different concentrations of casticin (0.1, 0.5, 1, 5, 10, 25, 50 and 100 μmol/L). The SRB method was used to detect the anti-proliferative rate of A549 cells in order to finally calculate its half inhibitory concentration (IC50). Furthermore, A549 lung cancer cells in the logarithmic phase were treated with final concentrations of casticin (0, 5 and 15 μmol/L) and meanwhile we observed their morphology of apoptosis by laser scanning confocal microscope after being treated with Hoechst33258 staining. The apoptosis rate of A549 cells was detected by flow cytometry. Results The anti-proliferative rates of A549 cells at 24 and 48 h were significantly increased with the increasing concentrations of casticin. In addition, after being treated with casticin from 0.5 to 100 μmol/L, the anti-proliferative rates of A549 cells at 48 h were significantly higher than those at 24 h (allP<0.05). The IC50of casticin were separately 14.74 μmol/L at 24 h and 8.16 μmol/L at 48 h. With the increasing concentrations of casticin, cell morphology at 24 h showed obvious changes, such as cell shrinkage, chromatin condensation, nucleus fragment and cellular debris. The morphology changes of A549 cells at 48 h were more obviously than those at 24 h. The apoptosis rates of A549 cells which were separately treated by casticin with concentrations of 0, 5 and 15 μmol/L for 24 and 48 h were all gradually increased. Furthermore, the proportion of cells at G1and S periods were all decreased and cells at G2/M period were increased (allP<0.05). The apoptosis rates of A549 cells treated by 5 and 15 μmol/L casticin at 48 h were all increased as compared to those at 24 h. With the same comparison, the proportion of cells at G1and S periods were both decreased and the cells at G2/M were increased (allP<0.05). Conclusion Casticin may block the cell cycle of A549 cells at G2/M period and is capable of anti-proliferation as well as promoting apoptosis, which is in a time- and dose-dependent manner.
lung carcinoma; A549 cells; casticin; apoptosis; proliferation; cell cycle
新疆生产建设兵团社会发展科技攻关与成果转化计划项目(2015AD007);国家级大学生创新创业训练计划项目(201510759066)。
张春春(1988-),女,硕士研究生,研究方向为药物新制剂与新剂型研究。E-mail: 1271403480@qq.com
简介:应雪(1981-),女,博士、副教授,研究方向为药物新剂型研究。E-mail: yingxue2011@qq.com
10.3969/j.issn.1002-266X.2016.36.004
R734.2
A
1002-266X(2016)36-0013-04
2016-01-04)
