二月兰种子生活力与耐盐能力研究
2016-12-04沈阳农业大学林学院辽宁沈阳110866
, , (沈阳农业大学林学院, 辽宁 沈阳 110866)
二月兰种子生活力与耐盐能力研究
祝朋芳,潘志超,张佳惠
(沈阳农业大学林学院, 辽宁 沈阳 110866)
研究了不同贮存年限二月兰种子的生活力,并采用单盐和复盐胁迫,系统研究了二月兰干种子与萌动种子在盐胁迫下的致死率与耐盐机理。结果表明:常温贮存2年的种子与贮存1年的种子发芽率与发芽势均较高,2013年种子生活力虽总体上好于2014年种子,但二者差异不显著。与干种子相比,萌动种子更耐盐胁迫;单盐胁迫下,干种子半致死浓度和临界浓度分别为1.6%和1.8%,萌动种子半致死浓度和临界浓度分别为1.8%和2.0%;复盐胁迫下,干种子半致死浓度和临界浓度分别为0.4%~0.6%和0.6%~0.8%,萌动种子半致死浓度和临界浓度分别为0.6%~0.8%和0.8%~1.0%。在干种子萌发过程中,随着盐胁迫浓度的增大,萌发高峰期延迟,发芽率下降。游离脯氨酸含量在单盐胁迫中呈持续增大趋势,而在复盐胁迫下则先上升后下降。相对电导率在单盐与复盐胁迫下虽然总体上均呈上升趋势,但出现了不同程度的小高峰。
二月兰种子; 生活力; 盐胁迫; 临界浓度; 耐盐机理
土壤盐渍化及次生盐渍化现象是目前世界性的重大环境问题之一[1]。在我国,盐渍土广泛分布于西北、华北、东北及沿海地区,耕地中也有大量盐渍化土壤分布[2]。盐渍化的土地不仅会导致作物减产,还会对当地的环境绿化、植物保护、作物生产等方面产生巨大的负面影响,严重影响我国农林经济的发展[3]。因此,高效利用并改善盐渍化土地成为了一个亟待解决的问题。二月兰(Orychophragmusviolaceus)是十字花科诸葛菜属植物,耐寒性强,易于栽培,不仅是美化早春园林绿地的重要植物材料,还对盐渍化土壤具有有效的培肥效果[4]。对于二月兰的研究主要集中在种间杂交、遗传多样性、生物学特性、培肥效果、抗旱性与耐盐性等方面[5-10],但对于盐渍化土壤中种子萌发后的存活与生长情况缺乏系统的研究。本试验以二月兰种子自播繁殖习性为依据,系统研究了常温贮存条件下不同贮存时间的二月兰种子生活力,以及不同种类与浓度盐胁迫下二月兰干种子与萌动种子的生长状况与耐盐机理,旨在为二月兰在盐渍化立地条件下的应用提供理论依据。
1 材料与方法
1.1 材 料
供试的二月兰种子采集于辽宁省实验中学,采集后常温贮存。种子萌发及耐盐性试验于2015年2—5月在沈阳农业大学进行。
1.2 方 法
1.2.1 不同贮存时间种子生活力测定
分别称量2013、2014年收获的二月兰种子千粒重。将2013、2014年收获的种子用75%乙醇浸泡3 min进行表面消毒后,用蒸馏水冲洗干净并浸泡2 h,播于铺有湿润滤纸的培养皿中,每个培养皿播100粒,在25 ℃人工气候箱暗培养,每天记录种子发芽数,测定发芽势、发芽率。重复3次。
发芽率(%)=发芽种子数/供试种子总数×100%。
发芽势为浸种处理第3天时的发芽率。
1.2.2 盐胁迫处理
以2013年收获的二月兰种子为试材,浸种预处理方法同1.2.1。盐胁迫处理分为干种子处理和萌动种子处理。干种子处理是指浸种预处理后直接进行耐盐试验,萌动种子是指胚根伸出种皮后进行耐盐试验。分别设置单盐胁迫(NaCl浓度为0%~2.0%,按质量百分比计算,下同;梯度为0.2%,下同)与复盐胁迫(NaCl∶NaHCO3=1∶1,浓度为0%~1.0%)2种处理,以蒸馏水作对照(ck),每隔24 h补充相应处理浓度的溶液,以刚浸透底部滤纸为宜。重复3次。
处理后每天记录不同胁迫下二月兰种子的萌发和生长情况,统计发芽率、发芽势及致死率,干种子在胁迫处理至种子不再萌发时统计致死率,萌动种子在胁迫处理7 d后统计致死率。
1.2.3 盐胁迫下生理指标的测定
胁迫处理7 d后,测定二月兰子叶幼苗的游离脯氨酸含量和相对电导率。游离脯氨酸含量用茚三酮法,相对电导率采用电导法[11]。
2 结果与分析
2.1 不同年份二月兰种子生活力测定
2013年种子千粒重略大于2014年种子,二者差异不显著(表1),表明发育良好的二月兰种子贮存2年与贮存1年内含物质量变化不明显。
种子浸种后, 2013年种子从浸种处理第2天开始萌发,并出现萌发高峰,萌发率达67.33%(表1)。2014年种子在浸种处理的第1天即开始萌发,第2天出现萌发高峰期,萌发率为62.33%;第4天时,发芽率仍均有不同程度的上升;第4天后,发芽率再无上升。2014年种子总发芽率与发芽势均低于2013年种子。经差异显著性分析,发芽处理第1天时,2年种子萌发率存在极显著差异;第2、3天即种子萌发高峰前期及高峰期时,二者间无显著差异;第4天为萌发终期,二者间也未出现显著差异;总发芽率和发芽势均无显著差异。由此可见,2013年种子发芽率和发芽势虽然总体上好于2014年,但二者间差异不显著,说明二月兰种子在常温贮存条件下,贮存2年与贮存1年生活力均较好,这有利于困难立地条件二月兰种群的复苏。
表1 不同年份二月兰种子萌发率比较

种子类型2013年(%)2014年(%)千粒重(g)2.10±0.007aA2.05±0.005aA处理时间(d)10aA9.00±0.577aB267.33±1.764aA62.33±2.333aA394.67±1.667aA88.00±0.577aA499.33±0.333aA96.67±0.667aA总发芽率(%)99.33±0.333aA96.67±0.667aA发芽势(%)94.67±1.667aA88.00±0.577aA
注:小写字母表示显著水平(p<0.05),大写字母表示极显著水平(p<0.01)。
2.2 二月兰干种子耐盐性
2.2.1 单盐胁迫下萌发能力分析
选取0%、0.4%、0.8%、1.2%、1.6%、2.0%浓度下种子萌发情况绘制成图(图1)。单盐胁迫处理第2天后,二月兰种子开始萌发,萌发大致集中在前4 d,处理4 d后萌发曲线趋于平缓。盐胁迫浓度不同,萌发高峰期出现的时间不同,在浓度为0.4%或低于0.4%时,萌发高峰期为处理后第2天;在浓度为0.4%~1.6%时,萌发高峰期为处理后第3天;在浓度大于1.6%时,萌发高峰期为处理后第4天。由此可见,随着盐胁迫浓度的增大,萌发高峰期延迟。此外,盐胁迫浓度越高,种子发芽率越低。

图1 单盐胁迫下种子萌发结果
2.2.2 复盐胁迫下萌发能力分析
复盐胁迫处理第3天后,二月兰种子开始萌发,种子萌发数与盐胁迫浓度呈负相关关系,随着胁迫浓度的增大,二月兰种子萌发率逐渐降低(图2)。在盐胁迫浓度低于或等于0.4%时,萌发高峰期为处理后第3天;在浓度为0.6%时,萌发高峰期为处理后第4天;在浓度高于或等于0.8%时,种子萌发数较少,且萌发缓慢。

图2 复盐胁迫下种子萌发结果
2.2.3 单盐与复盐胁迫下干种子致死性
不同盐胁迫下,二月兰干种子致死情况见表2。在单盐胁迫下,二月兰干种子的半致死浓度和临界浓度分别为1.6%和1.8%。在复盐胁迫下,干种子的半致死浓度为0.4%~0.6%(图版1-C,D),临界浓度为0.6%~0.8%(图版1-D,E)。
2.3 二月兰萌动种子耐盐性
2.3.1 单盐胁迫对二月兰游离脯氨酸含量和相对电导率的影响
单盐胁迫下,游离脯氨酸含量随胁迫浓度的增大呈上升趋势,并且在1.6%~2.0%的浓度下急剧上升,2.0%浓度时游离脯氨酸含量为24.98μg/g,约为空白对照的8倍(图1),表明在盐胁迫下,游离脯氨酸逐渐积累,这对组织细胞液起到了渗透调节作用,增强了二月兰的耐盐能力。
表2 不同盐胁迫下二月兰种子致死率

材料 半致死浓度(%) 临界浓度(%) 单盐复盐单盐复盐干种子1.60.4~0.61.80.6~0.8萌动种子1.80.6~0.82.00.8~1.0
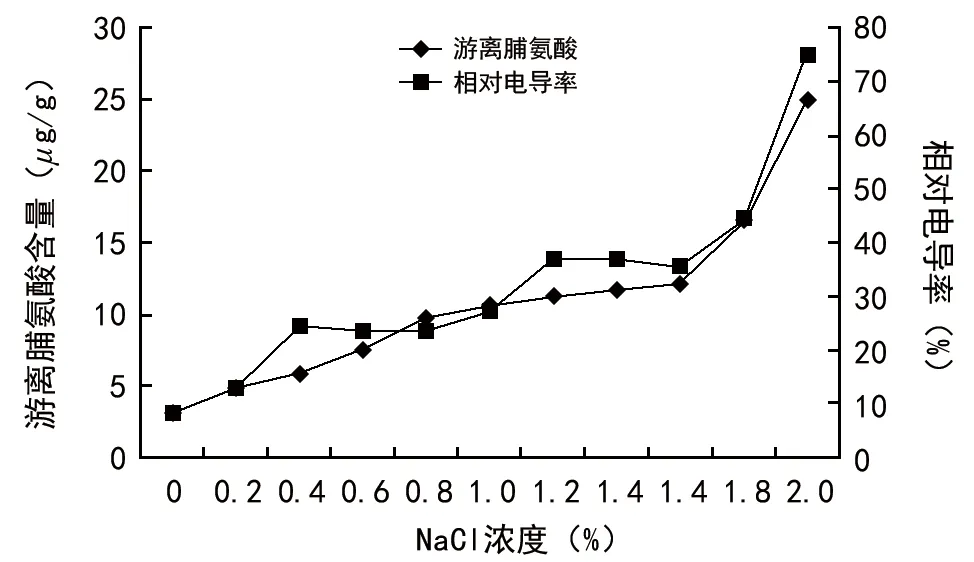
图3 单盐胁迫下游离脯氨酸含量与相对电导率变化
在盐胁迫下,相对电导率随胁迫浓度的增大总体呈上升趋势。在浓度为0.4%时,出现第一个小高峰,表明二月兰受到盐胁迫时,细胞迅速作出反应,细胞膜透性增大,导致相对电导率增大。在浓度为0.4%~1.0%时,相对电导率维持在了一个相对稳定的水平,表明该浓度下细胞液达到了一个新的平衡,足以抵抗逆境胁迫,从而不会对二月兰造成严重伤害。同样,在浓度为1.2%出现第2个小高峰,表明细胞内含物出现较大程度的外渗,从而造成相对电导率的增大。在1.2%~1.6%浓度时维持在了一个新的平衡,表明经过再次缓冲和自我调节后,二月兰细胞液又维持在了新的耐盐水平上。在胁迫浓度达到1.8%时,相对电导率迅速上升,表明细胞液电解质浓度明显增大,这可能是导致二月兰萌动种子半致死的主要原因。在2.0%时,相对电导率持续上升,达到74.8%,此时大部分试材出现死亡,这也正是二月兰萌动种子单盐胁迫下的临界剂量。
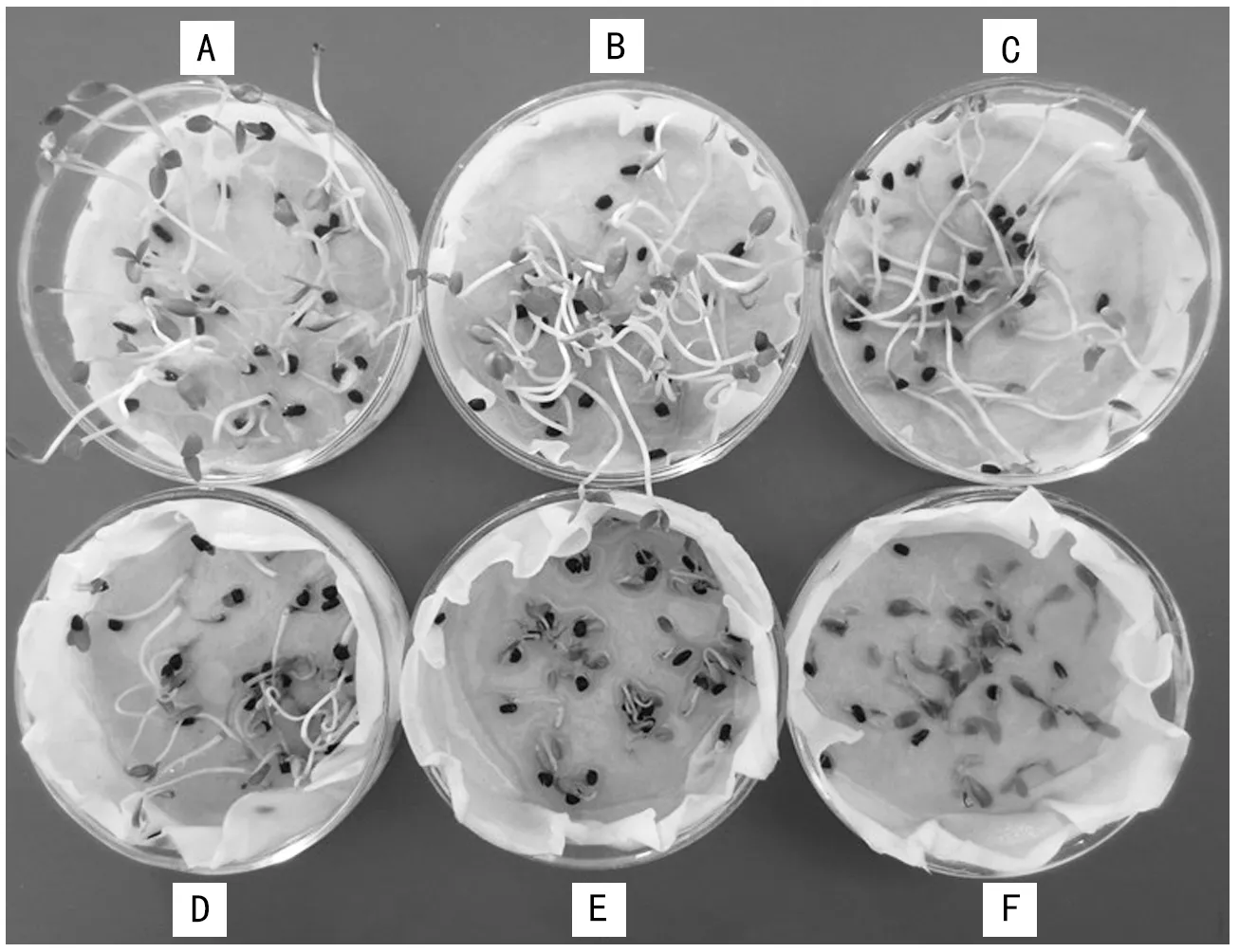
图版2 复盐胁迫下二月兰萌动种子生长状况
2.3.2 复盐胁迫对二月兰游离脯氨酸含量和相对电导率的影响
复盐胁迫下,游离脯氨酸含量随盐胁迫浓度呈先上升后下降趋势(图2)。在浓度低于0.6%时,游离脯氨酸含量缓慢上升,这表明随着盐胁迫的递进,二月兰细胞内游离脯氨酸逐渐积累。在浓度为0.6%时达到一个转折点,在浓度大于0.6%时,游离脯氨酸含量上升速度加快,在浓度为0.8%时达到最大值(11.71μg/g),约为空白对照的7倍,0.6%~0.8%浓度正是二月兰萌动种子复盐胁迫下的临界剂量。当胁迫浓度升高到1.0%时,游离脯氨酸含量迅速下降,这可能是细胞内催化其降解的酶活性受到不同程度的限制[12],此时试材已大量死亡。
相对电导率在0.2%浓度时出现小高峰,随后下降,在0.4%浓度时出现低谷,紧接着持续快速稳定上升,表明在复盐胁迫下,二月兰萌动种子细胞反应比单盐胁迫更加迅速,而后细胞膜通过自身调节通透性缓解了胁迫压力,当胁迫浓度大于0.4%时,细胞电解质呈现出大量的不可逆性外渗,导致相对电导率持续稳定增大。
2.3.3单盐及复盐胁迫下萌动种子致死性
由表2可看出,在单盐胁迫下,二月兰萌动种子的半致死和临界浓度分别为1.8%和2.0%。在复盐胁迫下,萌动种子的半致死浓度为0.6%~0.8%(图版2-D,E),临界浓度为0.8%~1.0%(图版2-E,F)。从表2中还可以看出,无论是单盐还是复盐胁迫处理,萌动种子的半致死浓度和临界浓度均高出干种子约0.2%,由此可见,与干种子相比,二月兰的萌动种子具有更强的耐盐性。
3 讨 论
在常温贮存条件下,贮存2年与贮存1年的二月兰种子千粒重、发芽率、发芽势差异均不显著,二月兰种子的生活力与贮存年份不存在正相关关系,表明发育良好的二月兰种子在贮存过程中内含物质量变化和活力变化均不明显,贮存2年与贮存1年的种子生活力均较好,这为困难立地下二月兰的种群繁育和复苏奠定了理论基础。张俊莉在研究2003—2005年种子生活力过程中发现,虽然2005年种子萌发力最好,但2003年种子较2004年种子萌发力好[13],这与本试验的研究结果一致。
不同的盐分及盐分组合可能对二月兰种子及幼苗生长造成不同的影响,试验选用盐渍土中广泛存在的Na+溶液模拟自然环境下的盐胁迫。结果发现,单盐和复盐处理条件下,萌动种子均比干种子耐盐,半致死和临界浓度差均达到了0.2%,这可以在种子萌发期通过人工洒水或自然降雨,使土壤中的盐浓度稀释,而使二月兰的种子萌发后得以成活。
植物体内游离脯氨酸含量在一定程度上可以反映植物在逆境下受伤害的程度,当植物受到盐胁迫时,体内会积累大量的游离脯氨酸来维持细胞的正常功能,其含量也会随着盐胁迫程度的增大而升高。本试验中,在单盐和复盐胁迫下,在二月兰不受到严重伤害而失去生命力的情况下,游离脯氨酸含量总体上均呈上升趋势,与盐胁迫程度呈正相关,说明游离脯氨酸对维持细胞内环境的相对稳定,提高植物对外界环境的干扰能力上起到了一定的作用。复盐胁迫下,在浓度为1.0%时,游离脯氨酸含量明显下降,此浓度也是二月兰萌动种子的临界浓度,大部分试材死亡。质膜相对透性的大小反映植物受伤害的程度,其透性越大,相对电导率越大,植物受伤害的程度越大。二月兰相对电导率随盐胁迫程度的增大大致呈正相关关系,单盐胁迫下,在浓度为0.4%~0.8%和1.2%~1.6%时,存在降低的情况,这可能与植物体内脯氨酸等内含物的含量增加有关,在受到胁迫失水时,会主动吸收可溶性物质来调节细胞渗透压[14],降低外渗液浓度以减轻伤害。在盐胁迫下,本实验得出的游离脯氨酸含量和相对电导率变化与半致死胁迫浓度和临界胁迫浓度相一致。
[1]谢振宇,杨光穗.牧草耐盐性研究进展[J].草业科学,2003,20(8):11-17.
[2]杨劲松.中国盐渍土研究的发展历程与展望[J].土壤学报,2008,45(5):837-845.
[3]牛东玲,王启基.盐碱地治理研究进展[J].土壤通报,2002,3(6):449-455.
[4]赵秋,高贤彪,吴迪,等.越冬绿肥二月兰耐盐能力及在盐碱耕地上的培肥效果[J].中国土壤与肥料,2010(4):65-68.
[5]罗鹏,李义文,黄邦全.优质油料种源诸葛菜[J].中国油料,1993(4):73-75.
[6]刘旻.白菜和白菜型油菜与诸葛菜杂种及后代的遗传研究[D].湖北:华中农业大学,2005.
[7]吴林园.四种形态类型诸葛菜的遗传多样性分析[D].安徽:安徽农业大学,2010.
[8]吴岱镳.地被绿化植物二月兰的生物学研究[D].湖南:湖南农业大学,2010.
[9]刘佳.二月兰的营养特性及其绿肥效应研究[D].北京:中国农业科学院,2010.
[10]潘秀秀.二月兰种子及幼苗抗旱性和耐盐碱性研究[D].黑龙江:东北林业大学,2011.
[11]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12]谢虹,杨兰,李忠光.脯氨酸在植物非生物胁迫耐性形成中的作用[J].生物技术通报,2011(2):23-27.
[13]张俊莉.二月兰遗传多样性研究[D].北京:北京林业大学,2008:33-38.
[14]张小艾,李名扬,汪志辉,等.重金属及盐碱对二月兰幼苗生长和生理生化的影响[J].草业学报,2013,22(2):187-194.
Studies on Viability and Salt Tolerance inOrychophragmusviolaceusSeeds
ZHUPengfang,PANZhichao,ZHANGJiahui
( College of Forestry, Shenyang Agricultural University,Shenyang Liaoning 110866,China)
This paper studied seeds germination rate and energy under different harvest years,and focused on fatality rates and salt tolerance mechanism of dry and germinated seeds.The results showed that seeds stored two years and one year were both very good.Compared to dry seeds,germinated seeds tolerated higher salt content.The median lethal and critical concentrations of dry seeds were 1.6% and 1.8%,respectively,while the median lethal and critical concentration of germination seeds were 1.8% and 2.0%,respectively,under single salt stress.Under the double salt stress,the median lethal and critical concentrations of dry seeds were 0.4%-0.6% and 0.6%-0.8%,respectively,while the median lethal and critical concentration of germination seeds were 0.6%-0.8% and 0.8%-1.0%,respectively.In the process of dry seed germination,the germination peak delayed and the germination rate declined with the increase of salt stress.The content of free proline showed a trend of continuous increase when single salt stress,while rose firstly and then fall down under double salt stress.The relative conductivity both presented ascending trends under single and double salt stresses with different small peaks.
seeds ofOrychophragmusviolaceus; viability; salt stress; critical concentration;mechanism of salt tolerance
2016-04-10
祝朋芳(1971-),女,辽宁朝阳人;博士,教授,主要从事园林植物遗传育种研究工作;E-mail:pfz2013@126.com。
10.16590/j.cnki.1001-4705.2016.09.046
S 688.4
A
1001-4705(2016)09-0046-05
