非深度生理休眠的落地梅种子的萌发行为
2016-12-04重庆师范大学生命科学学院植物环境适应分子生物学重庆市重点实验室重庆401331
, , , (重庆师范大学生命科学学院植物环境适应分子生物学重庆市重点实验室, 重庆 401331)
非深度生理休眠的落地梅种子的萌发行为
田美华,张有义,杨永清,唐安军
(重庆师范大学生命科学学院植物环境适应分子生物学重庆市重点实验室, 重庆 401331)
休眠是许多植物种子的一种重要的功能性状,但对许多观赏植物的种苗培育是十分不利的。为了查明落地梅种子的休眠原因及萌发行为,本研究以我国特有的观赏植物落地梅(Lysimachiaparidiformis)的种子为材料,充分分析了低温层积和赤霉素溶液在休眠解除中的效果,比较了光照和黑暗下的种子萌发行为。结果表明:落地梅种子的休眠是非深度生理休眠,且是光中性。90 d或120 d的低温层积(4 ℃)能有效地打破休眠;在20 ℃/10 ℃且光照的条件下,其萌发率分别为77%和75%。此外,赤霉素(GA3)溶液能促进种子萌发,其中500 mg/L的GA3能将种子的萌发率从20%提高到71%。无论是在光照下,还是在黑暗中,非休眠的落地梅种子表现出非常明显的萌发温度偏好,以20 ℃/10 ℃为最佳。
落地梅; 冷层积; 非深度生理休眠; 光中性种子
Non-photoblastic seeds
落地梅(LysimachiaparidiformisFranch.)是我国特有的植物,又称重楼排草、四块瓦、四儿风,隶属报春花科(Primulaceae),系多年生的矮小草本植物,主要分布于四川、重庆、贵州、湖北和湖南等地的林下湿润处,垂直分布的海拔为300~1 400 m[1]。目前,除了药用外,该植物亦具有良好的观赏价值,正被广泛栽植于公园和城市绿地。调查发现,在重庆、四川、湖南和广东等省区,野生资源已难以满足市场日益增长的需求,因而人工培育种苗已被提上日程。在野外,尽管该植物能通过根蘖的方式产生无性系后代,但其效率十分低下。但该植物可产生大量的种子。倘若能高效地利用种子培育种苗,不仅可以深化理解自然种群的有性更新特性,又能为景观建设提供大量的种苗。遗憾的是,尚未查阅到有关落地梅种子育苗的研究报道。所以,亟需研究落地梅的种子特性,为建立有效的人工繁育种苗的方法和技术提供理论参考。
在重庆和四川对该植物种群进行野外调查时发现,海拔为391~1 219 m之间的落地梅主要以无性繁殖的方式拓展种群;成熟的种子散落于7—9月份,而出苗于翌年的3—4月份,而且野外的幼苗十分稀少。由于资料的缺乏,至今亦不能客观地解释幼苗缺失的情形。研究表明,诸多植物类群尤其是濒危植物缺失幼苗的关键原因是种子转化为幼苗的过程受阻[2]。种子难以转化为幼苗的原因实际上是复杂多样的,不仅与种子的质量及生理特性相关(如休眠),也与环境因子的作用有关(如干旱或高温胁迫)。在报春花科中,分布于温带的一些种类所产生的种子是休眠的。例如,Washitani和Kabaya发现,新采集的Primulasieboldii种子在8~40 ℃之间的多个恒温下均不能萌发,但经8~12周的冷层积(2 ℃)处理能打破其休眠[4]。类似地,Shimono和Washitani发现,Primulamodesta的种子是休眠的,1个月的冷层积(4 ℃)处理能有效地解除其休眠[3]。此外,Rayburn等发现,长时间(270 d)的冷处理(1~2 ℃)能促进冷藏1~2年的Primulacusickianavar.maguirei的种子达到55.8%的萌发率,而且,冷处理过的种子的光敏性增强[5]。此外,钟花报春(Primulasikkinensis)和岩生报春(Primulasaxatilis)的种子是休眠的,而且被低温解除休眠的种子具有强烈的萌发温度偏好[6-7]。越来越多的研究表明,亲缘关系较近的类群在种子更新方面常存在一些相似的特性[8-10]。鉴于此,假设落地梅种子是休眠的,且能被特定的冷层积打破。为了检验假设是否成立以及建立有效的种苗培育方法,分析了落地梅种子的休眠特性以及温度和光照对种子萌发的影响。
1 材料与方法
1.1 种子的采集与处理
2012年8月9—11日,在重庆缙云山采集了大量成熟的落地梅种子。将采集的种子带回实验室,用浮选法除去明显空瘪的种子;洗净后晾干,然后装入牛皮纸袋,存放于10 ℃的恒温箱。
1.2 新鲜种子的萌发试验
将新采集的种子先用蒸馏水浸泡12 h,然后用1%的次氯酸钠溶液消毒10 min。在直径为9 cm的玻璃培养皿内放置2层滤纸,然后加入10 mL蒸馏水;将表面消毒的25粒种子点播于滤纸上,4个重复。萌发温度分别是5个恒温(10,15,20,25,30 ℃)和2个变温(20 ℃/10 ℃与25 ℃/15 ℃),光周期为12 h/d,光照强度约40μmol/(m·s)。萌发持续时间30 d。以胚根突破种皮且伸长至少1 mm作为萌发的标准(下同)。
1.3 种子的低温层积与干藏处理
在直径为15 cm的玻璃培养皿中,铺2层滤纸,加入16 mL的灭菌水充分润湿滤纸,然后在滤纸上放置200粒种子,8个重复。最后,将所有培养皿放于4 ℃且黑暗的条件下进行低温层积。在层积过程中,每隔30 d将2个培养皿中的所有种子取出,按照1.2所述的操作方法进行萌发检测,萌发温度分别为10 ℃、20 ℃、20 ℃/10 ℃以及25 ℃/15 ℃。
种子的干藏实验,具体操作为:取6个容量为50 mL的塑料冻存管(直径约3 cm),分别加入400粒种子(含水量约9.2%),然后加盖,并在盖的中央打1小孔(直径约2 mm)以便透气。最后,将上述3个塑料管分别保存于20 ℃、30 ℃和30 ℃/20 ℃(白天/黑夜)。在保存过程中,分别于第60天、第90天、第120天和第150天各取100粒,进行萌发检测,其操作方法如1.2所述,其萌发温度分别为10 ℃、20 ℃、20 ℃/10 ℃以及25 ℃/15 ℃。
1.4 赤霉素溶液处理
先配置浓度分别为50,100,200,500 mg/L和1 000 mg/L的GA3溶液,然后分别取上述溶液20 mL浸泡100 粒种子,48 h后用灭菌的蒸馏水冲洗种子3次。随后进行常规的萌发检测(见上述1.2),其萌发温度为20 ℃/10 ℃。
1.5 光照对种子萌发的影响
将低温层积90 d的种子分别放在光照和黑暗下进行萌发检测。周期性光照(12 h/d)的强度约40μmol/(m·s)。同时,进行如下黑暗处理:将萌发的培养皿用2层锡箔纸包裹,遮光,然后与其他照光组一同放入光照培养箱。在培养皿内0.8%的琼脂糖表面,均一地放置经消毒的种子25粒,4个重复。萌发温度分别是15 ℃、20 ℃/10 ℃和25 ℃/15 ℃。在30 d后结束此实验时,解开包裹的锡箔纸,计数萌发的种子。
1.6 数据统计分析
种子最终萌发率(%)均为4个重复的平均值±标准误(SD);对不同温度或赤霉素溶液处理后的萌发率,进行单因素方差分析(One-way ANOVA)和最小显著差异法比较(p=0.05),以此评价处理因子的作用效应。
2 结果与分析
2.1 新鲜落地梅种子的萌发率
在7个温度(10、15、20、25、30、20 ℃/10 ℃和25 ℃/15 ℃)下,新采集的落地梅种子的萌发率≤20%,以25 ℃/15 ℃的萌发率为最高(20%),其次是20 ℃/10 ℃(19%)(图1)。这些结果表明,新鲜的落地梅种子在给定的检测条件下难以萌发。

图1 新鲜的落地梅种子在不同温度下的萌发率
2.2 赤霉素溶液(GA3)处理对种子萌发的影响
低浓度的赤霉素(GA3)溶液(50、100 mg/L和200 mg/L)对种子萌发的促进作用较小(≤39%),而500 mg/L的GA3溶液能显著地促进种子萌发(71%)(图2)。但是,当浓度进一步增加到1 000 mg/L时,落地梅种子的萌发率为64%,这说明GA3溶液对落地梅种子的促进作用具有明显的剂量效应,而且存在作用最大化的适宜浓度。
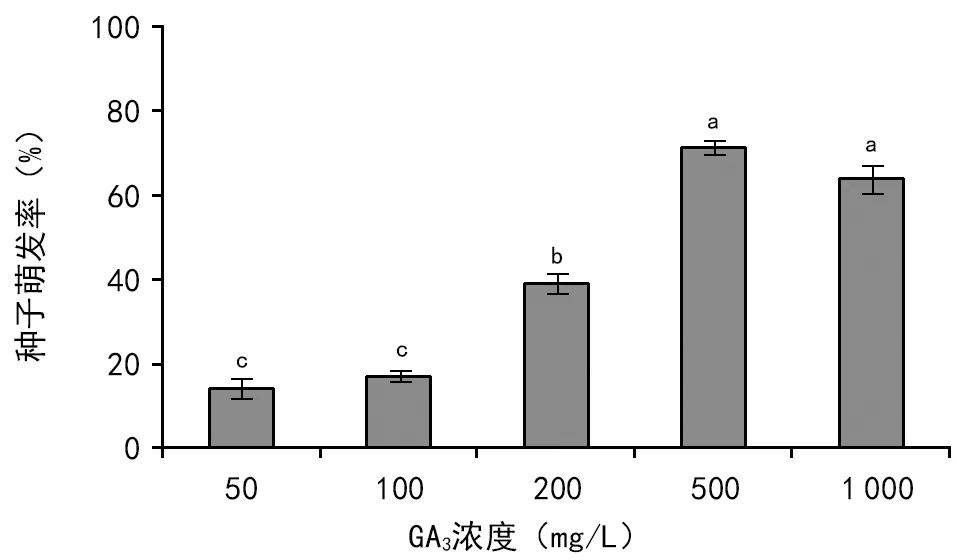
图2 赤霉素溶液对落地梅种子萌发的影响
2.3 低温层积和干藏对种子萌发的影响
经过低温层积(4 ℃)处理的种子,在4个萌发温度下,表现出非常明显的差异(p<0.05)(图3)。由图3可知,在20 ℃/10 ℃下,种子的萌发率最高,而10 ℃能强烈抑制萌发。当低温处理90 d后,种子能达到较高的萌发率(77%)(图3)。随着冷处理时间的进一步延长(如120 d),种子萌发率未发生明显变化(p>0.05)。这意味着适当的低温层积非常有利于后续的种子萌发,且具有明显的萌发温度偏好。
相反,干藏的种子经过30、60、90 d和120 d后,在试验的温度下都不能顺利萌发(<20%)(图4)。这意味着,在干藏中种子未能获得较高的萌发力。

图3 经低温层积(4 ℃)不同时间后的落地梅种子在不同温度下的萌发率(%)

图4 室温贮藏不同时间的落地梅种子在不同温度下的萌发率(%)
2.4 光照对种子萌发的影响

图5 低温层积90 d的落地梅种子在光照与黑暗下的萌发率
在相同的温度下,低温层积90 d的种子在光照和黑暗中的萌发率之间没有明显的差异(p>0.05)。无论是在光照下,还是在黑暗下,20 ℃/10 ℃最有利于萌发,其次是25 ℃/15 ℃(图5)。这说明落地梅种子在缺乏光的条件下仍能较好地萌发,而且光照对种子萌发没有明显的促进作用。
3 讨 论
在实验条件下,新成熟的落地梅种子在多个温度下的萌发率都非常低(图1)。而且,在干藏过程中,即使干藏120 d,种子的萌发力也未明显提升(图4)。然而,外施500 mg/L的赤霉素溶液(GA3)能有效地促进其萌发(图2)。而且,在冷层积(4 ℃)90 d和120 d后,种子的萌发率分别达到了77%和75%(图3)。Vleeshouwers认为,种子休眠是种子的一种特性,而且其休眠程度对其萌发条件的需求进行了内在界定[8]。后来,Baskin和Baskin重新定义了种子休眠的概念——成熟有活力的种子在适宜的环境中不萌发的现象,称之为休眠;同时,将种子休眠分为物理休眠、形态休眠、生理休眠、形态生理休眠和复合休眠五大类,并依据胚的发育程度和打破休眠的条件,包括种子对GA3溶液的敏感性和冷(暖)层积解除休眠的时间长度,构建了一个休眠分类的等级系统[9]。在这里,依据种子休眠的划分依据和落地梅的萌发特性,我们认为落地梅种子是非深度生理休眠的。
毋庸置疑,落地梅种子的休眠是在成熟脱落时就已存在,而不是环境诱导产生的(次级休眠或诱导休眠)。也就是说,落地梅的种子休眠是初生性的,是在种子发育过程形成的。然而,落地梅种子的非深度生理休眠在干藏过程中没有被解除,即种子没有完成后熟。种子后熟是指在干燥的条件下由于其生理生化的变化而导致种子休眠解除的现象[11]。譬如,非深度生理休眠的拟南芥(Arabidopsisthaliana)和水稻(Oryzasativa)的种子在室温干藏过程中就能迅速脱离休眠的状态[12-13]。这暗示落地梅种子与拟南芥和水稻等种子在休眠特性方面存在较大的差异。这意味着,在实践中,不能用干藏的方式打破落地梅种子的非深度生理休眠。当然,在本研究中,落地梅种子在特定的条件下未能完成后熟的现象可能受实验使用的温度、干藏时间、种子含水量以及光照条件等因素的制约,这尚需进一步分析才能揭示其本质。
经冷层积(4 ℃)或GA3溶液处理后,落地梅种子能在20 ℃/10 ℃下顺利萌发,但不能在10 ℃和20 ℃等温度下顺利萌发(图2,图3)。这表明非休眠的落地梅种子具有明显的萌发温度偏好。事实上,温度不仅能调控种子休眠状态的变化,也直接影响种子的萌发行为[14]。譬如,岩生报春(P.saxatilis)种子的适宜萌发温度为20~25 ℃[7];在光照下,小花报春(Primulaforbesii)种子在15 ℃时的萌发率为58%,在25 ℃和28 ℃时的萌发率分别为69%和70%[15]。在黑暗中,胭脂花(Primulamaximowiofi)种子在20 ℃时的萌发率(98.3%)显著地高于其他温度(15 ℃,41.9%;25 ℃,57.1%)下的萌发率[6]。在光下或黑暗中,四季报春(Primulaobconica)种子适宜的萌发温度范围为15~28 ℃[16]。在光照中,岩生报春(Primulasaxatilis)种子的萌发适宜温度为20~25 ℃[7]。不仅报春花科植物的种子有着特定的适宜的萌发温度或萌发温度范围,其他种子植物亦如此[14,17-18]。从生态学的观点看,萌发行为的温度偏好性可能是植物长期适应其生境而进化的结果[19]。事实上,在解除休眠后,种子在适宜的环境中萌发,能确保幼苗免受高温或低温等逆境伤害。而且,这样的温度选择性常与降雨发生的时间密切相关[11,14]。在本研究中,落地梅种子萌发的最适温度是20 ℃/10 ℃,其次是25 ℃/15 ℃,而20 ℃和10 ℃对种子萌发有明显的抑制效应(图1,图3,图4)。比较而言,变温更有利于非休眠的落地梅种子的萌发。这种特殊的萌发温度生态位在一定程度上反映了该物种的生态适应性。在重庆缙云山,我们发现有少量的落地梅幼苗出现于3月中旬至4月初,此时段生境的平均温度约18.3 ℃。在秋季或冬季,虽然某一时段的温度适于萌发,但由于种子处于休眠状态而难以转化成幼苗。
除了温度之外,光在种子萌发和植物形态建成中也起着重要作用。光对种子休眠的影响因植物种类而异。具有正常活力的种子因光照条件的限制而不萌发的现象,称之为光休眠(photodormancy)。由于光的存在而缩短或解除休眠的种子,称为喜光性种子或需光性种子(light-favored seeds),如水浮莲(Pistiastratiotes)的种子[20]和拟南芥(A.thaliana)的种子[21]。相反,因为光的存在而诱导休眠的种子,称为光抑制性种子(light-inhibited seeds);还有一些种子不会因为光照条件的变化而改变萌发行为,这些称之为光中性种子(non-photoblastic seeds)[22]。据报道,报春花科的种子对光照的反应是多样的,例如,光照对P.modesta[4]、岩生报春(P.saxatilis)[7]等植物种子的萌发有促进作用,而小报春(Primulaforbesii)[15]、四季报春[16]以及钟花报春(Primulasikkinesis)[23]等种类的种子对光照不敏感。在本研究中,一旦温度适宜,低温层积90 d的落地梅种子在光下和黑暗中就能较好地萌发(图5)。这表明非休眠的落地梅种子是光中性的。由此推知,只要水热条件适宜,非休眠的落地梅种子将会萌发。当然,在野外复杂的环境条件下,影响非休眠种子萌发的因素是多样的,一旦种子错过了最佳的萌发窗口,则难以萌发;即使能够萌发,其幼苗也会因逆境胁迫而难以建成。
综上所述,观赏植物落地梅所产生的种子是非深度生理休眠的,且是光中性的。在实践中,可以通过低温层积或外施500 mg/L的GA3溶液打破休眠。此外,变温20 ℃/10 ℃非常适合落地梅种子萌发。因此,在育苗过程中,施加GA3溶液处理已经冷层积处理一段时间(如90 d)的种子,将能更有效地加速种苗的培育。
[1]陈封怀,胡启明.报春花科(《中国植物志》第59卷第1分册)[M].北京:科学出版社,1989:76-77.
[2]王迎春,杨持.物种生活史策略的研究现状[J].内蒙古大学学报(自然科学版),2001,32(1):112-118.
[3]Shimono A,Washitani I.Seedling emergence patterns and dormancy/germination physiology of Primula modesta in a subalpine region[J].Ecological Research,2004,19:541-551.
[4]Washitani I,Kabaya H.Germination responses to temperature responsible for the seedling emergence seasonality of Primula sieboldii E[J].Morren in its nature habitat. Ecological Research,1988,3:9-20.
[5]Rayburn A,Davidson JB,Schupp EW.Effects of storage time,site and floral morph on seed germination of the threatened distylous primrose Primula cusickiana var.maguirei[J].Plant Species Biology,2013,28:101-108.
[6]薄伟,杨晓盆.胭脂花种子发芽生物学特性研究[J].山西农业大学学报(自然科学版),2009,29(5):415-418.
[7]董玲玲,潘会堂,张启翔,等.岩生报春种子萌发特性研究[J].种子,2010,29(5):75-77.
[8]Vleeshouwers LM,Bouwmeester HJ,Karssen CM.Redefining seed dormancy:an attempt to integrate physiology and ecology[J].Journal of Ecology,1995,83:1 031-1 037.
[9]Baskin JM,Baskin CC.A classification system for seed dormancy[J].Seed Science Research,14:1-16.
[10]Baskin CC,Chen SY,Chien CT,et al.Overview of seed dormancy in Viburnum (Caprifoliaceae)[J].Propagation of Ornamental Plants,2009,9(3):115-121.
[11]Probert RJ.The role of temperature in seed dormancy and germination.Seeds:The Ecology of Regeneration in Plant Communities (Fenner M,eds.,2 nd edition)[M].Uk,Wallingford,CAB International,2000,261-292.
[12]Footitt S,Douterelo-Soler,Clay H,et al.Dormancy cycling in Arabidopsis seeds is controlled by seasonally distinct hormone-signaling pathways[J].PNAS,2011,108(50):20 236-20 241.
[13]Itoh J,Nonomura KI,Ikeda K,et al.Rice plant development: from zygote to spikelet[J].Plant and Cell Physiology,2005,46(1),23-47.
[14]Baskin CC,Baskin JM.Seeds:Ecology,Biogeography,and Evolution of Dormancy and Germination (second edition).London,Academic Press/Elsevier,2014.
[15]张晓曼,孙晓光,张启翔.小报春种子萌芽生物学特性的研究[J].河北农业大学学报,2005,28(4):58-60.
[16]张晓曼,孙晓光,杜绍华,等.四季报春花萌芽生物学特喜性研究[J].西北林学院学报,2009,24(5):85-87.
[17]Bewley JD,Black M.Seeds:Physiology of Development and Germination (2 nd edition).New York,Plenum Press,1994.
[18]唐安军.中国特有植物凹叶木兰种子的休眠与贮藏行为[J].植物生理学报,2014,50(1):105-110.
[19]Kitajima K,Fenner M.Ecology of seedling regeneration.Seeds:The Ecology of Regeneration in Plant Communities (Fenner M,eds.,2 nd edition).Uk,Wallingford,CAB International,2000,331-359.
[20]傅家瑞.大薸种子中依稀和喜光休眠间的关系[J].植物生理学报,1985,11:58-65.
[21]Baskin JM,Baskin CC.Ecological life-cycle and physiological ecology of seed germination of Arabidopsis thaliana[J].Canadian Journal of Botany,1972,50:353-360.
[22]唐安军,龙春林.种子的休眠及其控制[M]//宋松泉,程红焱,姜孝成,等.种子生物学.北京:科学出版社,2008:224-242.
[23]蔡艳飞,李世锋,李树发,等.钟花报春种子萌发生物学特性研究[J].西南农业学报,2010,23(1):280-281.
Dormant Characteristics and Germination Behavior in OrnamentalLysimachiaparidiformisSeeds
TIANMeihua,ZHANGYouyi,YANGYongqing,TANGAnjun
(Chongqing Key Laboratory of Molecular Biology of Plant Environmental Adaptations,College of Life Sciences,Chongqing Normal University,Chongqing 401331,China)
Dormancy is an important functional trait for many plant species;however,it is unwelcome for propagating seedling by seeds of ornamental species in practice.To reveal the reasons of seed dormancy and germination behavior,we firstly used ornamentalLysimachiaparidiformisseeds as experimental materials,and fully investigated effects of cold stratification (4 ℃) and application of GA3solutions on dormancy release,and also compared seed germination behavior of non-dormant seeds in both light and dark.The data indicated that the seeds ofL.paridiformiswere non-deep physiologically dormant and non-photoblastic.Moreover,the non-deep physiological dormancy could be broken by cold stratification at 4 ℃.After being cold stratified for 90 d or 120 d,the seeds that were released from dormancy were able to germinate well to 77% and 75% at 20 ℃/10 ℃ in light,respectively.Moreover,application of GA3solutions obviously promoted seed germination of this species.For example,500 mg/L GA3enhanced the final germination percentage from 20% to 71%.Also,the seeds released from dormancy were highly temperature-dependent for germination whether light existed or not.Among a few temperatures applied,20 ℃/10 ℃ was optimal to germination (77%) in light.
Lysimachiaparidiformis; cold stratification; Non-deep physiological dormancy;
2016-04-17
重庆师范大学校级基金项目(编号:2011 SLX 34);重庆市科委自然科学基金项目(编号:cstc 2013 jcyjA 00002);重庆市教委科技项目(编号:KJ 1400504)。
田美华(1981—),女(苗族),助理研究员,研究方向:种子生理与进化生态学。
唐安军,E-mail:tanganjun@mail.kib.ac.cn。
10.16590/j.cnki.1001-4705.2016.09.032
S 567.23+9
A
1001-4705(2016)09-0032-05
