不同因素对小麦根尖染色体制片的影响
2016-12-04,,,,
, , , ,
(河北科技师范学院生命科技学院, 河北 秦皇岛 066004)
不同因素对小麦根尖染色体制片的影响
邹景伟,郭振清,张志雯,任学军,林小虎
(河北科技师范学院生命科技学院, 河北 秦皇岛 066004)
以小麦根尖为材料,探讨了低温、秋水仙素、8-羟基喹啉和对二氯苯4种预处理对小麦根尖细胞有丝分裂积累中期分裂相的效果。结果表明,这4种预处理方法积累有丝分裂中期分裂相效果的明显程度由大到小依次为秋水仙素、低温、对二氯苯和8-羟基喹啉,前2种方法效果明显且差异不大,后2种方法效果略差。在此基础上,对低温预处理后的根尖在制片过程中的一些因素进行了摸索,发现影响制片效果的主要因素是低温预处理时间和HCl解离时间。最终得到以小麦根尖为取样对象的体细胞染色体制片的最适方法。为小麦族物种的染色体加倍、异染色体系的鉴定、细胞遗传学研究等领域提供方法依据。
小麦; 根尖体细胞; 染色体制片; 影响因素
小麦(TriticumaestivumL.)是我国重要的粮食作物。随着时间的推移和气候条件的变化,对小麦的种质资源创新与品种的改良提出了越来越多的要求[1-3]。利用小麦近缘属种的优良基因是改良普通小麦性状的重要手段,其主要方法有染色体倍性化、异染色体系和远缘杂交等。其中,倍性鉴定和异染色体系鉴定是染色体工程育种及其应用的重要鉴定手段[4]。准确、有效地鉴定出倍性水平及异染色体数目的方法,对控制育种工作的盲目性、显著降低工作量、降低成本、加速育种进程具有重要意义[5]。
在众多鉴定方法中,细胞学鉴定是检验外源染色体的基本手段,染色体制片则是细胞学鉴定的基本技术手段[6-7]。染色体制片法是进行细胞倍性和异染色体系鉴定最直接、最可靠的方法。它不仅计数准确,而且不需要复杂的仪器,是目前应用最多的鉴定方法。由于普通小麦是异源六倍体,所以它可以与小麦的近缘属种进行远缘杂交产生的代换系、易位系等众多异染色体系等,都需要进一步进行细胞学等鉴定工作。例如,普通小麦与八倍体小偃麦,普通小麦与长穗偃麦草,普通小麦与中间偃麦草等远缘杂交产生的后代都需要对其染色体水平上进行鉴定[8-10]。染色体制片技术不仅在小麦属的倍性鉴定和异染色体系鉴定上应用广泛,而且在其他植物中都应用广泛。在鹰嘴豆、天山雪莲、菜用大黄等植物中也有关于染色体制片的报道,并以此为基础,对其进行深入的研究[11-13]。
长期以来,人们一直在探索和改进观察染色体方法,从最早的涂片法到经典的常规压片法,从20世纪60年代末建立的显带技术[14]到90年代发展起来的染色体原位杂交技术[15-16]。染色体制片技术已经成为细胞遗传学检测技术的基础。但是,影响染色体制片技术的因素很多。本研究对小麦根尖体细胞染色体的制片技术进行了探讨和适当的改进,供业内专家们参考。
1 材料与方法
1.1 材 料
由河北科技师范学院生命科技学院小麦育种课题组选育的种质材料HB 20121023。HB 20121023是本课题组利用八倍体小黑麦劲松5号(2n=8 X=56)与普通小麦品种京冬8号(2n=6 X=42)杂交、回交、自交后获得,具体世代为BC1F4代,且染色体数目为42条。
1.2 方 法
1.2.1 材料的前处理
选取饱满的小麦种质材料HB 20121023种子浸泡在培养皿中,在室温或者恒温箱(25 ℃)黑暗条件下,培养至种子露白。然后将种子摆放在垫有湿滤纸的培养皿内,继续在室温或恒温箱(25 ℃)黑暗条件下培养。待小麦根尖长至1.0~1.5 cm时,进行取材。取材时间一般在09:00~11:00时(此时间段内细胞分裂旺盛,容易得到良好的分裂相)。
将取好的根尖根据不同的预处理方法分为4个组别。由于试剂的不同,其预处理时间也不相同。根据前人研究和本研究的前期试验,本试验选取了4种比较适宜的预处理方法进行前期的预处理。前3种方法的预处理时间为相应预处理方法的最佳预处理时间。同时,针对预处理条件为低温的组别,分别设置4个不同处理时间的组别(24,28,32,36 h)。然后将经过预处理的根尖,用新配制的卡诺固定液(无水乙醇∶冰醋酸=3∶1)固定24 h,然后换入70%的酒精中,于4 ℃冰箱中保存备用。
表1 不同预处理方法与预处理时间

组别指标预处理时间(h)秋水仙素[17]0.1%3对二氯苯[18]饱和水溶液48⁃羟基喹啉[19]0.002mol/L2低温4℃24,28,32,36
1.2.2 小麦根尖临时装片制作与观察统计
小麦临时装片的制作流程参照李丹丹等[20]的植物染色体装片的制作流程,并对其进行了部分改进,以便更适合本次研究。每一试样观察6~8个根尖装片,记录每个视野中观察的总细胞数、分裂的细胞数及分别处于前、中、后末期的细胞数,并对各组别的染色体形态特征进行观察和分析。
根据预处理的试验结果,选取预处理条件为低温处理28 h组别的根尖进行临时装片的制作。方法:将固定好的幼根用蒸馏水清洗2~3 min,用滤纸吸干处理好的小麦幼根上的浮水,浸于在65 ℃的水浴锅中预热的1 mol/L HCl,解离时间分别设置为5,10,15 min和20 min。取出后,用蒸馏水清洗2~3 min;用刀片取根尖发白处2~3 mm,用卡宝品红染色3~5 min,然后进行压片观察。以此探索不同的解离时间对小麦中期染色体形态的影响,探究其最适解离时间。
2 结果与分析
2.1 4种不同预处理方法对小麦根尖细胞染色体积累中期分裂相的影响
观察4种不同预处理方法下小麦根尖细胞的分裂相和染色体的形态特征,对各种处理的前、中、后、末期的染色体形态和细胞数目进行观察与统计(表2)。秋水仙素能成功地使有丝分裂停滞在中期,并且有效积累中期细胞(58.82%);低温对其抑制作用(55.43%)仅次于秋水仙素;对二氯苯对纺锤体的抑制效果(37.29%)略优于比8-羟基喹啉(26.39%)。
2.2 预处理条件为低温,不同预处理时间对小麦根尖细胞中期染色体的影响
根据本试验的前期试验结果,将预处理时间设为4个时间梯度。试验结果表明:在一定的预处理时间范围内,预处理时间越短,则染色体的浓缩程度不明显,染色体越长且细(图1 A和图1 B);低温预处理时间越长,染色体的浓缩程度明显,染色体缩短变粗;染色体的缢痕明显(图1 C和图1 D)。
2.3 预处理条件为低温(预处理时间为28 h),不同解离时间对小麦根尖细胞染色体制片效果的影响
表2 4种不同预处理方法对有丝分裂的影响
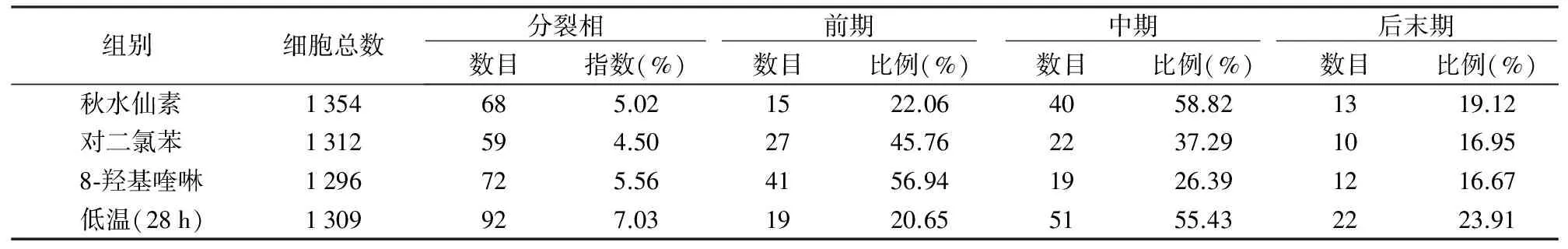
组别细胞总数 分裂相 前期 中期 后末期 数目指数(%)数目比例(%)数目比例(%)数目比例(%) 秋水仙素1354685.021522.064058.821319.12 对二氯苯1312594.502745.762237.291016.95 8⁃羟基喹啉1296725.564156.941926.391216.67 低温(28h)1309927.031920.655155.432223.91

图1 不同预处理时间对小麦根尖细胞中期染色体的影响
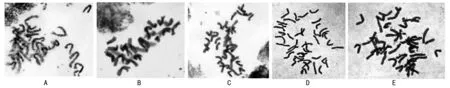
注:A为20 min,B为15 min,C为15 min,D为10 min,E为10 min。图2 不同解离时间对小麦根尖细胞中期染色体的影响
试验中发现,由于材料解离不充分,使得制片时细胞不易分散,染色体集中成团,分散效果不好,不能得到良好的分裂相;同样,用解离过度的材料进行压片时发现,染色体易断裂,制片效果模糊,也得不到效果好的分裂相(图2 A)。解离时间为10 min时,可以得到较好的分裂相(图2 D和图2 E)。
3 讨 论
在染色体制片技术中,前期预处理试验是整个染色体制片试验过程中最为重要的一个环节。不同植物不仅在取材、预处理上存在较大差异,而且在预处理试剂与预处理时间的选择上,也会关系到染色体制片的质量[21]。有丝分裂染色体的运动与纺锤体的牵引具有密切关系。因此,只有成功地抑制或者破坏纺锤体的形成,才能够更多地积累有丝分裂中期的细胞。在细胞分裂过程中,纺锤体是由微管组成的,而微管管壁的主要成分为微管蛋白,有α微管蛋白和β微管蛋白2种。目前,在不同植物的根尖预处理试验中,一般采取0.1%的秋水仙素水溶液、对二氯苯饱和水溶液、0.002 mol/L 8-羟基喹啉水溶液和低温处理等方法。其中秋水仙素会与微管中β微管蛋白肽链中的第201位半胱氨酸结合,结合后不仅会阻断微管的继续聚合,而且会导致先前装配好的微管发生解聚。因此秋水仙素能够干扰微管装配、破坏纺锤体形成和终止细胞分裂。低温(4 ℃)则影响了微管的装配,不能进一步形成纺锤体,使得染色体失去了向细胞两极移动的动力,所以进行低温预处理的细胞的有丝分裂会停留在中期阶段,从而大量积累处于分裂中期的细胞[22]。本研究采用4种不同的预处理方法对小麦根尖进行了预处理,得出如下结论:在本研究中,这4种预处理方法积累有丝分裂中期分裂相效果的明显程度依次是:秋水仙素、低温、对二氯苯和8-羟基喹啉。因此,秋水仙素和低温是良好的预处理方法,8-羟基喹啉和对二氯苯则不是很理想,而且8-羟基喹啉不易溶于水,配制水溶液较为困难。试验应运用秋水仙素和低温的方法对材料进行前期的预处理试验,结合经济角度和试验安全性方面考虑,低温则是最佳的预处理试验方法。由于前人并没有针对低温预处理的不同时间对小麦染色体形态的影响进行过研究,因此本研究又针对低温预处理的时间长度进行了探究,不同的低温预处理时间与小麦根尖染色体的浓缩程度具有一定的相关性。在一定的低温预处理时间内,处理的时间越长,染色体浓缩程度越大,且缢痕明显(图1 D)。
HCl能够解离细胞壁之间的果胶物质和细胞质,使细胞变得分散。HCl可以使染色体中DNA与蛋白质的联系削弱使之分开。由于HCl直接作用于根尖分生区细胞的细胞壁,解离程度是否合适直接影响到制片的好坏[23]。因此,本研究针对低温预处理条件下,不同解离时间对小麦根尖细胞制片的影响情况进行了探索性研究。结果表明,本试验材料的染色体数目为2n=42条,解离时间为10 min,解离效果最好;解离5 min左右的材料制片效果不是很好(未能取得较好的照片),可能是细胞质解离不够的原因;解离时间超过10 min的细胞,染色体形态比较模糊,极个别细胞染色体发生断裂,分析可能是因为解离过度,导致染色体形态发生变形。这说明,细胞的染色体容易受到高温,强酸,强碱,辐射等因素的影响,并非是稳定不变的。所以长时间解离会导致盐酸解离液与染色体接触时间过长,对染色体的结构造成物理伤害,使其发生断裂。
通过对本材料的试验证明:在前期预处理过程中,秋水仙素与低温对小麦根尖细胞有丝分裂中期的细胞积累效果较好;低温条件下,不同预处理时间和不同解离时间的研究结果表明,小麦根尖前期低温预处理的最佳预处理时间为28 h,最佳解离时间为10 min,能够得到染色体的形态、大小较适宜的装片。在低温预处理的条件下,影响小麦细胞学制片的主要因素是对材料的预处理时间和解离时间。此外个人的制片技术熟练程度以及供试材料的差异也影响制片的质量。
[1]Larkin P J,Banks P M,Lagudah E S,et al.DisomicThinopyrumintermediumaddition lines in wheat with barley yellow dwarf virus resistance and with rust resistances[J].Genome,1995,38(2):385-394.
[2]Tang S,Li Z,Jia X,et al.Genomic in situ hybridization (GISH) analyses ofThinopyrumintermedium,its partial amphiploid Zhong 5,and disease-resistant derivatives in wheat[J].Theoretical and Applied Genetics,2000,100(3-4):344-352.
[3]Franke R,Nestrowicz R,Senula A,et al.Intergeneric hybrids betweenTriticumaestivumL. and wild Triticeae[J].Hereditas,1992,116(s1):225-231.
[4]韩毅科,杜胜利,王鸣.黄瓜染色体制片及倍性研究[J].华北农学报,2003,18(1):72-74.
[5]王玉祥,陈述明,张博.苜蓿根尖制片技术研究[J].中国农学通报,2013,29(9):163-166.
[6]王歆,徐如宏,张立异,等.小麦外源基因检测研究进展[J].山地农业生物学报,2001,20(1):70-75.
[7]王彩华.普通小麦-中间偃麦草抗条锈异代换系和异附加系的选育与鉴定[D].济南:山东大学,2006.
[8]孙蕾,胡铁峰,何莉炜,等.八倍体小偃麦与普通小麦杂种衍生后代HBOT 09035形态学、细胞学和白粉病抗性鉴定[J]种子,2012,31(7):21-24.
[9]张其鲁,夏光敏,权太勇,等.小麦与长穗偃麦草(高冰草)体细胞杂种后代的性状变异及选育[J].麦类作物学报,2005,25(6):11-14.
[10]王黎明,林小虎,赵逢涛,等.一个小麦-中间偃麦草异代换系的形态学和细胞学鉴定[J].西北植物学报,2005,41(7):51-53.
[11]赛尔兰,陈全家.不同预处理对鹰嘴豆根尖细胞染色体制片的影响[J].生物学通报,2014,49(4):47-49.
[12]刘敏,王卉,宁慧霞,等.天山雪莲根尖染色体制片影响因素研究及组型分析[J].西北农业学报,2013,22(2):170-176.
[13]任文娟,郭小菲,姜立娜,等.菜用大黄染色体制片优化及核型分析[J].华北农学报,2013,28(5):128-132.
[14]姚启伦,陈发波,刘红芳,等.西南地区玉米地方品种B染色体多态性分析[J].中国农业科学,2015,48(14):2 697-2 704.
[15]Qi ZJ,Du P,Qian BL,et al.Characterization of a wheat-Thinopyrumbessarabicum(T 2 JS-2 BS·2 BL) translocation line[J].Theoretical and applied genetics,2010,121(3):589-597.
[16]Bie TD,Cao YP,Chen PD.Mass production of intergeneric chromosomal translocations through pollen irradiation ofTriticumdurum-Haynaldiavillosaamphiploid[J].Journal of Integrative Plant Biology,2007,49(11):1 619-1 626.
[17]刘莹,赵翠荣,王立峰,等.小麦根尖染色体制片及植株倍性鉴定[J].安徽农业科学,2012,40(25):12 349-12 350.
[18]李懋学.对二氯苯在植物染色体预处理中的应用[J].遗传,1980,2(6):30-32.
[19]刘焰,孟霞,吴建国,等.小麦和无融合生殖小麦草杂交后代(BC 2 F 2)的生物学特性及根尖染色体数目变化研究[J].华中农业大学学报,2001,39(4):201-209.
[20]李丹丹,王洪刚,刘树兵,等.抗白粉病小偃麦异代换系的细胞学鉴定和RAPD分析[J].作物学报,2003,20(3):525-529.
[21]刘敏,王卉,宁慧霞,等.树上干杏染色体制片优化及核型分析[J].西北植物学报,2012,21(10):79-83.
[22]陈晶鑫.梅花染色体制片技术优化及基于荧光原位杂交的核型分析[D].北京林业大学,2013.
[23]陈高,孙航,孙卫邦.改进的植物染色体制片方法[J].植物生理学通讯,2007,43(4):759-760.
Influences of Different Factors on Chromosome Preparation of Root-tip Tissue in Wheat
ZOUJingwei,GUOZhenqing,ZHANGZhiwen,RENXuejun,LINXiaohu
(College of Life Science and Technology,Hebei Normal University of Science amp; Technology,Qinhuangdao Hebei 066004,China)
Based on the root tips of wheat,this experiment studied four pretreatment factors,which are low temperature,colchicine,8-hydroxyquinoline and p-dichlorobenzene,affecting the effect of chromosomes in the metaphase of mitosis.The results indicated that the influencing effects of chromosomes in the metaphase of mitosis were significantly obvious.It was colchicine,low temperature,8-hydroxyquinoline and p-dichlorobenzene in turns.The influence degree of the first two factors was more significantly obvious than another two factors.Then based on the previous achievements of the study,it was also groped for other factors in the process of chromosome preparation under low temperature.It found that the major influencing factors were time for preliminary treatment under low temperature and times for disaggregation with HCl.In the end,It was determined that the most suitable method about chromosome preparation with the root tips of wheat,which is expected to provide the basic method for chromosome doubling,identification of heterochromosome system and cytogenetics for Triticeae Dumort.
wheat; root tip cell; chromosome preparation; influencing factors
2016-07-27
“十二五”国家重大科技支撑计划项目(编号:2011 BAD 16 B 08 S 10);河北省高等学校科学技术研究项目(编号:Q 2012005);河北省自然科学基金项目(编号:C 2015407038)。
邹景伟(1990—),男,河北沧州人;在读研究生,研究方向:作物遗传育种;E-mail:zoujingwei2013@qq.com。
林小虎(1972—),男,内蒙古赤峰人;教授,博士,硕士生导师,主要从事作物遗传育种学教学及科研工作;E-mail:xiaohulin2008@163.com。
10.16590/j.cnki.1001-4705.2016.12.008
S 512.1
A
1001-4705(2016)12-0008-04
