黄酒对小鼠抗疲劳能力和衰老小鼠免疫器官的影响
2016-12-02仝令印孙海基
王 璟,秦 雪,仝令印,孙海基
(山东师范大学生命科学学院,山东 济南 250014)
黄酒对小鼠抗疲劳能力和衰老小鼠免疫器官的影响
王 璟,秦 雪,仝令印,孙海基*
(山东师范大学生命科学学院,山东 济南 250014)
目的:研究黄酒对正常小鼠抗疲劳能力和D-半乳糖所致亚急性衰老小鼠免疫器官的影响。方法:抗疲劳能力实验中,小鼠分别灌胃给予双蒸水(0.25 mL/d)、高(0.4 mL/d)、中(0.25 mL/d)、低(0.15 mL/d)剂量的黄酒(乙醇体积分数为8%)15 d,小鼠游泳后检测肝糖原(hepatic glycogen,HG)、尿素氮(blood urea nitrogen,BUN)和血乳酸(blood lactic acid,BLA)含量的变化。在黄酒对亚急性衰老小鼠免疫器官影响的实验中,采用腹腔注射D-半乳糖建立亚急性衰老小鼠模型,分别灌胃双蒸水、酒精和不同剂量的黄酒,每天1 次,连续灌胃56 d,测定小鼠胸腺指数、脾脏指数和亚急性衰老模型建立前后的体质量增值。结果:黄酒能显著提高小鼠体内HG的含量(P<0.01);增加运动后小鼠BLA增长率(P<0.05)和BUN的廓清率(P<0.05);黄酒能抑制衰老小鼠胸腺(P<0.01)和脾脏(P<0.05)质量的减少,有助于衰老小鼠的体质量增长(P<0.05)。结论:黄酒能提高小鼠的抗疲劳能力,增强衰老小鼠的免疫能力。
抗疲劳;免疫器官指数;黄酒;小鼠
黄酒是以稻米、黍米、玉米、小米、小麦等为主要原料,经蒸煮、加曲、糖化、发酵、压榨、过滤、煎酒、贮存、勾兑而成的酿造酒;作为我国传统酒,以独创的复式发酵酿造工艺,与葡萄酒、啤酒并列为世界三大酿造酒。黄酒中含有丰富的糖类、维生素、微量元素、γ-氨基丁酸、生物活性肽、酚类和黄酮类物质,以及20 种左右的氨基酸,从而成为人们广为熟知的养生佳品,亦作为中医处方中常用的、理想的药引子[1-2]。但与啤酒和葡萄酒研究相比,黄酒的研究大多集中于理化检测和发酵工艺等方面,对黄酒的生理功效和活性物质研究还停留在起步阶段。黄玥等[3]通过实验,对黄酒中总酚、总黄酮含量进行了测定,并通过动物实验研究了黄酒对体内抗氧化能力的影响;马良[4]通过观察黄酒对大鼠肠道微生物的影响,认为黄酒中富含的低聚糖可以增加肠道益生菌,减少肠道致病菌或条件致病菌,对肠道微生物具有一定调控作用;倪瓒等[5]通过铅中毒模型小鼠发现,黄酒可降低铅中毒小鼠血液和肝脏中的铅含量,对铅中毒具有拮抗作用;谢广发等[6]的大鼠Y-型电迷宫实验结果表明,黄酒可增强大鼠的学习记忆能力;沈赤等[7-8]通过免疫缺陷小鼠发现,黄酒多糖可以提高免疫缺陷小鼠的免疫功能。但对黄酒生理功效的研究仅局限于上述方面,其他研究所知甚少。在如今快节奏的现代社会生活中,疲劳严重影响学习和日常生活,所以研究延缓或消除疲劳的措施具有十分重要的意义。鹿茸血酒、五加皮酒[9-10]等众多保健酒具有抗疲劳的功效,然而黄酒对抗疲劳能力的研究,国内外鲜见相关的报道。黄酒中的蛋白质含量高于其他酒精饮料,富含包括8 种必需氨基酸在内的多种氨基酸。除此之外,黄酒中含有的其他生物活性成分,如:γ-氨基丁酸、谷胱甘肽、多酚、黄酮类物质及铁、锌、铜、锰、硒等微量元素,表现出了良好的抗氧化活性,保护细胞免于自由基的伤害,具有抗机体氧化、抗衰老等功效。然而,国内外对黄酒延缓衰老作用的研究相对较少。本研究通过小鼠游泳和亚急性衰老小鼠模型实验分别探讨黄酒对抗疲劳能力以及亚急性衰老小鼠免疫器官的作用,旨在明确黄酒保健养生的作用机理,为提升黄酒的价值和黄酒的推广提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
雄性昆明种小鼠160 只,即8 周龄(20±2) g 120 只,12 周龄(30±2) g 40 只,由山东大学动物实验中心提供,生产许可证:SCXK(鲁)20130009,使用许可证:SYXK(鲁)20130001。
黄酒(乙醇体积分数为8%)由河北省农林科学院谷子研究所提供:小米筛选除杂、浸渍、沥水、蒸煮、冷却,添加酒曲糖化酵母发酵,最后压榨、澄清、过滤,获得产品[11]。
肝糖原(hepatic glycogen,HG)试剂盒、血乳酸(blood lactic acid,BLA)试剂盒、血清尿素氮(blood urea nitrogen,BUN)试剂盒 南京建成生物工程研究所;D-半乳糖 北京索莱宝科技有限公司。
1.2 仪器与设备
HH-S2型数显恒温水浴锅 金坛市医疗仪器厂;Mini 4K微型离心机 湖南湘仪离心机仪器有限公司SartoriusAG BS200S-WE1精密电子天平 德国塞多利斯公司;UV-1800紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 动物分组及给药方法
小鼠用基础饲料(购自山东大学动物实验中心)喂养1 周以适应环境,之后将8 周龄和12 周龄小鼠分别随机分组。8 周龄小鼠分为4 组,每组30 只:对照组(双蒸水0.25 mL/d)、黄酒高剂量组(0.4 mL/d)、黄酒中剂量组(0.25 mL/d)和黄酒低剂量组(0.15 mL/d),连续灌胃15 d,进行抗疲劳实验;12 周龄小鼠分为5 组,每组10 只:对照组、衰老模型对照组、衰老模型酒精组、衰老模型黄酒组1和衰老模型黄酒组2。衰老模型酒精组和衰老模型黄酒组2分别以体积分数8%的酒精和黄酒各0.4 mL灌胃,衰老模型黄酒组1给予0.25 mL黄酒灌胃,对照组与衰老模型对照组灌胃0.4 mL双蒸水,每天1 次,连续灌胃56 d。同时,衰老模型对照组、衰老模型酒精组、衰老模型黄酒组1和衰老模型黄酒组2小鼠,按剂量200 mg/(kg·d)腹腔注射D-半乳糖,对照组小鼠腹腔注射生理盐水[12]。
1.3.2 抗疲劳实验参数测定
1.3.2.1 HG含量的测定
黄酒连续灌胃15 d,分别从高、中、低剂量组和对照组中随机取出10 只小鼠,末次灌胃12 h后,在温度30 ℃的游泳箱(70 cm×50 cm×60 cm)中不负重游泳90 min后,立即颈椎脱臼处死,剖取肝脏,精确称质量,测定HG的含量[13]。
1.3.2.2 BUN含量的测定
分别从高、中、低剂量组和对照组中随机取出10 只小鼠,末次灌胃12 h后,在温度30 ℃的游泳箱中不负重游泳90 min,捞出小鼠擦干,每只小鼠分别于游泳后即刻、游泳后30 min采眼球血,分离血清。用BUN试剂盒测定其含量,按式(1)计算BUN增长率。

式中:c1为运动后30 min时BUN含量/(mmol/L);c2为运动后即刻BUN含量/(mmol/L);t为时间30 min。
1.3.2.3 BLA含量的测定
分别从高、中、低剂量组和对照组中随机取出10 只小鼠,末次灌胃12 h后,在温度30 ℃的游泳箱中负重5%游泳10 min,捞出小鼠擦干,每只小鼠分别于游泳后即刻、游泳后20 min内眦采血,分离血清。用BLA试剂盒测定其含量,按式(2)计算BLA廓清率[14]。
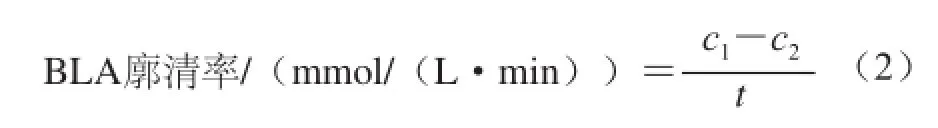
式中:c1为运动后即刻BLA含量/(mmol/L);c2为运动后休息20 min时BLA含量/(mmol/L);t为时间20 min。
1.3.3 D-半乳糖所致亚急性衰老小鼠免疫器官指数和体质量的变化
各组小鼠称质量,然后D-半乳糖和黄酒同时给药处理56 d后禁食12 h,称质量。颈椎脱臼处死,剖取胸腺、脾脏,去除脏器周围的脂肪和结缔组织,滤纸吸附血液,精确称质量,按式(3)计算免疫器官指数。

1.4 数据统计分析
采用SPSS 19.0统计软件对各项指标进行统计,并进行单因素方差分析,采用Duncan’s进行组间多重比较,实验数据均以表示。
2 结果与分析
2.1 黄酒对HG含量的影响
表1 不同剂量黄酒对HG含量的影响(,n=10)Table 1 Effect of CRW at various doses on hepatic glycogen content (,n= 10) mg/g

表1 不同剂量黄酒对HG含量的影响(,n=10)Table 1 Effect of CRW at various doses on hepatic glycogen content (,n= 10) mg/g
注:*. 与对照组相比差异显著(P<0.05);**. 与对照组相比差异极显著(P<0.01);##. 与低剂量组相比差异极显著(P<0.01)。下同。
组别对照组低剂量组中剂量组高剂量组HG含量12.20±1.4322.03±2.12**26.55±1.32**28.03±1.54**##
由表1可知,与对照组比较,各剂量组小鼠HG含量均明显增加,且差异具有统计学意义(P<0.01),其增长效果由强到弱依次为高剂量组>中剂量组>低剂量组。说明黄酒能显著增加小鼠HG含量,且具有剂量依赖性。
2.2 黄酒对BLA含量的影响
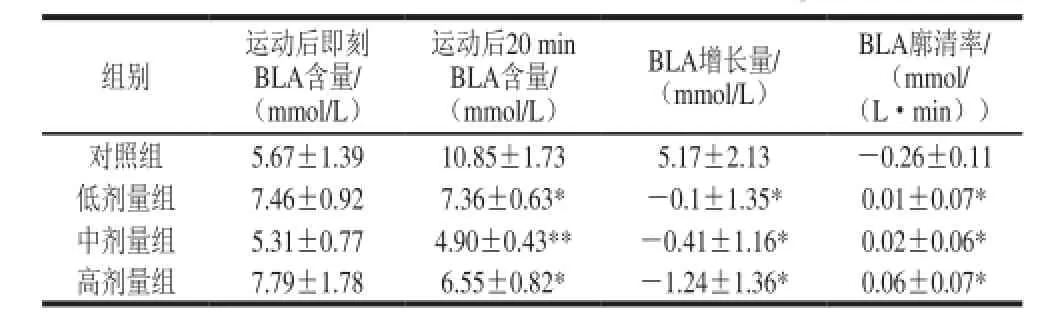
表2 不同剂量黄酒对BLA含量的影响(x±s,n=10)Table 2 Effect of CRW at various doses on BLA change (x±s,n= 10)
以小鼠运动后血清中乳酸水平评价小鼠抗疲劳能力,结果见表2。游泳后20 min时,与对照组相比,黄酒各剂量组小鼠BLA均降低,且具有统计学意义(P<0.05),中剂量组与对照组相比,差异具有统计学意义(P<0.01)。游泳后0~20 min的廓清率,与对照组比,各剂量组差异具有统计学意义(P<0.05),其作用效果依次为高剂量组>中剂量组>低剂量组,表明黄酒能明显减少小鼠运动后体内BLA的含量,在一段时间内能快速清除小鼠体内的BLA。
2.3 黄酒对BUN含量的影响
表3 不同剂量黄酒对BUN含量的影响(,n=10)Table 3 Effect of CRW at various doses on BUN change (n= 10)
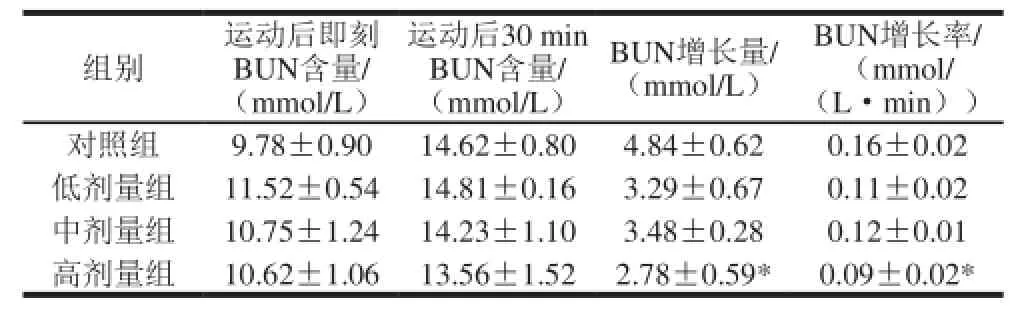
表3 不同剂量黄酒对BUN含量的影响(,n=10)Table 3 Effect of CRW at various doses on BUN change (n= 10)
BUN增长率/(mmol/(L·min))对照组9.78±0.90 14.62±0.804.84±0.620.16±0.02低剂量组11.52±0.5414.81±0.163.29±0.670.11±0.02中剂量组10.75±1.2414.23±1.103.48±0.280.12±0.01高剂量组10.62±1.0613.56±1.522.78±0.59*0.09±0.02*组别运动后即刻BUN含量/(mmol/L)运动后30 min BUN含量/(mmol/L)BUN增长量/(mmol/L)
由表3可知,在游泳完即刻,各剂量组小鼠BUN含量与对照组相比,无显著差异(P>0.05),且对照组小鼠BUN略低于实验组;游泳后休息30 min时,各剂量组小鼠BUN含量与对照组相比,亦无显著差异(P>0.05),但此时除低剂量组之外,中剂量组和高剂量组小鼠BUN含量均低于对照组。从游泳后即刻到游泳后30 min时,各组小鼠BUN含量增长量及增长率来看,高剂量组与对照组相比,差异具有统计学意义(P<0.05),其他剂量组小鼠BUN的增长量和增长率均低于对照组。说明黄酒能抑制小鼠运动后体内BUN含量的增长。
2.4 黄酒对D-半乳糖所致亚急性衰老小鼠免疫器官指数的影响

表4 不同剂量黄酒对免疫器官指数的影响(x±s,n=10)Table 4 Effect of?CRW?at various doses on thymus and spleen indices (x ± s, n= 10) mg/g
由表4可知,衰老模型对照组小鼠胸腺指数与对照组、衰老模型黄酒组1和衰老模型黄酒组2比较,差异均具有统计学意义(P<0.01);且衰老模型酒精组与衰老模型黄酒组1和衰老模型黄酒组2相比,差异均具有统计学意义(P<0.05)。从脾脏指数结果来看,衰老模型酒精组与对照组和衰老模型黄酒组2差异具有统计学意义(P<0.05),而衰老模型黄酒组2和衰老模型对照组之间,差异亦具有统计学意义(P<0.05);衰老模型黄酒组1、2与对照组相比,无显著性差异(P>0.05)。表明黄酒在由D-半乳糖所致亚急性衰老小鼠的免疫器官方面,对小鼠免疫器官具有抑制其衰老退化的作用。
2.5 黄酒对D-半乳糖所致亚急性衰老小鼠体质量的影响
表5 不同剂量黄酒对体质量的影响(,n=10)Table 5 Effect of CRW at various doses on body weight of aging mice (,n= 10) g
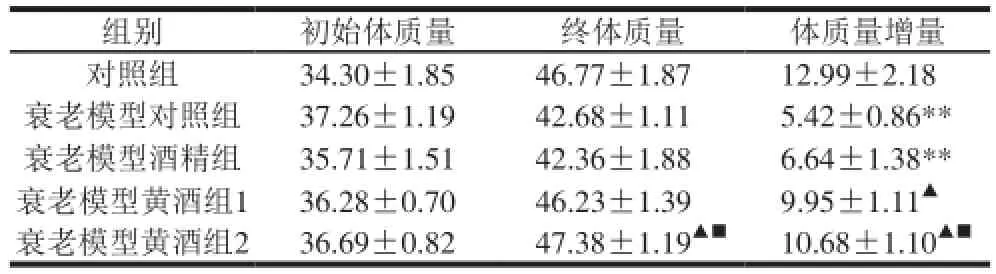
表5 不同剂量黄酒对体质量的影响(,n=10)Table 5 Effect of CRW at various doses on body weight of aging mice (,n= 10) g
组别初始体质量终体质量体质量增量对照组34.30±1.8546.77±1.8712.99±2.18衰老模型对照组37.26±1.1942.68±1.115.42±0.86**衰老模型酒精组35.71±1.5142.36±1.886.64±1.38**衰老模型黄酒组136.28±0.7046.23±1.399.95±1.11▲衰老模型黄酒组236.69±0.8247.38±1.19▲■10.68±1.10▲■
由表5可知,各组小鼠实验前体质量均无显著差异,实验后衰老模型黄酒组2分别与衰老模型对照组和衰老模型酒精组存在差异(P<0.05);从体质量增长值来看,衰老模型对照组和衰老模型酒精组小鼠体质量增量与对照组存在差异(P<0.01),衰老模型对照组分别与衰老模型黄酒组1和衰老模型黄酒组2比较,差异具有统计学意义(P<0.05),衰老模型酒精组与衰老模型黄酒组2之间具有显著差异(P<0.05);而对照组小鼠体质量增量与衰老模型黄酒组1和2均无显著性差异(P>0.05)。表明黄酒对D-半乳糖所致亚急性衰老小鼠的体质量增长具有积极作用。
3 讨 论
疲劳是一种为防止机体机能进一步衰竭而产生的生理生化过程[15-16]。疲劳可以导致精神萎靡不振、身体乏力,严重时甚至会摧毁人体神经系统和免疫系统等,故研究抵抗疲劳的措施具有十分重要的意义[17]。
糖作为机体供能的首选物质,也是肌肉运动时重要的能量来源。长时间的紧张运动中,体力的衰竭总是同时伴随着肌糖元的耗竭。与此同时,HG为了机体血糖水平的稳定,会不断转化成血糖,从而其储备量不断减少,因此可通过HG储备量的增加或运动时HG消耗的情况推断疲劳程度。所以,HG常作为一项较敏感的指标来衡量抗疲劳能力[18]。从本实验结果中可以看出,黄酒各剂量组与对照组均有极显著差异,说明黄酒可以有效增加小鼠机体HG的储备含量。黄酒中的碳水化合物基本上是可被直接吸收的葡萄糖、果糖等单糖以及麦芽糖、异麦芽糖、乳糖等低聚糖,会直接被代谢或以糖原的形式储存到肝脏和肌肉中,以满足组织和细胞的能量需求,补充和平衡能量的需要[19]。
肌乳酸是供能体系的中产物,较长时间的剧烈运动导致机体相对缺氧,糖酵解加快,产生大量乳酸在肌肉中堆积,导致疲劳。肌乳酸会在5~15 min内渗入血液,使BLA含量上升,直至二者平衡。因此,运动后BLA的变化,廓清率是衡量抗疲劳效果的重要指标[20]。本实验证明,黄酒各剂量组能使小鼠运动后BLA的廓清率较对照组有显著差异,说明黄酒能增加BLA的清除速率,增加机体的抗疲劳能力。其机制可能与黄酒中众多的抗氧化成分可以提高乳酸脱氢酶活性有关。
蛋白质较少参与短时运动的供能,而长时间运动后,机体无法通过糖和脂肪的代谢获取足够能量,蛋白质和氨基酸的分解代谢便会加强,并随运动负荷的增加而增加。蛋白质分解加强不仅发生在运动期,还会延续到运动后的休息期,因而在运动后较长时间内,BUN水平可持续升高[15,21]。本实验中,虽然黄酒各剂量组在运动后即刻以及运动后30 min时,各组小鼠BUN无显著差异,但其间在小鼠BUN的增长量和增长率方面,黄酒高剂量组与对照组间具有显著差异,且其余剂量组均低于对照组,说明黄酒对长时间运动后BUN含量的升高具有抑制作用。
D-半乳糖是一种生理性营养成分,在机体内通过半乳糖酶生成醛糖和过氧化氢,其过量造成的损伤可致机体产生衰老现象[22]。胸腺、脾脏作为中枢和重要的外周免疫器官,其萎缩、质量的降低、功能的衰退可使免疫功能降低,因此胸腺指数和脾脏指数是用来检查免疫器官生长和免疫细胞功能的指标[23-25]。本实验发现,黄酒就亚急性衰老小鼠胸腺指数、脾脏指数的降低有着抑制作用,能促进提高机体的免疫力。另一方面,体质量是动物实验中评价动物生长状况,反映机体综合机能的非特异性指标。通过实验测得,黄酒对D-半乳糖所致亚急性衰老的小鼠体质量增长具有促进作用,与前人研究结果吻合,可能与黄酒降低D-半乳糖导致的机体代谢紊乱程度有关[26-27]。黄酒中含有的多糖可以对免疫功能起到良好的调控作用,黄酒中的多酚、黄酮类等抗氧化物质对机体内自由基的清除、脂质过氧化的抑制、机体代谢紊乱程度的减轻等均有积极作用,从而起到抑制机体衰老的作用[3,8]。综上,黄酒具有良好的抗疲劳功效和提高免疫力的作用。但目前国内外对黄酒在体实验以及黄酒中各种成分在各种功效中作用机制的相关研究报道依旧较少,因此,对黄酒的开发利用价值还有很大空间。同时,黄酒对机体保健功效的机制还有待进一步研究。
[1] 倪莉, 吕旭聪, 黄志清, 等. 黄酒的生理功效及其生理活性物质研究进展[J]. 中国食品学报, 2012, 12(3): 1-7. DOI:10.3969/ j.issn.1009-7848.2012.03.001.
[2] 王家林, 张颖, 于秦峰. 黄酒中生物活性成分的探讨[J]. 酿酒科技, 2014(7): 47-50.
[3] 黄玥, 厉曙光, 孙宇立, 等. 黄酒对D-半乳糖衰老小鼠抗氧化能力的影响[J]. 营养学报, 2013, 35(3): 304-306.
[4] 马良. 黄酒对大鼠肠道微生物的影响[J]. 中华医院感染学杂志, 2013(17): 4107-4108; 4124.
[5] 倪赞, 寿春波, 史锋, 等. 黄酒对实验性铅中毒的拮抗作用研究[J]. 中国食品学报, 2007, 7(2): 38-41. DOI:10.3969/j.issn.1009-7848.2007.02.008.
[6] 谢广发, 朱成钢, 胡志明, 等. 绍兴黄酒对大鼠学习记忆力的影响[J].酿酒科技, 2007(5): 139-141. DOI:10.3969/j.issn.1001-9286.2007.05.036.
[7] 沈赤, 毛健, 陈永泉, 等. 黄酒多糖对免疫缺陷小鼠血清免疫相关因子的影响[J]. 食品科学, 2015, 36(5): 158-162. DOI:10.7506/ spkx1002-6630-201505030.
[8] SHEN C, MAO J, CHEN Y Q, et al. Extraction optimization of polysaccharides from Chinese rice wine from the Shaoxing region and evaluation of its immunity activities[J]. Journal of the Science of Food & Agriculture, 2014, 95(10): 1991-1996. DOI:10.1002/jsfa.6909.
[9] 白晨, 王淑珍, 周晓望, 等. 鹿茸血酒抗疲劳活性实验研究[J]. 食品科学, 2008, 29(11): 575-578. DOI:10.3321/j.issn:1002-6630.2008.11.134.
[10] 王亚东, 王海玉, 李立, 等. 五加皮酒抗疲劳作用的实验研究[J]. 中国卫生检验杂志, 2009(6): 1404-1405.
[11] 刘敬科, 赵巍, 付会期, 等. 小米黄酒酿造工艺的研究[J]. 粮食与饲料工业, 2009(12): 22-23.
[12] ZHOU Y, DONG Y, XU Q G, et al. Mussel oligopeptides ameliorate cognition deficit and attenuate brain senescence in D-galactose-induced aging mice[J]. Food & Chemical Toxicology, 2013, 59(8): 412-420. DOI:10.1016/j.fct.2013.06.009.
[13] 王洪涛, 尹花仙, 金海珠, 等. 海参肽对小鼠抗疲劳作用的研究[J]. 食品与机械, 2007, 23(3): 89-91. DOI:10.3969/ j.issn.1003-5788.2007.03.025.
[14] 郑哲君, 李晓莉, 王朔. 抗疲劳功能食品的研究进展[J]. 食品科技, 2006, 31(2): 4-7. DOI:10.3969/j.issn.1005-9989.2006.02.002.
[15] 宋伟峰, 苏俊芳, 罗淑媛. 荔枝多糖抗疲劳作用的实验研究[J]. 中药材, 2012, 35(9): 1485-1487.
[16] NI W H, GAO T T, WANG H L, et al. Anti-fatigue activity of polysaccharides from the fruits of four Tibetan plateau indigenous medicinal plants[J]. Journal of Ethnopharmacology, 2013, 150(2): 529-535. DOI:10.1016/j.jep.2013.08.055.
[17] WANG J, LI S S, FAN Y Y, et al. Anti-fatigue activity of the watersoluble polysaccharides isolated from Panax ginseng C. A. Meyer.[J]. Journal of Ethnopharmacology, 2010, 130(2): 421-423. DOI:10.1016/ j.jep.2010.05.027.
[18] 王曦, 许晓燕, 郑林用, 等. 乳酸菌发酵黄芪的抗疲劳保健功能研究[J]. 时珍国医国药, 2011, 22(6): 1422-1424.
[19] 陈成, 殷子建, 徐速. 浅析黄酒的历史及营养价值[J]. 酿酒, 2002, 29(1): 55-56. DOI:10.3969/j.issn.1002-8110.2002.01.028.
[20] 张睿, 赵玉红, 王忠政. 鹿茸水提物对小鼠抗疲劳功能的影响[J]. 食品工业科技, 2011, 32(4): 365-367.
[21] 覃辉艳, 赵鹏, 杨俊峰, 等. 肉苁蓉茶对小鼠抗疲劳和耐缺氧能力的影响[J]. 现代预防医学, 2011, 38(12): 2362-2364.
[22] 任瑞琴, 陈丹, 程清, 等. 芙蓉李总多酚提取物对D-半乳糖所致亚急性衰老小鼠的抗氧化作用[J]. 中国现代应用药学, 2014, 31(1): 5-9.
[23] FAN L P, DING S D, AI L Z, et al. Antitumor and immunomodulatory activity of water-soluble polysaccharide from Inonotus obliquus[J]. Carbohydrate Polymers, 2012, 90(2): 870-874. DOI:10.1016/ j.carbpol.2012.06.013.
[24] WANG M, MENG X Y, YANG R L, et al. Cordyceps militaris polysaccharides can enhance the immunity and antioxidation activity in immunosuppressed mice[J]. Carbohydrate Polymers, 2012, 89(2): 461-466. DOI:10.1016/j.carbpol.2012.03.029.
[25] YANG T H, JIA M, ZHOU S Y, et al. Antivirus and immune enhancement activities of sulfated polysaccharide from Angelica sinensis.[J]. International Journal of Biological Macromolecules, 2012, 50(3): 768-772. DOI:10.1016/j.ijbiomac.2011.11.027.
[26] 徐智, 吴国明, 钱桂生, 等. 大鼠衰老模型的初步建立[J].第三军医大学学报, 2003, 25(4): 312-315. DOI:10.3321/ j.issn:1000-5404.2003.04.010.
[27] 余资江, 应大君, 董世武, 等. 半乳糖急性致衰老动物模型剂量的探讨[J]. 解剖学杂志, 2005, 28(4): 422-424; 445. DOI:10.3969/ j.issn.1001-1633.2005.04.019.
Anti-Fatigue Effect of Chinese Rice Wine in Normal Mice and Its Influence on Immune Organ Indexes of Aging Mice
WANG Jing, QIN Xue, TONG Lingyin, SUN Haiji*
(School of Life Science, Shandong Normal University, Jinan 250014, China)
Objective: The aim of this study was to evaluate the anti-fatigue effect of Chinese rice wine (CRW) in normal mice and its influence on immune organ indexes of D-galactose-induced aging mice. Methods: Mice were randomly divided into four groups: control, low-dose CRW, middle-dose CRW and high-dose CRW groups, which were given by gavage 0.25 mL of distilled water, and 0.15, 0.25 and 0.4 mL of CRW for 15 consecutive days, respectively for exploring the antifatigue effect of CRW. Then, changes in hepatic glycogen, blood urea nitrogen (BUN) and blood lactic acid (BLA) contents in mice after forced swimming were measured. A mouse model of sub-acute aging was established by intraperitoneal injection of D-galactose and the aging mice were respectively given distilled water, aqueous ethanol and CRW once a day by intragastric administration for 56 days. Finally, the mice were sacrificed, for the measurement of thymus index, spleen index and body weight gain. Results: CRW could significantly increase hepatic glycogen level (P < 0.01) and enhance postexercise increase in BLA level (P < 0.05) and the clearance rate of BUN level (P < 0.05). In addition, CRW significantly inhibited the decrease in thymus (P < 0.01) and spleen (P < 0.05) weights and increased body weight (P < 0.05). Conclusion: CRW can exert an anti-fatigue effect and enhance immune function in aging mice.
anti-fatigue effect; immune organ indexes; Chinese rice wine; mice
10.7506/spkx1002-6630-201621038
G804.7
A
1002-6630(2016)21-0224-05
王璟, 秦雪, 仝令印, 等. 黄酒对小鼠抗疲劳能力和衰老小鼠免疫器官的影响[J]. 食品科学, 2016, 37(21): 224-228.
DOI:10.7506/spkx1002-6630-201621038. http://www.spkx.net.cn WANG Jing, QIN Xue, TONG Lingyin, et al. Anti-fatigue effect of Chinese rice wine in normal mice and its influence on immune organ indexes of aging mice[J]. Food Science, 2016, 37(21): 224-228. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201621038. http://www.spkx.net.cn
2015-12-23
公益性行业(农业)科研专项(201303069-07)
王璟(1990—),男,硕士研究生,研究方向为动物生理。E-mail:594625761@qq.com
*通信作者:孙海基(1970—),男,副教授,博士,研究方向为神经消化生理。E-mail:sunhj5018@126.com
