响应面优化鱿鱼须脱皮液胶原肽酶解工艺及抗氧化活性
2016-12-02罗春艳吴杨阳孙海燕江旭华陈小娥
罗春艳,吴杨阳,孙海燕,2,余 辉,江旭华,陈小娥,2,*
(1.浙江海洋大学食品与医药学院,浙江 舟山 316022;2.浙江省水产品加工技术研究联合重点实验室,浙江 舟山 316022;3.浙江富丹旅游食品有限公司,浙江 舟山 316104)
响应面优化鱿鱼须脱皮液胶原肽酶解工艺及抗氧化活性
罗春艳1,吴杨阳1,孙海燕1,2,余 辉1,江旭华3,陈小娥1,2,*
(1.浙江海洋大学食品与医药学院,浙江 舟山 316022;2.浙江省水产品加工技术研究联合重点实验室,浙江 舟山 316022;3.浙江富丹旅游食品有限公司,浙江 舟山 316104)
目的:研究秘鲁鱿鱼须脱皮液胶原肽酶解工艺及抗氧化活性。方法:以水解度和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为指标,利用单因素试验和响应面法对其酶解工艺进行优化,并采用2,2’-联氮-二(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)自由基与·OH清除率及亚铁还原能力评价其酶解产物抗氧化活性以及通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和凝胶排阻色谱分析其分子质量分布。结果:最适酶解工艺为酶解温度50 ℃、初始pH 7.4、底物蛋白质质量分数3.2%、酶解时间3.7 h、酶添加量3 000 U/g。在此条件下,水解度和酶解产物DPPH自由基清除率分别为(37.23±0.08)%和(43.61±0.09)%,对ABTS+·和·OH清除率的IC50分别为0.37 mg/mL和0.41 mg/mL,且表现出较强的亚铁还原能力;SDS-PAGE显示最适酶解工艺下,蛋白质基本被水解为小分子多肽;凝胶排阻色谱分析可知,酶解产物分子质量在1~5 kD之间。结论:酶解产物具备较强的抗氧化活性,可作为抗氧化活性物质基料,充分开发利用。
鱿鱼须脱皮液;酶解;抗氧化;水解度;半抑制浓度
我国远洋捕捞鱿鱼种类主要有秘鲁鱿鱼、阿根廷鱿鱼和北太平洋鱿鱼。秘鲁鱿鱼是至今为止发现个体最大、资源最充足的原料之一,已成为浙江省水产加工的主要品种,仅2014年其捕捞量就高达37万 t,占浙江省远洋鱿鱼捕捞量一半以上[1-3]。因秘鲁鱿鱼须表皮深黑、厚实、吸盘难脱除等问题,致使其深加工一直受到限制,因此,如何对其进行脱皮是秘鲁鱿鱼须深加工目前面临的首要问题[4-5]。课题组前期对鱿鱼须酶法脱皮工艺进行了深入研究,建立了秘鲁鱿鱼须胰酶脱皮工艺[6],该工艺已在当地企业逐步推广应用。但在企业生产过程中产生了大量的脱皮液,其含有丰富的维生素、微量元素、不饱和脂肪酸和牛磺酸等营养物质[7],一般直接排入城市污水处理系统,不仅浪费资源,而且还需支付昂贵的排污费用[8]。因此,对其进行有效开发利用,提高其附加值成为水产加工企业急需解决的问题。
目前,有关鱿鱼须脱皮废液深加工利用的研究相对较少,如从鱼糜漂洗液等废水中回收蛋白质[9-11]或蛋白酶[12];利用鲭鱼罐头蒸煮液开发调味品[13-15]或制备抗氧化肽[16]等。迄今为止,国内外有关鱿鱼须脱皮液深加工利用研究鲜见报道。研究表明,脱皮液中富含蛋白质,特别含有大量的胶原蛋白[17-18]。因此,针对鱿鱼须脱皮液的成分特性,本实验利用商业化的胶原蛋白酶对其进行酶解以制备具有抗氧化活性的胶原肽,通过响应面法优化酶解工艺,并分析了最适工艺条件下酶解产物的抗氧化活性及通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)图谱观察酶解效果,利用凝胶排阻色谱分析其分子质量分布,以期为鱿鱼资源深度开发及其下脚料的综合利用提供实验依据。
1 材料与方法
1.1 材料与试剂
鱿鱼须脱皮液(-20 ℃冰箱保存) 浙江富丹旅游食品有限公司;胶原蛋白酶(2×105U/g)南宁庞博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-二(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS) 美国Sigma公司;其他化学试剂均为分析纯国药集团化学试剂有限公司。
1.2 仪器与设备
HH-601型超级恒温水浴锅 常州市顶新实验仪器有限公司;BS110S型电子天平 德国赛多利斯公司;pHS-3B型精密pH计 上海精密科学仪器有限公司;UV-2800型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;AKTA purifier100蛋白纯化系统 瑞典Amersham Biosciences公司。
1.3 方法
1.3.1 鱿鱼须脱皮液酶解单因素试验
考察底物蛋白质质量分数、酶解时间及酶添加量对水解度和DPPH自由基清除率的影响。酶解基本条件为:酶解温度50 ℃、初始pH 7.4、底物蛋白质质量分数3%、酶解时间3 h、酶添加量3 000 U/g(酶解温度和初始pH值的固定水平根据酶的性质选定),其中单因素底物蛋白质质量分数设定为1%、2%、3%、4%、5%,酶解时间设定为1、2、3、4、5 h,酶添加量设定为1 000、2 000、3 000、4 000、5 000 U/g(以蛋白计)。待反应结束后,沸水浴灭酶10 min,冰浴冷却,冷冻保存。
1.3.2 鱿鱼须脱皮液酶解工艺响应面优化试验
在上述单因素试验结果的基础上,以水解度和酶解产物DPPH自由基清除率为响应值,选取底物蛋白质质量分数(A)、酶解时间(B)、酶添加量(C)为试验因子,根据Box-Behnken试验中心设计原理,利用软件Design-Expert V 8.0.6对试验结果进行响应面分析,获得鱿鱼须脱皮液最佳酶解工艺条件。
1.3.3 指标测定
1.3.3.1 基本成分测定
蛋白质含量按GB 5009.5—2010《食品中蛋白质的测定》[19]中凯氏定氮的方法测定;羟脯氨酸含量按DB 37/T 2094—2012《水产品中羟脯氨酸含量的测定 高效液相色谱法》[20]中高效液相色谱的方法测定;脂肪含量按GB/T 9695.7—2008《肉与肉制品 总脂肪含量测定》[21]中酸解法的方法测定;总糖含量按GB/T 9695.31—2008《肉制品 总糖含量测定》[22]中分光光度法测定;灰分含量按GB 5009.4—2010《食品中灰分的测定》[23]的方法测定。
1.3.3.2 水解度测定
水解度按Guerard等[24]的方法测定。
1.3.3.3 抗氧化活性测定
DPPH自由基清除率按Tepe等[25]的方法测定;ABTS+·清除率按Wang Bin等[26]的方法测定;·OH清除率按Wang Jingfeng等[27]的方法测定;亚铁还原能力采用铁氰化钾还原法[28]测定。
1.3.4 分子质量分布测定
SDS-PAGE按Gómez-Guillén等[29]的方法进行分析,酶解产物相对分子质量分布采用凝胶排阻色谱法[30]测定,洗脱体积-分子质量标准方程为:y=16 966-722.35x,R2=0.999 3。
1.4 数据处理
采用Origin Pro 8.5软件绘图,应用SPSS 17.0进行数据分析,采用Tukey法检验差异显著性,显著性水平为α=0.05。
2 结果与分析
2.1 鱿鱼须脱皮液基本成分

表1 鱿鱼须脱皮液基本成分Table 1 Basic components of squid tentacle peeling liquid %
由表1可以看出,鱿鱼须脱皮液中主要成分为蛋白质,含量高达15.18%,而通过羟脯氨酸计算出胶原蛋白含量为10.08%,即胶原蛋白占总蛋白的66.40%,与王燕[31]的结果一致,由此可见鱿鱼须脱皮液中胶原蛋白含量高。因此,本实验选用商业化胶原蛋白酶对其酶解,从而制备抗氧化活性胶原肽。
2.2 单因素试验结果
2.2.1 底物蛋白质质量分数对酶解产物水解度和DPPH自由基清除率的影响
图1表明,酶解产物的水解度和DPPH自由基清除率均随底物蛋白质质量分数的增加而增大,当底物蛋白质质量分数为3%时,其水解度和DPPH自由基清除率分别为34.27%和40.75%,进一步提高底物蛋白质质量分数,两者均无显著变化(P>0.05),因此选用底物蛋白质质量分数为3%左右。
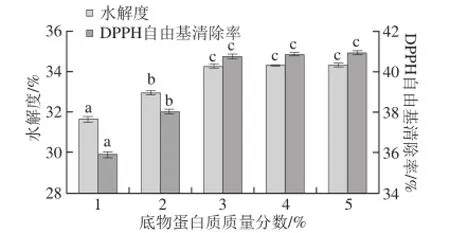
图1 底物蛋白质质量分数对水解液水解度和DPPH自由基清除率的影响Fig. 1 Effect of substrate protein concentration on DPPH radical scavenging capacity and DH
2.2.2 酶解时间对酶解产物水解度和DPPH自由基清除率的影响
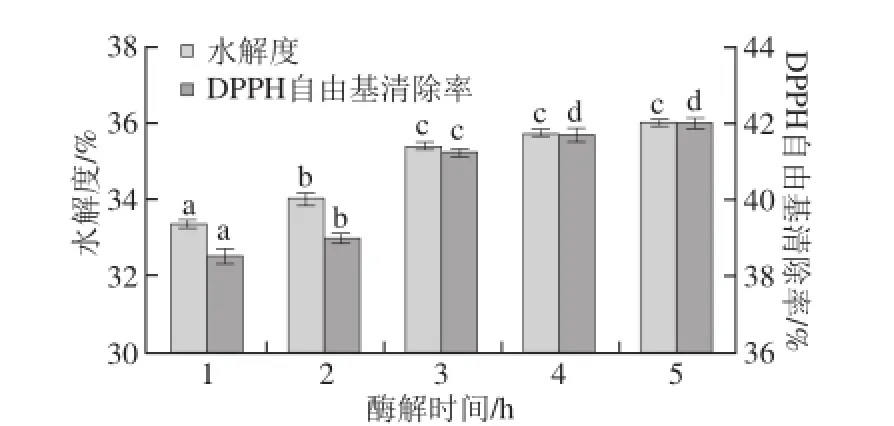
图2 酶解时间对水解液水解度和DPPH自由基清除率的影响Fig. 2 Effect of hydrolysis time on DH and DPPH radical scavenging capacity
通过图2发现,随着酶解时间的延长,酶解产物的水解度逐步增大,当酶解时间为4 h时,无显著增大(P>0.05),同时DPPH自由基清除率也随酶解时间的延长,逐步增大,水解5 h时,无显著增大(P>0.05),因此,综合考虑水解度和DPPH自由基清除率,选择酶解时间为3~4 h为宜。
2.2.3 酶添加量对酶解产物水解度和DPPH自由基清除率的影响

图3 酶添加量对水解液水解度和DPPH自由基清除率的影响Fig. 3 Effect of enzyme dosage on DH and DPPH radical scavenging capacity
由图3可知,酶解产物的水解度和DPPH自由基清除率均随酶添加量的提高而逐渐增大,当酶添加量为3 000 U/g时,其水解度和DPPH自由基清除率分别为36.24%和42.41%,继续增加酶量,两者均无显著增大(P>0.05),故适宜的酶添加量为3 000 U/g左右。
2.3 响应面优化试验结果
根据单因素试验结果,以水解度和DPPH自由基清除率为响应值进行响应面优化试验,试验方案及结果如表2所示。
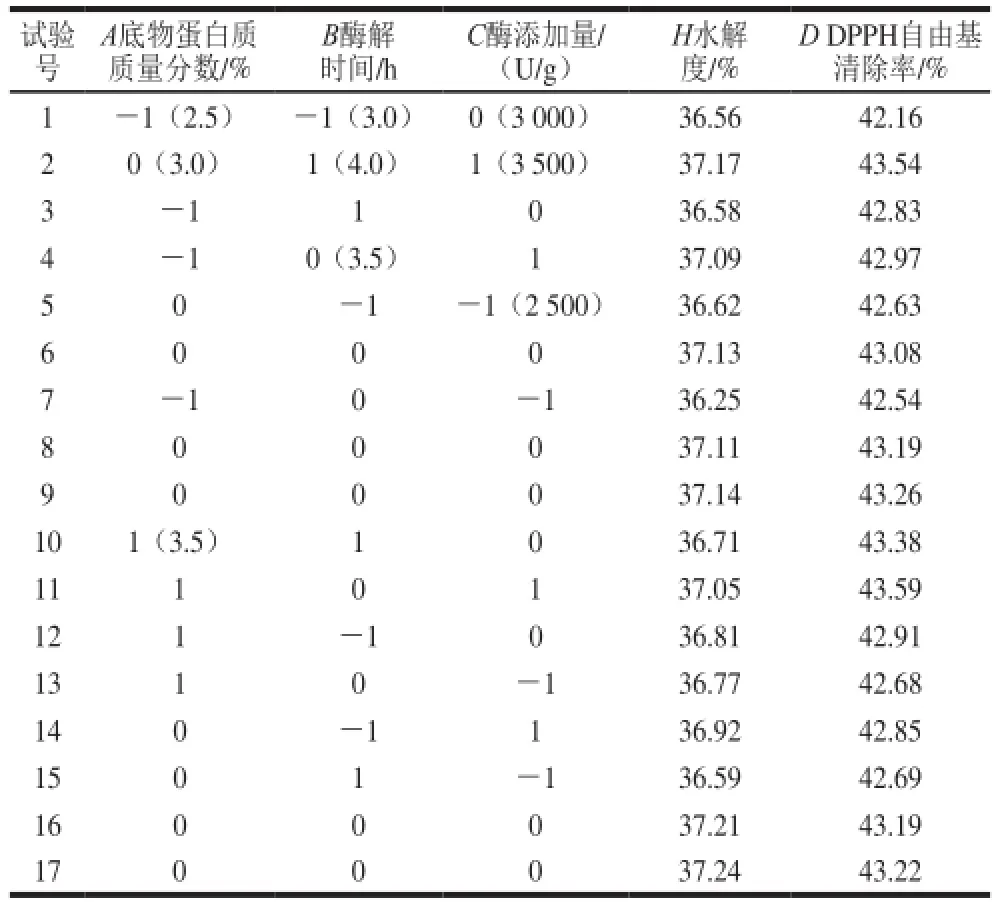
表2 响应面试验设计与结果Table 2 Experimental design and results for response surface analysis
使用Design-Expert V 8.0.6软件建立响应值对自变量编码值的二次回归模型方程:

为了检验模型的实际有效性,对结果进行方差分析与显著性检验,结果见表3、4。通过表3分析可知,两个模型的P<0.000 1和P=0.000 3,说明这两个模型极显著;失拟项的P=0.243 2>0.05和P=0.081 5>0.05,不显著;对水解度和DPPH自由基清除率的回归方程进行显著性检验,发现两个模型的相关系数分别为R2=0.976 4>0.95和R2=0.963 9>0.95,说明模型拟合程度较好;变异系数分别为0.18%和0.25%,可知两个模型都能较好地反映真实试验值。因此,可用这两个模型对鱿鱼须脱皮液胶原蛋白酶的酶解效果进行预测。
分析这两个模型各个系数的P值,发现因素A、C、AC、A2、B2对水解度的影响极显著(P<0.01),因素A、B、C、B2对DPPH自由基清除率的影响极显著(P<0.01);因素BC、C2对水解度的影响显著(P<0.05),因素BC、A2对DPPH自由基清除率影响显著(P<0.05)。
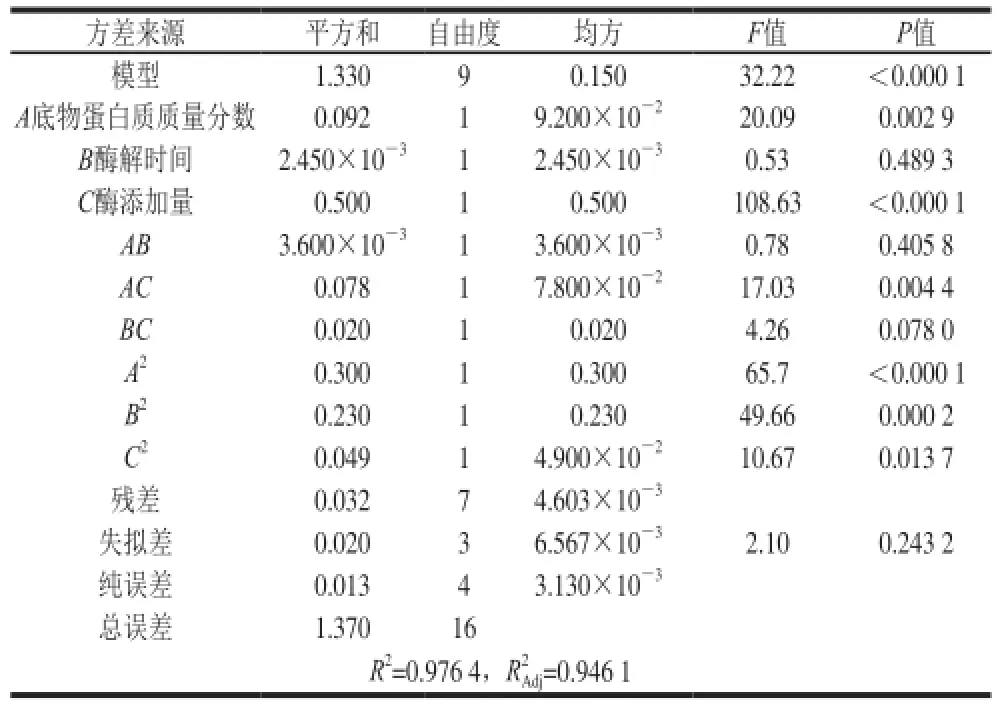
表3 回归模型的方差分析(水解度为响应值)Table 3 Analysis of variance of the regression model with DH as response value
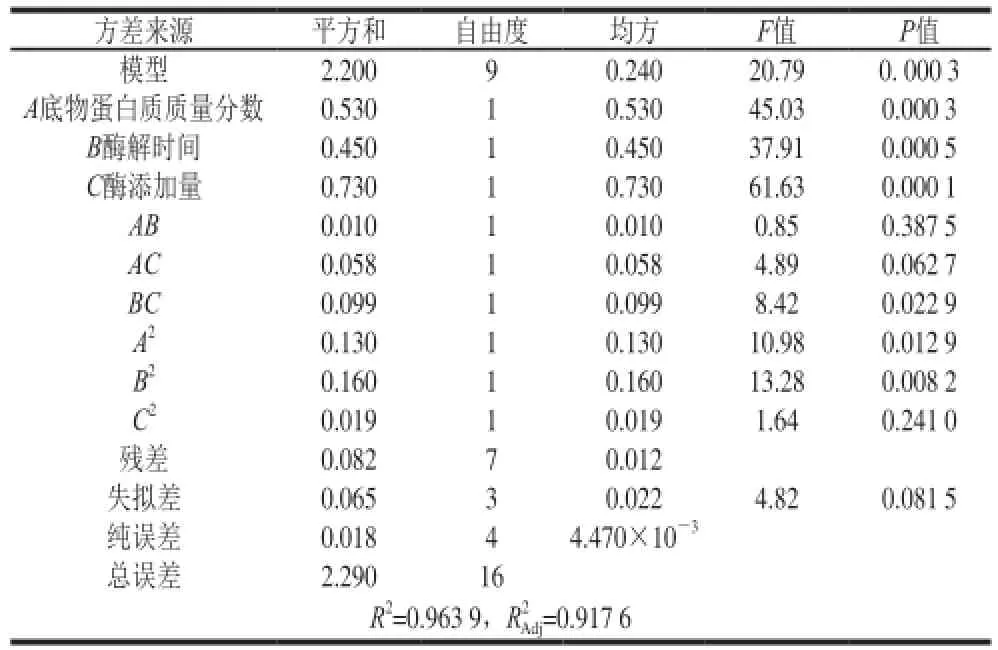
表4 回归模型的方差分析(DPPH自由基清除率为响应值)Table 4 Analysis of variance of the regression model with DPPH radical scavenging capacity as response value
通过Box-Behnken试验回归模型得到各响应面和等高线图(图4~6),图中椭圆排列越稀疏,说明因素变化对结果影响越小,反之;响应面坡度越陡,说明响应值对工艺参数的变化越敏感,该参数对试验结果的影响越大,反之;等高线的形状可反映交互作用的强弱,椭圆表示两因素交互作用显著,圆形反之[32]。通过观察图4~6可知:交互项中底物蛋白质质量分数和酶添加量对水解度和DPPH自由基清除率的响应面坡度最陡,说明底物蛋白质质量分数和酶添加量对试验结果的影响最大;底物蛋白质质量分数与酶解时间之间交互的等高线图成圆形,说明底物蛋白质质量分数与酶解时间的交互作用可忽略。此结果与二次回归方程得到的结果相一致。
结合模型和响应面曲线图分析,得到鱿鱼须脱皮液胶原蛋白酶酶解较合适的工艺参数为:底物蛋白质质量分数3.125%、酶解时间3.735 h、酶添加量3 000 U/g,预测的水解度与DPPH自由基清除率分别为37.27%、43.64%,为了实际操作方便,选取底物蛋白质质量分数为3.2%、酶解时间3.7 h、酶添加量3 000 U/g,在此条件下,进行6次重复验证性实验,得到水解度与DPPH自由基清除率分别为(37.23±0.08)%、(43.61±0.09)%,与回归方程所得的水解度与DPPH自由基清除率的相对误差分别为0.11%和0.07%,以上验证实验可以说明通过响应面优化得到的最佳工艺参数可靠、有效,能较好预测鱿鱼须脱皮液酶解产物的水解度与DPPH自由基清除率。
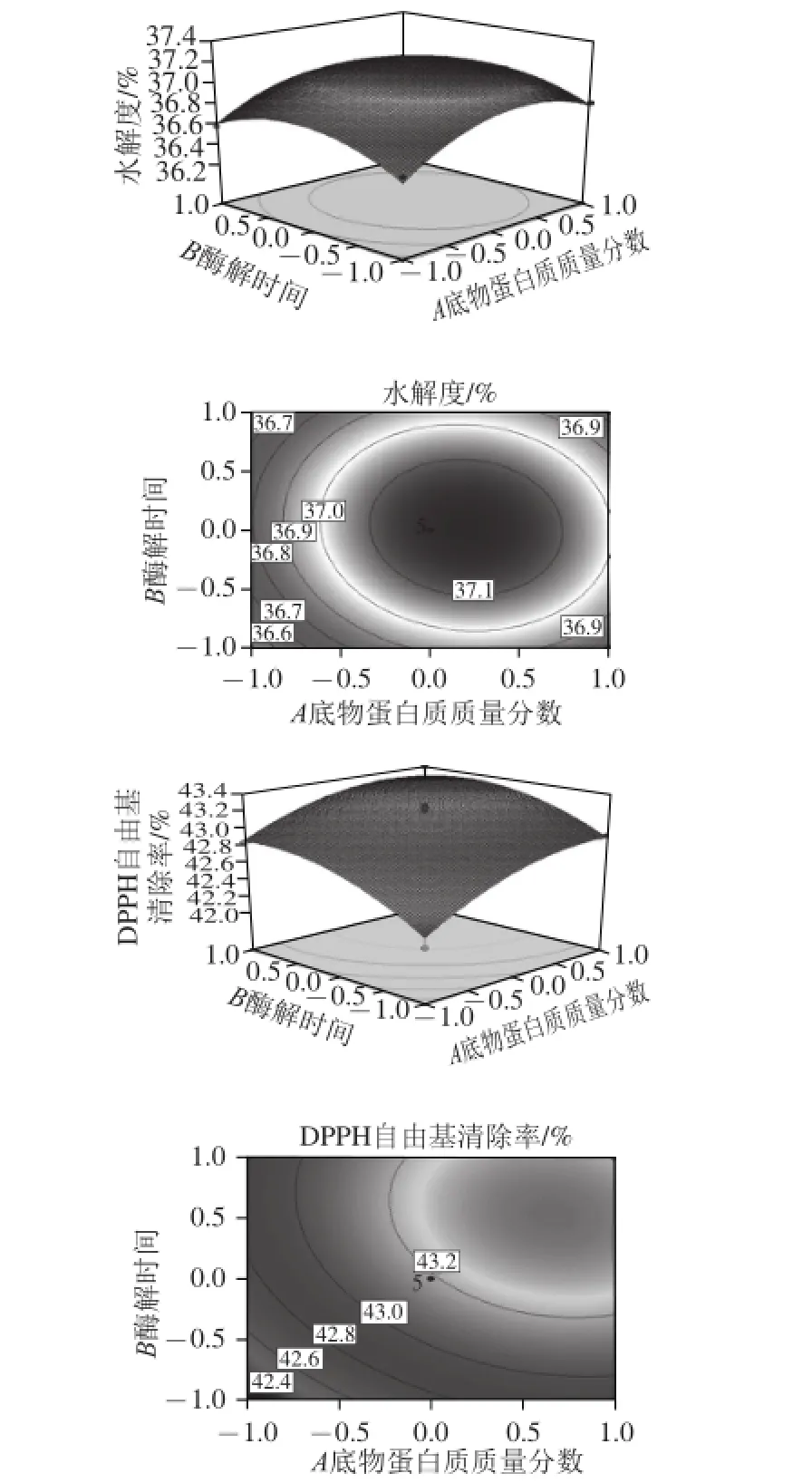
图4 底物蛋白质质量分数和酶解时间对水解度和DPPH自由基清除率影响的响应面与等高线图Fig. 4 Response surface and contour plots for the effect of substrate protein concentration and hydrolysis time on hydrolysis degree and DPPH radical scavenging rate
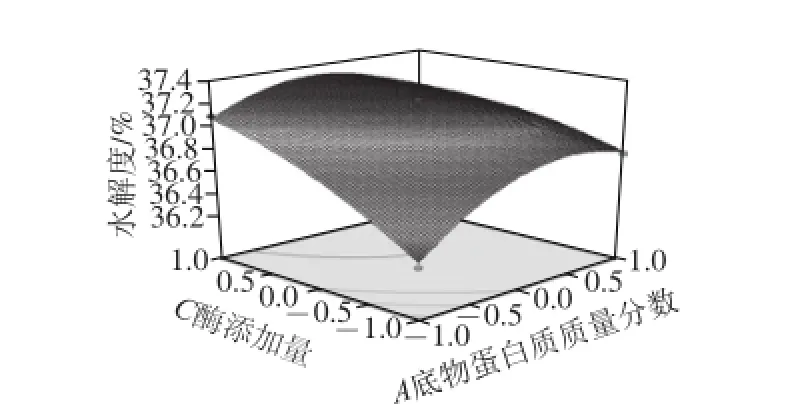
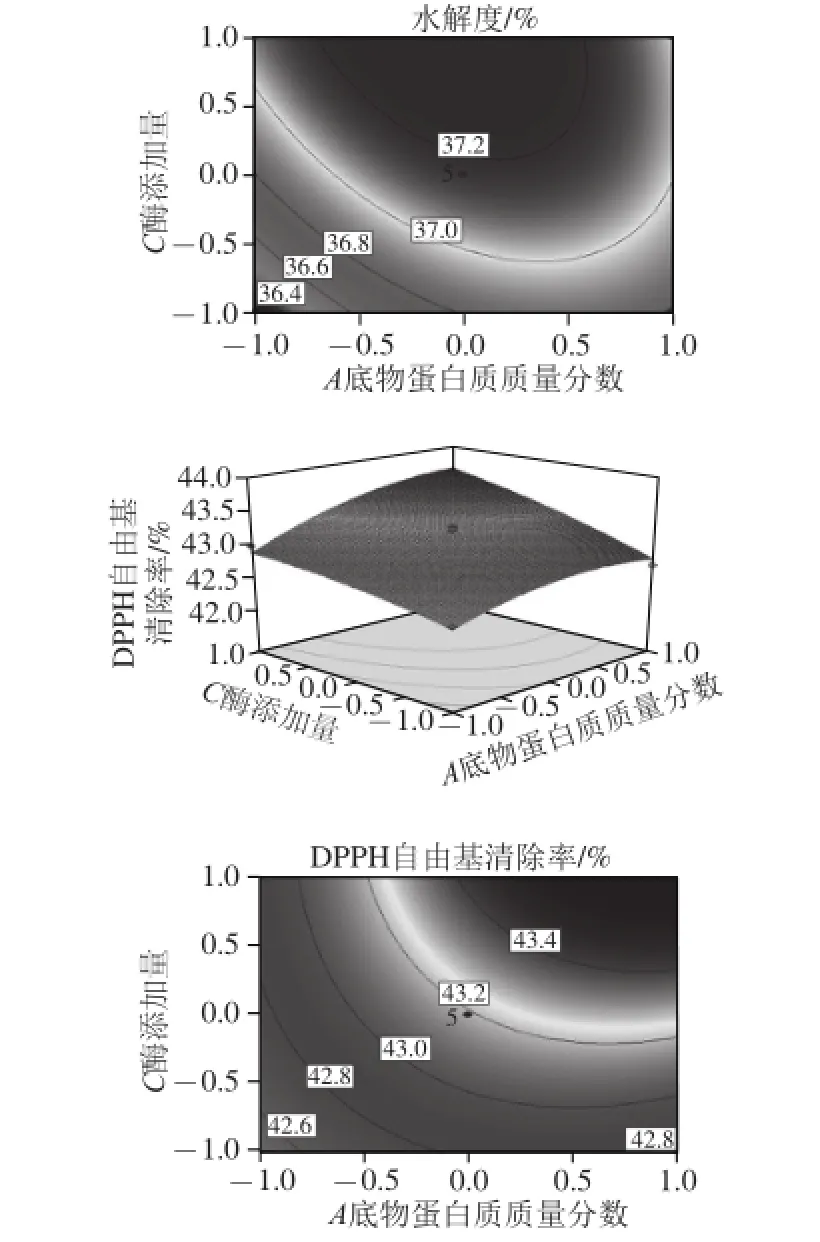
图5 底物蛋白质质量分数和酶添加量对水解度和DPPH自由基清除率影响的响应面与等高线图Fig. 5 Response surface and contour plots for the effect of substrate protein concentration and enzyme dosage onhydrolysis degree and DPPH radical scavenging rate

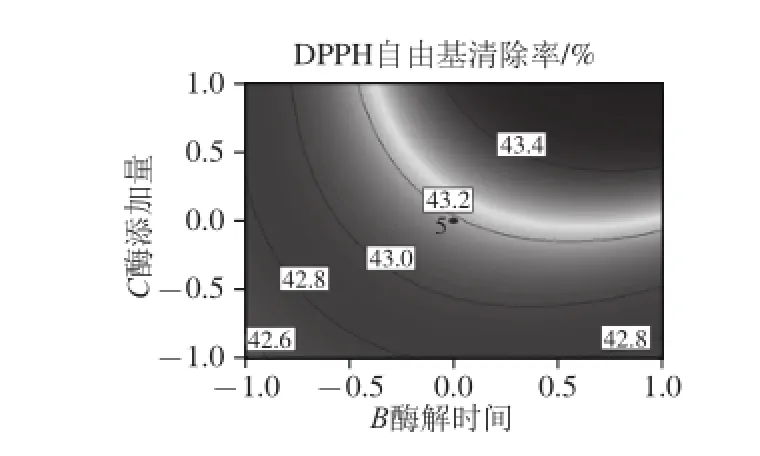
图6 酶解时间和酶添加量对水解度和DPPH自由基清除率影响的响应面与等高线图Fig. 6 Response surface and contour plots for the effect of hydrolysis time and enzyme dosage on hydrolysis degree and DPPH radical scavenging rate
2.4 鱿鱼须脱皮液酶解产物抗氧化活性评价

图7 鱿鱼须脱皮液酶解产物抗氧化活性Fig. 7 Antioxidant activities of squid tentacle peeling liquid
由图7可知,随着酶解产物质量浓度的增加,其抗氧化活性也逐渐升高,其中对ABTS+·与·OH均具有较强的清除能力,即IC50分别为0.37 mg/mL和0.41 mg/mL。Cai Luyun等[33]研究了草鱼皮的3种抗氧化肽Pro-Tyr-Ser-Phe-Lys (640.74 D)、Gly-Phe-Gly-Pro-Glu-Leu(618.89 D)、Val-Gly-Gly-Arg-Pro (484.56 D)的ABTS+·清除率IC50值分别为0.18、0.33、0.47 mg/mL;王雨生等[34]研究了黄鳍金枪鱼皮胶原肽的抗氧化活性,其·OH清除率的IC50为0.39 mg/mL,与之相比,本实验胶原肽的ABTS+·与·OH清除率低于以上研究结果,有可能是因为本酶解产物是粗提物所致;当质量浓度为0.20 mg/mL时,胶原肽的OD700nm值为0.53,而贾建萍等[35]报道的三文鱼皮,在质量浓度为2.5 mg/mL时,胶原肽的OD700nm值为0.41,由此可见,本鱿鱼须脱皮液胶原肽具有较好的抗氧化活性。
2.5 酶解产物分子质量分布
SDS-PAGE图谱显示(图8a),在最适的酶解工艺下,蛋白条带基本消失,说明鱿鱼须脱皮液中的蛋白质基本被水解成小分子多肽,证实此酶解工艺较好。为进一步分析酶解液多肽的分子质量分布,采用凝胶排阻色谱对酶解产物的分子质量分布进行分析,由图8b可知,酶解产物的分子质量多集中在1~5 kD之间,占49.90%,进一步证明了SDS-PAGE图谱的结果。

图8 胶原肽的分子质量分布图谱Fig. 8 Molecular weight distribution of collagen-derived peptides
3 结 论
为了解决企业在加工鱿鱼须过程中产生的脱皮液处理问题,对其进行有效开发利用,提高其附加值,节约资源,为鱿鱼资源深度开发及其下脚料的综合利用提供实验依据。本研究采用胶原蛋白酶对鱿鱼须脱皮液进行酶解,得到最适工艺为:酶解温度50 ℃、底物蛋白质质量分数3.2%、酶解时间3.7 h、酶添加量3 000 U/g、初始pH 7.4,此时样品的水解度与DPPH自由基清除率分别为(37.23±0.08)%和(43.61±0.09)%。抗氧化活性评价结果表明该酶解产物具有较强的ABTS+·清除率与·OH清除率,它们的IC50分别为0.37 mg/mL和0.41 mg/mL,且具有一定的亚铁还原能力;SDS-PAGE显示:最适酶解工艺下,鱿鱼须脱皮液中的蛋白质基本被水解成小分子多肽;凝胶过滤层分析可知:酶解产物的分子质量多集中在1~5 kD之间。因此,酶解产物具备较强的抗氧化活性,可作为抗氧化活性物质基料充分开发利用。
[1] 蔡江佳, 李晔, 张云云, 等. 鱿鱼皮胶原蛋白对H2O2诱导MC3T3-E1损伤的修复作用[J]. 中国食品学报, 2015, 15(1): 6-12. DOI:10.16429/j.1009-7848.2015.01.002.
[2] MILLÁN-MÁRQUEZ A M, SALINAS-ZAVALA C, CRUZ P, et al. Isolation and characterization of microsatellites for jumbo squid Dosidicus gigas (Ommastrephidae)[J]. Journal of Genetics, 2014, 93: 38-40. DOI:10.1007/s12041-014-0361-4.
[3] 林伟伟. pH和盐浓度对秘鲁鱿鱼肌原纤维蛋白聚集过程的影响[D].杭州: 浙江工商大学, 2015: 1-60. DOI:10.7666/d.Y2750808.
[4] 王丽丽. 鱿鱼足即食休闲风味食品研究初探[D]. 大连: 大连海洋大学, 2014: 1-31.
[5] 王丽丽, 杨宪时, 李学英, 等. 鱿鱼足酶法去皮工艺的优化[J]. 食品与机械, 2013, 29(3): 216-221.
[6] 罗春艳, 汪振涛, 傅鹏程, 等. 响应面优化鱿鱼须酶法脱皮工艺及其质构特性的研究[J]. 食品科学, 2015, 36(6): 29-34. DOI:10.7506/ spkx1002-6630-201506006.
[7] WANG Bin, MA Jjiahui, QU Youle, et al. Process optimization and composition analysis of antioxidant enzymatic hydrolysate from squid by-products by papain[J]. Applied Mechanics and Materials, 2011, 79: 198-203. DOI:10.4028/www.scientific.net/AMM.79.198.
[8] 王虒菁. 关于我国排污权有偿使用和交易制度的法律建议[J]. 法制与经济, 2015(2): 51-52.
[9] 吴靖娜, 杨叶辉, 王茵, 等. 氯化铁法回收鱼鳞漂洗液中水溶性蛋白质的研究[J]. 渔业现代化, 2013, 40(1): 63-67. DOI:10.3969/ j.issn.1007-9580.2013.01.012.
[10] YEONG W T, MOHAMMAD A W, ANUAR N, et al. Potential use of nanofiltration membrane in treatment of wastewater from fish and surimi industries[J]. Songklanakarin Journal of Science and Technology, 2002, 24: 977-987.
[11] BOURTOOM T, CHINNAN M S, JANTAWAT P, et al. Recovery and characterization of proteins precipitated from surimi washwater[J]. LWT-Food Science and Technology, 2009, 42(2): 599-605.
DOI:10.1016/j.lwt.2008.09.001.
[12] DEWITT C A M, MORRISSEY M T. Parameters for the recovery of proteases from surimi wash water[J]. Bioresource Technology, 2002, 81(3): 241-247. DOI:10.1016/S0960-8524(01)00130-4.
[13] 王晓宾, 李晶, 方旭波, 等. 细点园趾蟹蒸煮液营养成分分析及加工工艺的研究[J]. 食品工业, 2013, 34(2): 104-107.
[14] 赵华杰, 杨荣华, 戴志远. 贻贝蒸煮液发酵调味品的感官评价及呈味成分的分析[J]. 中国食品学报, 2009, 9(4): 187-191. DOI:10.3969/ j.issn.1009-7848.2009.04.030.
[15] 卜俊芝, 戴志远, 李燕, 等. 细点圆趾蟹加工水煮液的营养成分及风味物质分析[J]. 中国食品学报, 2013, 13(9): 207-216. DOI:1009-7848(2013)09-0207-10.
[16] 张露, 叶秀云, 谢金盛, 等. 酶解鲭鱼罐头蒸煮液制备生物活性肽[J].福州大学学报(自然科学版), 2014, 42(6): 950-956. DOI:10.7631/ issn.1000-2243.2014.06.0950.
[17] 杨娜, 王鸿飞, 林燕, 等. 鱼皮酶解产物抑菌及对血管紧张素酶的抑制作用[J]. 中国食品学报, 2015, 15(1): 92-98. DOI:10.16429/j.1009-7848.2015.01.015.
[18] KARAMANOS N K, ALETRAS A J, ANTONOPOULOS C A, et a1. Chondroitin proteoglycans from squid skin-isolation, characterization and immunological studies[J]. European Journal of Biochemistry, 1990, 192(1): 33-38. DOI:10.1111/j.1432-1033.1990.tb19191.x.
[19] 卫生部. 食品中蛋白质的测定: GB 5009.5—2010[S]. 北京: 中国标准出版社, 2010.
[20] 山东省质量技术监督局. 水产品中羟脯氨酸含量的测定 高效液相色谱法: DB 37/T 2094—2012[S]. 山东: 山东省地方标准出版社, 2010.
[21] 卫生部. 肉与肉制品 总脂肪含量测定: GB/T 9695.7—2008[S]. 北京: 中国标准出版社, 2008.
[22] 卫生部. 肉制品 总糖含量测定: GB/T 9695.31—2008[S]. 北京: 中国标准出版社, 2008.
[23] 卫生部. 食品中灰分的测定: GB 5009.4—2010[S]. 北京: 中国标准出版社, 2010.
[24] GUERARD F, GUIMAS L, BINET A. Production of tuna waste hydrolysates by a commercial neutral protease preparation[J]. Journal of Molecular Catalysis B: Enzymatic, 2002, 19/20: 489-498. DOI:10.1016/S1381-1177(02)00203-5.
[25] TEPE B, SOKMEN M, AKPULAT H A, et al. In vitro antioxidant activities of the methanol extracts of five Allium species from Turkey[J]. Food Chemistry, 2005, 92(1): 89-92. DOI:10.1016/ j.foodchem.2004.07.016.
[26] WANG Bin, LI Zhongrui, CHI Changfeng, et al. Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J]. Peptides, 2012, 36(2): 240-250. DOI:10.1016/j.peptides.2012.05.013.
[27] WANG Jingfeng, WANG Yuming, TANG Qingjuan, et al. Antioxidation activities of low-molecular-weight gelatin hydrolysate isolated from the sea cucumber Stichopus japonicus[J]. Journal of Ocean University of China, 2010, 9(1): 94-98. DOI:10.1007/s11802-010-0094-9.
[28] OYAIZU M. Studies on products of the browning reaction: antioxidative activities of browning reaction products prepared from glucosamine[J]. Japanese Journal of Nutrition, 1986, 44(6): 307-315.
[29] GÓMEZ-GUILLÉN M C, TURNAY J, FERNÁNDEZ-DÍAZ M D, et al. Structural and physical properties of gelatin extracted from different marine species: a comparative study[J]. Food Hydrocolloids, 2002, 16(1): 25-34. DOI:10.1016/S0268-005X(01)00035-2.
[30] HUO Jianxin, ZHAO Zheng. Study on enzymatic hydrolysis of Gadus morrhua skin collagen and molecular weight distribution of hydrolysates[J]. Agricultural Sciences in China, 2009, 8(6): 723-729. DOI:10.1016/S1671-2927(08)60271-0.
[31] 王燕. 鱿鱼皮胶原蛋白的制备及胶原海绵的初步研究[D]. 舟山: 浙江海洋学院, 2012: 1-12.
[32] 杨杰, 谷新晰, 李晨, 等. 响应面法优化植物乳杆菌绿豆乳增值培养基[J]. 中国食品学报, 2015, 15(12): 83-90. DOI:10.16429/j.1009-7848.2015.12.012.
[33] CAI Luyun, WU Xiaosa, ZHANG Yuhao, et al. Purification and characterization of three antioxidant peptides from protein hydrolysate of grass carp (Ctenopharyngodon idella) skin[J]. Journal of Functional Foods, 2015, 16: 234-242. DOI:10.1016/j.jff.2015.04.042.
[34] 王雨生, 冷云, 陈海华, 等. 黄鳍金枪鱼皮胶原肽酶解工艺及抗氧化活性研究[J]. 中国食品学报, 2015, 15(2): 72-78. DOI:10.16429/ j.1009-7848.2015.02.011.
[35] 贾建萍, 周彦钢, 鲁健章, 等. 三文鱼皮胶原肽的制备及其抗氧化活性的研究[J]. 中国食品学报, 2010, 10(4): 94-99. DOI:10.3969/ j.issn.1009-7848.2010.04.014.
Optimization of Enzymatic Hydrolysis of Collagen-Rich Waste Liquid from Squid Tentacle Peeling for Preparing Antioxidant Peptides Using Response Surface Methodology and Their Antioxidant Activities
LUO Chunyan1, WU Yangyang1, SUN Haiyan1,2, YU Hui1, JIANG Xuhua3, CHEN Xiaoe1,2,* (1. School of Food and Pharmacy, Zhejiang Ocean University, Zhoushan 316022, China; 2. Joint Key Laboratory of Zhejiang Province for the Research of Fishery Processing Technology, Zhoushan 316022, China; 3. Zhejiang Fudan Tourism Food Co. Ltd., Zhoushan 316104, China)
Objective: To investigate the optimum parameters for enzymatic hydrolysis of collagen-rich waste liquid from squid (Dosidicus gigas) tentacle peeling and evaluate the antioxidant activity of its hydrolysate. Methods: The hydrolysis parameters were optimized using one-factor-at-a-time method and response surface methodology based on 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity and degree of hydrolysis (DH). The antioxidant activity of hydrolysate was evaluated by using scavenging rate of 2,2’-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt radical (ABTS+·) and hydroxyl radical scavenging and ferric reducing/antioxidant power (FRAP) assays and the molecular weight distribution was analyzed by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) and gel filtration chromatography. Results: The optimal hydrolysis parameters were determined as follows: hydrolysis temperature, 50 ℃; substrate (protein) content, 3.2%; hydrolysis time, 3.7 h; enzyme dosage, 3 000 U/g; and initial pH, 7.4, resulting in a DH value of (37.23 ± 0.08) % and a scavenging rate of DPPH radical of (43.61 ± 0.09) %, respectively. The half inhibitory concentrations for ABTS+· and hydroxyl radical scavenging ability (IC50) of the hydrolysate obtained were 0.37 and 0.41 mg/mL, respectively. Moreover, the product showed a strong reducing capacity. SDS-PAGE analysis showed that most collagens in the waste liquid were hydrolyzed into small peptides with molecular weight of 1-5 kD as determined by gelexclusion chromatography. Conclusion: The hydrolysate derived from waste liquid from squid tentacles peeling has strong antioxidant activity and could be used as a functional seafood condiment and nutritional supplement for further development and utilization.
waste liquid from squid tentacle peeling; enzymatic hydrolysis; antioxidant activity; degree of hydrolysis; half inhibitory concentration
10.7506/spkx1002-6630-201621030
TS254.4
A
1002-6630(2016)21-0176-07
罗春艳, 吴杨阳, 孙海燕, 等. 响应面优化鱿鱼须脱皮液胶原肽酶解工艺及抗氧化活性[J]. 食品科学, 2016, 37(21): 176-182. DOI:10.7506/spkx1002-6630-201621030. http://www.spkx.net.cn
LUO Chunyan, WU Yangyang, SUN Haiyan, et al. Optimization of enzymatic hydrolysis of collagen-rich waste liquid from squid tentacle peeling for preparing antioxidant peptides using response surface methodology and their antioxidant activities[J]. Food Science, 2016, 37(21): 176-182. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621030. http://www.spkx.net.cn
2016-01-07
浙江省科技计划项目(2015C31106);舟山市科技计划项目(2016C41022);国家级大学生创新创业训练项目(201310340009)
罗春艳(1993—),女,硕士研究生,研究方向为食品加工与安全。E-mail:992351360@qq.com
*通信作者:陈小娥(1968—),女,教授,博士,研究方向为海洋资源综合利用。E-mail:xiaoechen@163.com
