绿豆芽萌发过程中氨基酸动态变化及营养评价
2016-12-02郑少杰任旺张小利明建
郑少杰,任旺,张小利,明建,2*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学国家食品科学与工程实验教学中心,重庆,400715)
绿豆芽萌发过程中氨基酸动态变化及营养评价
郑少杰1,任旺1,张小利1,明建1,2*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学国家食品科学与工程实验教学中心,重庆,400715)
文中对绿豆芽萌发过程中氨基酸含量及其组成的动态变化进行研究。应用模糊识别法和氨基酸比值系数法,以联合国粮食及农业组织推荐的全鸡蛋蛋白为标准蛋白,联合国粮食及农业组织/世界卫生组织提出的氨基酸模式为评价标准,对萌发6、24、42、53、64 h的绿豆芽蛋白与标准蛋白的贴近度、氨基酸比值、氨基酸比值系数、氨基酸比值系数分进行计算,进而全面分析评价不同萌发期的绿豆蛋白营养价值。结果表明:绿豆芽蛋白氨基酸种类丰富,至少含有17种氨基酸,必需氨基酸占总氨基酸的40%左右,第一限制氨基酸为蛋氨酸+半胱氨酸。发芽6 h时,绿豆芽蛋白与标准蛋白的贴近度最高;发芽42 h时,绿豆芽蛋白营养价值最高。
绿豆芽;氨基酸;动态变化;营养评价
豆类作为食用一大类品种,是人们膳食获取蛋白质、碳水化合物、维生素、矿物质的良好来源,但是由于豆类中含有胰蛋白酶抑制剂、植酸等抗营养成分,一般宜经过加工处理再食用。而可食用种子萌发生成芽菜后,抗营养因子及胀气因子(棉籽糖、鼠李糖和水苏糖等寡糖)减少,植酸在植酸酶的作用下降解而释放螯合的Ca、P、Fe和Zn等矿物质元素,蛋白质分解重新合成氨基酸种类和比例得以改善,维生素、黄酮多酚类化合物含量增加,使得原料的营养和保健价值提高[1];而且豆类萌发不需要特殊设备、工艺流程简单、一年四季都可以生产供应新鲜芽菜,因此发芽成为一种加工处理豆类的方式。绿豆(mung beans)中含有丰富蛋白质、膳食纤维、多种B族维生素以及Ca、K、Mg、Zn、Fe、Se等多种营养素和黄酮、多酚类物质、功能性低聚糖、豆固醇等功能成分,有较高的营养和保健价值[2,3]。绿豆芽,为绿豆的种子经浸泡后发出的嫩芽,又名豆芽菜。绿豆芽除了鲜食外,还被开发成系列加工制品,如芽菜汤料和复配五谷饮料等。PAJAK[4]等人研究发现,绿豆、向日葵种子发芽后多酚、黄酮、抗氧化活性明显提高。ZHENG等[5]研究表明,随着绿豆萌芽时间的推移,脂肪和还原糖含量不断下降,而蛋白质、VA、VC和异黄酮含量增加。大量研究都表明绿豆在萌发处理后产生丰富的有机酸,酚类物质、VC等增加,具有抗氧化、抗肿瘤、抗辐射、增加免疫力等功效[6-10]。本文对绿豆萌发各个阶段的蛋白氨基酸和游离氨基酸进行测定,采用模糊识别及氨基酸比值系数法,根据氨基酸平衡理论对各个阶段的氨基酸进行了营养评价。
1 材料与方法
1.1 材料与试剂
绿豆芽,实验室自制,采用DY801型豆芽机。
CuSO4·5H2O、K2SO4、H2SO4、H3BO3、NaOH、HCl、甲基红指示剂、溴甲酚绿指示剂、亚甲基蓝指示剂:分析纯,成都科龙化工试剂厂。
1.2 仪器与设备
L-8800型全自动氨基酸分析仪,日本日立高新技术公司;DY801型豆芽机,中山市迪尼仕电器制造有限公司;DL-1型万用电炉,北京中兴伟业仪器有限公司;BIO-BRI型自动凯氏定氮仪,北京青云卓立精密设备有限公司;FA2104型电子天平,上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 总蛋白含量的测定
凯氏定氮法[11]:参照GB/T 5009.5—2010《食品中蛋白质的测定》。
1.3.2 氨基酸含量的测定
参照GB/T5009.124—2003《食品中氨基酸的测定》。
1.3.2.1 蛋白氨基酸含量的测定
准确称取样品0.5 g于(15×150) mm试管中,加入8 mL 6 mol/L HCl,振荡混匀,在酒精喷灯上将试管口下1/3处拉细到4~6 mm,抽真空10 min后封管。处理过的试管置(110±1)℃恒温烘箱中沙浴水解22 h,取出冷却至室温,摇匀过滤后,取1 mL滤液于烧杯中,用60 ℃恒温水浴蒸干,加入0.02 mol/L HCl稀释,0.22 μm滤膜过滤后,用全自动氨基酸分析仪分析。
1.3.2.2 游离氨基酸含量的测定
准确称取样品2 g于离心管中,加入2 mL 4%磺基水杨酸溶液,震荡摇匀。于13 000 r/min离心2 min,稀释后用0.22 μm滤膜过滤,全自动氨基酸分析仪分析。
1.3.2.3 分析条件
分离柱:(4.6 mm×60 mm)洗脱液流速0.4 mL/min,柱温70 ℃,柱压10.627 MPa;反应柱:茚三酮及茚三酮缓冲液流速0.35 mL/min,柱温135 ℃,柱压1.078 MPa。
1.4 评价方法
1.4.1 模糊识别法[12]
采用兰氏距离法定义评价豆芽蛋白与标准蛋白(FAO全鸡蛋蛋白)的贴近度μ(a,ui),其贴近度的值越接近于1,其蛋白质营养价值相对越高。公式如下:
(1)
式中:ak(k=1、2……7),标准蛋白的7种必需氨基酸含量;鸡蛋蛋白中7种必需氨基酸的含量,mg/g;ak=(a1、a2、a3……a7) =(50.3、92.5、56.3、34.1、56.3、52.3、68.39)[25];a1、a2、a3……a7依次代表异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸和缬氨酸的含量,mg/g;uik——为第i个评价对象的第k种必需氨基酸含量,mg/g。i=1、2、3、4、5,分别代表发芽6、24、42、53、64 h时的蛋白。
1.4.2 氨基酸比值系数法[13-14]
将豆芽中氨基酸组成与FAO/WHO提出的人体必需氨基酸模式进行比对,计算氨基酸比值(ratio of amino acid, RAA)、氨基酸比值系数(ratio coefficient of amino acid, RCAA)、氨基酸比值系数分(score of ratio coefficient of amino acid, SRCAA),并对豆芽氨基酸的营养价值进行评价。
(2)
式中:待评价蛋白质某必需氨基酸含量与FAO/WHO模式中相应必需氨基酸含量均以1 g蛋白质中的含量计,mg/g蛋白。
(3)
SRCAA=100(1-CV)
(4)
式中:CV为RCAA的变异系数;CV=标准差/均数。
2 结果与分析
2.1 不同萌发期绿豆芽总蛋白质和总氨基酸含量变化
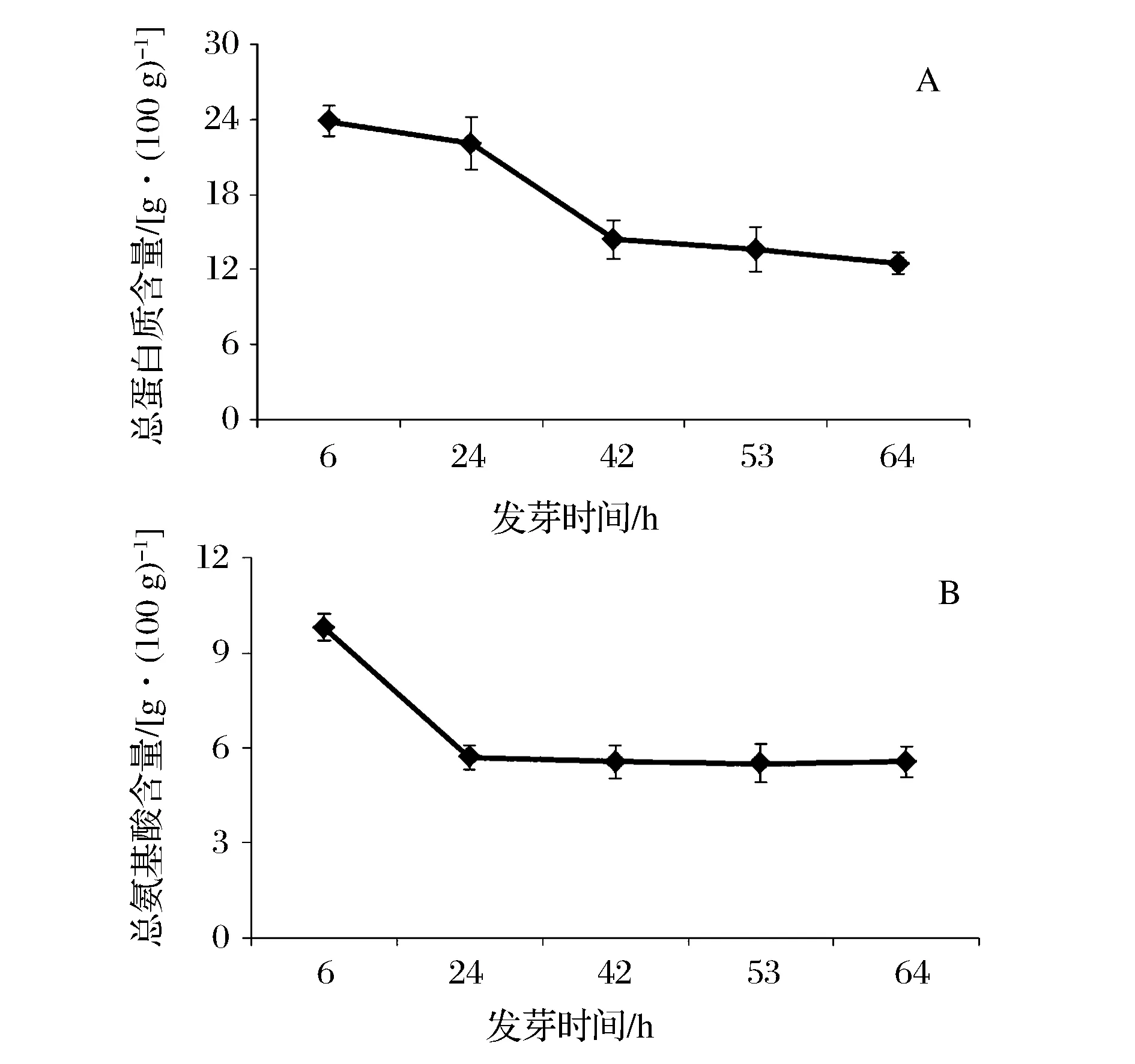
图1 不同萌发期绿豆芽中总蛋白质和总氨基酸含量Fig.1 Total protein and total amino acids in different germination periods of mung bean
图1-A、图1-B反应了绿豆萌发过程中总蛋白质、总氨基酸含量的变化。绿豆从种子吸水膨胀胚根伸出及芽体幼苗发育的过程中,其内部各种营养成分一直处于动态变化中,由于蛋白酶的激活,贮藏蛋白在蛋白酶的作用下被分解成供胚发育的氨基酸,从而使游离氨基酸增加,再将氨基酸运转到胚的生长部分,然后以各种方式结合重新合成新的蛋白质,所以,测得的蛋白质含量是原存储的蛋白质水解和新蛋白质合成的共同结果[15]。由图1-A可知,蛋白质含量在0~42 h呈减少趋势,42 h后趋于稳定,说明绿豆芽萌发前期(0~42 h)蛋白质酶被激活,加快大分子蛋白质分解,蛋白质合成速度低于分解速度;42 h后芽体进行微弱的光合作用,自身可以合成一些蛋白质,蛋白质的分解速度和合成速度处于动态平衡状态,故蛋白质含量总体趋于平稳。而总氨基酸含量的变化在0~24 h呈下降趋势,24 h后变化趋于稳定,即氨基酸含量在萌发24 h后基本处于稳定状态(图1-B)。当然,发芽过程中除了蛋白质氨基酸发生变化,还有其他成分的变化,而这些变化与酶(如淀粉酶、蛋白酶、肽酶)的激活,新物质结构重建(如苯丙通路phenylpropanoids pathway, laccase),功能化合物如激素等的代谢作用有关[16-17]。另外,豆芽萌发中营养物质及活性成分除受发芽时间的影响,还受绿豆品种、成熟度、加水量、浸泡时间、温度、光照等因素的影响[18-19]。
2.2 不同萌发期绿豆芽蛋白氨基酸和游离氨基酸含量变化
表1为不同萌发期的绿豆芽中蛋白氨基酸、游离氨基酸的含量变化,由表1可知,绿豆芽蛋白质中氨基酸种类齐全,被检测的17种氨基酸均含有,其中包括除色氨酸以外的7种必需氨基酸,并且蛋白氨基酸含量远高于游离氨基酸含量。以上氨基酸中含量较多的为天门冬氨酸、精氨酸、亮氨酸。由于发芽种子中氨基酸的新形成,势必造成氨基酸的种类、比例以及蛋白的组成发生变化,使发芽种子的营养价值可能有别于萌发以前的干种子,而营养价值得以大幅提高[20]。氨基酸种类的含量和比例随发芽进程不断变化,一方面是由于萌发过程中豆芽中的蛋白质降解为可溶的小分子蛋白或者氨基酸,伴随芽苗的生长不同氨基酸变换比例重新合成新的蛋白质。另一方面,原有的蛋白质被消耗用作能量来源,尤其是在发芽的早期阶段。另外,有些氨基酸较其他种类容易分解,在种子发芽前的浸泡中就溶出,这也是萌芽过程中蛋白质氨基酸组成不断变化的另一潜在原因[21]。绿豆发芽过程中蛋白氨基酸的EAA/TAA值在0.4左右,EAA/NEAA值均大于0.65,符合FAO/WHO标准规定[13,22];有研究报道绿豆蛋白、大豆蛋白、桑叶蛋白的EAA/TAA值分别为:0.417、0.349、0.347;EAA/NEAA分别为0.716、0.538、0.531。绿豆芽蛋白EAA/TAA、EAA/NEAA值均高于大豆蛋白、桑叶蛋白EAA/TAA、EAA/NEAA值,略低于绿豆蛋白的EAA/TAA、EAA/NEAA值,说明绿豆芽蛋白营养价值高于大豆蛋白、桑叶蛋白,略低于绿豆蛋白[23-24]。
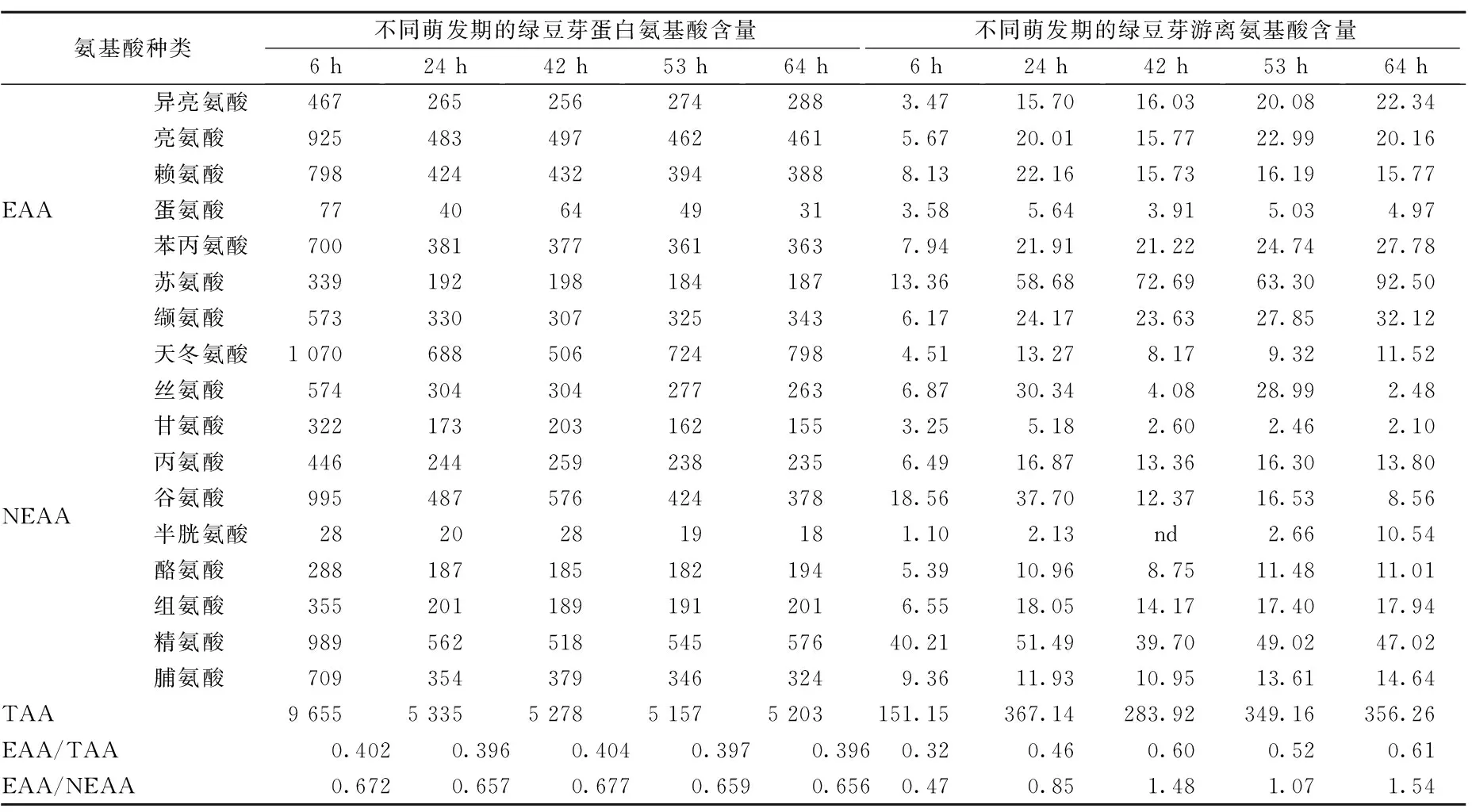
表1 不同萌发期绿豆芽中蛋白氨基酸和游离氨基酸含量 单位:mg/100g
注:“EAA”指必需氨基酸(essential amino acids);“TAA”指氨基酸总量(amount of amino acid);“NEAA”指非必需氨基酸(non-essential amino acids)。“nd”此浓度下未检出。
游离氨基酸的EAA/TAA值变化较大,除萌发6 h时EAA/TAA值低于0.4以外,24、42、53、64 h的EAA/TAA值均大于0.4,在萌发64 h时达到最大;EAA/NEAA值除萌发6h时EAA/NEAA值低于0.6以外,24、42、53、64 h的EAA/NEAA值均大于0.6,在萌发64 h时达到最大,变化规律和EAA/TAA值的变化规律一致。另外,由于游离氨基酸远低于蛋白氨基酸含量,可推测出绿豆芽萌发过程中蛋白水解为氨基酸后又迅速参与新蛋白的合成,氨基酸处于游离的状态很短暂。
2.3 绿豆芽氨基酸的营养价值分析
食物蛋白质的氨基酸组成比例虽不尽相同,但其营养价值的优劣主要取决于所含必需氨基酸的种类、数量和组成比例。本实验中主要采用模糊识别法和氨基酸比值系数法分析绿豆萌发过程中氨基酸营养价值的变化。
2.3.1 模糊识别法的评价结果
表2是由模糊识别法计算得出绿豆芽发芽6、24、42、53、64 h时的绿豆芽蛋白与标准蛋白(全鸡蛋蛋白)的贴近度。以全鸡蛋蛋白为标准,发芽6 h时的蛋白贴近度最高,为0.473,随着发芽时间增加绿豆芽蛋白与标准蛋白的贴近度有所降低。发芽24 h后,蛋白质贴近度趋于稳定。不同萌发期的绿豆芽蛋白与标准蛋白对的贴近度低于绿豆蛋白与标准蛋白的贴近度。

表2 不同萌发期的绿豆芽蛋白相对于标准蛋白的贴近度
2.3.2 氨基酸比值系数法的评价结果
表3、表4分别为不同萌发期的绿豆芽蛋白的氨基酸比值系数分表和不同萌发期的绿豆芽游离氨基酸比值系数分表。若食物蛋白质氨基酸组成含量比例与FAO/WHO模式氨基酸一致,则各种必需氨基酸的RCAA应等于1,数值大于或小于1均表示偏离氨基酸模式,RCAA>1表明该种EAA相对过剩,RCAA<1则表明该种EAA相对不足,RCAA最小者为第一限制性氨基酸(first limiting amino acid, FLAA)[25]。RCAA值越接近1,说明该蛋白氨基酸组成比例越接近FAO/WHO模式蛋白氨基酸。根据RCAA进一步计算得到SRCAA值,SRCAA值越接近100,说明蛋白质营养价值越高。
由表3中绿豆芽发芽6、24、42、53、64 h时的蛋白氨基酸的RCAA可知,绿豆芽的第一限制氨基酸是蛋氨酸+半胱氨酸,根据蛋白质互补理论和其他食物蛋白按一定比例混合食用互相补充,提高其营养价值。以上时间点取样的SRCAA值分别为63.58、63.85、68.62、65.88、62.54,营养价值都较高,萌发42 h时绿豆芽蛋白的营养价值最高。绿豆芽蛋白的SRCAA值略低于大豆蛋白、桑叶蛋白、绿豆蛋白[23-24],绿豆芽蛋白的营养价值略低于绿豆蛋白的营养价值,这可能是因为绿豆芽蛋白的所有指标均是按鲜重进行计算的。而萌发期间绿豆芽的游离氨基酸比值系数分变化较大,这可能和游离氨基酸在绿豆萌发期间的含量变化有关;萌发42 h时游离氨基酸的SRCAA最低,表明在萌发42 h时绿豆芽蛋白的营养价值主要归于蛋白氨基酸,游离氨基酸占的比重较小,这并不和萌发42 h时蛋白氨基酸的营养价值最高矛盾。
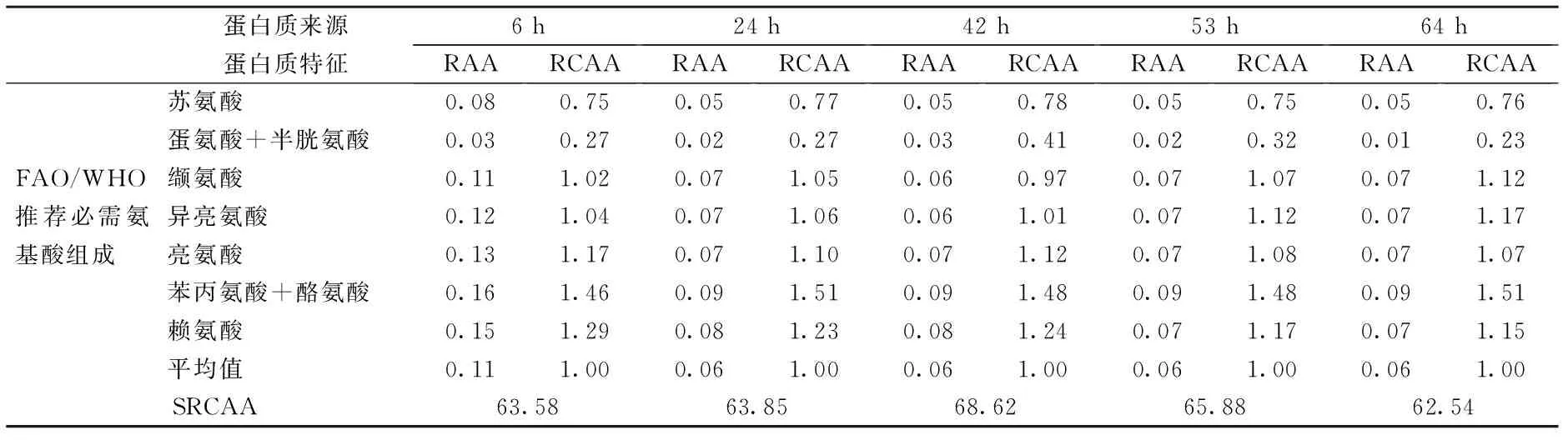
表3 不同萌发期的绿豆芽蛋白氨基酸比值系数分比较

表4 不同萌发期的绿豆芽游离氨基酸比值系数分比较
3 结论
应用模糊识别法和氨基酸比值系数法,对萌发过程中的绿豆芽蛋白质营养价值进行了全面分析评价。豆在萌发初期蛋白质含量降低,萌发过程中蛋白质转化为更易被人体吸收的游离氨基酸,使得绿豆芽的氨基酸种类增多,且组成比例合理,营养价值大大提高。绿豆芽蛋白质至少含有17种氨基酸,必需氨基酸占总氨基酸含量的40%左右,必需氨基酸与非必需氨基酸含量的比值在0.656~0.677之间,分别符合WHO/FAO标准规定的40%和0.6。以萌发6、24、42、53、64 h为抽样点,6 h时的绿豆芽蛋白与标准蛋白的贴近度最高,随着萌发的进行绿豆芽蛋白与标准蛋白的贴近度降低;根据氨基酸系数,发芽42 h时绿豆芽蛋白营养价值最高。整体而言,绿豆萌发可以提高绿豆的应用和价值,同时产出一种对人体健康有益的大众蔬菜。发芽食品的研究与开发,对于缓解农业生产面临的阶段性压力,提高农产品深加工的科技水平,改善食物的营养结构,丰富消费者的膳食生活,有重要的作用和意义。
[1] URBANO G, ARANDA P, VILCHENZ A, et al. Effects of germination on the composition and nutritive value of proteins inPisumsativumL.[J]. Food Chemistry, 2005, 93(4): 671-679.
[2] 庄艳, 陈剑. 绿豆的营养价值及综合利用[J]. 杂粮作物, 2009, 29(6): 418-419.
[3] LANDETE J M, HERNNDEZ T, ROBREDO S, et al. Effect of soaking and fermentation on content of phenolic compounds of soybean (Glycinemaxcv. Merit) and mung beans (VignaradiataL. Wilczek)[J]. International Journal of Food Sciences and Nutrition, 2015, 66(2): 203-209.
[4] PAJAK P, SOCHA R, GALKOWSKA D, et al. Phenolic profile and antioxidant activity in selected seeds and sprouts[J]. Food Chemistry, 2014, 143(1): 300-306.
[5] 郑丽娜, 曲颖. 发芽对绿豆营养成分的影响[J]. 现代食品科技, 2011, 27(2): 144-146.
[6] KIM D K, JEONG S C, GORINSTEIN S, et al. Total polyphenols, antioxidant and antiproliferative activities of different extracts in mungbean seeds and sprouts[J]. Plant Foods for Human Nutrition, 2012, 67(1): 71-75.
[7] HUANG Xiya, CAI Weixi, XU Baojun. Kinetic changes of nutrients and antioxidant capacities of germinated soybean (GlycinemaxL.) and mung bean (VignaradiataL.) with germination time[J]. Food Chemistry, 2014, 143(2): 268-276.
[8] JOM K N, FRANK T, ENGEL K H. A metabolite profiling approach to follow the sprouting process of mung beans (Vignaradiata)[J]. Metabolomics, 2011, 7(1): 102-117.
[9] CEVALLOS-CASALS B A, CISNEROS-ZEVALLOS L. Impact of germination on phenolic content and antioxidant activity of 13 edible seed species[J]. Food Chemistry, 2010, 119(4): 1 485-1 490.
[10] GUO X, LI T, KANG K, et al. Effect of germination on phytochemical proles and antioxidant activity of mung bean sprouts (Vignaradiata)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(44): 11 050-11 055.
[11] GB/T 5009.5—2010.食品中蛋白质的测定[S].
[12] 吴望名, 陈永义, 黄金丽, 等. 应用模糊集方法[M]. 北京: 北京师范大学出版社, 1985.
[13] FAO/WHO. Energy and protein requirements: technical reportserie[R]. Geneva: World Health Organization, 1973.
[14] YU Hua-hua, LI Rong-feng, LIU Song. Amino acid composition and nutritional quality of gonad from jellyfish Rhopilema esculentum[J]. Biomedicine and Preventive Nutrition, 2014, 4(3): 399-402.
[15] TAN-WILSON A L, WILSON K A. Mobilization of seed protein reserves[J]. Physiologia Plantarum, 2012, 145(1): 140-153.
[16] ROSENTAL L, NONOGAKI H, FAIT A. Activation and regulation of primary metabolism during seed germination [J]. Seed Science Research, 2014, 24(1): 1-15.
[17] RATAJCZAK W, KALEMBA E M, PUKACKA S, et al. Age-related changes in protein metabolism of beech (FagussylvaticaL.) seeds during alleviation of dormancy and in the early stage of germination[J]. Plant Physiology and Biochemistry, 2015, 94: 114-121.
[18] PAUCAR-MENACHO L M, BERHOW M A, MANDARINO J M G, et al. Effect of time and temperature on bioactive compounds in germinated Brazilian soybean cultivar BRS 258[J]. Food Research International, 2010, 43(7): 1 856-1 865.
[19] 尹涛, 丁俊胄, 陈芸, 等. 发芽条件对绿豆芽生长特性和营养品质的影响[J]. 华中农业大学学报, 2015, 34(4): 120-124.
[20] SANNI A, ONILUDE A, IBIDAPO O. Physicochemical characteritics of weaning food formulated from different blends of cereal and soybean[J]. Food Research and Technology, 1999, 208(3): 221-224.
[22] FAO/WHO. Protein quality evaluation: report of joint FAO/WHO Consultation Held in Bethesda[R]. Rome: Food and Agriculture Organization, 1990.
[23] 王芳, 乔璐, 张庆庆, 等. 桑叶蛋白氨基酸组成分析及营养价值评价[J]. 食品科学, 2015, 36(1): 225-228.
[24] 宋葆华, 李法曾, 贺新强, 等. 30种植物叶蛋白中氨基酸组成及含量的测定与营养价值评价[J]. 植物资源与环境学报, 2000, 9(1): 59-60.
[25] 钱爱萍, 林虬, 颜孙安, 等. 乌饭树叶蛋白质中氨基酸含量及营养价值评价[J]. 福建农业学报, 2008, 23(3): 306-309.
Amino acid dynamic change of mung bean and its nutritional evaluation in germinating process
ZHENG Shao-jie1, REN Wang1, ZHANG Xiao-li1, MING Jian1,2*
1(College of Food Science, Southwest University, Chongqing 400715, China) 2(National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China)
The dynamic processes of amino acids content and composition of mung bean sprouts during germination were studied. Using whole egg protein and FAO/WHO reference model on essential amino acid (EAA), the protein of mung bean sprouts in 6, 24, 42, 53, 64 h were evaluated for their nutritional values. The nutritional value of mung bean sprouts in different germination periods were compared by fuzzy pattern recognition and amino acid (AA) coefficient ratio. The results showed that mung bean sprouts are rich in amino acid and it contains at least 17 kinds of amino acids. EAA comprised about 40% of the total AA in the mung bean sprouts. The greatest limiting AA in protein was methionine and cysteine. We found that the protein of mung bean sprouts in 6 h was the highest close to standard protein, the highest nutritional value was at 42 h during the sprouting.
mung bean sprouts; amino acid; dynamic change; nutritive evaluation
10.13995/j.cnki.11-1802/ts.201610014
硕士研究生(明建教授为通讯作者,E-mail:mingj ̄ian1972@163.com)。
重庆市社会民生科技创新专项(cstc2015shmszx80019)
2016-01-19,改回日期:2016-03-28
