Cthrc1抑制小鼠肝星状细胞的增殖*
2016-12-02卞兆连
钟 巍 卞兆连 马 雄#
上海交通大学医学院附属仁济医院消化科 上海市消化疾病研究所1(200001) 南通市第三人民医院消化科 南通市肝病研究所2
Cthrc1抑制小鼠肝星状细胞的增殖*
钟 巍1卞兆连2马 雄1#
上海交通大学医学院附属仁济医院消化科 上海市消化疾病研究所1(200001) 南通市第三人民医院消化科 南通市肝病研究所2
背景:研究发现胶原三螺旋重复蛋白-1(Cthrc1)可能在肝脏疾病尤其是肝纤维化中发挥重要作用,但对肝星状细胞增殖的影响尚未完全阐明。目的:研究Cthrc1对肝星状细胞增殖的影响。方法:构建Cthrc1重组腺病毒载体,通过尾静脉注射小鼠体内,以实时PCR和蛋白质印迹法分别检测Cthrc1 mRNA和蛋白表达。通过胆总管结扎和3,5-二乙氧基羰基-1,4-二氢-2,4,6-三甲基吡啶(DDC)饲料喂养分别构建小鼠肝纤维化模型,分别尾静脉注射Ad-Cthrc1或Ad-GFP,以免疫荧光法检测肝星状细胞数量。结果:成功构建Cthrc1重组腺病毒载体;实时PCR和蛋白质印迹法证实尾静脉注射Ad-Cthrc1后小鼠肝内Cthrc1 mRNA和蛋白表达均较对照组增高。HE和Masson染色示成功建立了小鼠肝纤维化模型。免疫荧光法显示Cthrc1过表达能明显抑制肝纤维化模型小鼠肝星状细胞的增殖。结论:成功构建了重组腺病毒载体Ad-Cthrc1并可在体内高效稳定表达,能抑制肝星状细胞的增殖,有望成为肝纤维化的治疗靶点。
胶原三螺旋重复蛋白-1; 腺病毒载体; 肝星状细胞; 细胞增殖; 肝硬化
Cell Proliferation; Liver Cirrhosis
胶原三螺旋重复蛋白-1(Cthrc1)首先由Pyagay等[1]于2005年在大鼠损伤血管修复过程中的外膜成纤维细胞和平滑肌细胞中发现。Cthrc1是一种分泌性蛋白,在脊椎动物中极其保守,与目前已知蛋白的同源性极低[2]。目前研究发现Cthrc1蛋白参与机体生长发育、损伤修复等多种生理功能,可促进骨质形成,减轻骨质疏松[3];Cthrc1还参与肿瘤的发生、发展,在乳腺癌和黑色素瘤中高表达,并与肿瘤的分化和转移相关[4-5]。最新研究显示,Cthrc1能通过调控磷酸化Smad3,抑制肝纤维化的发生、发展[6]。为进一步研究Cthrc1基因在肝脏疾病中的作用,需调控其在肝内的表达,而腺病毒载体具有明显的嗜肝性,能在肝脏组织中稳定表达,是研究肝脏疾病的重要载体。本实验通过构建人Cthrc1基因的腺病毒载体并成功在小鼠体内过表达,旨在探讨Cthrc1基因对肝纤维化小鼠模型肝星状细胞增殖的影响。
材料与方法
一、实验动物、试剂和材料
雄性C57BL/6小鼠,6~8周龄,购自中国科学院上海分院斯莱克实验动物中心,饲养于上海交通大学医学院附属仁济医院动物房;3,5-二乙氧基羰基-1,4-二氢-2,4,6-三甲基吡啶(DDC)购自美国Sigma公司;AdMaxTM腺病毒包装系统购自加拿大Microbix公司;大肠杆菌DH-5α感受态细胞购自天根生化科技(北京)有限公司;293T细胞株购自中科院上海细胞典藏库;质粒DNA抽提试剂盒购自德国Qiagen公司;DNA凝胶回收试剂盒购自宝生物工程(大连)有限公司;Trizol、LipofectmaineTM2000、荧光二抗购自美国Invitrogen公司;葡萄糖、蛋白胨、酵母提取物、琼脂粉均购自英国Oxoid公司;逆转录试剂盒、PCR试剂、连接酶、DNA分子量marker均购自日本TaKaRa公司;DMEM、胎牛血清以及霉素和氨苄青霉素购自美国Gibco公司;山羊抗鼠Cthrc1抗体购自Santa Cruz公司,兔抗山羊IgG-HRP购自北京鼎国昌盛生物技术有限责任公司;Desmin抗体购自Abcam公司;引物合成和测序由生工生物工程(上海)股份有限公司完成;pcDNA3.1-human Cthrc1质粒为实验室保留质粒载体。
二、实验方法
1. 重组腺病毒载体的构建和包装:根据Cthrc1基因序列信息(Sanger miRBase数据库收录)设计引物,上游:5’-CGA GCT CAA GCT TCG AAT TCG CCA CCA TGC GAC CCC AGG GC-3’,下游:5’-TCA TCC TTG TAG TCG GAT CCT TTT GGT AGT TCT TCA ATA ATG ATG-3’,上游引物的酶切位点为EcoRⅠ,下游为BamHⅠ。按照试剂盒说明书操作,以pcDNA3.1-human Cthrc1质粒为模板扩增得到大小约775 bp的片段,PCR反应条件:98 ℃ 10 s,55 ℃ 15 s,72 ℃ 1 min,共30个循环;切胶回收目的片段,随后与酶切后载体片段进行反应,并转化至DH-5α 感受态细胞,扩增后挑选单克隆菌落,行PCR扩增检测阳性菌落,产物行1.5%琼脂糖凝胶电泳,检测扩增条带大小。DNA序列鉴定由生工生物工程(上海)股份有限公司完成。
将待转染的病毒载体质粒4 μg(其中骨架质粒2 μg;穿梭质粒2 μg)共转染于HEK293细胞,约17 d 后待细胞完全病变后收集上清液,上清中即含有病毒颗粒。在HEK293细胞中扩增腺病毒,通过氯化铯密度梯度离心法纯化腺病毒,病毒梯度稀释法测定病毒滴度,倒置荧光显微镜下观察GFP的表达,比较GFP阳性率,计算病毒滴度。病毒滴度(PFU/mL)=(平均阳性细胞数/视野)×79×稀释倍数×10,-80 ℃保存备用,避免反复冻融。
2. Cthrc1 mRNA和蛋白表达的检测:将6只小鼠平均分为两组,分别尾静脉注射Ad-Cthrc1腺病毒和Ad-GFP腺病毒,剂量为2×109/只,3 d后处死小鼠,留取肝脏组织分别行实时PCR(引物序列见表1)和蛋白质印迹法检测肝内Cthrc1 mRNA和蛋白表达,具体步骤按说明书操作。
3. 肝纤维化模型小鼠的建立:将小鼠分为胆总管结扎(DBL)组、DDC组和正常对照组。分别通过DBL法和DDC饮食法建立肝纤维化模型,两种模型均在造模前3 d给予尾静脉注射腺病毒(Ad-Cthrc1或Ad-GFP)2×109/只,正常对照组不注射任何病毒。DBL法:以3.5%水合氯醛腹腔内注射后麻醉小鼠,暴露肝门部胆总管,并分离胆总管与肝门静脉、肝动脉,以6个0号丝线双线结扎胆总管,最后逐层关闭腹腔;正常对照组仅分离胆总管,不进行胆总管结扎。于造模后5 d颈椎离断处死全部小鼠。DDC组小鼠给予0.1% DDC饲料喂养,2周后颈椎离断处死全部小鼠。取各组小鼠肝脏组织石蜡包埋,行HE和Masson染色。

表1 PCR引物序列
4. 免疫荧光法:将小鼠肝组织标本石蜡切片(厚 4 μm)后常规脱蜡水化,PBS洗涤5 min×2次;3% H2O2室温孵育15 min;PBS洗涤5 min×3次,柠檬酸盐抗原修复液(微波修复15 min),冷却至室温;PBS冲洗后,滴加50 μL封闭血清,室温封闭30 min;移去封闭液,滴加一抗(工作浓度1∶100),4 ℃冰箱过夜。PBS冲洗后,滴加相应的荧光二抗(工作浓度1∶3 000)室温孵育30 min;PBS冲洗5 min×3次;晾干后,滴加DAPI-Fluoromount-GTM封片;最后在荧光显微镜(Olympus IX-73)下观察、摄片。
三、统计学分析

结 果
一、腺病毒载体的成功构建
PCR模板扩增产物片段大小为775 bp,与理论值完全相符(图1A);阳性菌落对应的PCR产物长度为775 bp(图1B);测序图谱结果与设计序列一致,未发现点突变。病毒滴度为2×1011PFU/mL。

A:模板扩增后PCR产物电泳;B:阳性菌落PCR后电泳检测产物
二、小鼠肝内Cthrc1基因和蛋白表达
小鼠尾静脉注射Ad-Cthrc1腺病毒后,肝内Cthrc1 mRNA和蛋白表达均较正常对照组明显增高(图2)。
三、HE和Masson染色
正常对照组小鼠肝脏HE染色和Masson染色均未见明显异常。BDL组小鼠结扎后进食逐渐减少,大体观察示肝脏明显肿大,棕黄色;组织学表现为肝细胞肿胀、空泡变性,且出现凝固性坏死灶,门管区扩大,胆管周围炎性细胞浸润;Masson染色发现门管区明显纤维化。DDC组小鼠大体观察示肝脏明显肿大;HE染色发现小鼠肝组织门管区大量炎性细胞浸润,胆管内明显胆栓形成;Masson染色观察发现门管区有明显的肝纤维化形成(图3)。
四、免疫荧光法
BDL组和BDL+Ad-GFP组小鼠肝组织内可见大量Desmin阳性的肝星状细胞,而BDL+Ad-Cthrc1组小鼠肝内Desmin表达明显减少(图4A)。同样,DDC组和DDC+Ad-GFP组小鼠可见肝组织内大量Desmin阳性的肝星状细胞,而注射Ad-Cthrc1腺病毒后,Desmin阳性的肝星状细胞明显减少(图4B)。说明Cthrc1基因可明显抑制小鼠体内肝星状细胞增殖。

A:Cthrc1 mRNA表达(PCR法);B:Cthrc1蛋白表达(蛋白质印迹法)
图2 注射Ad-Cthrc1腺病毒后肝脏Cthrc1 mRNA和蛋白表达
讨 论
目前多项研究发现Cthrc1基因在多种肿瘤组织中高表达,如黑色素瘤[5,7]、胃癌[8-9]、结直肠癌[10-11]、肝细胞癌[12-13]、胰腺癌[14]、肺癌[15]等实体肿瘤。本研究的前期研究[6]发现Cthrc1基因能抑制肝星状细胞Smad3蛋白的磷酸化,从而减少纤维化相关基因的合成,最终延缓肝纤维化的进展,说明Cthrc1基因在肝纤维化的发生、发展过程中发挥重要作用。本课题进一步研究发现Cthrc1能明显抑制小鼠肝纤维化过程中肝星状细胞的增殖,有望进一步阐明肝纤维化的发生机制,为其治疗提供可能的靶点。
外源基因进入机体通常需要“载体”, 提供高效的基因转移、 稳定的表达以及具有生物安全性的载

图3 各组HE和Masson染色结果(×200)
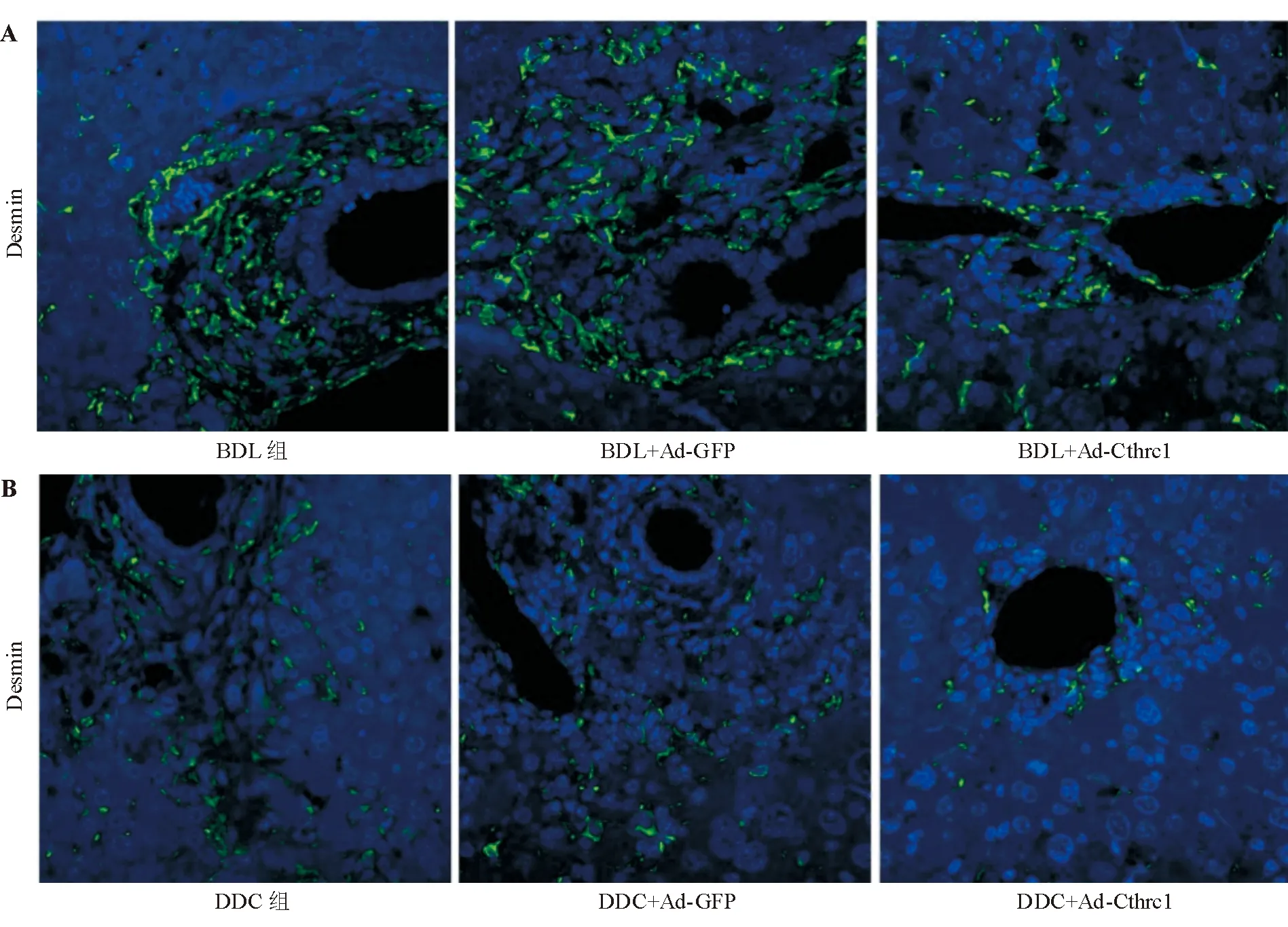
图4 各组小鼠Desmin表达(免疫荧光法,×400)
体是所有基因治疗必须解决的问题。目前所用的载体按种类可分为病毒载体和非病毒载体。与非病毒载体相比,病毒载体具有感染效率高、可在体内稳定表达等优点。本实验采用AdMaxTM腺病毒包装系统,能高效地将目的基因导入小鼠肝脏[16]。重组腺病毒载体因具有安全性好、转染效率高、感染谱较广、病毒滴度高且能容纳大片段外源基因等特点而得到广泛应用,尤其因其具有嗜肝性,因此更适用于将目的基因导入至肝脏的实验中[17]。本研究中,通过尾静脉注射Ad-Cthrc1腺病毒载体后,小鼠肝内Cthrc1 mRNA和蛋白表达均较正常对照组明显增高。
最新研究显示,Cthrc1可抑制TGF-β信号通路,影响细胞的多种生物学功能。Cthrc1可明显减少皮肤瘢痕组织中由TGF-β1诱导的Ⅰ型胶原沉积,并可抑制TGF-β1的分泌;在血管外膜平滑肌细胞损害后的分化过程中,Cthrc1可抑制局部胶原沉积[17]。另外研究还发现,Cthrc1作为Wnt信号通路的协同蛋白,通过稳定受体-配体的相互作用,协同激活Wnt/PCP信号通路,改变细胞极性,促进细胞迁移[18]。本研究发现,在肝纤维化过程中,Cthrc1基因能明显抑制小鼠肝星状细胞的增殖,提示Cthrc1基因在肝纤维化过程中发挥重要的生物学作用,尤其是在肝星状细胞增殖过程中。因此调控Cthrc1基因表达有望成为肝纤维化的治疗靶点,但仍需进一步研究证实。
1 Pyagay P, Heroult M, Wang Q, et al. Collagen triple helix repeat containing 1, a novel secreted protein in injured and diseased arteries, inhibits collagen expression and promotes cell migration[J]. Circ Res, 2005, 96 (2): 261-268.
2 LeClair R, Lindner V. The role of collagen triple helix repeat containing 1 in injured arteries, collagen expression, and transforming growth factor beta signaling[J]. Trends Cardiovasc Med, 2007, 17 (6): 202-205.
3 Kimura H, Kwan KM, Zhang Z, et al. Cthrc1 is a positive regulator of osteoblastic bone formation[J]. PLoS One, 2008, 3 (9): e3174.
4 Turashvili G, Bouchal J, Baumforth K, et al. Novel markers for differentiation of lobular and ductal invasive breast carcinomas by laser microdissection and microarray analysis[J]. BMC Cancer, 2007, 7: 55.
5 Tang L, Dai DL, Su M, et al. Aberrant expression of collagen triple helix repeat containing 1 in human solid cancers[J]. Clin Cancer Res, 2006, 12 (12): 3716-3722.
6 Bian Z, Miao Q, Zhong W, et al. Treatment of cholestatic fibrosis by altering gene expression of Cthrc1: Implications for autoimmune and non-autoimmune liver disease[J]. J Autoimmun, 2015, 63: 76-87.
7 Li J, Zhang Z, Li G. Patient outcome prediction using multiple biomarkers in human melanoma: A clinicopathological study of 118 cases[J]. Exp Ther Med, 2011, 2 (1): 131-135.
8 Gu L, Liu L, Zhong L, et al. Cthrc1 overexpression is an independent prognostic marker in gastric cancer[J]. Hum Pathol, 2014, 45 (5): 1031-1038.
9 Wang P, Wang YC, Chen XY, et al. CTHRC1 is upregulated by promoter demethylation and transforming growth factor-β1 and may be associated with metastasis in human gastric cancer[J]. Cancer Sci, 2012, 103 (7): 1327-1333.
10 Tan F, Liu F, Liu H, et al. CTHRC1 is associated with peritoneal carcinomatosis in colorectal cancer: a new predictor for prognosis[J]. Med Oncol, 2013, 30 (1): 473.
11 Palma M, Lopez L, García M, et al. Detection of collagen triple helix repeat containing-1 and nuclear factor (erythroid-derived 2)-like 3 in colorectal cancer[J]. BMC Clin Pathol, 2012, 12: 2.
12 Chen YL, Wang TH, Hsu HC, et al. Overexpression of CTHRC1 in hepatocellular carcinoma promotes tumor invasion and predicts poor prognosis[J]. PLoS One, 2013, 8 (7): e70324.
13 Tameda M, Sugimoto K, Shiraki K, et al. Collagen triple helix repeat containing 1 is overexpressed in hepatocellular carcinoma and promotes cell proliferation and motility[J]. Int J Oncol, 2014, 45 (2): 541-548.
14 Park EH, Kim S, Jo JY, et al. Collagen triple helix repeat containing-1 promotes pancreatic cancer progression by regulating migration and adhesion of tumor cells[J]. Carcinogenesis, 2013, 34 (3): 694-702.
15 Ke Z, He W, Lai Y, et al. Overexpression of collagen triple helix repeat containing 1 (CTHRC1) is associated with tumour aggressiveness and poor prognosis in human non-small cell lung cancer[J]. Oncotarget, 2014, 5 (19): 9410-9424.
16 齐桓. 以AdMax载体系统构建和制备肾癌相关抗原G250基因重组腺病毒表达载体[J]. 南方医科大学学报, 2008, 28 (9): 1617-1620, 1625.
17 LeClair RJ, Durmus T, Wang Q, et al. Cthrc1 is a novel inhibitor of transforming growth factor-beta signaling and neointimal lesion formation[J]. Circ Res, 2007, 100 (6): 826-833.
18 Yamamoto S, Nishimura O, Misaki K, et al. Cthrc1 selectively activates the planar cell polarity pathway of Wnt signaling by stabilizing the Wnt-receptor complex[J]. Dev Cell, 2008, 15 (1): 23-36.
(2016-08-22收稿)
Cthrc1 Inhibits Proliferation of Hepatic Stellate Cells in Mice
ZHONGWei1,BIANZhaolian2,MAXiong1
1DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity;ShanghaiInstituteofDigestiveDisease,Shanghai(200001);2DepartmentofGastroenterology,NantongThirdPeople’sHospital;NantongInstituteofLiverDisease,Nantong,JiangsuProvince
MA Xiong, Email: maxiongmd@163.com
Collagen Triple Helix Repeat Containing Protein-1; Adenovirus Vector; Hepatic Stellate Cells;
10.3969/j.issn.1008-7125.2016.10.003
江苏省自然科学基金(BK20160420)、南通市科技局南通市社会发展项目(MS22015105)
#本文通信作者,Email: maxiongmd@163.com
Background: Collagen triple helix repeat containing protein-1 (Cthrc1) has been reported playing an important role in liver diseases, especially in liver fibrosis, however, its effect on hepatic stellate cells proliferation is not fully clear. Aims: To investigate the effect of Cthrc1 on proliferation of hepatic stellate cells. Methods: Recombinant adenovirus vector of Cthrc1 was constructed. After injecting Ad-Cthrc1 through tail vein, mRNA and protein expressions of Cthrc1 were determined by real-time PCR and Western blotting, respectively. Liver fibrosis model was established by bile duct ligation and fed with 3,5-diethoxycarbonyl-1,4-dihydrocollidine (DDC) in mice, respectively. The liver fibrosis mice were injected with Ad-Cthrc1 or Ad-GFP through tail vein. Immunofluorescence was used to determine number of hepatic stellate cells. Results: Recombinant Cthrc1-adenovirus vector was successfully constructed. Real-time PCR and Western blotting showed that mRNA and protein expressions of Cthrc1 were increased in Ad-Cthrc1 group than in control group. HE and Masson staining demonstrated that mice model of liver fibrosis was successfully established. Immunofluorescence showed that overexpression of Cthrc1 inhibited significantly the proliferation of hepatic stellate cells. Conclusions: Recombinant adenovirus vector of Ad-Cthrc1 constructed can express stablyinvivo, and inhibit the proliferation of hepatic stellate cells. Therefore, Cthrc1 may become a potential target for treatment of liver fibrosis.
