CT门静脉成像在肝硬化食管胃静脉曲张中的应用价值
2016-12-02赵尚飞曲巧燕崔铭娟王艳婷谭军英宋明全
赵尚飞 冯 琨 曲巧燕 崔铭娟 王艳婷 谭军英 宋明全#
青岛大学医学部1(266071) 山东大学齐鲁医院(青岛)病理科2青岛大学附属医院消化内科3
CT门静脉成像在肝硬化食管胃静脉曲张中的应用价值
赵尚飞1*冯 琨2曲巧燕1崔铭娟3王艳婷3谭军英3宋明全3#
青岛大学医学部1(266071) 山东大学齐鲁医院(青岛)病理科2青岛大学附属医院消化内科3
背景:CT门静脉成像(CTP)可直观地显示门静脉及其侧支循环,为临床常用的门静脉高压评估方法。目的:评价 CTP在肝硬化食管胃静脉曲张中的应用价值。方法:回顾性收集2013年1月—2015年9月在青岛大学附属医院行CTP和胃镜检查并符合纳入标准的肝硬化患者143例,根据入院时有无消化道出血分为出血组(n=70)和未出血组(n=73)。采用Kappa一致性检验分析CTP与胃镜检查结果的一致性,采用ROC曲线分析CTP参数门静脉主干(MPV)、脾静脉(SPV)、胃左静脉(LGV)直径预测食管胃静脉曲张破裂出血的准确性。结果:CTP与胃镜检查判断食管胃静脉曲张的分型、分级一致性较好(κ=0.793, 0.775)。出血组MPV、SPV、LGV直径均显著宽于未出血组(P<0.01),三者预测食管胃静脉曲张破裂出血的ROC曲线下面积(AUC)分别为0.741、0.627和0.816,LGV直径的准确性最高,以6.1 mm为界值,其敏感性和特异性分别为65.71%和84.93%;MPV直径以16.3 mm为界值时,敏感性(75.71%)优于LGV和SPV。结论:CTP 可用于肝硬化食管胃静脉曲张的临床诊断,其参数LGV、MPV直径有助于静脉曲张破裂出血的预测。
肝硬化; 食管和胃静脉曲张; CT门静脉造影术; 胃镜检查; 胃肠出血
Gastrointestinal Hemorrhage
肝硬化是临床常见慢性进行性肝病,主要表现为肝功能下降和门静脉高压,后者所致的食管胃静脉曲张破裂出血(esophagogastric variceal bleeding)是肝硬化患者的主要死亡原因,因此预测食管胃静脉曲张破裂出血并采取积极预防措施具有重要临床意义[1-2]。胃镜检查是目前最常用的诊断食管胃静脉曲张的方法,但其只能观察食管和胃黏膜层静脉曲张而无法观察周围静脉曲张,且胃镜检查为侵入性检查,部分患者不能接受。CT 门静脉成像(CT portography, CTP)为非侵入性检查,显像清晰并有强大的后处理功能,可立体、清晰、直观地显示门静脉及其侧支循环的结构、形态、走行和空间毗邻关系,为临床常用的门静脉高压评估方法[3-4]。本研究通过与胃镜检查比较,评价CTP对肝硬化食管胃静脉曲张的诊断效能,同时分析其对食管胃静脉曲张破裂出血的预测价值。
对象与方法
一、研究对象
回顾性收集2013年1月—2015年9月在青岛大学附属医院消化内科住院并行CTP和胃镜检查的肝硬化患者。入选标准:①临床症状、体征以及实验室、影像学和(或)活检病理结果符合肝硬化标准;②未行内镜套扎术或硬化剂、组织胶注射治疗;③未行断流、分流术,如脾切除术、经颈静脉肝内门体分流术(TIPS)等;④无肝癌病史;⑤无胃切除术史;⑥无肾功能不全、碘过敏史。
结果共143例肝硬化患者纳入研究,其中男性96例,女性47例,年龄23~78岁,平均(52.39±9.85)岁。肝硬化病因:慢性乙型肝炎101例,酒精性肝病 16例,自身免疫性肝病7例,丙型肝炎5例,原发性胆汁性肝硬化5例,肝豆状核变性3例,隐源性肝硬化6例。肝功能 Child-Pugh分级:A级54例,B级48例,C级41例。根据入院时有无消化道出血将患者分为出血组(n=70, 49.0%)和未出血组(n=73, 51.0%)。消化道出血诊断标准:呕血、黑便、失血性周围循环衰竭临床表现,呕吐物或粪便隐血试验强阳性,血红蛋白、红细胞计数、红细胞比容降低。
二、胃镜检查和CTP
入选者均于入院1周内行胃镜检查和CTP,平均间隔时间(3.4±0.5) d。
1. 胃镜检查:检查前禁饮食8 h以上。使用Olympus 260电子胃镜,观察有无食管胃静脉曲张,行静脉曲张分型(Sarin分型)[5]和内镜分级[6]。Sarin分型:GOV1型,食管静脉曲张跨过胃食管交界处,沿胃小弯侧向下延伸达2~5 cm;GOV2型,食管静脉曲张伴胃底静脉曲张;IGV型,孤立性胃静脉曲张,静脉曲张位于胃底为IGV1型,位于胃体、胃窦、十二指肠为IGV2型。静脉曲张内镜分级:轻度,食管静脉曲张呈直线形或略有迂曲,无红色征;中度,食管静脉曲张呈直线形或略有迂曲,有红色征,或呈蛇形迂曲隆起,无红色征;重度,食管静脉曲张呈蛇形迂曲隆起,有红色征,或呈串珠状、结节状或瘤状,不论有无红色征。
2. CTP:检查前禁食6~8 h,检查前15 min口服800 mL清水充盈肠道。使用Siemens SOMATOM Sensation 64层螺旋CT扫描仪,扫描范围为膈顶至双侧髂嵴水平。扫描参数:管电压120 kV,管电流250 mA,层厚5 mm,螺距0.983。使用双筒高压注射器以3.0 mL/s的速率经前臂静脉注入总量为 80~100 mL(1.5 mL/kg)的非离子型造影剂碘海醇(300 mg I/mL),然后行动脉期(20 s)、门静脉期(60 s)和平衡期(120 s)动态增强扫描。所得图像传送至后处理工作站,采用容积再现(volume rendering, VR)、多平面重建(multiplanar reformation, MPR)、最大密度投影(maximum intensity projection, MIP)技术对门静脉及其侧支血管进行三维重建。观察有无食管胃静脉曲张并行Sarin分型[5]和CT静脉曲张分级[7-8]。CT静脉曲张分级:0 级,无静脉曲张;Ⅰ级(轻度),增强扫描食管内壁未见向管腔内突出并有强化的斑点状病灶;Ⅱ级(中度),介于Ⅰ级与Ⅲ级之间;Ⅲ级(重度),增强扫描食管内壁见向管腔内突出、明显强化的小结节状病灶。测量门静脉主干 (main portal vein, MPV)、脾静脉(splenic vein, SPV)、胃左静脉(left gastric vein, LGV)直径,其中MPV于主干最宽处取最大横径,SPV、LGV于距汇入点2 cm 范围内取最大横径。由经验丰富的放射科医师阅片,所有指标均测量2次,结果取均值。
三、统计学分析
结 果
一、CTP与胃镜检查诊断食管胃静脉曲张的一致性
143例肝硬化患者中,CTP提示食管胃静脉曲张阴性24例,阳性119例,包括单纯食管静脉曲张(EV)23例,GOV1型44例,GOV2 型48例,IGV1型4例,无IGV2型患者;CT静脉曲张分级阴性28例,Ⅰ级37例,Ⅱ级35例,Ⅲ级43例。胃镜检查提示食管胃静脉曲张阴性28例,阳性 115例,包括EV 28例,GOV1型38例,GOV2 型47例,IGV1型2例,无IGV2型患者;静脉曲张内镜分级阴性30例,轻度37例,中度37例,重度39例(表1、表2)。CTP发现胃-肾分流5例,脾-肾分流3例。Kappa一致性检验显示两项检查判断食管胃静脉曲张的分型、分级一致性较好,κ值分别为0.793(95% CI: 0.714~0.872,P<0.01)和0.775(95% CI: 0.693~0.858,P<0.01)。

表1 CTP与胃镜检查诊断食管胃静脉曲张分型比较(n)
二、CTP对食管胃静脉曲张破裂出血的预测价值
出血组MPV、SPV、LGV直径均宽于未出血组,组间差异有统计学意义(P<0.01)(表3)。三者预测食管胃静脉曲张破裂出血的ROC曲线分析结果见图1、表4,MPV和LGV直径预测食管胃静脉曲张破裂出血均有一定的准确性,LGV直径准确性更高,以6.1 mm为界值,其敏感性和特异性分别为65.71%和84.93%;MPV直径以16.3 mm为界值时,敏感性(75.71%)优于LGV和SPV直径。

表2 CTP与胃镜检查诊断食管胃静脉曲张分级比较(n)

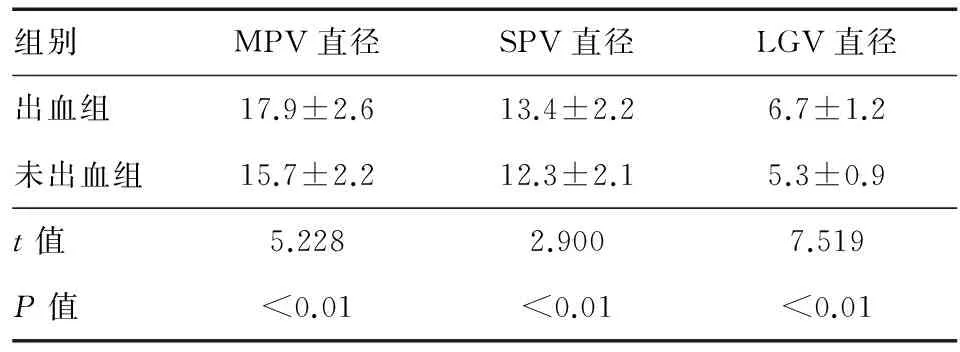
组别MPV直径SPV直径LGV直径出血组17.9±2.613.4±2.26.7±1.2未出血组15.7±2.212.3±2.15.3±0.9t值5.2282.9007.519P值<0.01<0.01<0.01
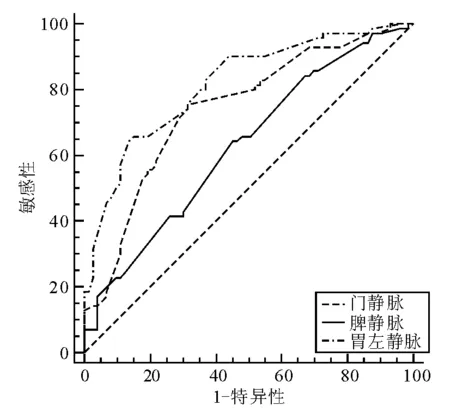
图1 CTP预测食管胃静脉曲张破裂出血的ROC曲线
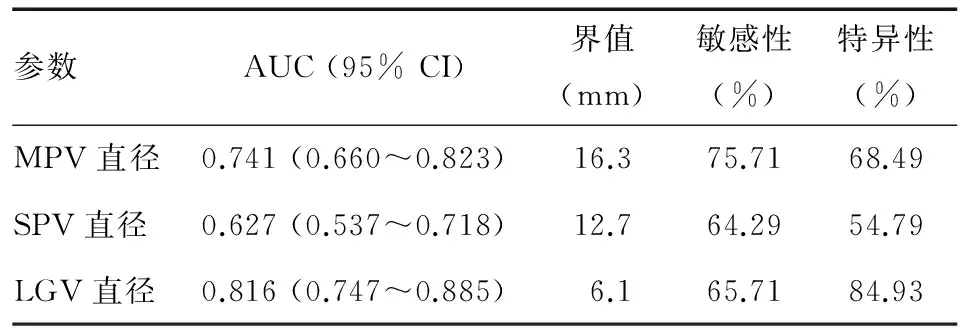
参数AUC(95%CI)界值(mm)敏感性(%)特异性(%)MPV直径0.741(0.660~0.823)16.375.7168.49SPV直径0.627(0.537~0.718)12.764.2954.79LGV直径0.816(0.747~0.885)6.165.7184.93
讨 论
食管胃静脉曲张是肝硬化门静脉高压的常见表现,其中食管静脉曲张首次出血的年发生率为5%~15%,1年内再出血率高达60%~80%,胃静脉曲张出血发生率低于食管静脉曲张,但出血量往往较大,病情较严重,病死率高达45%[9]。胃镜检查目前仍是诊断肝硬化食管胃静脉曲张的金标准,可于直视下观察静脉曲张的部位、形态及其曲张程度、是否有红色征等,但其仅能观察黏膜层静脉曲张而不能显示门静脉及其侧支循环情况,无法判断是否存在门-体分流。CTP现已逐步应用于肝硬化门静脉高压侧支循环的评价,该项检查能清晰显示静脉曲张的来源和引流血管,患者接受度较高,并可为外科手术或介入治疗提供指导意见,具有较好的临床应用前景。
本研究通过与胃镜检查比较,评价了CTP对肝硬化食管胃静脉曲张的诊断效能,发现两项检查对静脉曲张的分型、分级有较好的一致性(κ=0.793, 0.775),与郑盛等[10]的研究结果一致。同时,CTP检出的IGV1型例数多于胃镜检查(4例对2例),且8例胃镜检查诊断为EV型者CTP诊断为GOV1和GOV2型,表明CTP对胃静脉曲张的显示效果优于胃镜检查,可发现胃镜下无法判断的胃静脉曲张。其可能原因为:胃黏膜层静脉曲张程度较轻时,曲张静脉未突入管腔,表面黏膜色泽与正常黏膜相似,胃镜下难以与胃黏膜皱襞相区分,从而导致漏诊,而CTP可清晰显示胃壁各层次的静脉曲张。此外,胃镜检查无法精确测量曲张静脉直径,可能导致其对静脉曲张的分级发生误差。
研究显示门静脉及其分支血管宽度与肝硬化食管胃静脉曲张破裂出血相关,血管内径越大,静脉曲张破裂出血的风险越高[11]。本组患者门静脉及其分支血管直径的测量结果显示,出血组MPV、SPV、LGV直径均较未出血组显著增宽。进一步行ROC曲线分析,发现MPV和LGV直径对食管胃静脉曲张破裂出血的预测有一定准确性(AUC分别为0.741和0.816),LGV直径准确性更高,SPV直径的准确性则不甚理想(AUC 为0.627)。LGV又称胃冠状静脉 ,是门静脉系统的重要属支,作为食管胃静脉曲张形成的主要供血血管,在食管胃静脉曲张的发生、发展和转归中起重要作用。国内其他研究[8,12-14]亦表明LGV直径对肝硬化食管胃静脉曲张破裂出血有一定预测价值。
本研究分析显示,LGV直径预测食管胃静脉曲张 破裂出血的界值为6.1 mm,相应敏感性为65.71%,特异性为84.93%,敏感性较低而特异性较高,其他研究[12,14]分别以7 mm和6.5 mm为界值,亦发现LGV直径预测出血的敏感性低于70%而特异性为75%~80%。敏感性较低可能是由于肝硬化门静脉高压可影响门静脉所有分支,且静脉曲张的发生部位、程度以及门-体分流等均可影响出血发生,因此当LGV直径<6.1 mm时,仍可能有较多患者发生静脉曲张破裂出血。故对于LGV直径>6.1 mm的食管胃静脉曲张患者,应积极采取措施预防静脉曲张破裂出血。既往国内研究[8,12-14]中LGV直径预测出血的界值为6.0~7.0 mm不等,广泛适用的界值尚需开展更大样本的研究加以确定。
近年来,肝硬化食管胃静脉曲张的内镜治疗越来越普及,但常用的硬化剂、组织胶注射治疗可能发生异位栓塞并发症,如胃曲张静脉与左肾静脉间自发形成分流通道(胃-肾分流),组织胶可经该分流道进入体循环,造成肺、脑、心脏等重要脏器栓塞[15], 严重时可导致患者死亡,这在一定程度上限制了内镜治疗的临床应用。CTP可直观地显示门静脉及其分支血管以及是否存在门-体分流道[4],从而为内镜治疗提供指导意见,避免异位栓塞等并发症发生。本组患者通过CTP发现胃-肾分流5例、脾-肾分流3例,这些患者可选择手术或TIPS等治疗。
综上所述,在本组患者中,CTP可清晰显示门静脉及其侧支血管,对肝硬化食管胃静脉曲张分型、分级的判断与胃镜检查有较好的一致性,其参数LGV、MPV直径用于预测静脉曲张破裂出血有一定的准确性。因此,CTP可用于肝硬化门静脉高压食管胃静脉曲张的临床诊断和静脉曲张破裂出血的预测,并可指导内镜治疗。
1 Rahimi RS, Rockey DC. End-stage liver disease complications[J]. Curr Opin Gastroenterol, 2013, 29 (3): 257-263.
2 Kim JN, Sohn KM, Kim MY, et al. Relationship between the hepatic venous pressure gradient and first variceal hemorrhage in patients with cirrhosis: a multicenter retrospective study in Korea [J]. Clin Mol Hepatol, 2012, 18 (4): 391-396.
3 Kiyosue H, Ibukuro K, Maruno M, et al.Multidetector CT anatomy of drainage routes of gastric varices: a pictorial review[J].Radiographics, 2013, 33 (1): 87-100.
4 贺文,赵丽琴,马大庆. 多排螺旋CT门静脉成像对门静脉高压食管、胃底静脉曲张的评价[J]. 世界华人消化杂志, 2010, 18 (5): 462-466.
5 Ryan BM, Stockbrugger RW, Ryan JM. A pathophysiologic, gastroenterologic, and radiologic approach to the manage-ment of gastric varices[J]. Gastroenterology, 2004, 126 (4): 1175-1189.
6 中华医学会消化内镜学分会. 食管胃静脉曲张内镜下诊断和治疗规范试行方案(2003年)[J]. 中华消化内镜杂志, 2004, 21 (3): 149-151.
7 Kim YJ, Raman SS, Yu NC, et al. Esophageal varices in cirrhotic patients: evaluation with liver CT[J]. AJR Am J Roentgenol, 2007, 188 (1): 139-144.
8 刘桂勤,华静,沈加林. CT门静脉血管成像预测肝硬化门静脉高压食管胃底静脉曲张破裂出血价值[J]. 中华实用诊断与治疗杂志, 2015, 29 (4): 396-398.
9 中华医学会消化内镜学分会食管胃静脉曲张学组. 消化道静脉曲张及出血的内镜诊断和治疗规范试行方案(2009年)[J]. 中华消化内镜杂志, 2010, 27 (1): 1-4.
10 郑盛,唐映梅,杨晋辉,等. MSCTP 与内镜检查诊断肝硬化合并食管胃静脉曲张的比较[J]. 中华全科医学, 2014, 12 (7): 1127-1128.
11 鲍兵,邹晓平. 肝硬化食管静脉曲张破裂出血无创性多因素预测的临床价值[J]. 肝胆外科杂志, 2007, 15 (5): 357-359.
12 宋兵,李彩英,刘增品,等. 胃左静脉MSCTA预测肝硬化门静脉高压食管胃底静脉曲张破裂岀血的价值[J]. 临床放射学杂志, 2011, 30 (7): 979-983.
13 刘文娜,郝婷婷,王剑,等. 64层螺旋CT门静脉造影对肝硬化患者肝功能分级和食管静脉曲张破裂出血的预测价值[J]. 实用肝脏病杂志, 2014, 17 (3): 283-286.
14 梁晓春,王维,王小宜,等. CT预测肝硬化门静脉高压并发上消化道出血风险的ROC分析[J]. 临床放射学杂志, 2006, 25 (5): 434-438.
15 孙潇,刘迎娣,孙国辉,等. 合并胃肾或脾肾分流道的胃静脉曲张内镜下联合注射治疗[J]. 胃肠病学和肝病学杂志, 2014, 23 (10): 1141-1143.
(2016-01-12收稿;2016-04-19修回)
Application of CT Portography in Esophagogastric Varices in Cirrhotic Patients
ZHAOShangfei1,FENGKun2,QUQiaoyan1,CUIMingjuan3,WANGYanting3,TANJunying3,SONGMingquan3.
1QingdaoUniversityMedicalCollege,Qingdao,ShandongProvince(266071);2DepartmentofPathology,QiluHospital(Qingdao)ofShandongUniversity,Qingdao,ShandongProvince;3DepartmentofGastroenterology,theAffiliatedHospitalofQingdaoUniversity,Qingdao,ShandongProvince
SONG Mingquan, Email: songmingquan625@sina.com
Liver Cirrhosis; Esophageal and Gastric Varices; CT Portography; Gastroscopy;
10.3969/j.issn.1008-7125.2016.10.008
*Email: shangfeizhao@163.com
#本文通信作者,Email: songmingquan625@sina.com
Background: CT portography (CTP) permits comprehensive evaluation of portal vein and its collateral pathways. It is widely used for assessment of portal hypertension in clinical practice. Aims: To assess the value of CTP in esophagogastric varices in cirrhotic patients. Methods: A retrospective cohort study was performed in 143 cirrhotic patients admitted from Jan. 2013 to Sep. 2015 at the Affiliated Hospital of Qingdao University. All patients fulfilled the inclusion criteria and underwent CTP and gastroscopy within 7 days after admission. According to the occurrence of gastrointestinal bleeding at admission, patients were allocated into two groups: bleeding group (n=70) and non-bleeding group (n=73). Consistency of the results of CTP and gastroscopy was analyzed by kappa coefficient; the accuracy of CTP parameters, including diameters of main portal vein (MPV), splenic vein (SPV) and left gastric vein (LGV) for prediction of variceal bleeding was evaluated by ROC curve. Results: CTP and gastroscopy had a good consistency in typing and grading of esophagogastric varices, with the kappa value of 0.793 and 0.775, respectively. The diameters of MPV, SPV and LGV were significantly higher in bleeding group than in non-bleeding group (P<0.01), and their area under the ROC curve (AUC) in predicting variceal bleeding was 0.741, 0.627 and 0.816, respectively. The accuracy of diameter of LGV was superior to that of MPV and SPV. With the cutoff value of 6.1 mm, the sensitivity and specificity of diameter of LGV were 65.71% and 84.93%, respectively. With the cutoff value of 16.3 mm, the sensitivity of diameter of MPV was 75.71%, which was higher than that of LGV and SPV. Conclusions: CTP can be used in clinical diagnosis of esophagogastric varices in cirrhotic patients, and two CTP parameters, the diameters of LGV and MPV, might be helpful for prediction of variceal bleeding.
