推拿手法联合跑台训练促进大鼠坐骨神经再生的效果①
2016-12-02马书杰严隽陶陶然陆永嘉王春红潘俊峰马颖周帆鲍嘉敏符利娟
马书杰,严隽陶,陶然,陆永嘉,王春红,潘俊峰,马颖,周帆,鲍嘉敏,符利娟
推拿手法联合跑台训练促进大鼠坐骨神经再生的效果①
马书杰1,2,严隽陶1,陶然2,陆永嘉1,王春红1,潘俊峰1,马颖1,周帆1,鲍嘉敏2,符利娟2
目的 探讨推拿手法联合跑台训练对坐骨神经横断伤外膜修复后促进神经再生的效应及途径。方法 96只Sprague-Daw ley大鼠随机分为正常对照组、缝合对照组和缝合手法组,每组32只。后两组建立坐骨神经横断伤外膜缝合模型,缝合手法组给予捻揉手法及跑台训练,每天1次。分别于干预后2、3、4、8周各组取8只大鼠检测坐骨神经传导速度、再生神经轴突数及施万细胞数。结果 与缝合对照组比较,缝合手法组坐骨神经传导速度在干预后4周、8周加快(P<0.05),轴突数目在2周、4周时有显著性差异(P<0.05);施万细胞数无显著性差异(P>0.05)。结论 推拿手法联合跑台训练可促进损伤的周围神经再生。
推拿;跑台;神经再生;坐骨神经;传导速度;大鼠
[本文著录格式] 马书杰,严隽陶,陶然,等.推拿手法联合跑台训练促进大鼠坐骨神经再生的效果[J].中国康复理论与实践, 2016,22(11):1276-1280.
CITED AS:Ma SJ,Yan JT,Tao R,etal.Effects of Tuina combined with treadmill training on regeneration of sciatic nerve in rats[J]. Zhongguo Kangfu Lilun Yu Shijian,2016,22(11):1276-1280.
周围神经损伤临床发病率高。由于神经再生速度缓慢,平均1mm/d,当神经纤维长入失神经肌肉时,肌肉往往已发生纤维化,再生神经纤维无法形成有效神经-肌肉接头,导致肢体功能丧失。促进神经再生,提高神经再生速度是肢体功能恢复的重要前提。施万细胞(Schwann cells,SCs)是周围神经特有的胶质细胞。神经损伤后,施万细胞分裂增殖并分泌多种活性物质,与神经再生关系密切。神经缝合后的康复治
疗是促进神经再生、肢体功能恢复的重要手段。传统中医推拿手法及主动运动是十分重要的神经康复方法,被广泛应用于临床。本研究探讨推拿手法联合跑台训练促进神经再生的作用。
1 材料与方法
1.1 实验动物
清洁级雄性Sprague-daw ley大鼠96只,体质量180~220 g,由上海斯莱克实验动物有限责任公司提供,饲养于上海中医药大学动物实验中心,6只/笼,自由饮水,室温18℃,湿度40%~50%。
采用SPSS 19.0软件随机分为正常对照组(n=32)、缝合对照组(n=32)、缝合手法组(n=32)。每组再分为造模后2周、3周、4周、8周4个亚组,每亚组8只。
1.2 主要试剂及仪器
10%水合氯醛:上海西唐生物科技有限公司。石蜡、甲醛、氨水、二甲苯、无水乙醇、30%H2O2:上海国药集团。光谱二抗、DBA浓缩试剂盒、中性树脂、苏木精:上海长岛生物科技有限公司。CX41正置显微镜:OLYMPUS公司。SQ2125石蜡切片机:徕克公司。IMS图像分析系统:基尔顿生物科技(上海)有限公司。D5100数码相机:NIKON公司。自制手法模拟仪(与复旦大学共同研制)。RM-6240BD多道生理信号处理系统、YLS-15A大鼠转轮式跑步机:成都仪器厂。
1.3 动物造模
采用坐骨神经横断伤立即缝合模型。缝合对照组和缝合手法组以10%水合氯醛3m l/kg腹腔注射麻醉,备皮,俯卧位固定于手术台。距右侧坐骨结节下方约0.5 cm处沿坐骨神经走行,无菌条件下切开,于臀肌间显露坐骨神经干,弯头组织镊10倍显微镜下钝性分离,梨状肌下缘1 cm处整齐切断坐骨神经干,立即在外科显微镜下用11-0缝合线以神经表面血管走行为标志行神经外膜缝合。伤口洒入适量注射用青霉素钠粉剂,1号缝合线缝合皮肤3~4针,碘伏消毒。
1.4 干预方法
术后3周为造模成功时间。模型对照组和正常对照组不作任何干预,缝合手法组进行以下干预。
①采用自制推拿手法模拟仪进行捻揉法模拟手法治疗。手法参数:压力0.45 N,120/m in,共5m in。②采用YLS-15A大鼠转轮式跑步机进行主动训练,主动运动参数:0.65m in/转,5转/m in,共5m in。
以上干预均每天1次,于上海中医药大学动物实验中心完成。
1.5 检测指标
各组于造模成功后2、3、4、8周各取8只大鼠行以下指标检测。
1.5.1 大体观察
观察术后切口情况、肌肉萎缩程度、右下肢活动能力、步态变化及足趾溃疡等。
1.5.2 坐骨神经传导速度
采用RM-6240BD四通道生理记录仪,采集频率100 kHz,扫描速度0.8ms/格,灵敏度4mV,时间常数0.2 s;频波频率100 Hz,刺激电压1 V,波宽0.1 ms。将刺激电极正负极平行插入坐骨结节下方坐骨神经走行两侧,两针约距1 cm;两对记录电极分别置于腘窝处和跟腱处神经走行两侧;地线位于刺激电极和腘窝处记录电极之间。两对记录电极的距离/动作电位出现的时间差即为神经传导速度。每只大鼠测3次,取平均值。
1.5.3 坐骨神经轴突计数
神经传导速度测定结束后,处死各组大鼠,取出右侧坐骨神经断端下神经组织1 cm,石蜡包埋后切片。行HE染色。高倍镜下每标本取5个视野,HPIAS-1000病理图像分析系统记录视野内坐骨神经轴突数。
1.5.4 施万细胞计数
石蜡切片采用SP-9003试剂盒(美国ZYMED公司) 行S-100免疫组织化学染色。用HPIAS-1000病理图像分析系统400倍镜下每标本取5个视野行自动盲测,计数视野内阳性细胞数。
1.6 统计学分析
采用SPSS 18.0软件包进行数据分析与处理。计量资料以(±s)表示,采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 大体观察
手术过程中除大鼠麻醉意外死亡(由备用大鼠补齐)外,神经修复术后全部动物存活。大鼠手术侧早期出现失神经支配表现,部分足部皮肤发红,少数足趾肿胀,1周左右伤口愈合,伤口无感染。术后1~3周,各组均有大鼠出现不同程度足底溃疡、噬趾及踝关节不同程度僵硬、跖屈功能受限,坐骨神经支配区出现肌肉萎缩,右下肢跛行步态。足部溃疡经百多邦外用后明显好转。至8周时,各组大鼠溃疡均愈合,
术侧肌萎缩明显减轻,跛行步态减轻,踝关节功能活动不同程度恢复。
2.2 坐骨神经传导速度
缝合对照组和缝合手法组坐骨神经传导速度均较正常对照组下降(P<0.05),缝合手法组4周、8周时坐骨神经传导速度快于缝合对照组(P<0.05)。缝合手法组坐骨神经传导速度呈逐渐上升趋势,缝合对照组则呈逐渐下降趋势。见表1。
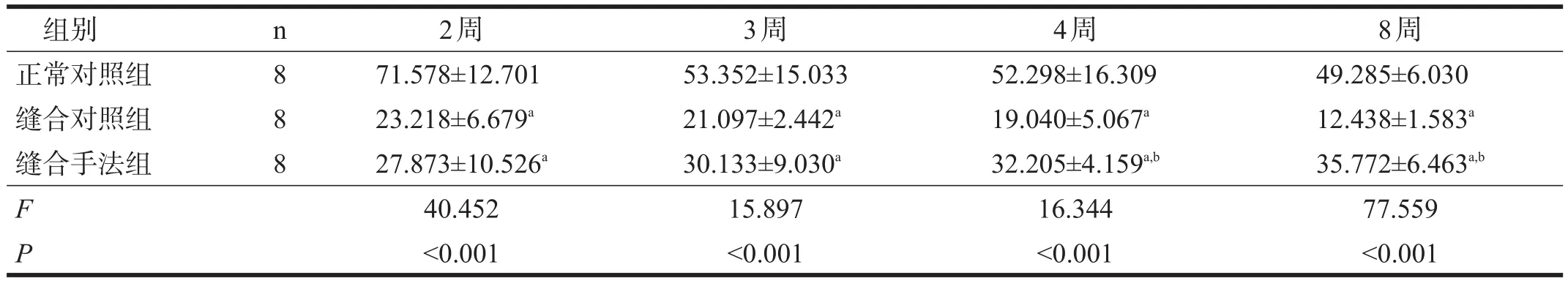
表1 各组造模后坐骨神经传导速度比较(m/s)
2.3 坐骨神经轴突计数
缝合对照组和缝合手法组坐骨神经轴突数均高于正常对照组(P<0.05),总体呈逐渐下降趋势。缝合手法组坐骨神经轴突数在4周之前迅速下降,4~8周时保持平稳;而对照组在4周以前保持稳定,8周时出现下降。见表2。
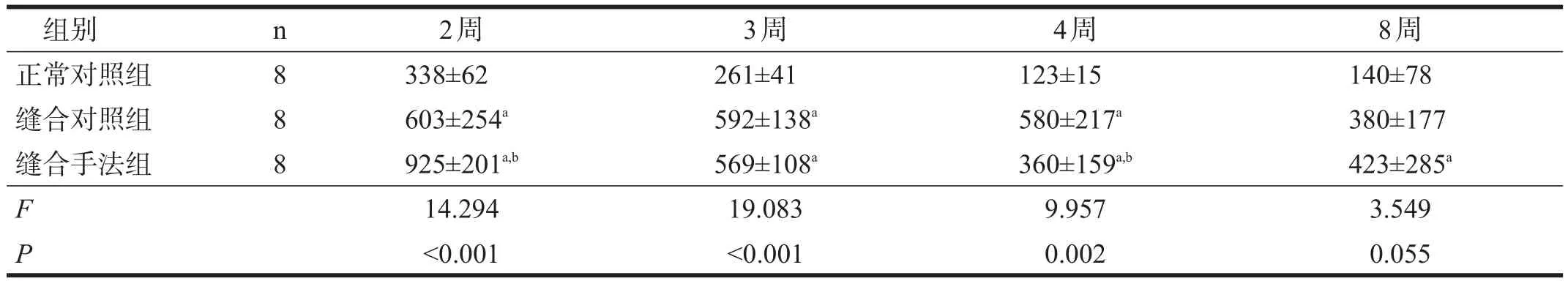
表2 各组造模后坐骨神经轴突计数比较
2.4 施万细胞计数
缝合对照组和缝合手法组坐骨神经施万细胞数均有高于正常对照组的趋势,但除3周时外(P<0.05),均无显著性差异。见表3。
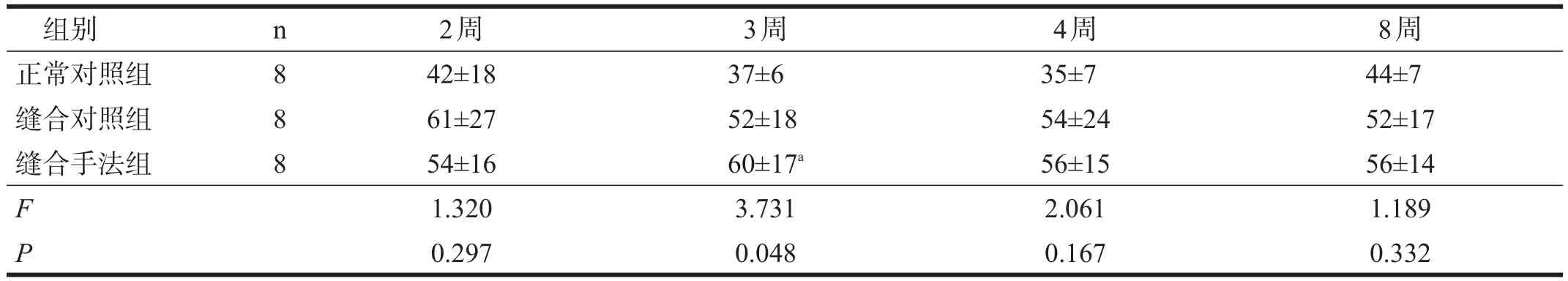
表3 各组造模后坐骨神经施万细胞计数比较
3 讨论
本研究显示,推拿手法联合跑台训练能加快周围神经损伤修复后大鼠坐骨神经传导速度,达到正常速度的72.6%。其发挥作用的机制可能是通过调节坐骨神经轴突的再生与退变,促进神经再生并沿正确的方向生长延伸。
手法联合跑台训练还能够促进施万细胞增殖,虽然除个别时间点外均没有统计学意义,但能使施万细胞数长时间维持在较缝合对照组更高水平,有利于神经修复后的再生及再生神经髓鞘化,从而可能促进神经传导功能的恢复。
周围神经损伤为临床常见病。2.8%创伤患者受周围神经损伤影响,部分患者甚至因此而终身残疾[1]。促进神经再生是周围神经损伤治疗的重要方面[2],除了药物和显微外科手术修复外,运动训练也是重要手段。无论是否手术,指导患者进行正确、适当的运动康复训练都是促进受损神经再生、恢复肢体功能的有效方法[3],包括被动活动和主动活动(助力运动、抗阻运动、等速运动等)[4]。近年来的研究表明,推拿能促进肌卫星细胞分裂增殖、调节生肌相关因子的表达[5-6],并早期促进快肌纤维恢复,改善失神经支配后骨骼肌结构形态,延缓失神经骨骼肌萎缩[7]。推拿可促进周围神经损伤后行为学、形态学恢复[8],并通过促进内源性因子及相关蛋白表达,促进神经再生及功能恢复[9-10]。康复训练能促进有髓神经纤维再生[11-12],对于促进感觉和运动功能恢复有积极作用[13-14]。
神经传导速度可以反映周围神经的功能状态。神经损伤后神经传导性受损,表现为神经传导速度减慢或消失[15-18]。本研究显示,神经损伤修复后,坐骨神经传导速度明显减弱;手法及运动训练后,坐骨神经传导速度明显恢复。坐骨神经传导速度的提高,提示神经修复后轴突再生,并有部分到达终末,对靶器官进行再支配。
周围神经损伤后,轴突近断端形成生长锥;生长锥发出许多细小神经轴丝,逐渐向远端延伸,这是神经轴突再生的基础。研究显示,再生轴丝在达到损伤区域前的生长速度很慢,约为0.2mm/d;而一旦进入远端神经,生长速度则可达2~3mm/d[19]。到达终末结构的轴丝越多,神经功能恢复也越好[20]。本研究显示,神经缝合后,坐骨神经轴突计数升高,提示神经进入再生阶段,轴丝增多,并通过神经缝合口向远端生长。但与对照组坐骨神经轴突数4周以前一直保持稳定,第8周出现下降不同,手法及运动训练后,大鼠坐骨神经轴突数在第2周之后就出现下降,第4周又有回升趋势。我们推测,手法及运动训练在2周以前能促进轴突生芽,增加轴丝数目,而在2周以后,则加速不能正常长入远端神经鞘膜管或错配的神经轴丝退化萎缩,使轴突数减少;4周后,又有新的神经纤维再生,轴突数出现上升趋势。
施万细胞是周围神经系统中特有的一类神经胶质细胞,与神经再生关系密切。诸多研究表明,其增殖、迁移、分泌在神经再生过程中起关键作用[21],不仅能够形成Bungner带,并且能分泌多种生物活性物质[22],构建周围神经再生的微环境,引导和支持神经再生[23]。施万细胞在周围神经损伤后修复过程中的促进作用随着时间的延长而逐渐降低[24]。促进施万细胞增殖、迁移和分泌,延长损伤远端失神经施万细胞支持神经再生功能的时间,是促进周围神经损伤后神经再生和功能恢复的重要途径。本研究显示,神经显微修复后3~8周,施万细胞数一直稳定保持在较高水平;在此期间,手法组施万细胞数有持续高于对照组的趋势,提示手法及运动训练有可能促进施万细胞增殖。施万细胞的增殖,可为新生神经轴浆转运提供良好环境,促进再生轴突沿着正确的方向生长,加速神经轴突直径增大、髓鞘厚度增加,提高坐骨神经传导速度。
本研究观察时间仅为2个月,而坐骨神经损伤后肢体功能恢复尚需较长时间,目前的结果尚不能全面显示推拿联合跑台训练在促进周围神经损伤再生中的作用。运动训练对周围神经损伤功能恢复的效果一直存在某些争议,焦点是运动训练所采取的负荷强度,如果负荷不当可能对周围神经功能产生不良影响[25]。由于每个研究采用的训练方式不同,运动负荷有其临界点,运动量超过临界点时可能妨碍神经再生并导致肌肉损伤,未达到临界点时可促进运动功能的恢复和神经再生[26-27]。另外,周围神经损伤后的再生机制复杂,包括神经胞体的存活、炎症免疫反应、沃勒变性的程度、神经损伤局部的微循环以及神经再生的微环境等。推拿及运动训练促进神经损伤后神经再生及肢体功能恢复的机制研究仍然任重而道远。
我们在今后的研究中,将增加动物数量,设置不同的运动量,从宏观角度观察推拿联合康复训练促进神经损伤后肢体功能恢复的影响,并从微观角度深入研究,从电生理、分子水平及基因水平研究其作用机制。运动对施万细胞的长期确切效应,也是今后研究的重要内容。
[1]Deumens R,Bozkurt A,Meek MF,etal.Repairing injured peripheral nerves:bridging the gap[J].Prog Neurobiol,2010,92 (3):245-276.
[2]Wang Y,Wang Q,Chen GP,et al.Effects of Jiaji electroacupuncture and neurodynam icmobilization technique on axon regenerationand content of neurotrophic factors in rabbits with sciatic nerve injury[J].Zhongguo Kangfu Lilun Yu Shijian, 2015,21(4):417-421.
[3]伍国维.周围神经损伤综合康复治疗疗效观察[J].实用医技
杂志,2007,14(4):412-413.
[4]赵继宗.神经外科学[M].北京:人民卫生出版社,2007: 695-696.
[5]马书杰,严隽陶.手法对家兔不同急性损伤骨骼肌卫星细胞影响观察[J].中华中医药学刊,2014,32(9):2118-2121.
[6]马书杰,严隽陶,黄品贤.推拿手法防治失神经骨骼肌萎缩的实验研究[J].江苏中医药,2014,46(11):79-81.
[7]郭汝宝,翁军,李增图,等.推拿手法对家兔失神经支配后肌球蛋白重链mRNA表达的影响[J].中华中医药学刊,2015,33 (1):46-48.
[8]吴剑聪,耿楠,李小琴,等.推拿影响坐骨神经损伤大鼠行为学及神经营养素3、酪氨酸激酶受体C表达的研究[J].环球中医药,2014,7(3):177-183.
[9]梅旭晖,纪倩,姚斌彬,等.推拿对坐骨神经损伤大鼠神经生长因子及其受体p75NTR的影响[J].中华中医药杂志,2013,28 (7):1994-1997.
[10]吴剑聪,鲁梦倩,于跃,等.推拿影响坐骨神经损伤大鼠NT-3及其受体TrkC表达的研究[J].中华中医药学刊,2014,32(5): 1032-1034.
[11]崔松彪,赵和龙,朴虎男,等.运动训练对周围神经损伤大鼠神经功能恢复的影响[J].中国临床康复,2004,8(34): 7705-7707.
[12]Sarikcioglu L,Oguz N.Exercise training and axonal regeneration after sciatic nerve injury[J].Int J Neurosci,2001,109 (3-4):173-177.
[13]江澜.外周神经损伤康复治疗及肌电图分析[J].中国康复, 2010,25(4):288-289.
[14]张兰,陆延任.臂丛神经损伤的康复治疗[J].中华物理医学与康复杂志,2001,23(3):190-191.
[15]Bilgin NG,Ozge A,Mert E,etal.Importance of electromyography and the electrophysiological severity scale in forensic reports[J].JForensic Sci,2007,52(3):698-701.
[16]Bromberg MB.Updating Motor Unit Number Estimation (MUNE)[J].Clin Neurophysiol,2007,118(1):1-8.
[17]SekiguchiM,AokiY,Konno S,etal.The effects of cilostazol on nerve conduction velocity and blood flow:acute and chronic caudda equine compression in a canine mode[J].Spine, 2008,33(24):2605-2611.
[18]李焰生.运动神经元疾病[M].上海:第二军医大学出版社, 2002:4.
[19]王栓科,张致英,洪光祥.周围神经损伤与轴突诱向因子[J].现代康复,2001,5(9):54-55.
[20]夏长所.周围神经外科治疗学[M].北京:中国科学技术出版社,2005:241-250.
[21]Kumar R,Sinha S,Hagner A,etal.Adultskin-derived precursor Schwann cells exhibit superior myelination and regeneration supportive properties compared to chronically denervated nerve-derived Schwann cells[J].Exp Neurol,2016,278(2): 127-142.
[22]Walsh SK,Kumar R,Grochmal JK,et al.Fate of stem cell transplants in peripheral nerves[J].Stem Cell Res,2012,8(2): 226-238.
[23]Whalley K.Glia:Schwann cells provide life support for axons[J].NatRev Neurosci,2014,15(11):698-699.
[24]Jam i S,Ahmet H.Advances in peripheral nerve regeneration[J].NatRev Neurol,2013,9(12):668-676.
[25]Rajaraman R,Guernsey DL,Rajaraman MM,et al.Stem cells,senescence,neosis and self-renewal in cancer[J].Cancer Cell Int,2006,8(1):1-26.
[26]Hervison GJ,Jeweed MM,Ditunno JF.Reinnervating ratskeletalmuscle:Effect of 35%grade treadm ill exercise[J].Arch PhysMed Rehabil,1982,63(7):313-316.
[27]Fow lerWM,Abresch RT.High-repetitive submaximal treadm ill exercise training:Effect on normal and dystrophic mice[J].Arch PhysMed Rehabill,1990,71(8):552-557
Effectsof Tuina Combined with Treadm ill Training on Regeneration of Sciatic Nerve in Rats
MA Shu-jie1,2,YAN Jun-tao1,TAO Ran2,LU Yong-jia1,WANG Chun-hong1,PAN Jun-feng1,MA Ying1,ZHOU Fan1, BAO Jia-min2,FU Li-juan2
1.Yueyang Hospital of Integrated Traditional Chinese and Western Medicine,Shanghai University of Traditonal ChineseMedicine,Shanghai200437,China;2.Schoolof Rehabilitation Science,ShanghaiUniversity of TraditonalChineseMedicine,Shanghai201203,China
Objective To explore the effectof Tuina combined with treadm ill training on nerve regeneration after sciatic nerve transection.Methods Ninty-six Sprague-Daw ley ratswere random ly divided into normal group(n=32),model group(n=32)and treatment group (n=32).The sciatic nervewas transected and the epineurium was sutured in the latter two groups.The treatmentgroup was given Tuinamanipulation and treadm ill training once a day.Eight rats from each group were detected their sciatic nerve conduction velocity(NCV),the number of axonsand Schwann cells(SCs)two,three,four and eightweeksafter intervention.Results Compared with themodelgroup,the NCV accelerated in the treatmentgroup fourand eightweeksafter intervention(P<0.05);while the numberof axonswas significantly different two and fourweeks after intervention(P<0.05),and the numberof SCswas notvery differentbetween the treatmentgroup and themodel group after intervention(P>0.05).Conclusion Tuina combined with treadmill trainingmay promote the regeneration of peripheral nerve after injury in rats.
Tuina;treadmill;neuranagenesis;sciatic nerve;conduction velocity;rats
10.3969/j.issn.1006-9771.2016.11.007
R745.4
A
1006-9771(2016)11-1276-05
2016-04-06
2016-06-24)
1.国家自然科学基金面上项目(No.30973806;No.81373764);2.国家自然科学基金青年基金项目(No.81603713)。
1.上海中医药大学附属岳阳中西医结合医院推拿科,上海市200437;2.上海中医药大学康复医学院,上海市201203。作者简介:马书杰(1986-),女,汉族,河北邢台市人,博士,博士后,主要研究方向:传统康复促进周围神经再生及防治失神经骨骼肌萎缩的基础研究与临床应用。通讯作者:严隽陶,男,主任医师、教授,博士研究生导师。E-mail:doctoryjt@sohu.com。
