CH2=C(CH3)COOCH3+O3反应机理及主通道速率常数的理论研究
2016-12-01刘金花杨锐妮
王 睿,刘金花,杨锐妮,杨 鑫
(陕西理工学院化学与环境科学学院,陕西省催化基础与应用重点实验室,陕西汉中 723001)
CH2=C(CH3)COOCH3+O3反应机理及主通道速率常数的理论研究
王 睿,刘金花,杨锐妮,杨 鑫
(陕西理工学院化学与环境科学学院,陕西省催化基础与应用重点实验室,陕西汉中 723001)
采用CBS-QB3方法构建了CH2=C(CH3)COOCH3+O3反应体系的势能剖面,并对其反应机理及速率常数进行了研究.计算表明,标题反应首先经过渡态TSa生成一个稳定的五元环臭氧化物中间体IMa,然后中间体IMa按不同O—O键的断裂方式发生五元环裂解反应,分别生成产物P1(CH2OO+CH3OC(O)C(CH3)O)和P2(CH2O+CH3OC(O)C(CH3)OO).利用经典过渡态理论(TST)并结合Wigner矫正模型计算了200~1 200 K范围内标题反应的速率常数kTST/W.结果表明,294 K时,CH2=C(CH3)COOCH3+O3反应速率常数为4.76×10-18cm3·molecule-1·s-1,与Bernard等对类似反应所测的实验值十分吻合.
CH2=C(CH3)COOCH3;O3;CBS-QB3;反应机理;速率常数
大气中臭氧层能够吸收太阳光中波长306.3 nm以下的紫外线来保护地球上的生物免遭紫外线的伤害.因此,臭氧层的存在及其浓度变化对人类生存环境和全球气候变化有着不可估量的影响[1-2],同时也使得科学家们对臭氧相关反应并从中得出保护臭氧层的有效措施也越来越感兴趣[3-4].除自由基及活性小分子等物种与臭氧反应消耗大气中臭氧外[5-8],烯烃是对流层大气中最活泼的挥发性有机化合物之一,其对臭氧的损耗也不能忽视[9].因CH2=C(CH3)COOCH3含有双键和酯基官能团,使得它具有高度化学活性,主要用于生产其他材料的中间体.同时,甲基丙烯酸甲酯为无色易挥发液体[10],是挥发性有机化合物之一,其进入大气环境中会在极大程度上消耗臭氧,导致臭氧层对紫外线的吸收能力降低,从而在大气化学以及局部空气质量中有重要的作用[11].因此选取甲基丙烯酸甲酯与臭氧反应,对其结构、性质以及反应机理进行理论研究,给出确切的反应机理及速率常数,为进一步研究不饱和酸酯类化合物的大气反应提供了一定的理论依据.
在实验方面,很多科学家已经报道了关于烯酸酯类化合物的臭氧化反应.例如,在室温条件下,Grosjean等[12]测定了CH3COOCH=CH2,CH2=CHCOOCH3和CH3COOCH2CH2=CHCH2CH3等与O3反应的产物及产量.Bernard等[13]对CH2=C(CH3)COOCH3,CH2=CHCOOCH3和CH2=CHCOOCH2CH3的臭氧化产物及反应动力学性质进行了研究,已测得294 K,1.013×105Pa下CH2=C(CH3)COOCH3+O3反应速率常数为(6.7±0.9)×10-18cm3·molecule-1·s-1,并推测得到此类反应符合图1所示的Criegee机理.

图1 Criegee反应机理示意Fig 1The reaction mechanism of Criegee reaction
在理论研究方面,何茂霞等[14]采用CCSD(T)/6-31G(d)+FC//B3LYP/6-31+G(d,p)水平对H2C=CHC(O)CH2CH3+O3以及类似反应体系[15]的反应机理和速率常数进行了研究.计算结果表明,在294 K和1.013×105Pa条件下,H2C=CHC(O)CH2CH3臭氧化反应的速率常数为1.37×10-18cm3· molecule-1·s-1.此外,本课题组[1]采用G3B3方法对CH3CHC(CH3)COOCH3+ O3的反应机理和速率常数进行了研究.计算结果显示,294 K 时,该反应速率常数为7.55×10-18cm3·molecule-1· s-1.遗憾的是,有关CH2=C(CH3)COOCH3+ O3的反应机理及速率常数却未见报道.为了更精准的探讨此类反应体系的臭氧化反应机理和动力学性质,并为后续生成的Criegee自由基反应提供理论依据和指导.本文采用CBS-QB3方法对CH2=C(CH3)COOCH3+O3反应体系的反应机理及速率常数进行了理论报道.
1 计算方法
采用CBS-QB3[16]组合方法对CH2=C(CH3)COOCH3+O3反应中涉及到的各反应物、中间体、过渡态和产物的几何构型进行了全参数优化,并在相同水平上进行了内禀反应坐标(IRC)分析,证实了过渡态与反应物(前中间体)或产物(后中间体)的关联性.
应用VKLab程序包[17],采用传统过渡态理论(TST)并结合Wigner校正模型[18-20]计算了200~1 200 K温度范围内CH2=C(CH3)COOCH3+O3反应的速率常数kTST/W,其计算方法为
(1)

2 结果与讨论
图2绘出了CH2=C(CH3)COOCH3+O3反应在CBS-QB3水平下优化得到的反应物、中间体、过渡态和产物的结构参数及部分实验值.图2所示的O3和CH2O物种中的键长、键角与对应的实验值(括号内为实验值)十分吻合;此外标题反应是在基态单重态下进行,此时计算的各物种的自旋角动
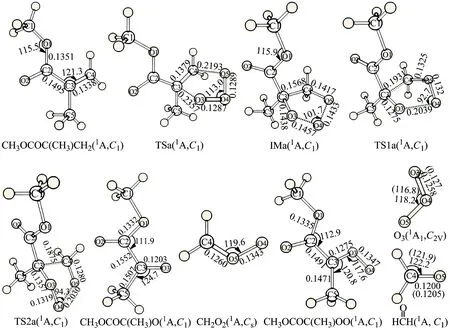
图2 CBS-QB3水平上优化所得的CH2=C(CH3)COOCH3+O3反应中反应物、 中间体、过渡态和产物的几何构型[键长(nm), 键角(°)]Fig 2 The geometrical structures of the optimized reactants,transition states,intermediates,products involving the CH2=C(CH3)COOCH3+O3 reaction at the CBS-QB3 level
量平方算符本征值〈S2〉为0.0000.说明波函数被自旋污染的程度并不严重,因此,〈S2〉可以忽略不计.说明选用CBS-QB3方法优化结构是合理的.图3为本文运用CBS-QB3方法构建的CH2=C(CH3)COOCH3+O3的势能剖面图.
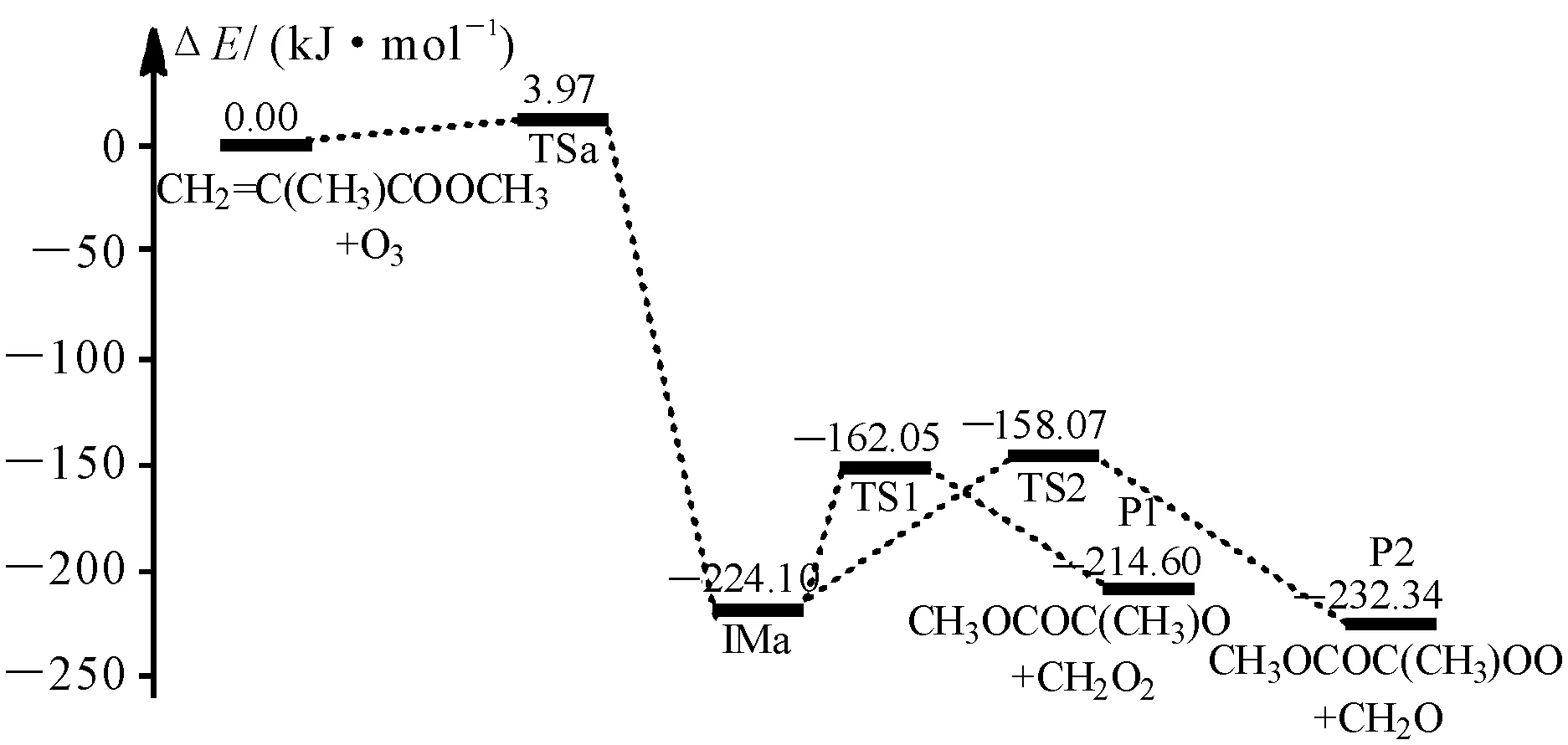
图3 CBS-QB3水平上CH2=C(CH3)COOCH3+O3反应的势能图Fig 3 Schematic energy diagram for the CH2=C(CH3)COOCH3+O3 reaction at the CBS-QB3 level
2.1 臭氧化反应机理
该反应符合Criegee反应机理[2-23].首先是臭氧的两个端位氧原子进攻CH2=C(CH3)COOCH3中的C=C双键进行环加成反应,然后经过渡态TSa形成五元环中间体IMa.因IMa中O-O键断裂方式不同,该中间体又按两条不同的路径进行后续反应.因此,本文将从臭氧化五元环中间体的形成以及裂解两部分来论述CH2=C(CH3)COOCH3+O3反应机理.
2.1.1 臭氧化五元环中间体的形成 在基态O3(1A1,C2v)分子[24]与CH2=C(CH3)COOCH3的反应中,本文以反应物(CH2=C(CH3)COOCH3+O3)的能量为反应零势能点.反应开始时,O3分子中的两个端位氧进攻CH2=C(CH3)COOCH3中C(3)=C(4)双键的两个碳原子发生五元环加成反应,越过能垒(TSa) 3.97 kJ·mol-1,形成稳定化能为224.10 kJ·mol-1的中间体IMa.在此过程中,O3中相邻氧原子间键长由0.125 8变为TSa中的0.128 9和0.128 7 nm,最终拉长到IMa中的0.143 3与0.145 7 nm,即在IMa中形成了典型的O—O单键.
在TSa中,O(4)原子和O(5)原子相距0.128 9 nm,十分接近反应物O3中的实验键长值(0.127 8 nm),为类反应物过渡态,由此认为该反应为强放热反应.C(3)=C(4)键长由CH2=C(CH3)COOCH3中的0.133 8 nm拉长到TSa中的0.137 9 nm,在IMa中其键长进一步拉长为0.156 8 nm,接近典型的C—C单键键长.IMa 中C(3)—O(3)和C(4)—O(5)键长分别由TSa中的0.235 7和0.219 3 nm缩短到0.143 8和0.141 7 nm,接近正常的C—O单键键长.臭氧化物IMa的生成,标志着偶极环加成过程的结束.
2.1.2 臭氧化五元环中间体的裂解 因断裂方式不同,IMa经过Path 1(IMa → TS1a → P1)和Path 2(IMa → TS2a → P2)分别生成产物P1(CH2OO+CH3OC(O)C(CH3)O)和P2(CH2O+CH3OC(O)C(CH3)OO).在Path 1中,IMa需克服62.05 kJ·mol-1的能垒(TS1a)形成产物P1((CH2OO+CH3OC(O)C(CH3)O).在过渡态TS1a的构型中,O(3)—O(4)和C(3)—C(4)键长值由IMa中的0.145 7和0.156 8 nm伸长到0.203 9和0.193 1 nm.同时,O(4)原子与O(5)原子互相靠近形成新键,键长缩短为0.132 2 nm.Path 2中的裂解需IMa克服66.03 kJ·mol-1的能垒越过五元环过渡态TS2a且TS2a中发生了与TS1a类似的构型变化.新生成O(3)—O(4)的键长为0.131 9 nm,C(3)—O(3)键长也较IMa缩短了0.008 1 nm,使得作用力增强;而O(4)—O(5)和C(3)—C(4)键同时拉长、逐渐断裂,形成产物P2(CH3OC(O)C(CH3)OO +CH2O),所克服的能垒比形成产物P1 (CH2OO+CH3OC(O)C(CH3)O)增加了3.98 kJ·mol-1.
2.2 臭氧化速率常数计算
由上述分析可知,CH2=C(CH3)COOCH3+O3反应符合Criegee反应机理.如图4所示,对于R+O3→IM,将该基元步的正、逆反应的速率常数记为k1和k-1,k2a和k2b分别为IM开始生成P1和P2的速率常数.所以,ka和kb分别为甲基丙烯酸甲酯的臭氧化反应从反应物开始分别生成P1和P2的速率常数.假设图4中所示的中间体IM与反应物处于动态平衡状态,根据复合反应的稳态近似条件,则ka和kb可由(2)式和(3)式得出

图4 CH2=C(CH3)COOCH3+O3反应通道示意Fig 4 The reaction channels of CH2=C(CH3)COOCH3+O3in rate constant calculations表1 200~1 200 K温度范围内CH2=C(CH3)COO-CH3+O3反应的速率常数信息(cm3·molecule-1·s-1)Tab 1 The predicted rate constant for the reaction of CH2=C(CH3)COOCH3+O3within the temperature range of 200~1 200 K

Tk1k-1k2ak2bkakbka/(ka+kb)kb/(ka+kb)2003.14×10-182.41×10-423.34×10-23.22×10-43.11×10-183.00×10-209.90×10-19.55×10-32253.50×10-183.56×10-361.34×1002.25×10-23.44×10-185.78×10-209.83×10-11.65×10-22363.67×10-187.18×10-345.35×1001.10×10-13.60×10-187.39×10-209.81×10-12.01×10-22503.91×10-183.15×10-312.63×1016.81×10-13.81×10-189.87×10-209.74×10-12.52×10-22754.37×10-183.57×10-273.06×1021.12×1014.22×10-181.54×10-199.66×10-13.52×10-22944.76×10-181.50×10-241.51×1036.87×1014.55×10-182.07×10-199.56×10-14.35×10-22984.85×10-184.87×10-242.05×1039.79×1014.63×10-182.21×10-199.55×10-14.56×10-23004.89×10-188.66×10-242.39×1031.16×1024.66×10-182.26×10-199.53×10-14.62×10-23095.09×10-181.05×10-224.63×1032.47×1024.83×10-182.58×10-199.49×10-15.07×10-23255.46×10-186.40×10-211.38×1048.49×1025.14×10-183.16×10-199.41×10-15.79×10-23506.09×10-181.86×10-186.20×1044.69×1035.66×10-184.28×10-199.29×10-17.03×10-23756.78×10-182.55×10-162.30×1052.07×1046.22×10-185.60×10-199.17×10-18.26×10-24208.19×10-184.15×10-131.66×1061.94×1057.33×10-188.57×10-198.95×10-11.05×10-15001.12×10-178.18×10-92.36×1073.94×1069.60×10-181.60×10-188.57×10-11.43×10-16001.62×10-174.82×10-52.45×1085.65×1071.32×10-173.04×10-188.15×10-11.88×10-18003.06×10-172.59×1004.67×1091.68×1092.25×10-178.10×10-187.35×10-12.65×10-19004.04×10-179.87×1011.25×10105.31×1092.84×10-171.20×10-177.03×10-12.97×10-110005.23×10-171.82×1032.77×10101.35×10103.52×10-171.71×10-176.73×10-13.27×10-112008.27×10-171.46×1059.15×10105.61×10105.13×10-173.14×10-176.20×10-13.80×10-1
(2)
(3)
表1列出了CH2=C(CH3)COOCH3+O3反应在200~1 200 K温度区间内计算的速率常数信息.由表1可知,随着温度的升高,ka和kb呈现正温度系数效应.在200~375 K温度范围内,ka的分支比始终处于绝对优势(大于90%),虽然kb的分支比也随着温度的升高而逐渐升高,当温度到达1 200 K时,kb分支比为38.0%,而ka仍占据62.0%.在294 K时,CH2=C(CH3)COOCH3+O3的反应速率常数为4.76×10-18cm3·molecule-1·s-1,与Bernard等该温度下测得的甲基丙烯酸甲酯臭氧化反应的速率常数的实验值((6.7±0.9)×10-18cm3·molecule-1·s-1)接近,这也间接说明本文的计算结果具有一定的可信度.
3 结论
采用CBS-QB3方法对CH2=C(CH3)COOCH3+O3反应机理以及200~1 200 K范围内的速率常数进行了理论研究,所得结论如下:
1)CH2=C(CH3)COOCH3+O3反应属于Criegee反应机理,臭氧进攻CH2=C(CH3)COOCH3中的C=C双键而发生偶极加成反应,该过程只需克服3.97 kJ·mol-1的能垒即可形成稳定的五元环中间体IMa.IMa发生五元环裂解反应,由于不同O—O键的断裂使得反应存在两条裂解路径分别形成产物P1(CH2OO+CH3OC(O)C(CH3)O)和P2(CH2O+CH3OC(O)C(CH3)OO).
2)294 K时,CH2=C(CH3)COOCH3+O3反应的总速率常数为4.76×10-18cm3·molecule-1·s-1,与Bernard等对类似反应的所测实验值非常接近.此外,速率常数计算支持P1(CH2OO+CH3OC(O)C(CH3)O)为CH2=C(CH3)COOCH3+O3反应的主产物.
[1] 张田雷,王渭娜,刘畅,等.反式2-甲基-2-丁烯酸甲酯与臭氧反应机理的计算研究[J].物理化学学报,2013,29(11):2313.
[2] 谢飞.平流层对流层物质交换以及平流层水汽与臭氧的研究[D].兰州:兰州大学,2011.
[3] GROSJEAN E,GROSJEAN D.The gas-phase reaction of alkenes with ozone:formation yields of carbonyls from biradicals in ozone-alkene-cyclohexane experiments[J].AtmosphericEnvironment,1998,32(20):3393.
[5] 李来才,邹勤,田安民.CH2X(X=H,F,Cl)与臭氧反应机理的量子化学研究[J].化学学报,2003,61(10):1524.
[6] 胡武洪,徐建华.O(3P)与CH2=CHF反应的理论研究[J].四川师范大学学报(自然科学版),2008,31(2):238.
[7] 王永成,戴国梁,耿志远,等.乙烯自由基与臭氧反应的DFT计算研究[J].物理化学学报,2004,20(9):1071.
[8] ATKINSON R,AREY J.Atmospheric degradation of volatile organic compounds[J].ChemicalReviews,2003,103(12):4605.
[9] 杨晓璐,陈建华,邓建国,等.烯烃臭氧化反应机制的研究进展[J].环境化学,2013,32(11).
[10] 梁西良,王素漪,徐虹,等.甲基丙烯酸甲酯合成及生产[J].化学与粘合,2005,27(1):57.
[11] COTTERS N.BOOTH N J,CANOSA-MAS C E,et al.Release of iodine in the atmospheric oxidation of alkyl iodides and the fates of iodinated alkoxy radicals[J].AtmosphericEnvironment,2001,35(12):2169.
[12] GROSJEAN E,GREEN P G,GROSJEAN D.Liquid chromatography analysis of carbonyl(2,4-dinitrophenyl) hydrazones with detection by diode array ultraviolet spectroscopy and by atmospheric pressure negative chemical ionization mass spectrometry[J].AnalyticalChemistry,1999,71(9):1851.
[13] BERNARD F,EYHLUNENT G,DAЁLE V.Kinetics and products of gas-phase reactions of ozone with methyl methacrylate,methyl acrylate,and ethyl acrylate[J].TheJournalofPhysicalChemistryA,2010,114(32):8376.
[14] HAN L,WANG P,DONG S.Progress in graphene-based photoactive nanocomposites as a promising class of photocatalyst[J].Nanoscale,2012,4(19):5814.[15] SUN Y,CAN H,HAN D.Reactions of N-butyl acrylate and ethyl methacrylate with ozone in the gas phase[J].ComputationalandTheoreticalChemistry,2014,1039(7):33.
[16] CASASNOVAS R,FRAU J,ORTEGA-CASTRO J,et al.Simplification of the CBS-QB3 method for predicting gas-phase deprotonation free energies[J].InternationalJournalofQuantumChemistry,2010,110(2):323.
[17] ZHANG S,TRUONG T N.VKLabVersion1.0[CP].Salt Lake City:University of Utah,2001.
[18] RESENDE S M,ORNELLAS F R.Atmospheric reaction between the HS radical and chlorine[J].ChemicalPhysicsLetters,2000,318(4):340.
[19] HERINDA-RAMN J M,KARLSTRM G.Study of the hydronium ion in water.A combined quantum chemical and statistical mmechanical treatment[J].JournalofMolecularStructure,2004,712(1):167.
[20] 司维江,禚淑萍,居冠之.NH+O3→ ONH+O2反应热力学和动力学研究[J].物理化学学报,2003,19(10):974.
[21] FRISCH M,TRUCKS G W,SCHLEGEL H B.et al.Gaussian09[CP].Revision A.02,Gaussian.Inc.,Wallingford,CT,2009.
[22] RESENDE S M,ORNELLAS F R.Mechanism and kinetics of the reaction between HS and Cl radicals[J].TheJournalofPhysicalChemistryA,2000,104(51):11934.
[23] 袁成,马嫣,陈敏东.烯烃气相臭氧化反应机理的研究进展[J].环境化学,2013,32(2):177.
[24] GERLT J A,KOZARICH J W,KENYON G L,et al.Electrophilic catalysis can explain the unexpected acidity of carbon acids in enzyme-catalyzed reactions[J].JournaloftheAmericanChemicalSociety,1991,113(25):9667.
(责任编辑 陆泉芳)
Computational study of the reaction mechanism and kinetics of CH2=C(CH3)COOCH3ozonolysis
WANG Rui, LIU Jin-hua, YANG Rui-ni,YANG Xin
(Shaanxi Province Key Laboratory of Catalytic Fundamental and Application,School of Chemical and Environment Science,Shaanxi University of Technology,Hanzhong 723001,Shaanxi,China)
The reaction mechanism and rate constant for the ozonolysis of CH2=C(CH3)COOCH3is investigated at the CBS-QB3 level.The calculated results show that the reaction of CH2=C(CH3)COOCH3and O3via a transition state TSa produce a stable five-membered ring ozonide intermidiate product IMa that can decompose readily to form P1(CH2OO+CH3OC(O)C(CH3)O)and P2(CH2O+CH3OC(O)C(CH3)OO) because it breaks different O—O bonds.The total rate constants(kTST/W) of the title reactions in the temperature range of 200~1 200 K are obtained by using the classical transition state theory (TST) with Wigner tunneling correction.The results show that the calculated rate constant is 4.76×10-18cm3·molecule-1·s-1at 294 K,which is in good agreement with Bernard’s experiment data for similar reactions.
CH2=C(CH3)COOCH3;O3;CBS-QB3;reaction mechanism;rate constant
10.16783/j.cnki.nwnuz.2016.01.013
2015-08-15;修改稿收到日期:2015-09-16
陕西理工学院科研计划资助项目(SLGQD13(2)-4);陕西理工学院大学生创新创业训练计划资助项目(UIRP15095)
王睿(1983—),女,甘肃酒泉人,讲师,博士.主要研究方向为理论与计算化学.
E-mail:wangrui830413@163.com
O 641.12
A
1001-988Ⅹ(2016)01-0057-05
