长程表面等离子体共振生物传感器的制备与应用
2016-12-01褚立强邹雪娜
褚立强,陶 顺,王 磊,邹雪娜
(天津科技大学化工与材料学院,天津 300457)
长程表面等离子体共振生物传感器的制备与应用
褚立强,陶 顺,王 磊,邹雪娜
(天津科技大学化工与材料学院,天津 300457)
长程表面等离子体共振(LRSPR)是超薄金属膜两侧的衰逝场发生耦合后所形成的一种新型表面光学现象.与传统的表面等离子体共振(cSPR)相比,LRSPR的表面衰逝场具有更强的表面电磁场强度、更长的表面传播距离以及更大的穿透深度.因此,基于 LRSPR现象的生物传感器被认为特别适合细胞或细菌等较大生物分子的检测及行为研究.为了更好地了解LRSPR生物传感器的最新研究进展,本文总结了LRSPR的光学原理、生物传感芯片的制备以及LRSPR传感器在生物检测领域的最新应用.
生物传感器;长程表面等离子体共振(LRSPR);氟碳薄膜;荧光光谱;拉曼光谱
生物传感器在临床诊断、生命科学研究、环境监测、食品与国防安全等诸多领域具有十分广泛的应用前景,因此生物传感器的研究与开发吸引了世界各国科学家的普遍关注.基于表面等离子体共振(SPR)现象的生物传感器具有无需标记、高灵敏、对样品无损伤、可在液体环境中动态实时检测等众多优势[1-2],从而成为过去30年中发展最快的一种光学生物传感技术,被广泛地应用于各种生物分子的原位实时检测[3-6].
近年来,随着对低浓度(<1,ng/mL)和低分子质量生物分子(MW<1,000)检测的需求不断扩大,人们开始探索各种方法提升传统表面等离子体共振(cSPR)传感器的检测灵敏度[7].尽管 cSPR已经被应用于细胞等生物大分子的研究,但是由于cSPR的衰逝场穿透深度(Lp)大概在 100~150,nm,仅仅能够检测到细胞的一小部分[8].针对 cSPR技术的上述两个局限,人们开始研究长程表面等离子体共振(LRSPR)生物传感器.与cSPR相比,LRSPR生物传感器是在高折射率棱镜和贵金属薄膜之间增加一定厚度的介电缓冲层,金属薄膜两侧的表面电磁场发生相互耦合,所形成的新衰逝场具有更强的表面电磁场强度、更长的表面传播距离和更大的穿透深度[9-11].因此,LRSPR生物传感器被认为特别适合于细胞或细菌等较大生物分子的检测及行为研究[12-14]. 此外,LRSPR表面衰逝场可以激发金属表面更广和更远范围内的荧光或拉曼信号分子[15-19],从而提高传统光学技术的检测灵敏度.
LRSPR光学现象在1969年Otto研究cSPR时就已经被讨论过[20],但是当时并没有提出这个概念.直到20世纪80年代初,Sarid和Quail等研究组才从理论和实验证实了 LRSPR的激发原理[21-23].2001年Nenninger等[24]利用LRSPR传感器检测溶液的折光指数,结果显示经过优化的 LRSPR传感器的检测灵敏度是cSPR的7倍,之后LRSPR作为传感器才开始受到关注.2005年 Wark等[25]首次报道了LRSPR显微成像技术用于生物小分子DNA的检测,其检测灵敏度与 cSPR相比可以提高 40%,.最近几年,LRSPR生物传感器被成功用于各种条件下细胞或细菌的行为研究,因此这种新型生物传感器开始获得越来越多的认可.为了更好地了解 LRSPR生物传感器技术,本文从 LRSPR的光学原理、生物传感芯片的制备以及其在生物检测领域的应用等几个方面述评该技术.
1 LRSPR原理
目前LRSPR生物传感器通常是基于Kretschmann构型,即利用高折射率棱镜在一定光波条件下激发LRSPR,因此本文主要介绍该种设计 LRSPR的物理原理.LRSPR是超薄贵金属膜两侧金属/介电质界面上的衰逝场发生耦合后所形成的一种新型表面光学现象.根据SPR物理理论,金属中的电子自由运动形成所谓的“电子气体”,受到表面限制形成电荷密度分布,被认为是一种“等离子体”.它们在电磁波的干扰下发生电荷密度振荡,具有电磁波的特性,被称为“表面等离子体共振(SPR)”.关于 cSPR的详细物理理论及应用,可阅读其他综述[2].
当采用较薄的金属膜并且金属膜两侧介电质的折光指数相同或接近时,金属膜两侧的 SPR衰逝场可以透过金属膜而发生耦合作用,进而形成一个新的表面增强电磁场,即所谓的LRSPR[26].如图1所示,cSPR中常用的金膜厚度为50,nm,而LRSPR中金膜的厚度多在 15~30,nm.根据传统的电磁学理论,LRSPR本质上是一种表面纵向(TM)电磁波,在金属/介电质界面上沿 x方向以衰减谐振波形式传播,在 z方向 LRSPR的电磁场强度呈指数衰减,即在 z方向形成衰逝场.衰逝场对于介电质的介电常数变化非常敏感,因此可以利用 LRSPR现象来检测金属表面的物质变化.
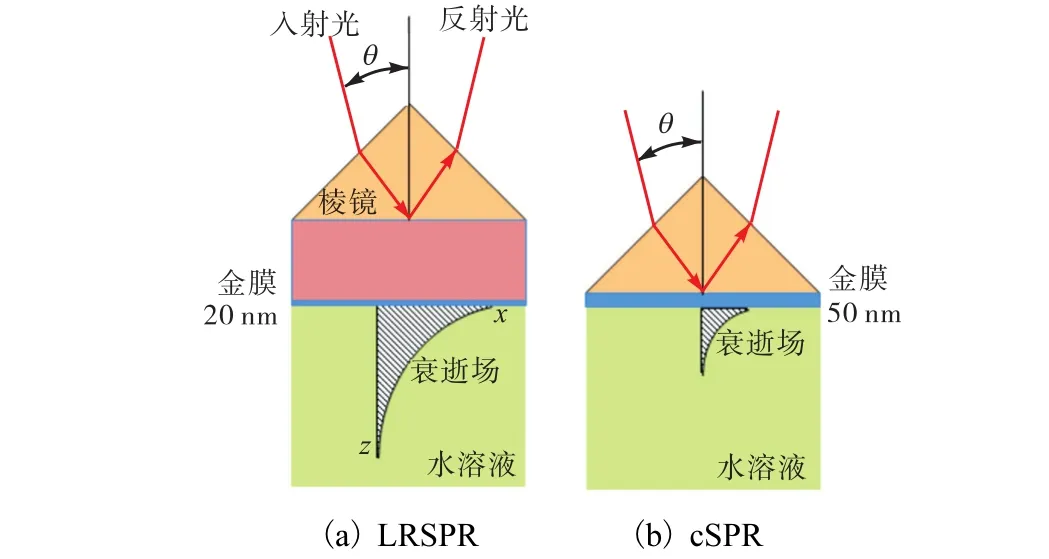
图1 LRSPR和 cSPR的芯片结构及表面衰逝场比较示意图Fig.1 Schematic comparison between LRSPR and cSPR in their chip structures and evanescent fields
理论模拟计算获得的两种不同介电缓冲层材料构建的 LRSPR与 cSPR表面电磁场强度分布如图2[27]所示.
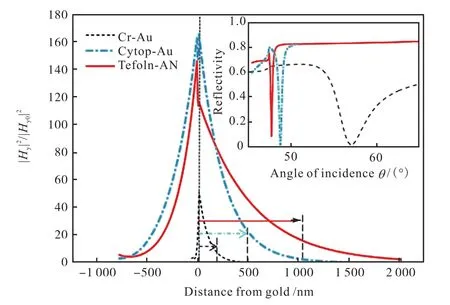
图2 理论模拟获得两种LRSPR和cSPR的表面电磁场强度分布比较图Fig.2 Comparison of the simulated electromagnetic field intensity profiles between two LRSPR chips and one cSPR
从图 2可以发现,LRSPR衰逝场的表面电磁场强度是入射光强度的约 150倍,即具有表面增强效应,可以用于增强拉曼或荧光等光学信号.另外,图2也显示 LRSPR衰逝场在介电质中的穿透深度 Lp在484~1,037,nm,远远大于cSPR的约150,nm穿透深度,所以 LRSPR可用于细胞等较大生物分子的检测.LRSPR的激发受入射光波长和入射角度、棱镜的折光指数、金属膜的厚度与折光指数、介电缓冲层的厚度与折光指数、芯片表面粗糙度等多因素的影响.
2 LRSPR芯片的制备
根据LRSPR的原理及图1所示,LRSPR芯片的主要组成部分包括介电缓冲层和金属薄膜.考虑到金属薄膜的稳定性和可修饰性,LRSPR芯片中最常用的是金膜(Au),最近也有报道用金-银双金属薄膜[28].金膜通常是通过热蒸镀法或磁控溅射法来沉积制备,金膜厚度可以通过沉积时间来控制.金膜厚度的细微误差对于LRSPR的激发及最终检测效果都至关重要.当金膜的厚度低于 20,nm时,由于金的吸收作用显著增强,所以并不适合于构建 LRSPR传感器[11].除了厚度,其表面粗糙度对最终 LRSPR传感器的性能也有一定影响[11,29].
构建LRSPR芯片的另一个关键是介电缓冲层的的制备.根据LRSPR的原理,介电缓冲层需要满足4个要求:①介电缓冲层与检测环境的折光指数尽量接近,这样才可以在金膜两侧形成对称环境.对于生物传感应用,分析物通常是水相样品,因此介电缓冲层的折光指数要接近于水(nw≈1.33);②介电缓冲层的厚度要可以调控,因为不同厚度的金膜需要采用不同厚度的介电缓冲层;③介电缓冲层与玻璃基底和金膜都要有很好的黏附性,保证芯片在液体环境中具有一定稳定性;④介电缓冲层要具有较低的表面粗糙度,避免表面粗糙造成的 LRSPR表面衰逝场的减弱.
考虑到对折光指数的特殊要求,可以用于LRSPR芯片制备的缓冲层材料多为含氟化合物或聚合物,包括氟化镁、共聚物 Teflon AF1600、聚合物Cytop、等离子体沉积氟碳薄膜ppPFOE等,这几种材料的基本特性列在表1中.氟化镁是LRSPR领域中使用时间最长的一种材料,可以通过热蒸镀法方便地控制膜厚度[30].氟化镁的折光指数 nd≈1.38,与水相比略高.氟化镁具有一定的毒性,并且在水中具有(极低)溶解性,因此限制了这种材料在生物传感器领域内的应用.

表1 LRSPR芯片中常用介电缓冲层材料的特性比较Tab.1 Comparison of various dielectric buffer materials used for the fabrication of LRSPR chips
Teflon AF1600是美国杜邦公司生产的一种可溶于特殊溶剂的含聚四氟乙烯共聚物[27],其折光指数nd≈1.31,比水的折光指数低.该材料可通过旋转涂层法来制备不同厚度的薄膜.由于其介电常数与水接近,因此所制备的 LRSPR芯片可以获得很高的表面电磁场强度和最大的穿透距离(见图 2)[11,27,23].不过,该材料的表面能低,造成其与玻璃基底和金膜之间的黏附性较差,所制备芯片存储一段时间后氟碳薄膜会从玻璃上脱离下来.为了提升Teflon AF1600与玻璃基底的黏附性,在旋涂前要先在玻璃基底上涂一层氟硅烷溶液,形成自组装层[31].另一方面,在沉积金膜之前,也需要对Teflon AF1600进行表面处理或者沉积另外一层高表面能薄膜[27].因此整个芯片制备过程非常繁琐且耗时长.
Cytop是日本Asahi公司提供的一种可溶性含氟聚合物,该聚合物与玻璃基底和金膜的黏附性要优于Teflon AF1600[27,29].另外,Cytop的折光指数 nd≈1.34,与细胞或细菌的折光指数接近(nc≈1.35~1.38)[8].因此,近年来在研究细胞行为时多采用Cytop材料构建 LRSPR芯片[11,25].Cytop和 Teflon AF1600 两种聚合物均要溶于特定的溶剂,通过调节溶液浓度和旋转涂层的速度来控制介电缓冲层膜厚.之后相应的溶剂必须采用热处理等技术去除.旋转涂层法制备薄膜的厚度并不能连续可调,另外该方法也不适合于大规模生产.
2015年,本课题组提出利用等离子体聚合法沉积ppPFOE氟碳薄膜来构建LRSPR芯片[32].以十七氟-1-癸烯为单体(PFOE),通过调节射频等离子体反应器的操作参数和沉积时间,直接在玻璃基底上沉积各种厚度的 ppPFOE薄膜.该薄膜的折光指数nd≈1.38,与传统的氟化镁基本一致.考虑等离子体聚合过程的特点,ppPFOE薄膜具有交联网络结构,与玻璃基底和金膜具有很好的黏附性,而且在水中和乙醇中都具有很好的稳定性.
图 3是本课题组利用光学波导谱(OWS)来检测1,678,nm厚 ppPFOE膜在水中时的厚度和折光指数变化[32].可以看出其折光指数 nd在 8,h内变化仅为0.000,9,而膜厚在8,h内的变化也仅为23.7,nm(即总膜厚度的1.4%,),基本保持稳定.利用ppPFOE膜来构建 LRSPR芯片过程步骤简单(见图 4),等离子体聚合操作容易,无需溶剂,膜厚容易控制,所构建芯片具有较好的检测效果.考虑该方法适合于大规模生产,因此该方法对于未来实现 LRSPR芯片的大规模制备及应用具有重要意义.
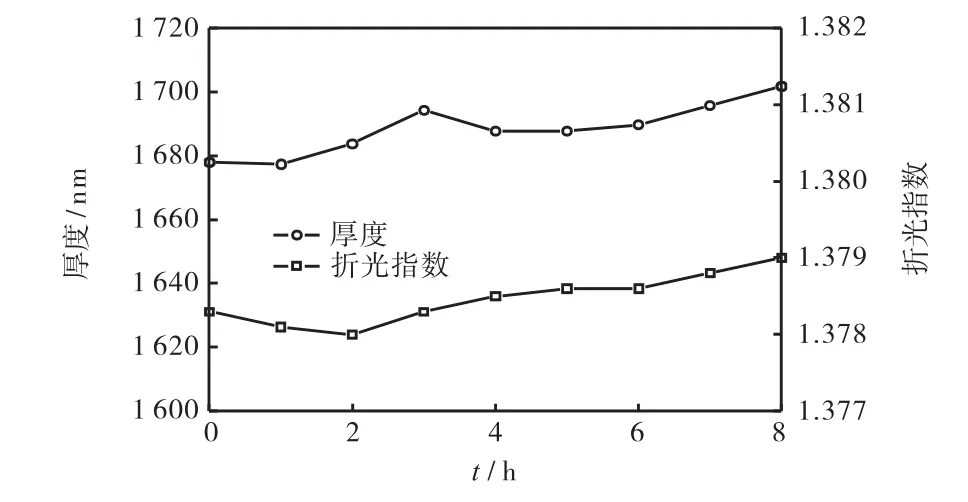
图3 OWS测试ppPFOE薄膜在水中的厚度和折光指数变化Fig.3 Evolution of the thickness and the refractive index of a ppPFOE film in water as measured using OWS

图4 等离子聚合沉积法制备LRSPR芯片的过程示意图Fig.4 Schematic representation of the preparation of LRSPR chip by using plasma polymerization technique
3 LRSPR生物传感器的应用
过去十多年中LRSPR生物传感器已经被用于检测各种生物分子,其中包括 DNA[25]、病毒[33-34]、细胞[35-36]、细菌等[37-38].与 cSPR类似,LRSPR生物传感器需要固定不同的生物分子识别体系(BIE),让待测样品流过传感器表面,若样品中有物质能够与芯片表面的 BIE发生特异性结合,就会引起反射光信号的变化[39].
Wong等[33]报道了利用LRSPR生物传感器来直接检测人体血液中的登革热病毒.他们比较了两种BIE固定方法对传感器检测性能的影响.结果表明LRSPR生物传感器完全可以实现对血液中的登革热病毒的有效检测.表面血浆固定法相比于传统的抗原固定法,减少了非特异性结合的发生,提高了检测仪器的灵敏度与准确度.前者所得实验结果可以和酶联免疫法(ELISA)所测实验结果相媲美,进一步印证了LRSPR传感器的可靠性。
2015年Beland等[14]利用LRSPR生物传感器对尿液中的致病菌进行检测.实验结果表明,该方法对革兰氏阴性菌和革兰氏阳性菌均具有良好的选择性,且浓度检测限可以低至1×105mL-1(国际认可的对尿路感染诊断的浓度阈值).Krupin等[35]利用LRSPR生物传感器检测人血液中红细胞.实验结果证明,经抗 A型血免疫球蛋白修饰的传感器表面,可以对 A型、AB型红细胞选择性识别,检测限可以低至 3×105mL-1.
B型淋巴细胞白血病的病人血清溶液中免疫 G蛋白的κ/λ 值会出现异常.如果能对血清中免疫G蛋白的κ/λ值进行检测,就可以实现B型淋巴细胞白血病的快速诊断.Krupin等[36]利用LRSPR生物传感器直接检测样品中免疫 G蛋白的κ/λ值.实验数据表明,在对High Lambda、High Kappa、Normal 3种类型血清溶液的检测中,反向法得到的κ/λ 值和目前医疗诊断时用的密度计法得到的值在趋势上保持一致,且在对High Lambda血清溶液的检测上,反向法得到的结果比密度计法所得结果值还要高.这说明 LRSPR生物传感器可以有效分辨 G蛋白成分的区别,并能快速得到样本中免疫G蛋白的κ/λ值.
细胞的形态变化反映着细胞的新陈代谢、内骨架重组、运动能力、浸润性等生物信息.LRSPR生物传感器的衰逝场具有较大的穿透深度,因此可以穿过细胞膜深入到细胞内,对细胞内高折射指数区域内的成分(如肌动蛋白纤维等)变化进行跟踪检测.Vala等[13]以 Cytop为介电缓冲层构建 LRSPR生物传感器,并将其用于实时监测鼠肾部上皮细胞在不同渗透压环境下的形态变化.实验结果表明,LRSPR传感器能够有效地反映出细胞体积的变化,并且比cSPR生物传感器的响应更快,强度更高,检测信号更准确.
2012年Chabot等[40]以Teflon AF1600为介电缓冲层构建LRSPR生物传感器,之后研究HEK-293细胞对不同浓度脂多糖(LPS)的毒性反应.结果表明其检测灵敏度比 cSPR要高 50%,.最近,Yang等[12]利用LRSPR生物传感器对纤维原细胞和人乳腺癌细胞的微移动进行监测.研究发现,LRSPR生物传感器对于由细胞的微移动导致的光学波动能够产生很强的检测信号,而cSPR生物传感器的检测信号在整个变化过程中始终很弱.
2014年 Mejard等[41]系统地比较了 LRSPR和cSPR两种生物传感器检测3T3小鼠成纤维细胞在表面的吸附和扩展过程.在不同细胞吸附密度时测量的cSPR和LRSPR谱图,以及不同密度下的细胞光学图片如图5[41]所示.,结果显示,尽管在这个研究中LRSPR与cSPR的灵敏度没有很大区别,但是LRSPR传感器的分辨率要高于cSPR.作者认为LRSPR可能更适合检测细胞内发生的变化.
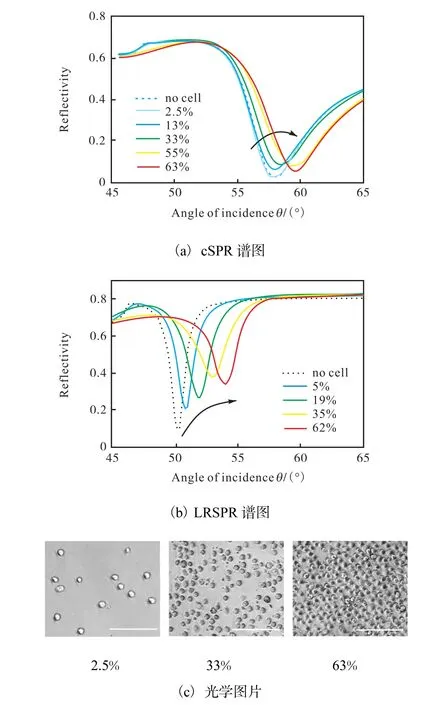
图5 不同密度3T3细胞条件下的cSPR和LRSPR谱图以及不同密度下光学图片Fig.5 Experimental spectra recorded for cSPR and LRSPR sensor at different cell coverage values and the optical micrographs at three different cell coverage of 3T3 cells
4 LRSPR增强荧光或拉曼光谱
LRSPR的表面增强电磁场可以激发其穿透深度内荧光或拉曼信号分子[42-43].2006年 Kasry等[42]发现在 LRSPR增强荧光生物传感器中,随着入射角的变化,荧光信号的强度也会相应改变,在共振角附近达到最大值.因此,可以通过反射性光谱调节荧光增强的最佳角度,然后以此角度进行相应的荧光检测. 2007年 Dostalek等[11]系统比较了 LRSPR和 cSPR两种传感器激发荧光分子的性能与荧光分子到金膜的距离之间的关系.当荧光分子距离金膜表面为460,nm时,LRSPR由于具有大的穿透深度,因此依然可以激发荧光信号.而 cSPR则不能有效激发荧光,这个结果表明 LRSPR增强荧光将获得更高的检测灵敏度.当荧光分子分布在 LRSPR衰逝场全部范围内时,LRSPR增强荧光的信号强度是cSPR的12倍.之后 Huang等[44]将水凝胶波导层(HOW)引入到LRSPR增强荧光传感器芯片上,以提高表面捕捉荧光信号分子的能力.图6[44]是Huang等设计芯片的结构示意图,利用LRSPR和HOW共同作用来提高荧光检测信号强度,对免疫球蛋白分子的检测极限可达到 20,fmol.

图6 LRSPR与HOW结合增强荧光检测芯片结构示意图Fig.6 Schematic representation of fluorescence detection chips through combining LRSPR and HOW
LRSPR增强荧光光谱也被应用于精液中的前列腺游离特异抗原[45]和牛奶中的黄曲霉毒素[19]的检测.前者的抗原识别采用夹心型模式[45],即先在芯片表面固定过量的抗体 Ab,然后加入一定量的未标记抗原 Ag,免疫反应后,再加入已标记荧光物质的抗体L-Ab.荧光强度越大表明抗原Ag的浓度越大.后者的抗原识别采用竞争型模式[19],即先在芯片表面固定一定浓度的抗体 Ab和标记抗原 L-Ag,随后被加入的未标记抗原Ag和标记抗原L-Ag竞争结合抗体 Ab.荧光强度越小表明未标记抗原 Ag的浓度越大.实验数据表明,该LRSPR增强荧光生物传感器对精液中前列腺游离特异抗原的检测限低至 34,fmol,对牛奶中黄曲霉毒素的检测限低至 1,pg/mL.相比于普通的荧光分析,检测限降低了至少三个数量级,且整个检测过程只需要不到1,h就能完成.Huang等[46]研究LRSPR增强荧光生物传感器对溶液中大肠杆菌的检测能力.结果表明,该传感器对于大肠杆菌的浓度变化非常灵敏,检测过程不超过 40,min,检测限低至10,mL-1.之后Huang等[16]还系统研究了溶液流动等对细菌检测的影响.
表面增强拉曼散射(SERS)经过40多年的发展,已经在材料分析、生物、医学、食品安全、环境监测和国家安全等领域获得了实际应用.SERS技术的主要优点包括无需标记,可直接获得化学结构信息,灵敏度高,不受水干扰等.2011年Liu等[17]首先报道了利用LRSPR表面衰逝场来增强SERS信号.他们以氟化镁为介电缓冲层制备了LRSPR芯片,检测4-巯基吡啶在银膜表面的拉曼光谱.由于 LRSPR具有更强的表面电磁场,信号是传统SPR增强拉曼散射的15倍以上.之后该研究组进一步在 LRSPR模式上引入了单层AgNPs[18],理论模拟显示在银膜与AgNPs之间将产生 2.1×104倍的电磁场增强,实验结果显示SERS信号提高了 40倍,这种条件下增强因子(EF)达到 9.2×108.该技术还允许通过调节入射光角度来调节衰逝场的穿透深度,进而调节被激发信号分子的范围[47].
5 结论与展望
LRSPR生物传感器的制备与应用是一个涉及生物、物理、化学、材料、医学等多学科交叉的研究领域.过去限制 LRSPR生物传感器发展的主要困难是制备过程繁琐及芯片稳定性低,因此人们对 LRSPR芯片的制备技术进行了不断的优化与完善.以Cytop为原料,通过旋转涂层法制备的 LRSPR芯片完全可以满足实验室研究的需要.最近,本课题组提出使用ppPFOE氟碳薄膜来构建芯片,尽管其折光指数偏高,但是可以实现大规模生产,相信可以促进本领域的发展.
经过20多年的研究,人们对于LRSPR芯片的结构与性能之间的关系已经有了一定的认识.其中最关键的一个问题是贵金属薄膜的制备.很多研究组(包括我们)都发现金膜厚度的细微变化对于LRSPR的谱图影响非常大,不同厚度金膜又需要用不同厚度的介电缓冲层与之匹配.目前常用的热蒸镀法和磁控溅射法制备金膜时对厚度的控制并不准确,因此未来还需要重点研究超薄金膜的制备技术.
近年来 LRSPR生物传感器在生物检测领域获得了越来越多的关注.尽管有些报道显示其灵敏度等要优于cSPR,不过也有些研究显示其优势并不明显.最新的研究报道显示,LRSPR生物传感器在研究细胞或细菌的动态行为时具有一定的优势,不仅可以实时监测细胞的吸附、分散、微移动和体积形态变化,而且可以跟踪细胞对外界刺激或物质的反应过程.LRSPR生物传感器穿透深度大,使其可能用于检测细胞间相互作用或细胞内部反应过程.
不过,当利用LRSPR生物传感器检测细胞的折光指数变化时,并不能区分细胞中不同成分的变化.将 LRSPR与荧光或拉曼光谱技术联用可以进一步增强灵敏性,而且可以通过标记分子或直接利用拉曼特征峰来区分细胞内不同成分.相信联用技术在未来会有更大的发展前景.到目前为止还没有将LRSPR和拉曼联用技术用于生物检测方面的报道,本课题组未来将尝试这方面的研究.
总之,关于LRSPR生物传感器的制备与应用研究才刚刚开始,对于LRSPR芯片的结构设计还需要优化和完善.相信随着LRSPR芯片制备技术、光学检测装置、数据模拟分析等方面的发展,LRSPR生物传感器在复杂样品实时监测、细胞功能调控、药物筛选等领域将获得越来越广泛的应用.
[1] Homola J. Surface plasmon resonance sensors for detection of chemical and biological species[J]. Chemical Reviews,2008,108(2):462-493.
[2] Knoll W. Interfaces and thin films as seen by bound electromagnetic waves[J]. Annual Review of Physical Chemistry,1998,49(1):569-638.
[3] Zeidan E,Kepley C L,Sayes C,et al. Surface plasmon resonance:A label-free tool for cellular analysis[J]. Nanomedicine,2015,10(11):1833-1846.
[4] Couture M,Zhao S S,Masson J F. Modern surfaceplasmon resonance for bioanalytics and biophysics[J]. Physical Chemistry Chemical Physics,2013,15(27):11190-11216.
[5] Šípová H,Homola J. Surface plasmon resonance sensing of nucleic acids:A review[J]. Analytica Chimica Acta,2013,773:9-23.
[6] Safina G. Application of surface plasmon resonance for the detection of carbohydrates,glycoconjugates,and measurement of the carbohydrate-specific interactions:A comparison with conventional analytical techniques. A critical review[J]. Analytica Chimica Acta,2012,712:9-29.
[7] Shalabney A,Abdulhalim I. Sensitivity-enhancement methods for surface plasmon sensors[J]. Laser & Photonics Reviews,2011,5(4):571-606.
[8] Méjard R,Griesser H J,Thierry B. Optical biosensing for label-free cellular studies[J]. TrAC Trends in Analytical Chemistry,2014,53:178-186.
[9] Isaacs S,Abdulhalim I. Long range surface plasmon resonance with ultra-high penetration depth for selfreferenced sensing and ultra-low detection limit using diverging beam approach[J]. Applied Physics Letters,2015,106(19):193701.
[10] Berini P. Long-range surface plasmon polaritons[J]. Advances in Optics and Photonics,2009,1(3):484-588.
[11] Dostalek J,Kasry A,Knoll W. Long range surface plasmons for observation of biomolecular binding events at metallic surfaces[J]. Plasmonics,2007,2(3):97-106.
[12] Yang C T,Méjard R,Griesser H J,et al. cellular micromotion monitored by long-range surface plasmon resonance with optical fluctuation analysis[J]. Analytical Chemistry,2015,87(3):1456-1461.
[13] Vala M,Robelek R,Bocková M,et al. Real-time labelfree monitoring of the cellular response to osmotic stress using conventional and long-range surface plasmons[J]. Biosensors and Bioelectronics,2013,40(1):417-421.
[14] Beland P,Krupin O,Berini P. Selective detection of bacteria in urine with a long-range surface plasmon waveguide biosensor[J]. Biomedical Optics Express,2015,6(8):2908-2922.
[15] Bauch M,Toma K,Toma M,et al. Plasmon-enhanced fluorescence biosensors:A review[J]. Plasmonics,2014,9(4):781-799.
[16] Huang C J,Knoll W,Sessitsch A,et al. SPR bacterial pathogen biosensor:The importance of fluidic conditions and probing depth[J]. Talanta,2014,122:166-171.
[17] Liu Y,Xu S,Xuyang X,et al. Long-range surface plasmon field-enhanced raman scattering spectroscopy based on evanescent field excitation[J]. The Journal of Physical Chemistry Letters,2011,2(17):2218-2222.
[18] Xuan X,Xu S,Liu Y,et al. A long-range surface plasmon resonance/probe/silver nanoparticle(LRSPR-PNP)nanoantenna configuration for surface-enhanced raman scattering[J]. The Journal of Physical Chemistry Letters,2012,3(19):2773-2778.
[19] Wang Y,Dostálek J,Knoll W. Long range surface plasmon-enhanced fluorescence spectroscopy for the detection of aflatoxin M1in milk[J]. Biosensors and Bioelectronics,2009,24(7):2264-2267.
[20] Otto A. Excitation by light of ω+and ω-surface plasma waves in thin metal layers[J]. Zeitschrift für Physik,1969,219(3):227-233.
[21] Sarid D. Long-range surface-plasma waves on very thin metal films[J]. Physical Review Letters,1981,47(26):1927-1930.
[22] Craig A E,Olson G A,Sarid D. Experimental observation of the long-range surface-plasmon polariton[J]. Optics Letters,1983,8(7):380-382.
[23] Quail J C,Rako J G,Simon H J. Long-range surfaceplasmon modes in silver and aluminum films[J]. Optics Letters,1983,8(7):377-379.
[24] Nenninger G G,Tobiška P,Homola J,et al. Long-range surface plasmons for high-resolution surface plasmon resonance sensors[J]. Sensors and Actuators B:Chemical,2001,74(1):145-151.
[25] Wark A W,Lee H J,Corn R M. Long-range surface plasmon resonance imaging for bioaffinity sensors[J]. Analytical Chemistry,2005,77(13):3904-3907.
[26] Kessler M A,Hall E A H. Multilayered structures exhibiting long-range surface exciton resonance[J]. Thin Solid Films,1996,272(1):161-169.
[27] Méjard R,Dostálek J,Huang C J,et al. Tuneable and robust long range surface plasmon resonance for biosensing applications[J]. Optical Materials,2013,35(12):2507-2513.
[28] Zekriti M,Nesterenko D V,Sekkat Z. Long-range surface plasmons supported by a bilayer metallic structure for sensing applications[J]. Applied Optics,2015,54(8):2151-2157.
[29] Huang C J,Dostalek J,Knoll W. Optimization of layerstructure supporting long range surface plasmons for surface plasmon-enhanced fluorescence spectroscopy biosensors[J]. Journal of Vacuum Science & Technology B,2010,28(1):66-72.
[30] Shi H,Liu Z,Wang X,et al. A symmetrical optical waveguide based surface plasmon resonance biosensing system[J]. Sensors and Actuators B:Chemical,2013,185:91-96.
[31] Slavík R,Homola J. Ultrahigh resolution long range surface plasmon-based sensor[J]. Sensors and Actuators B:Chemical,2007,123(1):10-12.
[32] Wang L,Liu X J,Hao J,et al. Long-range surface plasmon resonance sensors fabricated with plasma polymerized fluorocarbon thin films[J]. Sensors and Actuators B:Chemical,2015,215:368-372.
[33] Wong W R,Krupin O,Sekaran S D,et al. Serological diagnosis of dengue infection in blood plasma using longrange surface plasmon waveguides[J]. Analytical Chemistry,2014,86(3):1735-1743.
[34] Wong W R,Sekaran S D,Adikan F R M,et al. Detection of dengue NS1 antigen using long-range surface plasmon waveguides[J]. Biosensors and Bioelectronics,2016,78:132-139.
[35] Krupin O,Wang C,Berini P. Selective capture of human red blood cells based on blood group using long-range surface plasmon waveguides[J]. Biosensors and Bioelectronics,2014,53:117-122.
[36] Krupin O,Wang C,Berini P. Detection of leukemia markers using long-range surface plasmon waveguides functionalized with Protein G[J]. Lab on a Chip,2015,15(21):4156-4165.
[37] Vala M,Etheridge S,Roach J A,et al. Long-range surface plasmons for sensitive detection of bacterial analytes[J]. Sensors and Actuators B:Chemical,2009,139(1):59-63.
[38] 王慧,蒋冬梅,黄小林,等. 长程表面等离子体共振技术在检测大肠杆菌浓度中的应用研究[J]. 功能材料,2011,42(S5):817-820.
[39] Wijaya E,Lenaerts C,Maricot S,et al. Surface plasmon resonance-based biosensors:From the development of different SPR structures to novel surface functionalization strategies[J]. Current Opinion in Solid State and Materials Science,2011,15(5):208-224.
[40] Chabot V,Miron Y,Grandbois M,et al. Long range surface plasmon resonance for increased sensitivity in living cell biosensing through greater probing depth[J]. Sensors and Actuators B:Chemical,2012,174:94-101.
[41] Mejard R,Thierry B. Systematic study of the surface plasmon resonance signals generated by cells for sensors with different characteristic lengths[J]. PloS One,2014,9(10):e107978.
[42] Kasry A,Knoll W. Long range surface plasmon fluorescence spectroscopy[J]. Applied Physics Letters,2006,89(10):101106.
[43] Liu Y,Xu S,Tang B,et al. Note:Simultaneous measurement of surface plasmon resonance and surfaceenhanced Raman scattering[J]. Review of Scientific Instruments,2010,81(3):036105.
[44] Huang C J,Dostalek J,Knoll W. Long range surface plasmon and hydrogel optical waveguide field-enhanced fluorescence biosensor with 3D hydrogel binding matrix:On the role of diffusion mass transfer[J]. Biosensors and Bioelectronics,2010,26(4):1425-1431.
[45] Wang Y,Brunsen A,Jonas U,et al. Prostate specific antigen biosensor based on long range surface plasmonenhanced fluorescence spectroscopy and dextran hydrogel binding matrix[J]. Analytical Chemistry,2009,81(23):9625-9632.
[46] Huang C J,Dostalek J,Sessitsch A,et al. Long-range surface plasmon-enhanced fluorescence spectroscopy biosensor for ultrasensitive detection of E. coli O157:H7[J]. Analytical Chemistry,2011,83(3):674-677.
[47] Liu Y,Xu S,Li H,et al. Localized and propagating surface plasmon co-enhanced Raman spectroscopy based on evanescent field excitation[J]. Chemical Communications,2011,47(13):3784-3786.
责任编辑:周建军
Preparation and Applications of Long-range Surface Plasmon Resonance Biosensors
CHU Liqiang,TAO Shun,WANG Lei,ZOU Xuena
(College of Chemical Engineering and Materials Science,Tianjin University of Science & Technology,Tianjin 300457,China)
Long-range surface plasmon resonance(LRSPR)is a novel surface optical phenomenon by coupling the evanescent fields on the opposite interfaces of an ultrathin metallic film embedded between two dielectric layers with same/similar refractive indices.In contrast to conventional surface plasmon resonance(cSPR),LRSPR exhibits a stronger surface electromagnetic field,a longer propagation length,as well as a larger penetration depth.Consequently,LRSPR-based biosensors are believed to be particularly suitable for the detection of large biomolecules(e.g.,cells,bacteria,etc)and the real-time monitoring of cellular behavior.In order to better understand the state of the art in LRSPR biosensors,we herein summarize the physical principles behind the LRSPR,the fabrication of LRSPR chips and their biosensing applications.
biosensors;long-range surface plasmon resonance(LRSPR);fluorocarbon thin films;fluorescence spectroscopy;Raman spectroscopy
O657.3
A
1672-6510(2016)04-0001-08
10.13364/j.issn.1672-6510.20160105
2016-03-24;
2016-05-06
教育部新世纪优秀人才支持计划资助项目(NCET-12-1064)
褚立强(1974—),男,辽宁绥中人,教授,chuliqiang@tust.edu.cn.
