转Mz2NHX1基因拟南芥对盐胁迫的生理响应
2016-11-30王璐平张永利孙婷梅于梦楠秦家慧
王璐平+张永利+孙婷梅+于梦楠+秦家慧+李爱+彭立新
摘 要:为了探讨珠美海棠Na+/H+逆向转运蛋白基因Mz2NHX1在植物耐盐中的作用,以野生型拟南芥和转Mz2NHX1基因拟南芥为材料,研究不同盐浓度对转基因和野生型拟南芥种子萌发、植株耐盐性相关生理指标的影响。结果表明:在不同盐胁迫下,转基因拟南芥种子发芽率明显高于野生型。随着盐浓度的增加,野生型和转基因植株的电导率呈上升趋势;SOD活性呈先上升后下降趋势;POD活性、可溶性糖含量、脯氨酸含量在野生型植株中呈先上升后下降趋势,在转基因植株中呈不断升高的趋势。盐胁迫下,转基因植株的各项生理指标均优于野生型,表明Mz2NHX1基因的过量表达,提高了转基因拟南芥的耐盐性。
关键词:Mz2NHX1基因;拟南芥;盐胁迫;生理响应
中图分类号:Q945 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.11.001
Abstract: To study the role of Na+/H+ antiporter gene Mz2NHX1 of Malus zumi in plant salt resistance, wild type Arabidopsis thaliana and transgenic Mz2NHX1 Arabidopsis thaliana were used to study the effects of different salt concentrations on seed germination of transgenic and wild type Arabidopsis thaliana and the physiological characteristics of plant salt resistance. The results showed that the seed germination rate of transgenic Arabidopsis thaliana was significantly higher than that of wild type under different salt stress. With the increase of salt concentration, the conductivity of wild-type and transgenic plants showed an increasing trend; SOD activity increased first and then decreased; POD activity, soluble sugar content and proline content increased first and then decreased in wild-type plants , while they were in increasing trend in transgenic plants. The physiological characteristics of transgenic plants were better than that of wild type under salt stress, which indicated that over-expression of Mz2NHX1 gene enhanced the salt tolerance of transgenic Arabidopsis thaliana.
Key words: Mz2NHX1; Arabidopsis thaliana; salt stress; physiological response
土地盐渍化是一个世界性的环境问题,随着城市化的发展,可耕种土地在减少,设施农业的推广,使土壤盐渍化加重,严重地影响了农作物的生长和产量[1]。研究植物对盐胁迫的生理响应,对于分析植物耐盐机理,培育新的耐盐植物具有重要意义。
大多数双子叶植物对盐碱环境的适应通常有三种方式,即Na+的外排、Na+在细胞内的区隔化及拒绝对Na+的吸收,而前两种方式是由细胞内的Na+/H+逆向转运蛋白完成的。在植物细胞内有两类Na+/H+逆向转运蛋白基因,一类位于液泡膜,编码液泡膜Na+/H+逆向转运蛋白,另一类位于质膜,编码质膜Na+/H+逆向转运蛋白[2]。
2009年,孟晓烨[3]克隆得到了珠美海棠Na+/H+逆向转运蛋白基因的cDNA全序列,并将该基因命名为Mz2NHX1,序列分析初步表明其属于液泡膜Na+/H+逆向转运蛋白基因,证明了Mz2NHX1基因与珠美海棠的耐盐性有关。
拟南芥是研究有花植物遗传、发育、分子生物学的模式植物。将外源基因在拟南芥中过表达,是分析基因功能的手段之一。为了进一步分析Mz2NHX1基因的功能,张永利等[4]首次构建了珠美海棠的表达载体pRI201-AN-GUS-Mz2NHX1,并利用农杆菌介导法,将Mz2NHX1基因转化到拟南芥中,得到了转基因植株。
本研究在前人工作的基础上,对野生型和转Mz2NHX1基因拟南芥进行盐胁迫处理,观察其表型变化,并测定其耐盐相关生理生化指标,旨在进一步分析Mz2NHX1基因的功能,为培育耐盐果树砧木提供理论依据和基因资源。
1 材料和方法
1.1 材 料
野生型拟南芥(Arabidopsis thaliana L.)种子由天津农学院林学实验馈赠;转Mz2NHX1基因拟南芥种子由天津农学院果树重点实验室提供。
1.2 方 法
1.2.1 点种与发芽培养 灭菌前分别将NaCl添加至配制好的MS培养基中,使NaCl终浓度分别为0 (CK), 50, 100, 150, 200, 250 mmol·L-1 ,高压蒸汽灭菌( 121 ℃,20 min) 后分装到培养皿中。将拟南芥种子用1 mL的5%次氯酸钠溶液与1 μL TritonX-100混合,消毒10 min,期间不断振荡,5 000 r·min-1,离心1 min,吸除上清液,用超纯水清洗4次。于超净工作台上将种子均匀地点种在每个培养皿中,每皿点种野生型与转基因拟南芥种子各30粒,重复3皿,封口。4 ℃春化3 d后,将点好种的培养皿置于人工气候室中培养,培养条件为:16 h·d-1光照、8 h·d-1 黑暗,空气相对湿度保持在60%~70%、温度控制在22 ℃、光照为3 000 lx。记录并计算拟南芥种子在不同盐浓度培养基中的发芽数和发芽率。
发芽率(GP)=发芽终期(萌发第15天)正常发芽粒数/供试种子数×100%[5]
1.2.2 土壤培养 培养土按大汉土、蛭石2∶1混合,加超纯水搅拌均匀,在0.1 MPa,121 ℃条件下灭菌30 min。选择口径为7 cm的塑料花盆,装入等量培养土,将4 ℃春化3 d的野生型与转基因拟南芥种子分别点播到培养土中,每盆3~5粒。3周后,选择生长发育程度基本一致的植株分别用浓度为 0 (CK),100,150,200,250,300 mmol·L-1的NaCl溶液浇灌拟南芥幼苗,每盆浇100 mL NaCl溶液,共6个处理,每个处理5盆,重复3次。7 d后取各处理下生长的拟南芥叶片放入-20 ℃冰箱冷藏备用。
1.2.3 生理指标测定 采用浸泡法测定相对电导率[6];蒽酮法测定可溶性糖含量;氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性;愈创木酚显色法测定过氧化物酶(POD)的活性;酸性茚三酮法测定脯氨酸含量[7]。
利用SPSS统计软件(17.0版),平均值比较以LSD0. 05为标准,对获得的试验数据进行统计分析。
2 结果与分析
2.1 盐胁迫对转Mz2NHX1基因拟南芥种子发芽率的影响
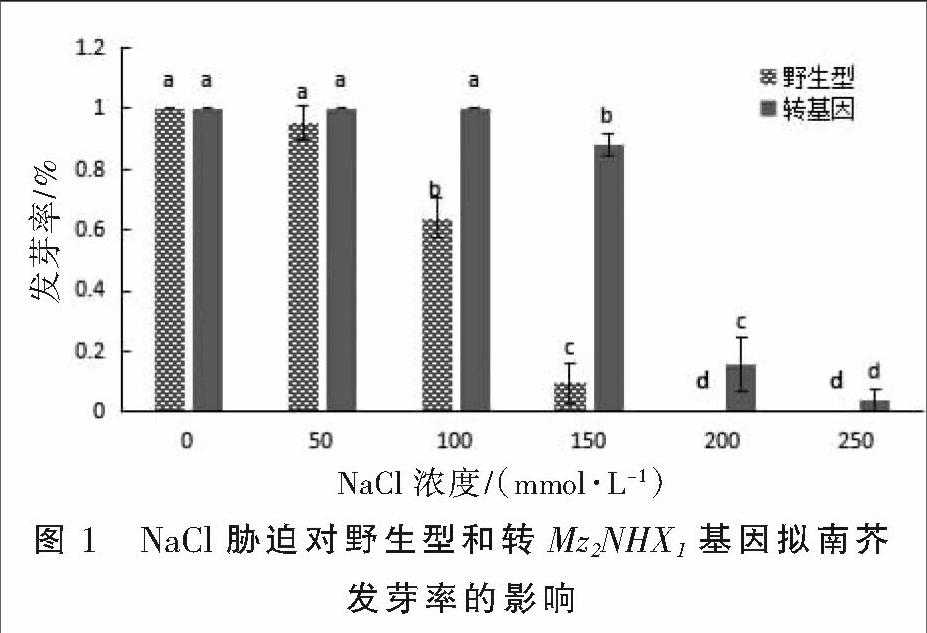
野生型和转基因拟南芥在不同盐浓度培养基上的发芽率见图1。从图1可以看出,在低盐浓度下,两种类型拟南芥发芽率与对照差异均不显著。当盐浓度为100 mmol·L-1时,野生型拟南芥种子发芽率为63.82%,转基因种子发芽率为100%。盐浓度为150 mmol·L-1时,转基因拟南芥种子发芽率为87.7%,而野生型仅9.6%。盐浓度达到250~300 mmol·L-1时,野生型拟南芥种子不再萌发,转基因拟南芥种子发芽率较对照也显著下降。结果表明,在一定的盐浓度下,Mz2NHX1基因的转入提高了转基因拟南芥种子的发芽率。
2.2 盐胁迫下转Mz2NHX1基因拟南芥电导率的变化
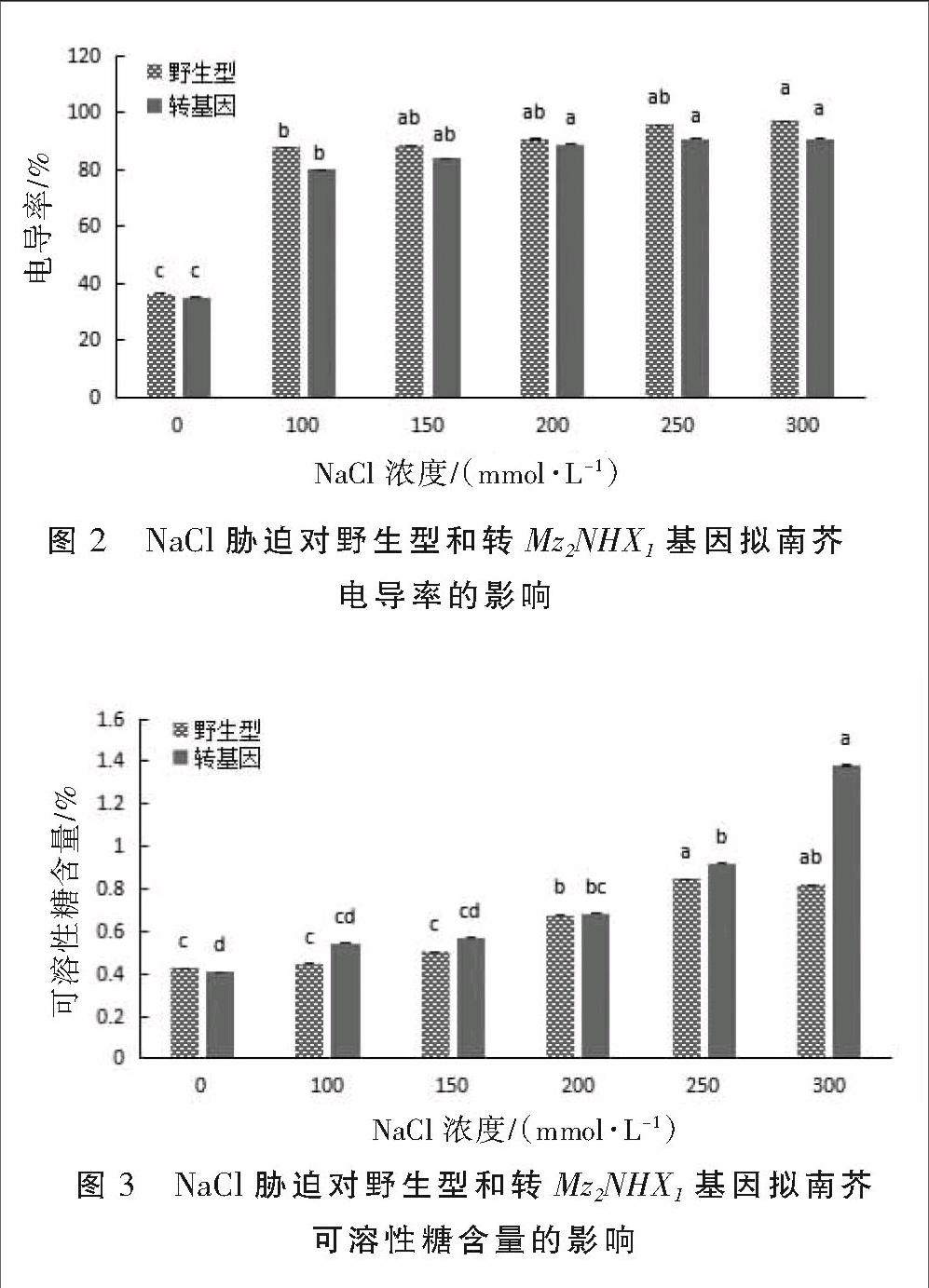
细胞膜透性的大小可以用相对电导率来表示,它可以反映植物细胞膜在逆境条件下的透性变化和细胞膜受损伤的程度[8]。野生型和转基因拟南芥在不同盐浓度处理下电导率变化见图2。从图2可以看出,随着NaCl浓度的增加,二者叶片的电导率均呈现升高趋势,与对照差异显著。在所有盐浓度下,转基因植株的电导率均低于野生型,反映了野生型拟南芥电解质外渗大于转基因拟南芥,质膜受损较重。表明转基因拟南芥的耐盐性在一定程度上优于野生型。
2.3 盐胁迫下转Mz2NHX1基因拟南芥可溶性糖含量的变化
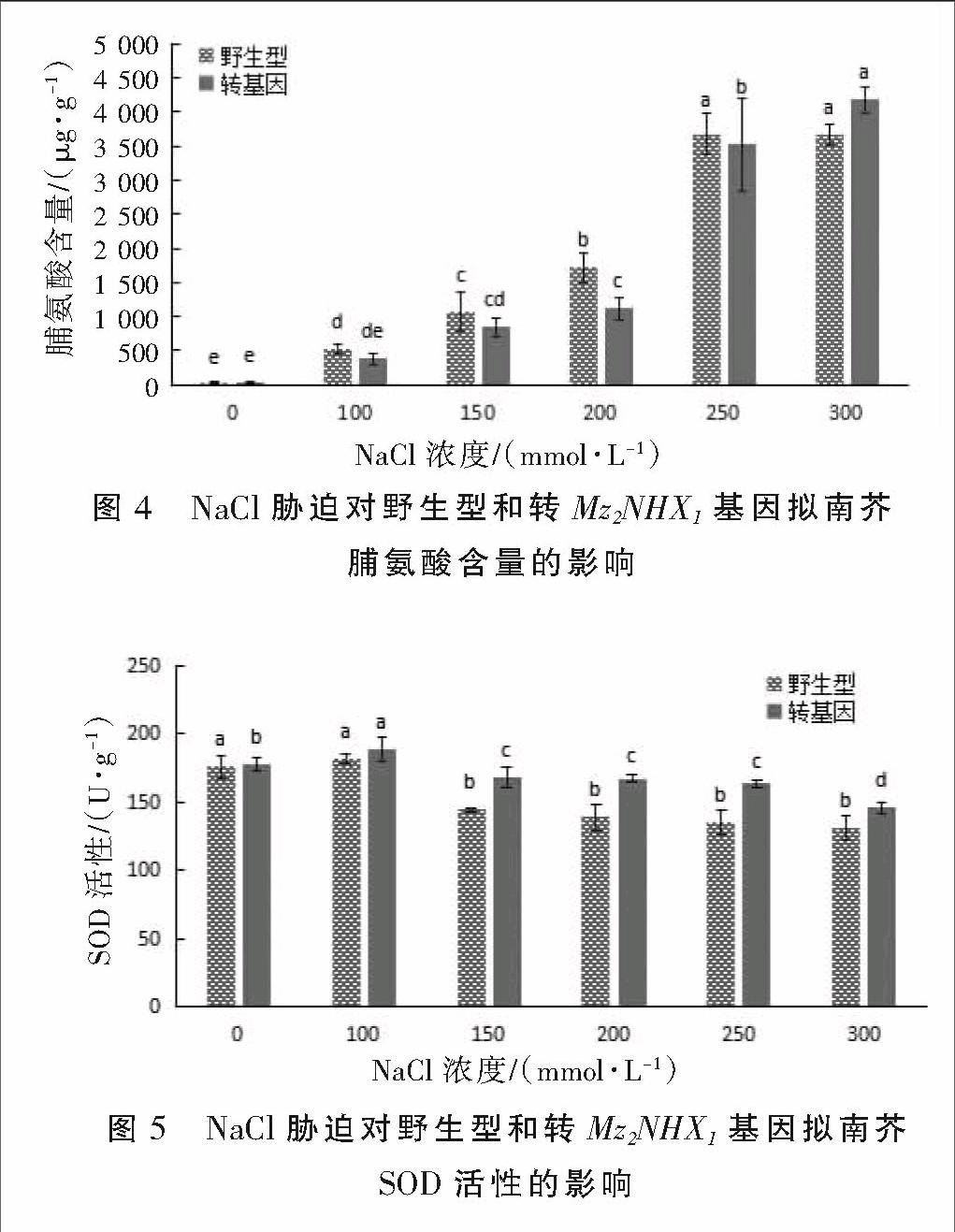
可溶性糖是逆境胁迫诱导产生量增加的小分子溶质之一。在盐胁迫下,可溶性糖含量发生一定变化,使植物能够保持正常生长[9]。野生型和转基因拟南芥在不同盐浓度处理下可溶性糖含量变化见图3。如图3所示,二者在100~150 mmol·L-1盐浓度下,可溶性糖含量均与对照差异不显著;在200~300 mmol·L-1盐浓度下,可溶性糖含量较对照显著升高。在不同盐浓度下,转基因拟南芥的可溶性糖含量均高于野生型,表明其渗透调节能力提高,转基因拟南芥的耐盐性高于野生型。
2.4 盐胁迫下转Mz2NHX1基因拟南芥脯氨酸含量的变化
植物在逆境下一般会积累一些渗透调节物质来维持渗透平衡。脯氨酸作为植物体内重要的渗透调节物质,它的积累可以稳定细胞结构,降低氧化损伤[10]。野生型和转基因拟南芥在不同盐浓度处理下脯氨酸含量变化见图4。从图4可以看出,在100~250 mmol·L-1盐浓度下,野生型拟南芥脯氨酸含量高于转基因植株。在300 mmol·L-1盐浓度下,野生型拟南芥脯氨酸含量稍有下降,而转基因植株脯氨酸含量随着盐浓度增加而升高,说明转基因拟南芥渗透调节能力有所提高,其耐盐性高于野生型。
2.5 盐胁迫下转Mz2NHX1基因拟南芥SOD活性的变化
SOD的作用是清除O2- 等活性氧,减轻其对膜的过氧化损伤。在盐胁迫下SOD活性增强,有助于清除过多的活性氧,保证植物正常的生理代谢活动[11]。野生型和转基因拟南芥在不同盐浓度处理下SOD活性变化见图5。如图5所示,盐浓度为100 mmol·L-1时,二者的SOD活性均达到最大值,转基因拟南芥SOD活性显著高于其他处理浓度。当盐浓度为150~300 mmol·L-1时,SOD活性均显著低于对照。不同盐浓度下,转基因拟南芥SOD活性均高于野生型拟南芥,说明转基因拟南芥抗氧化能力更强些。
2.6 盐胁迫下转Mz2NHX1基因拟南芥POD活性的变化
野生型和转基因拟南芥在不同盐浓度处理下POD活性变化见图6。如图6所示,低盐胁迫对二者POD活性影响不大,与对照间均没有显著差异。当盐浓度为200~300 mmol·L-1时,POD活性较对照均显著增强。盐胁迫为300 mmol·L-1时,野生型拟南芥POD活性下降,而转基因拟南芥POD活性显著上升,说明转基因拟南芥在一定程度上可以减轻活性氧对细胞膜的伤害,从而保护植物体不受伤害。
3 讨 论
过量表达液泡膜 Na+/H+逆向转运蛋白基因对提高植物的耐盐性起着非常重要的作用。植物通过液泡膜 Na+/ H+逆向转运蛋白实现Na+的区隔化入液泡, 维持了胞质内较低的Na+水平, 既减少其对细胞器的毒害,又降低了细胞的渗透势, 实现植物在盐胁迫环境下正常生长[12]。
盐胁迫会破坏种子内细胞膜的结构和功能,致使代谢紊乱,活力下降甚至不能萌发[13]。游朝等获得转MvNHX1基因的棉花,通过种子发芽率试验证实转MvNHX1基因棉花种子的发芽率较对照显著提高,显示出较强的耐盐性[14]。本研究中,转基因Mz2NHX1拟南芥种子发芽率在不同盐浓度下均明显高于野生型,可能是由于转入Mz2NHX1基因增加了Na+/H+逆向转运蛋白含量,将Na+区隔化入液泡中,降低了细胞质内Na+含量[15]。
在盐胁迫条件下,细胞质膜首先受到盐离子胁迫影响而产生胁变,导致质膜受伤。质膜胁变最明显的表现是质膜透性增加。电导率的大小能直接反映质膜受伤害的程度,即数值越大,质膜受到的伤害也越大[16]。本研究中,随着盐浓度的增加,转基因与野生型拟南芥的电导率均升高,但在不同盐浓度下转基因拟南芥的电导率均低于野生型,说明转基因拟南芥质膜受伤害的程度较小。
逆境胁迫下,植物细胞通过积累在渗透上有活性而对细胞无毒的有机物来进行渗透调节[17]。可溶性糖作为植物体内积累的主要渗透调节物质,对维持细胞的渗透平衡有重要作用。本研究中,随着盐浓度的增加,野生型拟南芥可溶性糖含量先升高,在盐浓度达到300 mmol·L-1后,由于盐胁迫超过其耐受极限,导致细胞受损严重,可溶性糖含量降低;转基因拟南芥可溶性糖含量一直呈上升趋势,说明转基因拟南芥渗透调节能力增强,从而提高了植株的耐盐能力。
脯氨酸是衡量植物抗逆性强弱的一个重要指标,但对于脯氨酸在盐胁迫中的作用,还一直存在争议。有研究者认为脯氨酸的积累是由于渗透胁迫引起的损伤,是逆境胁迫下造成伤害的病理结果[18-19]。但更多的研究结果表明脯氨酸的积累量与植物耐渗透胁迫的程度呈正相关,脯氨酸的积累是植物为了对抗盐胁迫而采取的一种保护性措施,可以平衡液泡中的高浓度盐分 ,避免细胞质脱水,保持膜结构的稳定性[20-21]。本研究中,100~250 mmol·L-1的盐浓度下,野生型拟南芥脯氨酸含量均高于转基因植株,在盐浓度达到300 mmol·L-1时,转基因拟南芥脯氨酸含量显著上升,含量高于野生型。分析原因,可能是由于野生型拟南芥对盐胁迫反应更为敏感,需要通过大量的脯氨酸积累来缓解因盐胁迫引起的自由基和过氧化物对植株的伤害。高盐浓度下野生型拟南芥脯氨酸含量下降,说明野生型拟南芥耐盐能力相对较弱,脯氨酸的渗透调节作用超过了阈值,渗透调节作用减弱。转基因拟南芥在盐浓度为250~300 mmol·L-1时,脯氨酸的鸟氨酸合成途径被激活,脯氨酸含量显著上升[22]。
盐胁迫等逆境条件下,植物体内活性氧代谢系统的平衡受到影响,产生较多的活性氧自由基,活性氧一方面攻击细胞膜,另一方面攻击核酸、蛋白质,造成植物细胞损伤。SOD和POD是防御活性氧及其他自由基对细胞膜系统伤害的保护酶。有报道表明SOD、POD活性随着盐浓度的增加呈单峰曲线变化趋势,活性先升高,后下降[23]。本研究中,SOD活性变化趋势与前人结果基本一致。随着盐处理浓度的提高(150~300 mmol·L-1)SOD活性呈下降趋势,这一现象可能与 H2O2积累过量反馈抑制SOD活性有关[24]。野生型拟南芥的POD活性先上升,在盐浓度为300 mmol·L-1时有所下降;转基因拟南芥则一直上升。探究原因,可能是由于逆境胁迫下,植物细胞所能承受的活性氧水平存在一个阈值,在此阈值内,植物可以提高抗氧化酶活性,来消除活性氧带来的伤害。超过这个阈值,抗氧化酶活性就会下降,过量的活性氧就会对植物细胞造成伤害。本研究中,野生型拟南芥SOD、POD活性变化趋势与转基因拟南芥基本相同,只是略低于后者,这可能是由于前者体内也存在Na+/H+逆向转运蛋白基因,转入Mz2NHX1基因后,该基因过量表达,使其保护酶活性提高。
综合本研究的各项结果,转Mz2NHX1基因拟南芥在种子发芽率以及幼苗生长中的各项生理指标均优于野生型拟南芥,证明Mz2NHX1基因的转入提高了转基因拟南芥的耐盐性,对该基因转入其他植物,完善植物耐盐体系具有参考依据。
参考文献:
[1]李建国,濮励杰,朱明,等.土壤盐渍化研究现状及未来研究热点[J].地理学报,2012,67(9):1233-1245.
[2]彭立新,王明启.渗透胁迫调节基因-Na+/H+Antiporter基因与植物耐盐性[J].天津农学院学报,2005,12(2):45-47.
[3]孟晓烨.盐胁迫下珠美海棠Na+/H+逆向转运蛋白基因(MzNHX1)的分离及表达特性研究[D].天津:天津农学院, 2010.
[4]张永利,孟晓烨,孙婷梅,等.珠美海棠Mz2NHX1基因的克隆和序列分析[J].江苏农业科学,2015,43(9):20-25.
[5]鲁红侠,杨艳,朱小茜.NaCl胁迫对拟南芥种子萌发与幼苗生长的影响[J].安徽农业科学,2013,41(8):3331-3333.
[6]陈爱葵,韩瑞宏,李东洋,等.植物叶片相对电导率测定方法比较研究[J].广东教育学院学报,2010,30(5):88-91.
[7]张治安,张美善,蔚荣海.植物生理学实验指导[M].北京:中国农业科学技术出版社,2004.
[8]孙海菁,王树凤,陈益泰.盐胁迫对6个树种的生长及生理指标的影响[J].林业科学研究,2009,22(3):315-324.
[9]田晓艳,刘延吉,郭迎春.盐胁迫对NHC牧草Na+、K+、Pro、可溶性糖及可溶性蛋白的影响[J].草业科学,2008,25(10):34-38.
[10]张腾国,寇明刚,王圆圆,等.盐胁迫对两种油菜叶片生理指标的影响[J].西北师范大学学报(自然科学版),2014,50(5):85-90.
[11]王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
[12]许祥明,叶和春,李国凤.植物抗盐机理的研究进展[J].应用与环境生物学报,2000,6(4):379-387.
[13]贺军民,佘小平,张键.番茄种子吸湿—回干处理对盐胁迫伤害的缓解效应[J].园艺学报,2000,27(2):123-126.
[14]游朝,晁朝霞,姚正培,等.转MvNHX1和MvP5CS基因棉花耐盐抗旱性比较与育种价值分析[J].棉花学报,2015,27(3):198-207.
[15]郑琳琳,张慧荣,贺龙梅,等.唐古特白刺质膜Na+/H+逆向转运蛋白基因的克隆与表达分析[J].草业学报,2013,22(4):179-186.
[16]李彦,张英鹏,孙明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展[J].中国农学通报,2008,24(1):258-265.
[17]陈洁,林栖凤.植物耐盐生理及耐盐机理研究进展[J].海南大学学报(自然科学版),2003,21(2):177-182.
[18]HARO R, BANEULOS M A, QUINTERO F J, et al . Genetic basis of sodium exclusion and sodium tolerance in yeast. A model for plants[J].Physiologia plantarum,2006, 89(4): 868-874
[19]DEMIRAL T, RKAN T. Comparative lipid peroxidation, antioxidant defense systems and proline content in roots of two rice cultivars differing in salt tolerance[J].Environmental and experimental botany,2005,53(3):247-257.
[20]SANADA Y, KURIBAYASHI K, ANDOH T,et al .Novel light-dark change of proline levels in halophyte(Mesembryanthemum crystallinum L.)and glycophytes(Hordeum vulgare L.and Triticum aestivum L. )leaves and roots under salt stress[J].Plant &cell physiology,1995, 36(6): 965-970.
[21]SANTA-CRUZ A,ACOSTA M,RUS A,et al.Short-term salt tolerance mechanisms in differentially salt tolerant tomato species[J].Plant physiology & biochemistry,1999,37(1):65-71.
[22]彭志红,彭克勤,胡家金,等.渗透胁迫下植物脯氨酸积累的研究进展[J].中国农学通报,2002,18(4):80-83.
[23]彭立新,周黎君,冯涛,等.盐胁迫对沙枣幼苗抗氧化酶活性和膜脂过氧化的影响[J].天津农学院学报,2009,16(4):1-4.
