体外高通量评价过敏反应模型的建立及其对潜在过敏原异莲心碱的评价研究
2016-11-30王莉刘青王石峰俞洋洋孙圣楠蒋俊史新元栗世铀
王莉 刘青 王石峰 俞洋洋 孙圣楠 蒋俊 史新元 栗世铀
摘要:目的 建立体外高通量评价过敏反应模型,并对中药单体化合物进行筛选,从而确定其中的潜在过敏原。方法 建立稳定表达MrgX2的高通量药物筛选细胞模型。首先将重组质粒pmCherry-C1-MrgX2转染人胚肾HEK293细胞,通过G418筛选建立稳定表达人MrgX2的细胞株;再通过MrgX2特异性激动剂C48/80和拮抗剂2-APB检测细胞株的功能和稳定性,以Z因子确认高通量体系的稳定性和可靠性。采用上述模型对180个单体化合物进行筛选,以EC50、IC50、特异性及毒性确定该激动剂的功能性。结果 MrgX2细胞模型对特异性激动剂C48/80和特异性拮抗剂2-APB的EC50和IC50分别为2.7 ?g/mL和46.29 ?mol/L,MrgX2细胞模型第1代和第20代对激动剂的反应基本一致,该模型Z因子为0.78。筛选得到异莲心碱为阳性激动剂,其功能验证结果为:EC50为4.5 ?mol/L、IC50为39.47 ?mol/L,只能特异性激动MrgX2受体,且无细胞毒性。结论 采用钙流方法可成功构建基于过表达细胞系HEK293/MrgX2的体外高通量评价过敏反应模型,并且初步确定异莲心碱为潜在引发过敏反应的过敏原。
关键词:MrgX2;过敏反应评价方法;高通量;钙流检测;异莲心碱
DOI:10.3969/j.issn.1005-5304.2016.11.013
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)11-0051-06
Abstract: Objective To establish a high-throughput evaluation model for anaphylactic reactions; To screen and identify potential anaphylactogens from TCM monomeric compounds. Methods Cell model of stably expressed MrgX2 was established. Recombinate plasmid pmCherry-C1-MrgX2 was transfected to HEK293 to establish cell line for screening model. MrgX2 agonist and antagonist were used to identify the validation and stability of the cell line. A small library consisting of 180 compounds was profiled by using a cell-based calcium mobilization assay to find novel compounds targeting the MrgX2 receptor. EC50 test, IC50 test, specificity validation and cytotoxicity evaluation were carried out to detect the function of the positive agonist. Results The EC50 of C48/80 to MrgX2 model was 2.7 ?g/mL and the IC50 of 2-APB (evoked by 10 ?g/mL C48/80) was 46.29 ?mol/L. The first generation cell model of MrgX2 was similar to the 20th generation, and the Z factor of MrgX2 cell model was 0.78. In the primary screening for agonist, isoliensinine was identified as a novel agonist targeting receptor MrgX2 with an EC50 of 4.5 ?mol/L and IC50 of 39.47 ?mol/L. Moreover, isoliensinine was validated to activate MrgX2 receptor specifically without cytotoxicity. Conclusion A high-throughput evaluation method for anaphylactic reactions can be established in vitro through calcium mobilization assay. A potential anaphylactogen isoliensinine is identified and validated.
Key words: MrgX2; evaluation method for anaphylactic reactions; high throughput; calcium mobilization assay; isoliensinine
随着中药临床应用的日益增长,中药安全性“事件”时有发生[1],尤其中药注射剂的临床安全性问题倍受关注[2]。目前过敏反应评价方法分为体内法和体外法。体内法存在主观性强、周期偏长、不适合大规模药物筛选等缺点[3];体外法通常具有假阳性率高、人鼠种群的差异性等缺点[4]。因此,建立一种快速、准确的过敏反应检测方法势在必行。研究表明,MrgX2受体在过敏和慢性炎症中发挥着重要作用[5]。约翰霍普金斯大学研究人员确定MrgX2受体将是解决药物过敏反应的极其重要的靶点[6]。本研究建立基于过表达MrgX2的重组细胞系钙流高通量筛选方法,并应用所建模型对180个中药化合物进行筛选,以期对潜在致敏物质进行早期预测。
1 实验材料
1.1 药物与试剂
重组质粒pmCherry-C1-MrgX2,Genewiz;人胚肾HEK-293细胞,中国科学院精准基因组医学重点实验室;二甲基亚砜(DMSO)培养基和胎牛血清(FBS),Gibco BRL;ATP、G418、C48/80、Probenecid、acid red 1、2-氨基乙氧基联苯硼酸盐(2-APB)及DMEM,Sigma-Aldrich;Matrigel基质,Becton Dickinson;钙离子指示剂Fluo-4/AM,Molecular Probes;96孔黑壁透明底板,Costar;180个中药单体化合物(纯度>98%),中国科学院精准基因组医学重点实验室;CellTiter-Glo?发光法细胞活力检测试剂盒,Promega。
1.2 仪器
FLEX Station Ⅱ荧光成像分析系统,Molecular Devices。
2 实验方法
2.1 稳定细胞系的构建
HEK293细胞于37 ℃、5%CO2孵箱中培养至状态良好,将构建的含有抗性标记的MrgX2真核表达质粒pmCherry-C1-MrgX2转染入HEK293细胞。转染24 h后,将细胞以1∶30、1∶40和1∶50比例稀释并传代至6 cm培养皿,培养约2~3 d,待细胞状态稳定后,加入终浓度为800 ?g/mL选择培养基进行筛选。约2周后,直至未转入质粒的HEK293细胞全部死亡,进行单克隆细胞系的挑选并进行扩大培养。随后,通过检测单克隆细胞对MrgX2特异性激动剂C48/80的钙流信号进行阳性单克隆的筛选,再转入400 ?g/mL G418培养液扩大培养,进行下一步研究。
2.2 钙流检测方法
HEK293/MrgX2(P6-P8)以36 000/孔密度接种于Matrigel包被的96孔黑壁透明底板,置于37 ℃孵箱中培养过夜。测试前移除培养基,每孔加100 ?L loading buffer(含4 ?mol/L Fluo-4/AM和2.5 mmol/L probenecid的HBSS)。细胞置于5%CO2、37 ℃培养30 min。通过钙离子指示剂Fluo-4/AM进行钙流检测,FLEX Station荧光成像分析系统获得数据(λexcitation=485 nm,λemission=525 nm)。于化合物板中配制5×测试浓度的激动剂,通过机器加样,瞬时钙流信号被FLEX Station荧光成像分析系统捕获,采集数据直至80 s。抑制剂检测采用二次加样方式,在进行钙流荧光检测前10 min中加入拮抗剂(5×待测浓度),避光孵育10 min后开始检测,激动剂采用机器加样,并采集数据至80 s。为评价高通量筛选体系的稳定性和可靠性,需进行Z因子检测,阳性对照(40 ?g/mL C48/80)与阴性对照(0.25%DMSO)在同一96孔板中进行钙流检测。在进行细胞系稳定性的验证时,每隔5代进行激动剂C48/80对HEK293/MrgX2激动作用的剂量依赖曲线,并比较EC50的差异性。在进行激动剂的初筛时,与阳性对照C48/80比较,激动效应超过50%才被初步认定为阳性激动剂。在进行阳性激动剂EC50与IC50的检测时,所有浓度均进行复孔检测。
2.3 化合物准备
用DMSO将中药化合物溶解,并以36 mmol/L浓度保存。初筛前,用DMSO将化合物从36 mmol/L稀释至4 mmol/L,拮抗剂2-APB也以4 mmol/L浓度进行短暂保存。初筛时,将化合物用HBSS稀释400倍至终浓度10 ?mol/L(DMSO终浓度为0.25%),阳性对照为10 ?g/mL C48/80(HBSS稀释),阴性对照为0.25%DMSO。在本实验室已经进行对包括G蛋白偶联受体(GPCR)在内的药物靶体所进行的筛选中,均从这个天然产物库中找到了先导化合物,充分证明了其可用性与多样性[7-8]。
2.4 特异性及受体选择性
为了检测阳性激动剂能否使HEK293细胞系产生钙流信号值,HEK293被一系列不同浓度的阳性化合物刺激,同时,5 ?mol/L ATP和0.25%DMSO分别用作阳性对照和阴性对照,按照钙流实验中激动剂的检测方法进行检测。
稳定表达TRPA1、TRPV1、TRPV2、TRPV3、T2R以及ETB受体的重组细胞系由中国科学院北京基因组研究所提供。这些细胞系已经过已知激动剂和拮抗剂的验证,确保其功能性和检测体系的可靠性。这些重组细胞系以36 000/孔密度铺于matrigel包被的96孔黑色透明板,置于5%CO2、37 ℃孵箱中培养过夜,应用钙流检测方法来检测阳性化合物对这些受体的激动作用,阳性化合物终浓度为10 ?mol/L。HEK293细胞组作为空白对照。
2.5 毒性检测
应用荧光素酶耦合检测方法检测阳性化合物异莲心碱的毒性。HEK293/MrgX2以1000/孔密度接种于96孔板,5%CO2、37 ℃孵箱中过夜培养。第2日,每孔移除20 ?L培养基,并加入不同浓度的化合物(浓度梯度与测定EC50时相同),5%CO2、37 ℃孵箱中孵育2 h,CellTiter-Glo试剂孵育10 min,随后用Envision2100进行细胞活力的检测。0.25%DMSO作为阴性对照。
3 统计学方法
钙流结果转化为相对荧光单位(RFU),RFU最大值用于绘制剂量依赖曲线,EC50、IC50、Z因子由GraphPad Prism软件获得。所有数据均为3个独立实验结果的平均值,不同组间比较采用单因素方差分析进行。P<0.05表示差异有统计学意义。
4 结果
4.1 体外高通量评价过敏反应模型构建
4.1.1 稳定细胞系的构建 将构建的带有红色荧光标签的重组质粒pmCherry-C1-MrgX2转染HEK-293 细胞,经G418筛选后共获得46个单细胞克隆。用10 ?g/mL阳性激动剂进行刺激,通过钙流方法检测激活钙流信号强弱挑选MrgX2高表达克隆,共挑选得到16株阳性单克隆细胞系。最终挑选信号值最稳定、最强的6号单克隆作为高通量筛选的稳定细胞系,命名为HEK293/MrgX2,转入400 ?g/mL G418进行后续研究。
4.1.2 细胞系功能性与稳定性验证 为了应用HEK/MrgX2重组过表达细胞系进行MrgX2受体激动剂的筛选,首先应通过阳性激动剂C48/80以及拮抗剂2-APB进行细胞系功能性和实用性验证。由图1A可知,C48/80对细胞系具有明显的激动作用且表现出明显的剂量依赖效应,EC50为2.7 ?g/mL,2-APB是 MrgX2的抑制剂,可阻断其通道的功能,抑制钙离子的通过。由图1B可知,其对由C48/80引起的钙流信号具有明显的抑制作用且IC50为46.29 ?mol/L,结果与文献报道基本一致[6,9]。随后,为检测重组细胞系HEK293/MrgX2的稳定性,将HEK293/MrgX2细胞培养至25代以上,并且同时检测C48/80在P0、P10、P20代HEK293/MrgX2细胞的激动作用并计算EC50,由图1C可知,得到的EC50值无明显变化。
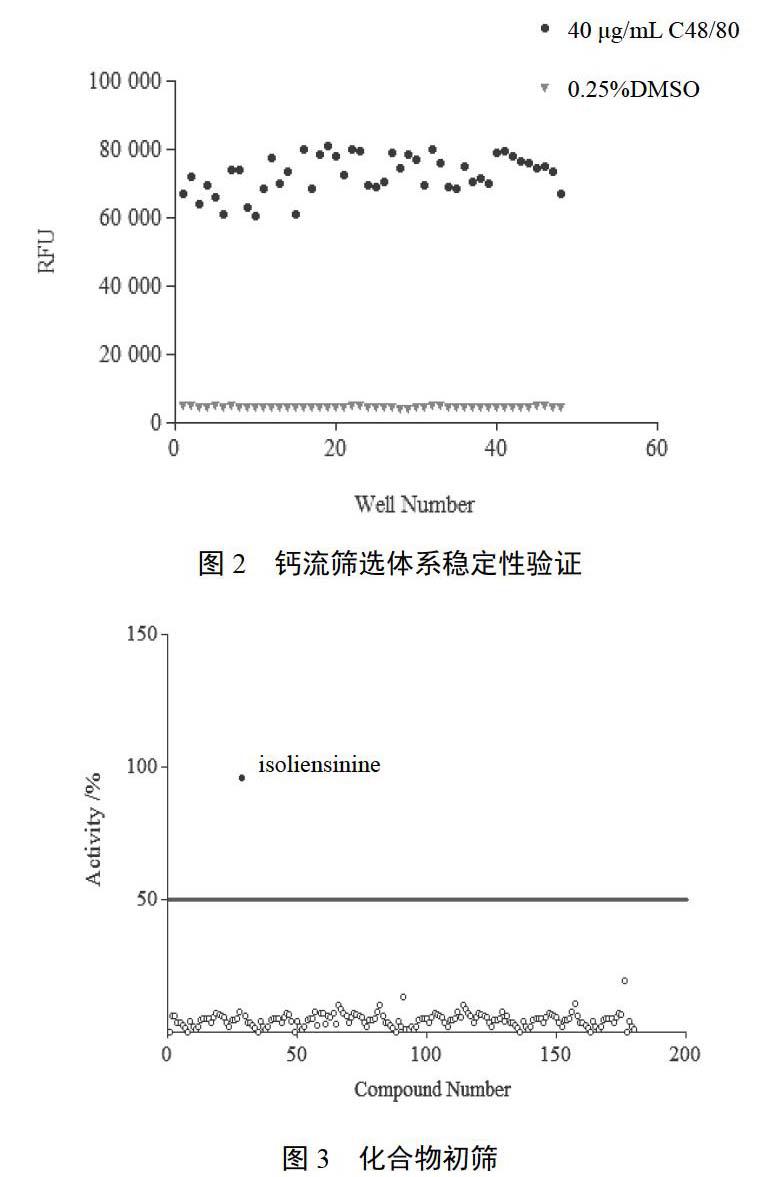
4.1.3 钙流筛选体系稳定性验证 采用Z因子评价筛选体系的稳定性。通常Z因子值>0.5时,则该体系适用于高通量筛选。40 ?g/mL C48/80和0.25%DMSO作为阳性对照和阴性对照,HEK293/MrgX2细胞系进行48孔刺激和48孔阴性对照,利用Z因子算法,建立的2个筛选系统Z因子值为0.78,结果见图2。结果表明本实验建立的筛选系统可靠、稳定。
4.2 中药化合物筛选
应用基于过表达细胞系HEK293/MrgX2的高通量筛选模型进行180个中药单体化合物(10 μmol/L)激动效果的评价,与阳性对照C48/80比较,当化合物激动效应>50%时,可初步判定为阳性激动剂。结果见图3。异莲心碱(isoliensinine)被挑选出来进行进一步的验证研究。
4.3 阳性化合物验证
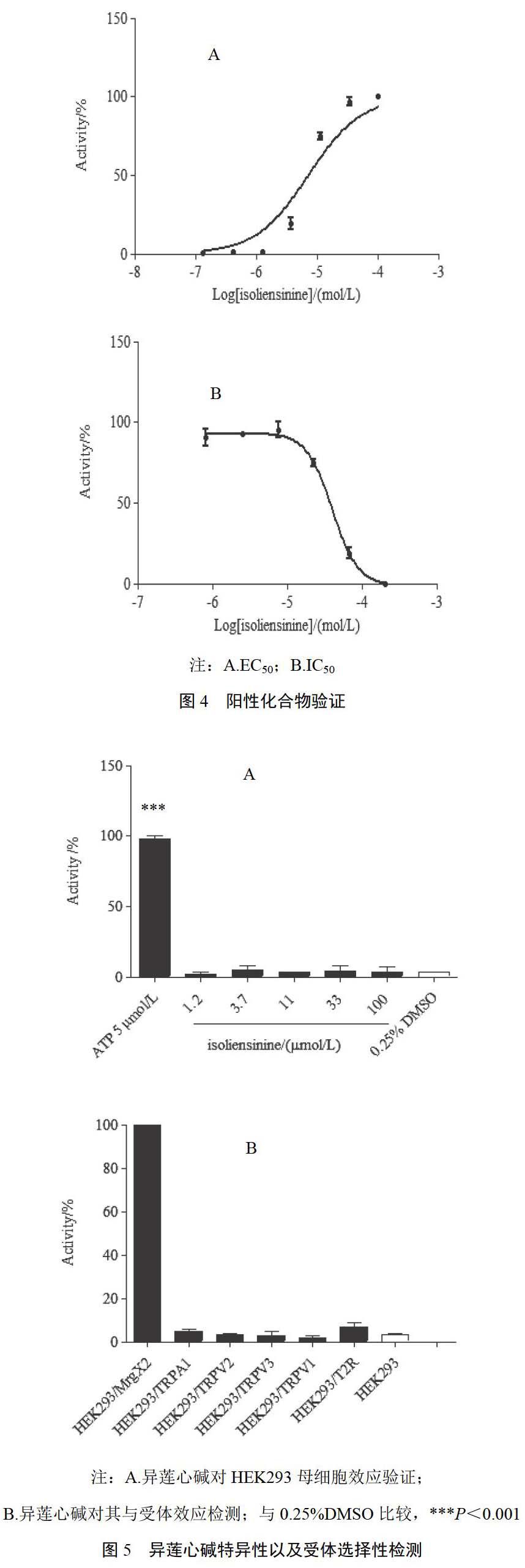
4.3.1 阳性化合物功能性验证 为获得阳性激动剂剂量反应,检测不同浓度异莲心碱对HEK293/MrgX2的激动效应。结果显示,其激动效应呈现明显的剂量依赖趋势,且EC50为4.5 ?mol/L;2-APB是MrgX2受体的拮抗剂,用系列浓度2-APB拮抗10 ?mol/L异莲心碱引起钙流信号,计算得到IC50为39.47 ?mol/L。结果见图4。
4.3.2 特异性以及受体选择性验证 假阴性结果是高通量筛选的主要问题。若一个化合物能同时激动HEK293/MrgX2细胞系和HEK293母细胞系,则这个化合物就被看作假阳性激动剂。ATP可激动绝大多数细胞系,它通过激动P2Y受体来产生钙流信号[10]。为了排除假阳性结果的可能性,用异莲心碱作用HEK293母细胞系,以5 ?mol/L ATP和0.25%DMSO被用作阳性对照和阴性对照。结果显示,异莲心碱对HEK293的作用与阴性对照的结果无显著差异,表明异莲心碱激活的是MrgX2受体,排除了其为假阳性的可能性,见图5。MrgX2是GPCR大家族的一个成员,为了验证异莲心碱对MrgX2激动效应的特异性,检测了异莲心碱对TRPA1、TRPV1、TRPV2、TRPV3、Tas2R以及ETB的激动效应。结果显示,异莲心碱对这些GPCR受体无激动效应。
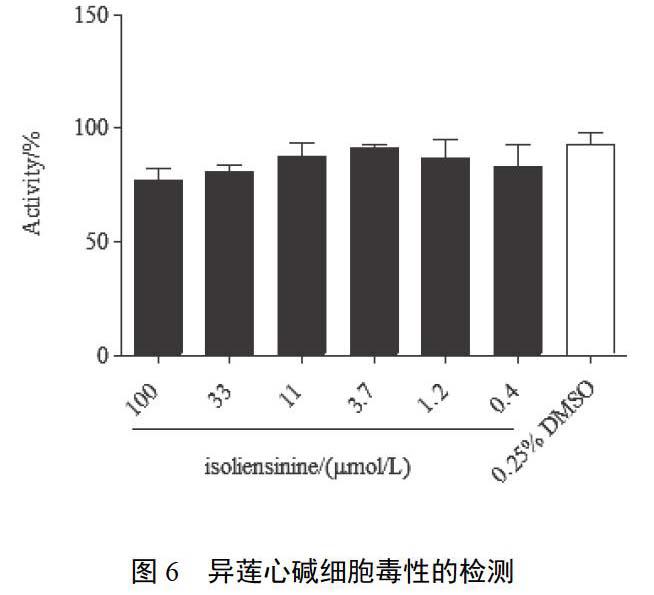
4.3.3 细胞毒性的验证 为了确定异莲心碱对HEK293/MrgX2细胞系是否具有毒性,应用酶联荧光方法进行毒性检测。不同浓度异莲心碱作用下细胞活力与阴性对照组0.25%DMSO比较差异无统计学意义,见图6。因此异莲心碱对HEK293/MrgX2细胞系的细胞活力没有影响,即异莲心碱无细胞毒性。
5 讨论
中药的过敏反应已成为制约中药发展和应用的重要因素,因此进行中药的质量控制显得尤为重要。目前,中药质量控制中缺乏较为灵敏简便以及高通量评价过敏反应的方法[11]。MrgX2是引发过敏反应重要的潜在靶点,在预测过敏原起到重要作用。因而,在中药过敏性评价、过敏原筛查中可起到关键作用。
高通量药物筛选是发现特异性配体的一种高效率的手段,保证筛选体系的稳定性和可靠性是其关键性环节。由于MrgX2受体可与Gq蛋白耦联,引起细胞内钙流的变化,本研究建立了一种基于细胞内钙流测定的方法来建立筛选模型。基于细胞的方法可以展现丰富的待测化合物的功能性信息,因此在新药筛选过程中被广泛的应用。基于flexstation Ⅱ的钙流筛选方法可以实现自动加样以及高通量,大大地提高了新药发现的效率[12-13]。研究结果表明,该方法快速、灵敏、稳定性高,适合于高通量筛选。特异性与稳定性是高通量筛选模型的基本要求,特异性是阳性化合物对受体的特异性结合与反应,而稳定性是细胞稳定表达受体。本研究通过检测模型对其特异性激动剂C48/80浓度依赖反应来确定模型的特异性,继而通过检测细胞在20代之后对配体浓度依赖的反应来确定其稳定性。Z因子是评价一个筛选方法质量的可靠参数,通常来说,Z因子值>0.5时即可判定这个方法体系具有足够的稳定性来进行高通量筛选[14]。本实验Z因子值为0.78,说明此筛选体系具备较高的筛选质量。假阳性是高通量筛选的主要问题,为了解决这一问题,采用不含MrgX2受体的HEK293细胞进行阳性化合物异莲心碱的验证,并采用其余6个GPCR(TRPA1、TRPV1、TRPV2、TRPV3、Tas2R和ETB)对异莲心碱进行验证,结果表明异莲心碱是MrgX2的特异性激动剂。
异莲心碱是从睡莲科莲属植物莲成熟种子的绿色幼叶及胚根中分离的一种双苄基异喳琳生物碱单体[15]。研究表明,异莲心碱具有改善心血管功能、降压、抗心律失常、抗心肌缺血、改善急性肺损伤和肺纤维化、抗血小板聚集和抗凝血、抗氧化、清除自由基等功效[16-17]。但是,尚未见到有关异莲心碱在免疫系统发挥作用的文献报道。本实验结果显示,异莲心碱可能会在机体内引发过敏反应,为异莲心碱的安全应用提供新的依据。
综上所述,本研究建立了一种体外高通量评价过敏反应的方法,并且筛选得到异莲心碱为潜在的能引发机体产生过敏反应的过敏原。此外,从分子靶点的层面解释了异莲心碱对免疫系统的影响。
参考文献:
[1] CHAN K, ZHANG H, LIN Z X. An overview on adverse drug reactions to traditional Chinese medicines[J]. British Journal of Clinical Pharmacology,2015,80(4):834-843.
[2] HUANG H, QU H. In-line monitoring of alcohol precipitation by near-infrared spectroscopy in conjunction with multivariate batch modeling[J]. Analytica Chimica Acta,2011,707(1/2):47-56.
[3] KNIPPING K, SIMONS P J, BUELENS-SLEUMER L S. Development of β-lactoglobulin-specific chimeric human IgEκ monoclonal antibodies for in vitro safety assessment of whey hydrolysates[J]. PLoS One,2014,9(8):e106025.
[4] COSTA J, ANSARI P, MAFRA I. Assessing hazelnut allergens by protein- and DNA-based approaches:LC-MS/MS, ELISA and real-time PCR[J]. Analytical &Bioanalytical; Chemistry,2014,406(11):2581- 2590.
[5] TATEMOTO K, NOZAKI Y, TSUDA R. Immunoglobulin E-independent activation of mast cell is mediated by Mrg receptors[J]. Biochemical & Biophysical Research Comunications,2006,349(4):1322-1328.
[6] MCNEIL B D, PRIYANKA P, SONYA M. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions[J]. Nature,2015,519(7542):237-241.
[7] LIU Q, LIU J J, GUO H L, et al. [6]-gingerol:a novel AT1 antagonist for the treatment of cardiovascular disease[J]. Planta Medica, 2013,79(5):322-326.
[8] ZHAI C X, LIU Q, ZHANG Y X, et al. Identification of natural compound carnosol as a novel TRPA1 receptor agonist[J]. Molecules,2014,19(11):18733-18746.
[9] HARIHARAN S, KSHITIJ G, DONGUK L. β-Defensins activate human mast cells via Mas-related gene X2[J]. Journal of Immunology, 2013,191(1):345-352.
[10] RITTINER J E, KORBOUKH I, HULL-RYDE E A. AMP is an adenosine A1 receptor agonist[J]. Journal of Biological Chemistry,2012, 287(8):5301-5309.
[11] ZENG Z P, JIANG J G. Analysis of the adverse reactions induced by natural product-derived drugs[J]. British Journal of Pharmacology,2010,159(7):1374-1391.
[12] ZHENG W, SPENCER R H, KISS L. High throughput assay technologies for ion channel drug discovery[J]. Assay & Drug Development Technologies,2004,2(5):543-552.
[13] MARSHALL I C B, OWEN D E, MCNULTY S. Measuring Ca2+ changes in multiwell format using the fluorometric imaging plate reader[J]. Methods in Molecular Biology,2005,312:125-131.
[14] ZHANG J H, CHUNG T D Y, OLDENBURG K R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays[J]. Journal of Biomolecular Screening,1999, 4(2):67-73.
[15] SHU G, YUE L, ZHAO W. Isoliensinine, a bioactive alkaloid derived from embryos of nNelumbo nucifera, induces hepatocellular carcinoma cell apoptosis through suppression of NF-κB signaling[J]. Journal of Agricultural & Food Chemistry, 2015,63(40):8793-8803.
[16] XIAO J H, ZHANG J H, CHEN H L. Inhibitory effects of isoliensinine on bleomycin-induced pulmonary fibrosis in mice[J]. Planta Medica,2005,71(3):225-230.
[17] XIE Y, ZHANG Y, ZHANG L T. Protective effects of alkaloid compounds from Nelumbinis Plumula on tert-butyl hydroperoxide- induced oxidative stress[J]. Molecules,2013,18(9):10285-10300.
