芍药ITS片段重组质粒的构建及筛选
2016-11-30王小国
◎王小国
(三门峡职业技术学院 食品园林学院,河南 三门峡 472000)
技术与应用
芍药ITS片段重组质粒的构建及筛选
◎王小国
(三门峡职业技术学院 食品园林学院,河南 三门峡 472000)
目的:重组质粒构建、转化和α-互补筛选是基因工程的中心环节,为了对纯化回收后的芍药ITS片段进行重组质粒构建和筛选。方法:通过芍药纯化回收后的ITS片段,进行了重组质粒构建、连接和α-互补筛选,结果ITS片段和PMD18-T Vector比例为0.5∶1时较为适中,转化效率较高,培养时间以12h为宜,当培养时间过长时,易长出卫星菌落。结论:构建了芍药ITS片段重组质粒,为下一步利用ITS序列对芍药进行系统发育分析奠定基础。
芍药;ITS;重组质粒;构建;筛选
重组质粒构建、转化和α-互补筛选是基因工程的中心环节,在功能基因的分离、克隆和表达中有着广泛地应用[1-3]。其基本原理是在体外将目的基因通过DNA连接酶连接到质粒载体上,转化到氯化钙处理后的大肠杆菌E.coli感受态细胞(competent cell)中,并利用质粒载体上含有的β-半乳糖苷酶基因(LacZ)的调控序列,使重组体在异丙基-β-D-硫代半乳糖苷(IPTG)的诱导下,β-半乳糖苷酶将底物半乳糖苷(X-Gal)水解,形成蓝色菌落,而有外源DNA片段重组质粒的细菌则形成白色菌落的过程。
芍药(Paeonia lactiflora)为芍药科芍药属多年生草本植物,有较高的观赏和药用价值[4,5],但品种变异丰富,表型性状多样[6],给芍药的准确分类和亲缘关系的鉴定带来一定困难,ITS(Internal transcribed spacer)是位于核基因组中的一段内转录间隔区[7],即使在相近的种群中也有着高度的变异,因此常用于植物的系统发育分析,在辨明同属物种的关系中扮演重要的作用[8]。
目前,已有很多对植物ITS片段序列分析的报道。例如:李喜凤对不同种群蒲公英内转录间隔区(ITS)序列及其亲缘关系进行了分析[9],刘建全等[10]利用ITS探讨了青藏高原特有植物华福花属的亲缘关系,序列比较和分支分析表明,华福花属与五福花属近缘,为华福花属植物的亲缘关系研究提供了参考资料。本研究通过纯化回收后的芍药ITS片段,进行重组质粒构建、连接和α-互补筛选,为下一步利用ITS序列对芍药进行系统发育分析奠定基础。
1 试验材料
试验材料:三门峡牡丹苑采集的芍药当年生嫩叶。
2 试剂及仪器
主要试剂有:PMD18-T Vector、T4连接酶和E.coli感受态,LB培养基,X-Gal、IPTG和Amp(均为市售)等。所需仪器主要有:超低温冰箱(美国Thermo公司),低温冰箱,恒温水浴锅,恒温摇床,高速离心机,超净工作台(吴江市净化设备总厂),微量移液器(Eppendorf)等。
3 试验方法
3.1 芍药DNA的提取
(1)称取芍药嫩叶100mg,加入液氮研磨,将粉末迅速转移至2ml离心管中,加入700μl预热的缓冲液GP1;(2)颠倒混匀,将离心管放置在预热65℃的恒温水浴锅中水浴30min,水浴过程中每隔5min混匀;(3)30min后加入700μl氯仿充分混匀,12000rpm离心10min;(4)小心将上层水相转移至新的EP管中,加入800μlGP2充分混匀;(5)将液体转移至吸附柱中,12000rpm离心2min,弃掉废液;(6)用移液枪吸取500μl缓冲液GD,加入到吸附柱中,12000rpm离心2min,倒掉废液,将吸附柱重新放回到收集管中;(7)用移液枪吸取600μl漂洗液PW,加入吸附柱中,12000rpm离心2min;(8)将废液倒掉,吸附柱重新放入收集管中,重复清洗步骤,倒掉废液;(8)离心5min;(9)将吸附柱置于室温下10分钟左右,以彻底晾干吸附柱中残留的漂洗液;(10)将晾干后的吸附柱放入一个新EP管中,100μl ddH2O溶解后离心10min,将溶液收集到离心管中。
3.2 芍药ITS片段的扩增
PCR反应体系为 10μL,10×buffer1μL,dNTP0.8μL,Taq酶 0.05μL,Primer各 0.5μL,DNA模板0.3μL,ddH2O6.85μL。扩增程序为:95℃预变性5min,94℃变性30s,50℃退火30s,72℃延伸1.5min,进行20个循环反应后,72℃延伸10min。
3.3 芍药ITS片段的回收
将扩增出的芍药ITS序列的PCR产物,进行琼脂糖凝胶回收,具体操作步骤如表1所示:

表1 芍药ITS片段的回收
3.4 芍药ITS片段的体外连接
在EP管中进行芍药ITS片段的体外连接,反应液总体积10μl,其组成如表2:反应液于16℃反应30分钟后,4℃连接过夜。
3.5 感受态细胞的制备
新鲜的细胞是制备感受态细胞和进行成功转化的关键。首先,从37℃培养16-20h的平板上挑取单菌落,转移至含有100mlLB液体培养基的三角瓶中,37℃振荡培养3h(180r/min)。然后将细菌转移到无菌、预冷的离心管中,冰浴10min,5000r/min常温离心2min,弃上清。之后以10ml预冷的0.1mol/LCaCl2重悬沉淀,冰浴20min。5000r/min常温离心2min,弃上清。用预冷的0.1mol/LCaCl2重悬沉淀,分装后于-80℃超低温冰箱中保存备用。
3.6 热激转化
将感受态细胞取出后冰上融化,每管中加入10μl过夜连接反应液,冰上静置30min,42℃水浴60s(时间可根据EP管为尖底或圆底进行适当调整),迅速转移至冰水混合物中,冷却3min,每管中加入LB液体培养基,固定于振荡培养箱中,180r/min振荡培养1h后,5000 r/min常温离心2min,弃上清。
3.7 α-互补筛选
将菌液吹打混匀后用无菌玻璃珠均匀涂布于含有X-Gal、IPTG和Amp的LB平板中 (作一空白对照),37℃培养12h后挑选阳性克隆。

表2 连接反应液组成

图1 所提取
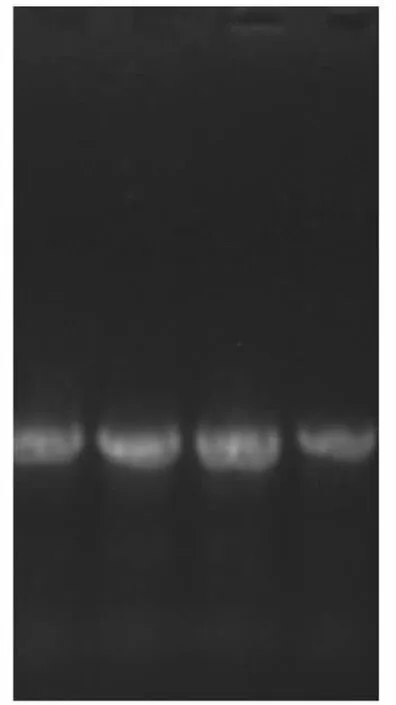
图2 扩增的
4 结果及分析
4.1 提取的DNA电泳结果
提取的芍药DNA电泳结果如图1所示。
从图1中可看出,所提取芍药DNA的电泳条带清晰,质量较高,无蛋白和RNA等杂质。
4.2 ITS扩增结果
芍药ITS扩增结果如图2所示。由图可知,扩增的ITS片段大小约800bp,无扩增杂带。
4.3 α-互补筛选结果
α-互补筛选结果如图3所示。
从图3可知,ITS片段和PMD18-T Vector比例为0.5:1时较为适中,转化效率较高,培养时间以过夜为宜。当培养时间过长时,则会长出卫星菌落(图4),从而影响到克隆的挑选。图5为不含重组质粒的E.coli在Amp培养基上生长的情况,由于PMD18-T Vector带有Amp抗性,而无重组质粒的对照E.coli在含Amp的培养基上没有菌落形成,表明Amp未失活,生长的E.coli菌落均带有抗性载体。

图3 α-互补筛选结果

图4 卫星菌落

图5 不含重组质粒的E.coli在Amp培养基上的情况
5 小结
本研究通过纯化回收后的芍药ITS片段,进行了重组质粒构建、连接和α-互补筛选,为下一步利用ITS序列对芍药进行系统发育分析奠定基础。但在具体操作过程中,应注意以下一些方面:1)倒平板时应控制好培养基温度,温度不要过高,否则会使加入的氨苄西林失效,并在平板培养基和培养皿盖表面形成大量冷凝水,冷凝水滴到培养基上后会造成污染及影响单菌落的形成;2)E.coli感受态细胞较脆弱,用移液枪轻轻吸打使其悬浮时动作要轻;3)-80℃冰箱储存的感受态细胞要尽快使用,一般在半年后,感受态转化率会降低;4)培养时间不能过长,以免卫星菌落的出现;5)含有X-gal的培养基4℃避光保存,在1-2周内使用等。此外,α-互补筛选除了利用质粒载体上含有的β-半乳糖苷酶基因的调控序列,使质粒大肠杆菌重组子产生β-半乳糖苷酶将底物X-Gal水解,通过颜色变化进行筛选之外,也同时利用了Amp的抗性筛选,单一的大肠杆菌感受态是不具有抗性的,只有转化了质粒载体的大肠杆菌才具有Amp抗性,所以在Amp+培养基上形成的菌落都是转化了质粒载体的大肠杆菌,不带有质粒载体的大肠杆菌或其他杂菌在Amp+培养基上是不会生长的。当然,形成的白色菌落也可能是空载体,判断其是否真正插入了目的片段,还需要经过进一步的菌液PCR或菌落PCR验证之后才能确定。
国内诸多研究者对T载体构建、α-互补筛选机制及改进方法进行了研究。钟星等[11]构建了定向T载体,重组效率100%,结果表明该载体非常适合基因的克隆和表达;齐向辉等[12]以常用的克隆载体pGEM.3zf(+)为出发材料,将其改造成通用的T载体;郑高阳等[13]将平板上生长的蓝色菌落进行回收后扩大培养,然后从大肠杆菌中提取质粒,重新构建了T载体,大大节约了成本,并对T载体构建及构建过程中常见问题的处理方法进行了探讨;周玉亭等[14]对α-互补机制进行了探究;潘韵芝[15]对蓝白斑筛选技术的改进并探讨了其在生物医学方面的新应用,可见载体构建和重组子高效筛选是当前很多研究者共同关注的问题。
[1]崔洋.牡丹蔗糖转运蛋白基因PsSUT1的克隆与表达[D].郑州:河南农业大学,2014.
[2]亓倩,于淑惠,孙涛,等.白蜡虫蜡酯合酶在昆虫细胞Sf9中的表达[J].林业科学研究,2016,02:191-195.
[3]仲念念,朱伶俐,王旋,等.TAZ基因重组质粒的构建与表达[J].河南大学学报:医学版,2015,02:111-114.
[4]孙丽荣,曹雄,侯凤青,等.芍药苷研究进展[J].中国中药杂志,2008,33(18):2028-2032.
[5]曾宇.当归芍药散抗衰老活性的药效学和药代动力学研究[D].广州:广州中医药大学,2013.
[6]孙晓梅,高昊丹,周文强,等.芍药属品种亲缘关系的形态学研究[C]//中国园艺学会观赏园艺专业委员会、国家花卉工程技术研究中心、中国观赏园艺研究进展,2011.
[7]倪梁红,赵志礼,熊波,等.ITS与叶绿体基因组多片段组合鉴定甘肃产秦艽基原植物的策略[J].药学学报,2016(5).
[8]Zhang D-Y,ZhangY,J.F.Gaskin,et al.Systematic position of Myrtama Ovcz.&Kinz.based on mor phological and nrDNA ITS sequence evidence.Chinese Science Bulletin,2006(51):117-123.
[9]李喜凤,邱天宝,张红梅,等.不同种群蒲公英内转录间隔区(ITS)序列及其亲缘关系分析[J].中国药学杂志, 2013,48(9):687-690.
[10]刘建全,陈之端,路安民.从ITS序列探讨青藏高原特有植物华福花属的亲缘关系[J].植物学报,2000,42(6).
[11]钟星,翟超,陈亮,等.构建定向T载体用于基因克隆和表达[J].生物工程学报,2013,04:510-519.
[12]齐向辉,陈辉,沈琦,等.一种构建新型T载体的简便方法及应用[J].生物技术通报,2011,03:163-165+174.
[13]郑高阳,刘晓颖,王振英.T载体构建及其构建过程中常见问题的处理方法[J].实验室科学,2009,01:116-117.
[14]周玉亭,曹建斌.α-互补与蓝白斑筛选机制的探究[J].生物技术通报,2010,08:218-221.
[15]潘韵芝.蓝白斑筛选技术的改进及其生物医学应用[D].苏州:苏州大学,2014.
(责任编辑 卞建宁)
S682.12
B
1671-9123(2016)03-0136-04
2016-06-27
王小国(1977-),男,山西长治人,三门峡职业技术学院食品园林学院讲师。
