贵阳市食品中沙门氏菌污染检测
2016-11-30刘玉婷郎小倩翁庆北
黄 磊,刘玉婷,郎小倩,翁庆北
(贵州师范大学 生命科学学院,贵州 贵阳 550001)
贵阳市食品中沙门氏菌污染检测
黄 磊,刘玉婷,郎小倩,翁庆北*
(贵州师范大学 生命科学学院,贵州 贵阳 550001)
利用沙门氏菌invA基因序列设计引物并建立PCR反应,该反应灵敏度为3.6×102CFU/mL。在1mL样中含菌量106CFU/mL时增菌4h、含菌量103CFU/mL时增菌8h、含菌量102CFU/mL时增菌12h后可检出。从贵阳市各区随机购买113份肉、蛋类食品,检出10份样品含有沙门氏菌,总检出率为8.8%。该方法准确、灵敏、快捷、成本低,可广泛应用于沙门氏菌检测。
贵阳市;沙门氏菌;分子检测;PCR
世界卫生组织报告指出污染食品将严重威胁人类健康和生命安全[1]。食品安全问题直接关系到人民群众生命、健康和社会稳定。国家卫生计生委突发公共卫生事件网络直报系统2013年共收到全国食物中毒类突发公共卫生事件报告152起,中毒5 559人,死亡109人。目前,已知的食源性疾病致病因子有250种之多,其中大部分为细菌、病毒和寄生虫。其中,肠道致病菌(约10种)是食源性疾病中最常见的生物致病因素,感染后可引起细菌性食物中毒和多种感染性腹泻。微生物污染是食品安全中极为重要的因素,食品法典委员会将微生物性健康危害列为食源性健康危害的三大原因之一。我国对致病微生物引起的食源性食品安全问题重视尚不足。2016年第一、二季度,全国食品安全监督抽检各类食品(含保健食品和食品添加剂),结果表明食品中微生物污染高达22.9%和25.5%[2]。据相关数据显示,美国、英格兰和威尔士每年患食源性疾病的数分别达到7 600多万人和236多万人[3],根据国家食源性疾病监测网的统计资料显示自1992~2001年间我国由微生物引起的疾病事件中,沙门氏菌占到17.9%,是最常见和最主要的病因物质[4]。
沙门氏菌(Salmonella)属于肠杆菌科(Enterobacteriaceae),革兰氏阴性肠道杆菌,大小0.6~1.0μm×2~3μm,无芽孢,一般有鞭毛,无荚膜,多数有菌毛,兼性厌氧菌,迄今发现的沙门氏菌超过2 500个血清型[5]。该菌是引起人畜共患的食源性致病菌,能导致鸡白痢、仔猪副伤寒,还能使人类发生伤寒、副伤寒、败血症、胃肠炎和食物中毒,是具有潜在扩散性的中度危害的生物性危害因子[6]。近年来由于沙门氏菌人畜共患的生态特征及其所引发的食源性腹泻发病率上升而使之成为世界卫生组织(WHO)广为关注的公共卫生问题[7]。该菌广泛分布于自然界, 常见于肉类和奶蛋类食品。在世界各地食物中毒中,沙门氏菌引起的中毒病例占首位或第二位[8,9]。我国细菌性食物中毒中70%~80%是由沙门氏菌引起[10]。就贵州省而言,1998年遵义市某幼儿园儿童食用蛋糕后发生急性中毒、2001年7月和8月,在贵阳市息烽县、开阳县村民办酒席后,发生两起食物中毒事件,经诊断均为都柏林沙门氏菌(Salmonelladublin)引起[11,12]。所以及时调查食品中食源性细菌的分布情况并及时处理受污染的食品,在公共卫生、食品安全等方面都具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 菌株
沙门氏菌(CMCC50094)和大肠杆菌(CMCC44102),本室保存。
1.1.2 样品
2012年7月~2013年2月,按照随机采样原则从贵阳市云岩区、花溪区、小河区、乌当区的各大菜市场、超市采集各类食品,包括猪肉、牛肉、鸡蛋、鸭蛋、鸡肝、猪肺、猪肝等。各区分批采集,当天采集的样品及时进行处理。
1.1.3 试剂和仪器
检测沙门氏菌所需的缓冲蛋白胨水(BPW)、亚硒酸盐胱氨酸增菌液(SC)、木糖赖氨酸脱氧胆盐(XLD)琼脂、三糖铁琼脂(TSI)、赖氨酸脱羧酶培养基、尿素琼脂、蛋白胨水、吲哚试剂、营养琼脂、硫化氢等均按照国标法(GB4789.4-2010)配制。
DNA Marker DL1000、Taq酶、dNTPs购自大连宝生物工程有限公司;琼脂糖购自西班牙Biowest公司;Bio-Rad PCR仪购自美国伯乐公司;DYY-2C型电泳仪购自北京六一仪器厂;BC-subMIDI多用途水平电泳槽购自北京百晶生物技术有限公司;GENE GENIUS全自动凝胶成像分析系统购自英国Syngene公司。
1.2 方法
1.2.1 DNA模板的制备
菌株活化后接入5mL LB液体培养基,220r/min培养12h后,菌液12 000r/min离心2min,弃上清,沉淀加入500μL双蒸水悬浮,100℃沸水浴10min后,12 000r/min离心5min,所得上清液即为DNA模板。
1.2.2 PCR扩增
根据沙门氏菌特异性侵袭蛋白基因invA设计PCR引物对:invA-F:5′-GTGAAATTATCGCCACGTTCGGGCAA-3′和invA-R:5′-TCATCGCACCGTCAAAGGAACC-3′,扩增片段长度为285bp[11]。引物委托上海(大连)宝生物工程有限公司合成。PCR反应体系:10×PCR buffer 2.5μL、dNTPs(2.5mM)2μL,引物(10μM)各0.2μL,DNA模板5μL、Taq DNA聚合酶1U,加灭菌双蒸水补至25μL。PCR反应条件:94℃预变性5min后,94℃变性30s,65℃退火30s,72℃延伸45s,经30个循环后,72℃延伸7min,4℃保存。取6μL扩增产物,2%琼脂糖凝胶电泳后,EB染色,凝胶成像系统观察结果。以沙门氏菌标准菌株DNA模板扩增产物作为阳性对照,大肠杆菌DNA模板扩增产物作为阴性对照,无菌水为模板扩增产物作为空白对照。
1.2.3 PCR方法反应灵敏度检测
将沙门氏菌接种于5mL LB中37℃振荡培养过夜,将菌液10倍梯度稀释为10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9,分别取1 mL不同稀释度的菌液,煮沸法提取DNA,PCR扩增检测。同时涂布平板法进行计数。
1.2.4 人工污染肉样
参照国标GB 4789.4-2010,检测样品经前增菌、选择性增菌和分离培养,将可疑菌株利用生理生化实验进行鉴定。经检测为沙门氏菌阴性的肉样,取25g加入225mL缓冲蛋白胨水(BPW),均质处理作为增菌培养液备用。
将沙门氏菌接种于5mL LB,37℃过夜培养,将菌液10倍梯度稀释为10-1、10-2、10-3、10-4、10-5、10-6、5×10-7、10-7、5×10-8、10-8、5×10-9、10-9、5×10-10、10-10、5×10-11,取10-4~10-8各稀释度200μL分别涂布平板,每个稀释度3组平行实验,培养36h后进行平板计数。取稀释度菌液1mL分别加入250mL上述均质增菌液中,37℃振荡培养,分别于培养后4h、8h、12h取增菌液1mL,提取DNA,PCR检测,确定检出限。以1mL LB培养基加入250mL增菌液作为未污染对照。
1.2.5 PCR方法检测待测样品
无菌操作下取25g待测样品加入225mL BPW培养基,均质,37℃培养12h,取1mL提取DNA,PCR扩增后电泳检测。同时按照国标法对样品进行检测,两种方法比较,计算PCR方法的符合率。
2 结果与分析
2.1 沙门氏菌PCR扩增结果
2.1.1 PCR方法反应灵敏度
将菌液涂布后,平板计数得到菌液中沙门氏菌菌数为3.6×109CFU/mL。各稀释度菌液提取的DNA进行PCR扩增后,可检出最低菌量为3.6×102CFU/mL(见图1)。

M:DL 1 000 Marker; 1~10泳道:菌悬液浓度分别为3.6×109~3.6×101 CFU/mL;11,阳性对照;12,阴性对照;13,空白对照图1 PCR方法灵敏度检测Fig.1 The sensitivity detection of PCR method
2.1.2 人工污染肉样检测结果
不同稀释度菌液人工污染肉样后,PCR检测表明,当样品中沙门氏菌含量为1.65×106CFU/mL时,经增菌培养4h(见图2),或含量为1.65×103CFU/mL时增菌培养8h(见图3),含量为3.3×102CFU/mL时增菌培养12h后(见图4),均可检出。

M:DL 1 000 Marker;1~15泳道:菌悬液浓度分别为1.65×1010~0.33 CFU/mL;16,阳性对照;17,阴性对照;18,空白对照。图3,图4与该条件相同。图2 沙门氏菌增菌4h后PCR检出限Fig.2 Detection limit of PCR for 4h Salmonella enrichment

图3 沙门氏菌增菌8h后PCR检出限Fig.3 Detection limit of PCR for 8h Salmonella enrichment

图4 沙门氏菌增菌12h后PCR检出限Fig.4 Detection limit of PCR for 12h Salmonella enrichment
2.1.3 国标法和PCR方法对样品检测的结果
同时用国标法和PCR检测方法对样品中的30份进行检测,两种方法均出现2份阳性结果,符合率100%(见图5和6)。

M:DL 1 000 Marker;1~21泳道为样品编号;22,阳性对照;23,阴性对照;24,空白对照图5 PCR实际检测1~21号样品实验结果Fig.5 The PCR detection results of NO.1~21 samples

M:DL 1 000 Marker;1~9泳道为样品编号;10,阳性对照;11,阴性对照;12,空白对照图6 PCR实际检测22~30号样品实验结果Fig.6 The PCR detection results of NO. 22~30 samples
2.1.4 PCR方法检测样品结果
利用PCR方法检测113份样品中沙门氏菌污染情况,结果10份样品中出现阳性结果,总检出率为8.8%。
2.2 贵阳市食品中沙门氏菌的分布情况
2.2.1 不同地区沙门氏菌分布情况
由表1可见,从贵阳市云岩区、花溪区、小河区和乌当区采集的样品中均检测到沙门氏菌,其中云岩区检出率 12%,花溪区检出率6.7%,小河区检出率4%,乌当区检出率12%。
2.2.2 不同种类食品中沙门氏菌分布情况
由表2可知:肉类食品中沙门氏菌污染率最高,检出率为11.8%;内脏次之,检出率7.9%;蛋类检出率最低,检出率为4.2%。

表1 各区食品沙门氏菌分布情况Tab.1 The distribution of Salmonella spp.in foods from different districts
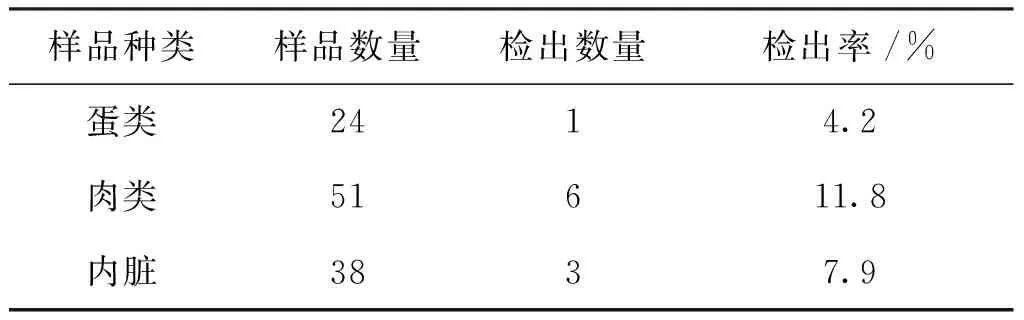
表2 不同种类食品中沙门氏菌分布情况Tab.2 The distribution of salmonella spp. in different kinds of foods
2.2.3 不同市场食品中沙门氏菌分布情况
由表3可知,从农贸市场采集的食品中沙门氏菌检出率11.8%,自由市场中食品检出率 7.1%,超市中食品未见沙门氏菌检出。

表3 不同市场食品中沙门菌分布情况Tab.3 The distribution of salmonella spp. in foods from different markets
3 讨论
沙门氏菌是常见人畜共患病原菌,菌型繁多,所以对该菌在食品和水源卫生的监测显得非常重要。长期以来,传统的细菌培养法(包括分离培养、血清学试验、生化反应等)在沙门氏菌的检测方面发挥了重要作用,但其自身局限性,如步骤繁琐、检测周期长(一般需4~7d),不能满足大宗样品和快速检测的需要[12]。随着分子生物学技术的发展,PCR技术以其敏感性强、特异性高、快速等优点广泛用于沙门氏菌的检测。本实验采用PCR方法,灵敏度达到107CFU/mL,当1mL样品中含有102个沙门氏菌时,增菌12h后即可检出,能达到快速检测的要求,对及时有效地控制病原菌传播、预防食物中毒有至关重要的作用。本研究采用PCR方法对贵阳市内各区随机采样的食品样品中沙门氏菌的分布情况进行检测,结果显示在113份样品中共检出10份样品含有沙门氏菌,检出率为8.8%。此外,在贵阳市各区购买的食品中均检出沙门氏菌的存在,这说明沙门氏菌分布的广泛性,其中购自农贸市场的食品沙门氏菌检出率最高,说明沙门氏菌的分布与周边环境卫生条件有较大关系。鉴于此,研究提示相关部门要加强农贸市场及周边餐饮行业的卫生监督,以减少沙门氏菌引起食物中毒的机率。
[1] 世界卫生组织.沙门氏菌(非伤寒)[EB/OL].(2013-08-10)[2016-07-02].http://www.who.int/mediacentre/factsheets/fs139/zh/.
[2] 国家食品药品监督管理总局.总局关于2016年第二季度食品安全监督抽检情况分析的通告(2016年第109号)[EB/OL].(2016-07-20)[2016-08-05].http://www.sda.gov.cn/WS01/CL1687/159821.html.
[3] MEAD P S,SLUTSKER L,DIETZ V.Food-related illness and death in the United States[J].Emerging Infectious Disease,1999,5(5):607-625.
[4] 刘秀梅,陈艳,王晓英.1992~2001年食源性疾病爆发资料分析—国家食源性疾病监测网[J].卫生研究,2004,33(6):725-727.
[5] 孙园园,赵鹏,刘骏,等.沙门氏菌检测方法研究进展[J].中国畜牧兽医, 2011,38(1):218-221.
[6] 黄金林,焦新安,文其乙,等.直接ELISA和PCR相结合快速检测样品中的沙门氏菌[J].中国人兽共患病杂志,2004,20(4):321-327.
[7] ALBUFERA U,BHUGALOO V P,LSSACK M I,et al.Molecular characterization ofSalmonellaisolates by REP-PCR and RAPD analysis[J].Infection Genetics and Evolution,2009,9(3):322-327.
[8] 刘斌,史贤明.扩增内标在沙门氏菌PCR检测方法中的应用[J].微生物学通报,2006,33(2):156-161.
[9] 向雪菲,刘斌,张利达,等.食品中沙门氏菌分子检测靶点的筛选与评价[J].微生物学报,2008,48(7):941-946.
[10]刘胜责,魏麟.应用PCR技术检测猪肉中沙门氏菌的研究[J].食品科学,2007,28(3):254-256.
[11]刘建国,朱玲,翁小林,等.一起都柏林沙门氏菌食物中毒的调查报告[J].遵义医学院学报,2001,24(4):362-366.
[12]周凤兰,王安姝,崔代华,等.开阳县一起都柏林沙门氏菌食物中毒的调查报告[J].贵州医药,2003,27(1):91-93.
[13]张恬恬,李翠丽,李清和,等.食源性沙门氏菌的PCR检测[J].畜牧与饲料科学,2010,31(3):112-113.
[14]马素霞,李小丽,郑晓燕,等.PCR法与细菌培养法在急性腹泻患者沙门氏菌检测中的应用比较[J].中国病原生物学杂志,2008,3(10):735-737.
Detection ofSalmonellaspp. in foods from Guiyang city by PCR
HUANG Lei, LIU Yuting, LANG Xiaoqian, WENG Qingbei*
(School of Life Sciences, Guizhou Normal University, Guiyang,Guizhou 550001, China)
In this study, we designed a pair of primers specific to invA gene ofSalmonella, and established PCR reaction conditions. The reaction sensitivity is 3.6×102CFU/mL. In one mL sample, 106CFU/ml, 103CFU/ml and 102CFU/ml can be detected after 4h, 8h and 12h enrichment with LB culture media respectively. A total of 89 meat and 24 egg samples from supermarket or trade market in Guiyang city were analyzed, ten samples containedSalmonella, and the contamination rate was 8.8%. Our method is accurate, sensitive, fast and with low cost,hence it can be widely used to detectSalmonellain foods.
Guiyang city;Salmonella; molecular test; PCR
1004—5570(2016)05-0036-05
2016-08-20
贵阳市社会发展领域科技攻关项目(2010筑科农合同字第1-社-51)
黄 磊(1987-),男,硕士,研究方向:应用生物化学,E-mail:leihuangluck@163.com.
*通讯作者:翁庆北(1975-),女,教授,研究方向:微生物及分子生物学,E-mail:wengqb@126.com.
S851
A
