多器官细胞共同培养方法检测双黄连口服液的细胞毒性
2016-11-30于海明唐家泷于风江阎政礼朱勇飞
于海明,贺 明,唐家泷,于风江,阎政礼,付 虎,朱勇飞
(1.湖南师范大学第一附属医院/湖南省人民医院 重症医学科,长沙 410006;2. 湖南师范大学医学院预防医学系,长沙 410013;3.湖南师范大学化学与化工学院,长沙 410086)
多器官细胞共同培养方法检测双黄连口服液的细胞毒性
于海明1,贺 明2,唐家泷2,于风江3,阎政礼2,付 虎2,朱勇飞2
(1.湖南师范大学第一附属医院/湖南省人民医院 重症医学科,长沙 410006;2. 湖南师范大学医学院预防医学系,长沙 410013;3.湖南师范大学化学与化工学院,长沙 410086)
目的:观察双黄连口服液对人类体外不同靶器官细胞的毒性及特点。方法:应用人类多器官细胞共培养模型,观察双黄连口服液分别作用24、48、72 h后,对WI-38、HepG2、HEK293、SH-SY5Y和HCF细胞增殖的影响。结果:双黄连口服液处理24、48、72 h后,各种细胞的增殖率有随着剂量的降低而升高的趋势、且有较好的剂量-效应关系。该药除在72 h后的1/32浓度对HEK293细胞无影响外,在所有时点的各浓度均抑制该细胞的增殖。处理24 h后,1/4~1(原液)浓度的双黄连口服液抑制WI-38细胞,1/8~1(原液)浓度的该药抑制HepG2、SHSY5Y和HCF细胞增殖;48 h后,1/16~1(原液)浓度抑制WI-38、HepG2、SH-SY5Y和HCF细胞;72 h后,1/2~1(原液)浓度的双黄连口服液抑制WI-38细胞,所有浓度的该药均抑制HepG2、SH-SY5Y和HCF细胞。结论:双黄连口服液对WI-38、HepG2、HEK293、SH-SY5Y和HCF细胞可能均有毒作用,其可能的毒性大小顺序为肾细胞>肝细胞>神经、心肌细胞>肺细胞。
多器官细胞共培养方法;双黄连口服液;细胞毒性
近年来中成药在临床上的安全性一直是国内外都予以重视的问题,关于中成药毒性反应事件时有报道,中成药“药害”事件不断曝光[1,2],使之成为中医药现代化和走向世界的主要障碍之一,也使中药面临严峻挑战[3,4]。因此,迫切需要建立新的、能更好地对中成药毒性进行研究和评价的方法。发展基于细胞的体外毒性方法成为毒理方法学研究的主要发展趋势和研究热点。我们以前建立并运用大鼠肝、肾、神经、心、肺等多器官原代细胞共同培养的方法研究了几种上市多年的化学药物(红霉素、链霉素、多柔比星和白消安)的毒性,可较好地反映靶器官并发现了这些药物的某些潜在毒性[5]。本研究拟利用人类多器官细胞共培养模型对双黄连口服液的细胞毒性进行测试,目的是进一步揭示该药的潜在毒性,为进一步研究提供依据,同时为多器官细胞共培养模型的改进和应用提供依据。
1 资料与方法
1.1 主要仪器和试剂 CO2培养箱(Thermo公司),倒置显微镜(Lecia公司),多功能酶标仪(BioTek公司),48孔培养板(Corning公司);双黄连口服液(河南某制药股份有限公司,批号151211052);噻唑兰(MTT)购自Sigma公司,胰蛋白酶,DMEM(高糖)培养基购自Hyclone公司;胎牛血清(FBS)为Gibco公司产品。共培养板为自己改制的48孔培养板,每6孔为一组,在6个孔与孔之间孔壁底部打一洞,当孔内培养基超过0.3 cm高度时使六个孔之间培养基能相互连通(见图1)。
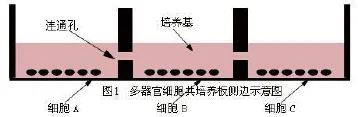
1.2 培养液配制 细胞单培养和共培养时,均采用同一种培养液,即在DMEM高糖培养基,加入10%的FBS和1%青霉素链霉素。
1.3 细胞共培养模型的建立及染毒 参照文献[5],先将WI-38细胞(人正常胎儿肺细胞)、HepG2细胞(人肝癌细胞)、HEK293细胞(人胚肾细胞)、SH-SY5Y细胞(人神经母细胞瘤细胞)、HCF细胞(人心脏成纤维细胞)复苏并分别培养,待细胞增殖到足够数量时将其共同接种于各孔连通的共培养板,待细胞全部贴壁后进行染毒。双黄连口服液临用前分别用培养液稀释成1/2、1/4、1/8、1/16、1/32浓度,空白对照为新鲜培养液;分别将新鲜培养液、双黄连原液以及各种浓度的药物各100 μL加入对应的培养孔中[6,7],所有受试物每个剂量组设3个平行实验孔。将所有受试物加入共培养板以后,立即置于37 ℃、5% CO2培养箱中培养,分别于24、48、72 h后检测细胞相对增殖率。
1.4 MTT法检测相对增殖率 参照文献[8]提供的方法,配制MTT溶液,并在加入受试物24 h后,每孔加入MTT溶液(5 g·L-1)20ul,于37 ℃孵育4 h,弃孔内培养上清液,每孔加二甲亚砜(DMSO)150 μL,震荡,用酶标仪于490 nm波长测定各孔吸光度(OD)。细胞相对增殖率(relative growth rate,RGR)的计算公式:RGR(%)=(试验组平均OD值)/(对照组平均OD值)×100%。
1.5 统计学方法 采用SPSS18.0软件进行统计学分析,计量资料数据以均数±标准差表示;同种物质作用下,同种细胞的所有剂量比较采用单因素方差分析(one-way ANOVA);比较两个剂量的RGR时,采用独立样本t检验;差异性显著率以0.05为标准。
2 结果
2.1 双黄连口服液处理24 h后对各种细胞的影响表1显示,双黄连口服液处理24 h后,各种细胞的增殖率有随着剂量的降低而升高的趋势,且有较好的剂量-效应关系(P<0.05);1/4~1(原液)浓度的双黄连口服液抑制所有细胞的增殖;1/8浓度的该药抑制HepG2、HEK293、SHSY5Y、HCF细胞增殖,但对WI-38细胞无影响;1/4~1/32浓度对HEK293细胞的增殖有抑制作用,而对其它细胞无影响。

表1 双黄连口服液处理24小时后各种细胞的相对增值率(%)
2.2 双黄连口服液处理48 h后对各种细胞的影响由表2看出,双黄连口服液处理48 h后,该药对各种细胞的抑制有随着剂量的升高而升高的趋势,且有较好的剂量-效应关系(P<0.05);1/16~1(原液)浓度的双黄连口服液抑制所有细胞的增殖;1/32浓度的该药对HepG2细胞仍有抑制作用,对WI-38、HEK293、SHSY5Y、HCF细胞无影响。
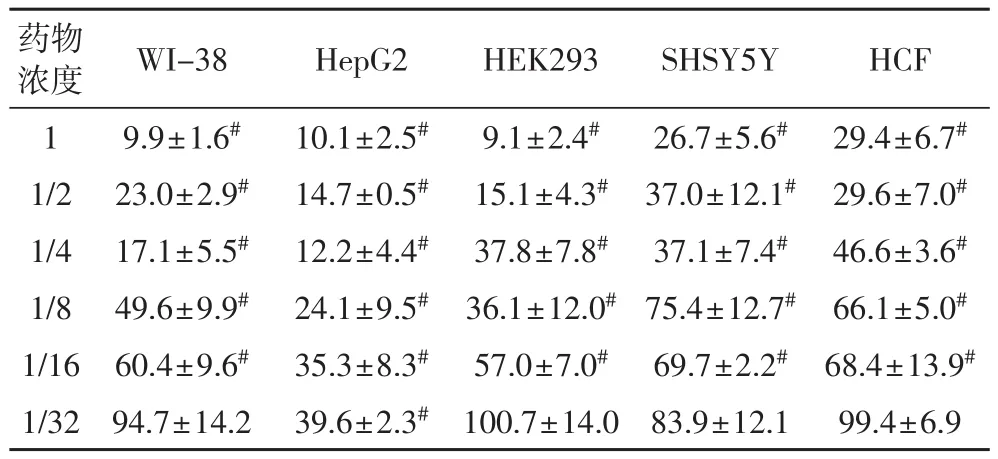
表2 双黄连口服液处理48小时后各种细胞的相对增值率(%)
2.3 双黄连口服液处理72 h后对各种细胞的影响由表3可知,双黄连口服液处理72 h后,各种细胞的增殖率有随着药物剂量的降低而升高的趋势,且存在较好的剂量-效应关系(P<0.05);1/32~1(原液)浓度的该药抑制HepG2、HEK293、SHSY5Y、HCF细胞的增殖;1/2~1(原液)浓度的双黄连口服液抑制WI-38细胞的增殖,1/32~1/4浓度的该药则对其无影响。
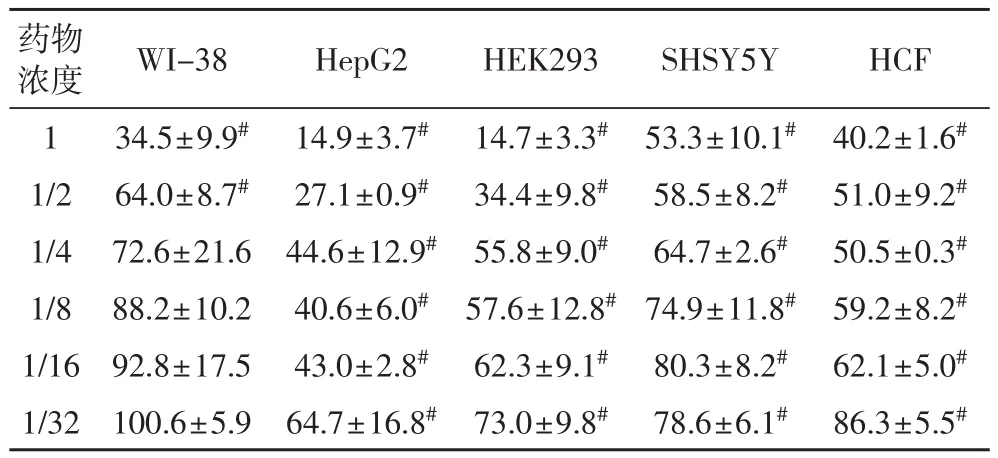
表3 双黄连口服液处理72小时后各种细胞的相对增值率(%)
3 讨论
发展基于细胞的体外毒性方法成为毒理方法学研究的主要发展趋势和研究热点。多器官细胞共培养方法克服了现行毒理学体外毒性研究方法存在的以下问题:1.仅能评价毒物对某种细胞的特定作用;2.多数毒物在体内需经代谢转化解毒或活化成毒性代谢产物,目前采用肝S9作为代谢活化系统不能完全模拟体内状况;3.不同器官细胞具有不同的受体和损伤修复机制[9]。为此,张天宝教授等发展了大鼠肝、肾、神经、心、肺等多器官原代细胞共同培养的方法,表明可作为靶器官毒性的筛选方法[10]。基于以前的研究,本文将人类WI-38、HepG2、HEK293、SH-SY5Y和HCF细胞共同培养,用于检测双黄连口服液潜在的细胞毒性,以期为以后的用药方案提供参考。
双黄连口服液的成分为金银花、黄芩、连翘,辅料为蔗糖;其功能主治为清热解毒,用于风热感冒发热,咳嗽,咽痛;目前报道的不良反应为过敏反应。我们的研究发现,双黄连口服液处理24、48、72 h后,各种细胞的增殖率有随着剂量的降低而升高的趋势、且有较好的剂量-效应关系,提示该药对WI-38、HepG2、HEK293、SH-SY5Y、HCF细胞可能均有毒性。因为该药的辅料为蔗糖,说明药物的毒性可能来自金银花、黄芩、连翘本身或其它杂质。
双黄连口服液处理后,该药仅在72 h后的1/32浓度对HEK293细胞无影响,说明该药对HEK293细胞有较大的毒性、肾脏可能是该药潜在的靶器官,无论是短期还是长期服用该药物,要注意对肾功能进行监测。处理24 h后,1/8~1(原液)浓度的双黄连口服液抑制HepG2细胞,说明短时间内中、高浓度的该药可造成肝细胞的损伤;处理48、72 h后,所有浓度的该药均抑制HepG2细胞增殖;以上说明双黄连口服液对肝细胞有较强的毒性,尤其是长时间作用于肝细胞后可导致其损伤,提示较长时间使用该药要注意观察肝功能。处理24 h后,1/8~1(原液)浓度的双黄连口服液抑制SHSY5Y和HCF细胞,说明短时间内中、高浓度的该药可造成神经、心肌细胞的损伤;处理48 h后,1/16~1(原液)浓度的该药抑制SH-SY5Y和HCF细胞,而72 h后,所有浓度的药物均抑制SH-SY5Y和HCF细胞,提示作用时间越长,双黄连口服液对神经、心肌细胞增殖率抑制越大。1/16~1(原液)浓度的该药在染毒48 h后均抑制WI-38细胞,而在24 h后是1/4~1(原液)浓度、在72 h后是1/2~1(原液)浓度抑制WI-38细胞增殖,说明此药对肺的毒性稍弱。
综上所述,双黄连口服液对肺、肝、肾、神经和心肌细胞可能都有毒性,其对各种细胞可能的毒性大小顺序为肾细胞>肝细胞>神经、心肌细胞>肺细胞。由于该药为口服液,需要经过胃肠道吸收后才进入血液和各个器官,到达器官后药物毒性可能会减弱,但是仍然切忌大剂量、长时间用药。
[1] Shaw D. Toxicological risks of Chinese herbs [J]. Planta Med, 2010, 76(17): 2012-2018.
[2] Williamson EM, Lorenc A, Booker A, et al. The rise of traditional Chinese medicine and its materia medica: a comparison of the frequency and safety of materials and species used in Europe and China [J]. J Ethnopharmacol, 2013, 149(2): 453-462.
[3] Zhang L, Yan J, Liu X, et al. Pharmacovigilance practice and risk control of Traditional Chinese Medicine drugs in China: current status and future perspective [J]. J Ethnopharmacol, 2012, 140(3): 519-525.
[4] Uzuner H, Bauer R, Fan TP, et al. Traditional Chinese medicine research in the post-genomic era: good practice, priorities, challenges and opportunities [J]. J Ethnopharmacol, 2012, 140(3): 458-468.
[5] 魏会妙, 尹洪萍, 阎政礼, 等. 利用大鼠体外多器官细胞共培养方法检测红霉素、链霉素、多柔比星和白消安的细胞毒性[J]. 中国药理学与毒理学杂志, 2015, 29(1): 98-104.
[6] 周继春, 杨海燕, 徐晓月, 等. 柴胡注射液体外细胞毒性研究[J]. 药物分析杂志, 2010, 30(9): 1809-1812.
[7] 阮浩澜, 陈琪, 黎旸, 等. 中药注射液体外肾细胞毒性评价的方法学探讨[J]. 中国医药导报, 2014, 11(25): 11-14.
[8] 司徒镇强, 吴军正. 细胞培养[M]. 北京: 世界图书出版公司, 2004, 250-252.
[9] 许桂凤, 朱江波, 郑怡文, 等. 大鼠体外多器官细胞共培养模型的建立[J]. 中华劳动卫生职业病杂志, 2010, 28(7): 482-487.
[10] Albert P. Li, Chris Bodec, Yumiko Sakai. A novel in vitro system, the integrated discrete multiple organ cell culture(IdMOC)system, for the evaluation of human drug toxicity: comparative cytotoxicity of tamoxifen towards normal human cells from five major organs and MCF-7 adenocarcinoma breast cancer cells [J]. Chemico-Biological Interactions, 2004, 150(1): 129-136.
Investigating cytotoxicity induced by Shuanghuanglian oral liquid with the human IdMOC model
Yu Hai-ming1, He Ming2, Tang Jia-long2, Yu Feng-jiang3, Yan Zheng-li2, Fu Hu2, Zhu Yong-fei2
(1. Department of Critical Care Medicine, The First Affiliated Hospital / The People's Hospital of Hunan Province, Changsha 410005, China;
2. School of Medicine, Hunan Normal University, Changsha 410013, China;
3. School of Chemistry and Chemical Engineering, Hunan Normal University, Changsha 410013, China)
Objective To observe the cytotoxicity and its features, induced by Shuanghuanglian oral liquid, of human's different target organs cells cultured in vitro. Methods After the human IdMOC(integrated discrete multiple organ cell culture)model was administrated with Shuanghuanglian oral liquid for 24 hours, 48 hours and 72 hours, the growth of WI-38, HepG2, HEK293, SH-SY5Y and HCF cells was detected. Results After Shuanghuanglian oral liquid was treated the cells for 24, 48, 72 hours respectively, the relative growth rates of all kinds of cells were increased with the drug's concentration reducing, and there is a good dose-response relationship. Except that there is no effect on HEK293 cells induced by only the concentration of 1/32 of the drug after treated 72 hours, all kinds of cells proliferation was inhibited by all different concentration of Shuanghuanglian oral liquid at all time-points. After administrated by Shuanghuanglian oral liquid for 24 hours respectively, the proliferation of WI-38 cells was inhibited among the concentration of 1/4~1 of this drug, and that of HepG2, SH-SY5Y and HCF cells was among 1/8~1. The proliferation of WI-38, HepG2, SH-SY5Y and HCF cells was inhibited among the concentration of 1/16~1 of Shuanghuanglian oral liquid after treated 48 hours, and after 72 hours the proliferation of WI-38 cells was inhibited between the concentration of
IdMOC(integrated discrete multiple organ cell culture)model; Shuanghuanglian oral liquid; cytotoxicity
R114
A
1673-016X(2016)05-0004-04
2016-07-16
湖南省科技计划项目课题(2015SK2036)
朱勇飞,E-mail:njzhu70@163.com
1/2~1, and that of HepG2, SH-SY5Y and HCF cells was inhibited by all different concentration of this drug. Conclusion There might be cytotoxicity of Shuanghuanglian oral liquid to WI-38, HepG2, HEK293, SH-SY5Y and HCF cells, and the possible toxicity order of this drug was renal cells > hepatocytes > neural cells, cardiomyocytes > lung cells.
