山西省猪胸膜肺炎放线杆菌分离及药敏实验
2016-11-30雷宇平张仲萍罗甜甜山西省动物疫病预防控制中心030027
雷宇平 张仲萍 罗甜甜 (山西省动物疫病预防控制中心 030027)
山西省猪胸膜肺炎放线杆菌分离及药敏实验
雷宇平 张仲萍 罗甜甜 (山西省动物疫病预防控制中心 030027)
为了解山西省胸膜肺炎放线杆菌的流行分布及耐药情况,以确定有效的防控措施和用药计划,从山西省20个猪场采集疑似猪传染性胸膜肺炎的病料组织,经分离培养、生化鉴定、PCR检测和药敏实验。确定3株分离株为猪胸膜肺炎放线杆菌。药敏实验结果表明,3株菌对头孢克肟、氟苯尼考和氨苄西林最为敏感;对阿莫西林、恩诺沙星、环丙沙星等7种抗菌药物为中敏;而对链霉素、庆大霉素、强力霉素、四环素和氯霉素表现出耐药性。
胸膜肺炎放线杆菌;分离鉴定;PCR检测;耐药性
胸膜肺炎放线杆菌 (Actinobacillus pleuropneumoniae,APP)属于巴氏杆菌科嗜血杆菌属,是革兰氏阴性杆菌,有很强的致病性,能够引起猪传染性胸膜肺炎。猪传染性胸膜肺炎放线杆菌可以经消化道和呼吸道感染各年龄段的猪群[1],最常见的病理变化是肺脏出血、坏死和纤维素性渗出。急性感染的猪死亡率高,慢性感染的猪生长缓慢、饲料报酬低[2]。该病在我国的发生率逐年上升,已经严重危害到我国养猪业的发展[3-5]。APP血清型有15种[6],地域分布广,再加上长期不合理地使用抗菌药物使其产生耐药性,导致该病的诊断和防控工作异常艰巨。为了解山西省APP的流行分布及耐药情况,以确定有效的防控措施和用药计划,本研究于2014年对山西省11个地区的20个猪场进行了调查。
1 材料与方法
1.1 病料
2014年1月至12月,从山西省11个地区猪场采集病死猪的肺脏、肝脏、心脏、脾脏等病变组织。
1.2 培养基和试剂
营养琼脂培养基、麦康凯培养基购于国药集团化学试剂有限公司;微量生化管、药敏纸片购于杭州天和微生物试剂有限公司;Premix Taq,DL2000 DNA Marker ladder购于宝生物工程 (大连)有限公司。
1.3 细菌分离培养
无菌取病料,用接种环在血平板上划线,置于10%CO2,37℃培养24h,将疑似菌落接种到麦康凯培养基上。
1.4 生化试验
将纯化的细菌接种到微量生化管中,置于10%CO2,37℃培养24~48h,观察结果。
1.5 药敏试验
采用K-B药敏纸片法,将纯化的菌落均匀涂布于琼脂平板上,将药敏纸片贴于培养基表面,37℃培养12~16h,观察结果,并依据药敏试验抑菌环直径判断标准来判定试验结果。
1.6 致病性试验
将分离获得的菌株活化后接种于5% (v/v)的绵羊血琼脂培养基中,37℃培养18~24h后,稀释菌液,使其浓度为3×1010cfu/ml。取80只40日龄的猪,随机分成试验组1(菌株1),试验组2(菌株2),试验组3(菌株3)和对照组,每组20只,试验组各猪予肌肉注射3ml各分离菌株,对照组各猪肌肉注射等体积灭菌生理盐水。观察发病和死亡情况、剖检变化,并进行细菌分离。
1.7 PCR检测
根据Alain[7]等的方法,设计并合成一对针对APP保守序列APXIV的特异性引物:上游:5'-TGGCACTGACGGTGATGA-3',下游:5'-GGCCATCGACTCAACCAT-3',对分离株进行PCR检测。用DNA提取试剂盒制备分离株的基因组DNA作为PCR扩增的模板,加入酶、引物和ddH2O后,按照以下程序进行扩增:94℃预变性5min,94℃变性30s,54℃退火30s,72℃延伸40s,30个循环,72℃后延伸10min。取5μL PCR产物,用1%琼脂糖凝胶进行电泳分析。
2 结果
2.1 细菌分离培养特征
该菌在10%CO2,37℃培养条件下生长良好,24h形成1~2mm湿润、半透明、边缘整齐的菌落。经革兰氏染色,镜检为阴性小杆菌,菌体平直,单个或双个存在。
2.2 生化实验
3株分离株生化鉴定结果完全相同 (表1),葡萄糖、甘露糖、果糖、麦芽糖、VP试验、尿素酶、氧化酶、透明质酸酶和过氧化氢酶实验均为阳性;甘露醇、山梨醇和MR实验为阴性。
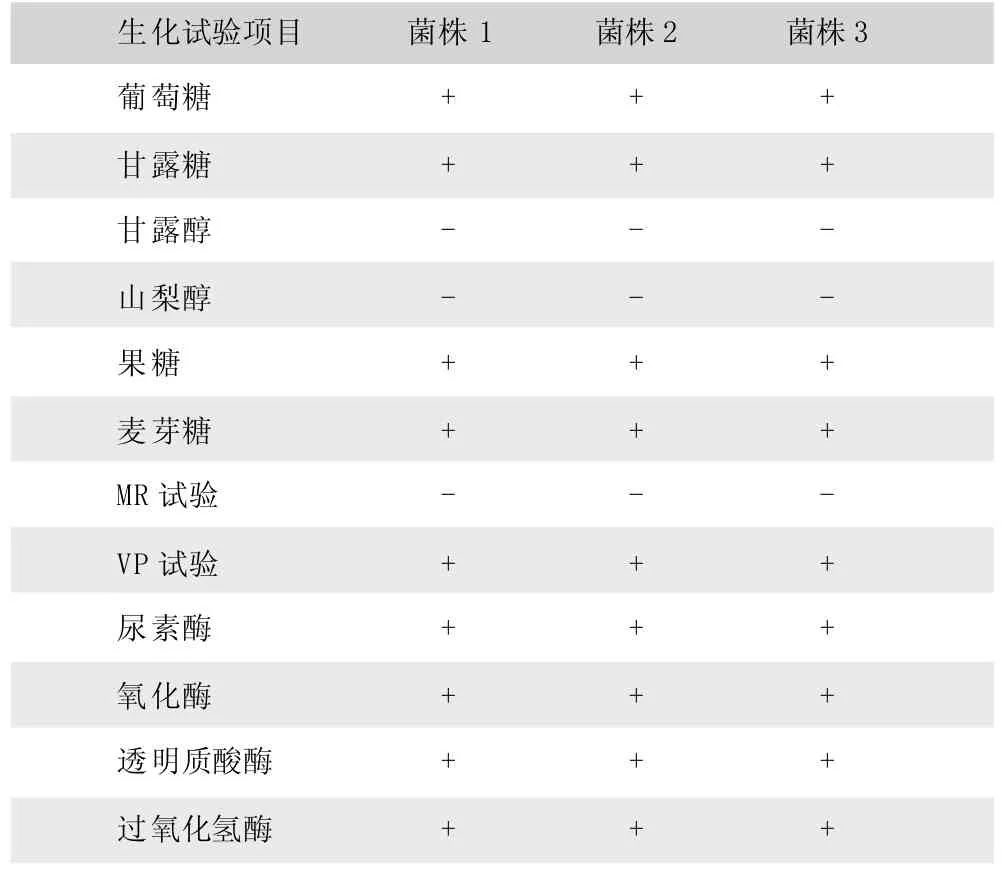
表1 菌株的生化鉴定结果
2.3 PCR鉴定
对菌株进行PCR检测,扩增出422bp的片段 (附图),说明该菌株为胸膜肺炎放线杆菌。
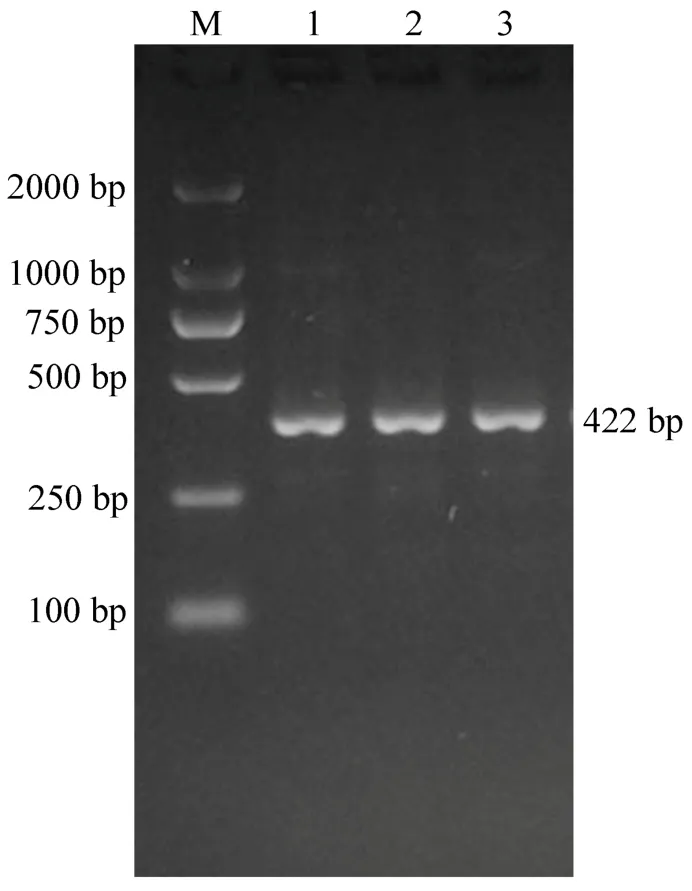
附图 PCR检测结果
2.4 致病性试验
40日龄试验猪感染后,各实验组第2天猪群开始发病,试验组1有13只发病,试验组2有15只发病,试验组3有14只发病,第3天各试验组试验猪均发病并出现临床症状,主要症状为精神沉郁,高温,呼吸困难。第4天出现死亡高峰,剖检可见纤维素性胸膜炎非常明显,严重的发现肺实质黏附在胸膜壁上。取病死猪的肺部进行细菌分离鉴定,其生化特性与接种菌一致。
2.5 药敏试验
由表2可见,3株菌对头孢克肟、氟苯尼考和氨苄西林最为敏感;对阿莫西林、恩诺沙星、环丙沙星等7种抗菌药物为中敏;对链霉素、庆大霉素、强力霉素、四环素和氯霉素表现出耐药。
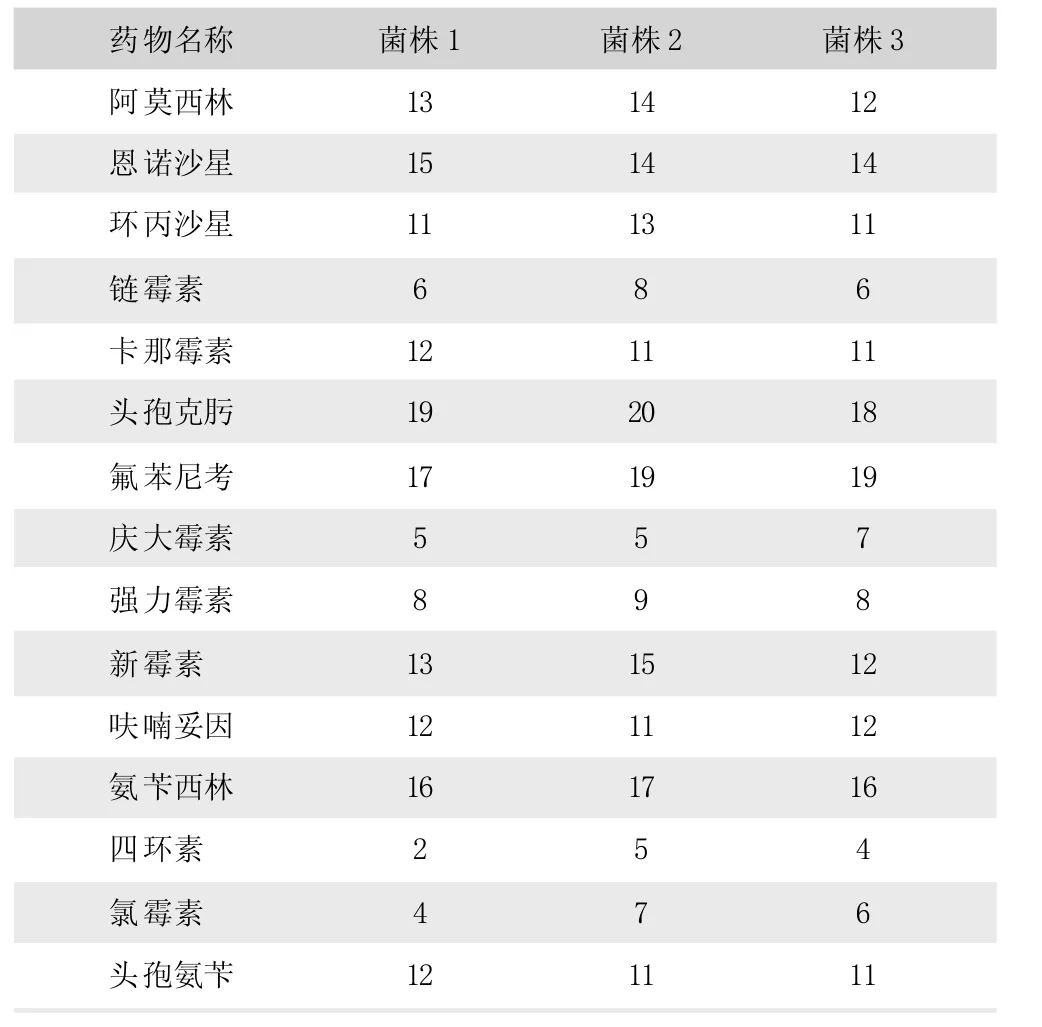
表2 分离猪传染性胸膜放线杆菌药敏试验
3 讨论
目前,实验室常用的APP诊断方法有血清学试验包括间接凝集试验、补体结合反应、玻片凝集试验、乳胶凝集试验、琼脂扩散试验和ELISA等方法。由于APP有很多血清型,各血清型之间没有很好的交叉反应[8],从而会影响血清学试验的准确性。而细菌分离培养、生化试验等方法费时费力。因此,建立一种方便快捷并且灵敏度高的诊断方法非常必要。
根据瑞士Alain Schaller[7]报道,以App所有血清型菌株做模板,用PCR方法都能扩增出APX IVA基因片段,而从其他亲缘关系相近的细菌中无法扩增这一片段,说明APX IVA基因具有很高的种特异性。因此本研究参照Alain的方法,对3株分离株进行PCR鉴定。结果显示,3株分离株均为胸膜肺炎放线杆菌。在此基础上,本研究继续对这3株APP进行常用抗菌药物敏感性试验。结果显示3株胸膜肺炎放线杆菌对链霉素、庆大霉素、强力霉素、四环素和氯霉素表现出耐药性且都表现出多重耐药,这与国内其他地区的报道[9-11]存在一定差异。究其原因可能是各地区使用的抗菌药物种类和用药时间有差异,也可能与细菌的血清型不同有关。
本研究通过对山西省11个地区20个猪场采集病料组织,经过细菌分离培养、生化培养和PCR鉴定,获得3株胸膜肺炎放线杆菌。对3株分离株进行药物敏感性试验测定,结果显示对链霉素、庆大霉素、强力霉素、四环素和氯霉素表现出耐药性。本研究为山西地区猪场防控APP,指导临床合理使用抗菌药物提供了科学依据。
[1]蔡宝祥.家畜传染病[M].2版.北京:中国农业出版社,1996.
[2]Savaeye C,Jobert,J L,Berthelot herault F,et al.A PCR assay used to study aerosol transmission of actionobacillus pleuropneumoniae from samples of live pigs under experimental conditions[J].Veterinary Microbiology,2000,73:337-347.
[3]陈如明,谢鸣星,李云峰,等.鲁豫地区驻军猪传染性胸膜肺炎血清学调查[J].中国畜禽传染病,1990(4):38-40.
[4]邬捷,姜永康,曹国文,等.四川猪嗜血杆菌胸膜肺炎血清学调查[J].动物检疫,1990(6):21-22.
[5]华云龙,张应国,钟南.云南猪传染性胸膜肺炎血清抗体调查[J].动物检疫,1992,9(3):27.
[7]SchallerA,Kuhn R,KuhnertP,et al.Characterization of apxIVA,a new RTX determinant of Actinobacillus pleuropneumoniae[J].Microbiology,1999,145(Pt 8):2105-2116.
[8]Freddy Haesebrouck,Anita Van de Kerkhof.Cross protection between Actionbacillus pleuropneumoniaes biotypes serotpes in pigs[J].Veterinary Microbiology,1996,52(3-4):277-284.
[9]何启盖,王贵平,刘军发,等.猪胸膜肺炎放线杆菌的分离鉴定及药敏试验[J].中国预防兽医学报,2003,25(5):360-363.
[10]李晓华,杨小燕.猪胸膜肺炎放线杆菌的分离鉴定[J].中国兽医科技,2003,33(3):49-51.
[11]周信荣,宋德平,彭棋,等.猪胸膜肺炎放线杆菌的分离鉴定、毒力基因检测及药敏试验[J].2016,37(1):67-71.
山西省科技攻关项目;项目名称:猪工厂化健康养猪精准技术体系研究——猪呼吸系统主要细菌病综合防控技术研究;项目编号:20140311020—6。
