药用真菌桑黄原生质体的制备和诱变*
2016-11-30许谦
许谦
(菏泽学院生命科学系,山东菏泽274015)
药用真菌桑黄原生质体的制备和诱变*
许谦
(菏泽学院生命科学系,山东菏泽274015)
利用酶处理桑黄(Phellinus igniarius)菌丝体,分离到原生质体并对其进行紫外线诱变,确定诱变后的致死率,以利于桑黄原生质体诱变及融合的合理实施。菌龄为10 d的桑黄菌丝体在1.5%溶壁酶、100 r·min-1、30℃条件下酶解3 h,获得原生质体;再分别经紫外线照射10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s、90 s后;利用血球计数板对美兰染色后的活性原生质体计数,计算桑黄原生质体紫外诱变后的致死率。结果显示,原生质体致死率随着照射时间的延长而增大,在40 s~50 s诱变时间内,曲线的变化最为剧烈;诱变时间为45 s时,致死率达到73%;诱变时间达到90 s时,致死率为100%。该结果能够为桑黄原生质体诱变育种及融合育种的实施提供切实的理论依据。
桑黄;原生质体;制备;诱变
桑黄(Phellinus igniarius)属于担子菌亚门(Basidiomycotina)层菌纲(Hymenomycetes)[1],是目前国际公认的抗癌效果最好的药用真菌之一[2-3],具有抗氧化、抗炎、降血脂、抗胃溃疡、抗菌、抗病毒等多种药理活性[4-5]。主要分布在中国、韩国、日本、朝鲜、俄罗斯远东地区、菲律宾、澳大利亚、北美、中南美等地,被现代人称为“森林黄金”[6]。
桑黄子实体自然形成周期长,其产品难以满足市场需求。为高效生产其产品,一方面依靠液体培养,缩短桑黄产品的生产时间[7];另一方面则进行桑黄高产菌株的育种研究[8-10]。原生质体诱变是一种行之有效的育种方法[11-13]。微生物原生质体因细胞壁缺失而对外界刺激敏感度提高,使诱变的生物学效率更加明显,有利于变异菌株的筛选和诱变机理探讨[1 4-1 5]。诱变剂有物理诱变剂和化学诱变剂,两者可单独使用也可复合使用。常用的物理诱变剂有紫外线、γ射线、激光、离子注入等,而化学诱变剂有烷化剂(NTG等)、碱基类似物(5-BU等)、脱氨基(亚硝酸)、移码诱变剂(吖啶类染料等)等[16]。紫外线作为物理诱变剂,因设备简单,成本低,诱变效果好,被广泛应用于诱变育种[17-24]。
诱变育种有2个重要的环节,即诱变和筛选,筛选重于诱变。筛选需要经验积累基础上的合理判断。有研究认为,原生质体诱变后,其致死率在70%~80%,获得的正突变菌株比率较高[25-26]。原生质体诱变的另一个作用是原生质体致死。原生质体致死是进行原生质体融合的一个有效方案。双亲原生质体致死后进行融合,便于融合子的顺利检出。但原生质体最好是在刚刚致死的状态下才有利于融合的成功实现[27]。所以100%致死率的精确判断会为原生质体的高效融合奠定坚实的基础。
本试验是为有效地进行桑黄原生质体诱变育种和原生质体融合育种而进行的前期工作,拟探索桑黄原生质体的制备及紫外线诱变技术,总结桑黄原生质体诱变后的致死率规律,为桑黄原生质体诱变育种及融合育种的实施提供切实的理论依据。
1 材料与方法
1.1材料与试剂
桑黄菌由菏泽学院生命科学系微生物实验室保藏;马铃薯、玉米粉、麸皮均为山东菏泽牡丹区生产;溶壁酶>2 000 μ·mg-1,上海蓝季科技发展有限公司;葡萄糖为AR,汕头市西陇化工厂有限公司;硫酸镁为AR,天津市河东区红岩试剂厂;磷酸二氢钾为AR,天津市科密欧化学试剂有限公司;乙醇95%,安徽安特生物有限公司;甘露醇均为AR,天津市科密欧化学试剂有限公司;琼脂粉为BR,天津市科密欧化学试剂有限公司。
1.2仪器与设备
高压蒸汽灭菌器MLS-3780,日本三洋电器株式会社;标准型双人净化工作台SW-CJ-1C,苏净集团苏州安泰空气技术有限公司;单人单面紫外诱变台(垂直)ZYT-DDC,济南杰康净化设备厂;恒温培养箱PYX-250B-Z,上海博讯实业有限公司;全温振荡器HZQ-Y,哈尔滨市东联电子技术开发有限公司;电冰箱BCD-282VBP,海信(北京)电器有限公司;药品保存箱HYC-360,上海肯强仪器有限公司;电子天平FA1004,梅特勒-托利仪器有限公司;移液枪brand,上海恒奇仪器仪表有限公司;台式高速冷冻离心机HR/T20M,湖南赫西仪器装备有限公司;血球计数板1103,姜堰市慧成玻璃制品厂;电热鼓风干燥箱01932,北京市永光明医疗仪器厂。
1.3方法
1.3.1培养基配制
PDA培养基:马铃薯200 g,去芽去皮切成小块,沸水中煮20 min,4层纱布过滤,取滤液,加入葡萄糖20 g、琼脂18 g,加水定容至1 000 mL,pH值为6,121℃蒸汽灭菌20 min。
液体培养基:玉米粉25 g、麸皮35 g,沸水中煮30 min,4层纱布过滤,取滤液加入硫酸镁1.5 g、磷酸二氢钾1 g,加水定容至1 000 mL,pH值为6,121℃蒸汽灭菌20 min。
1.3.2菌种活化
在无菌的条件下,将原种接种到PDA培养基平板上进行活化培养18 d。
1.3.3液体培养
菌种平板活化培养18 d后,在无菌条件下,用灭菌打孔器在活化平板外圈打取菌饼(直径1 cm),向装有50 mL液体培养基的250 mL锥形瓶中接入2个菌饼,29℃、160 r·min-1条件下液体培养10 d。
1.3.4桑黄原生质体制备的前期工作
(1)酶解液的制备(配制1.5%溶壁酶)
称量固体粉末状的溶壁酶0.12 g,放入15 mL灭菌离心管内,用灭菌的5 000 μL枪头取8 mL、0.6 mol·L-1渗透压稳定剂于上述15 mL离心管内溶解酶液。溶解起始时,由于酶制剂在冰箱内保存,易结成小块状固体,可上下颠倒离心管数次,使其完全溶解混匀。用无菌针管吸取15 mL离心管内的8 mL酶液,将针头拔掉,向上推出管内多余空气,再将0.22 μm灭菌微孔滤膜的两头,分别与针管和无菌针头安装,取另一支15 mL灭菌离心管,将酶液缓慢推入其中,过滤除菌后,上下颠倒离心管数次,使其混匀,置于离心管架待用。
(2)称量桑黄菌丝体
超净工作台灭菌30 min,无菌操作取29℃、160 r·min-1条件下摇床培养10 d的菌丝体,8层灭菌纱布过滤,无菌水洗涤2次,用牙签钝头搅拌,洗涤干净后用灭菌滤纸吸去表面水分,并用灭菌镊子挑取个体较小的菌丝体于放有称量纸的灭菌培养皿的天平上称量,称取5份150 mg菌丝体,分别放入5个2 mL灭菌EP管内待用。
1.3.5桑黄原生质体的制备
在无菌条件下,按150 mg湿菌丝加0.5 mL酶液,用1 000 μL移液枪取无菌酶液(5份)0.5 mL分别加入到上述待用的5个2 mL的EP管中,用牙签钝头搅拌,使EP管中的菌丝体与酶液混匀,在30℃下以100 r·min-1转速摇床振荡3 h[1]。
1.3.6桑黄原生质体的精制
将5个EP管的酶解液分别倒入灭菌漏斗中过滤,并用灭菌渗透压稳定剂洗涤2 mLEP管,每个EP管用1 000 μL移液枪量取0.5 mL的0.6 mol·L-1灭菌渗透压稳定剂冲洗,重复2次,合并冲洗液倒入灭菌漏斗中过滤,并用牙签钝头缓慢搅拌,过滤除去菌丝碎片,用1 000 μL移液枪吸取滤液置于50 mL灭菌离心管中,用0.6 mol·L-1灭菌渗透压稳定剂冲洗过滤使用的锥形瓶,将冲洗液倒入上述50 mL离心管中,稀释到15 mL,3 800 r·min-1离心10 min去上清液,用0.6 mol·L-1灭菌渗透压稳定剂洗涤2次,得到纯化后白色的桑黄原生质体沉淀。稀释后,通过血球计数板计数求得桑黄原生质体的平均产量。
1.3.7桑黄原生质体的紫外诱变
将原生质体用0.6 mol·L-1渗透压稳定剂稀释成原生质体悬液,用洁净的血球计数板计数,稀释到浓度1.58×106个·mL-1待用[17]。无菌操作下用1 000 μL移液枪各取1 mL稀释原生质体悬液于27个直径6 cm的培养皿中,轻微晃动,使菌液均匀分布在培养皿中,将培养皿放入距15 W的紫外灯管30 cm处(已预热30 min),打开皿盖进行紫外诱变,1组10 s,2组20 s,3组30 s,4组40 s,5组50 s,6组60 s,7组70 s,8组80 s,9组90 s,每组3个重复。诱变结束后,用移液枪吸取适量于血球计数板上,0.01%美兰染色后,计算诱变后桑黄原生质体的致死率,求3个重复的平均值。
(3)对供电可靠性要求较高的小区内,需要在环网柜进线侧加装电流互感器,选择型号为LZZB610 0.5/10P,额定电压10 kV,用作电气测量和电力保护。
1.3.8桑黄诱变原生质体致死率计算
诱变致死率(P)计算公式为:
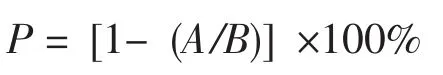
式中:A为诱变后存活的原生质体数,即经酶处理后的混合液用高渗溶液稀释,经紫外线诱变后,在显微镜下,血球计数板上存活的原生质体数(无色或淡蓝色原生质体,个/中格);B为未经诱变存活的原生质体数,即经酶处理后的混合液,用高渗溶液稀释,在显微镜下,血球计数板上存活的原生质体数(无色或淡蓝色原生质体,个/中格)。
2 结果与分析
2.1桑黄原生质体在显微镜下的形态
将纯化的白色原生质体沉淀,用0.6 mol·L-1灭菌渗透压稳定剂适当稀释后,得到原生质体悬液,用血球计数板观察桑黄原生质体的显微形态(图1)。
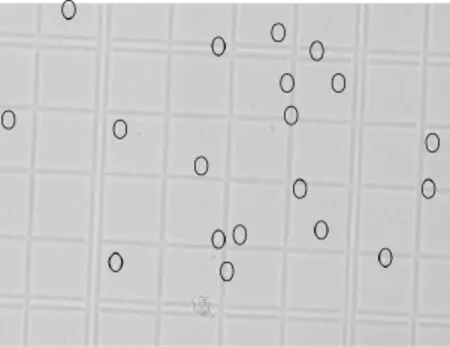
图1 桑黄原生质体的显微形态(×40)Fig.1 Microscopic morphology of Phellinus igniarius protoplast(×40)
图1显示,去壁后所得到的桑黄原生质体,个体较大,形态圆润,折光性较低。可能是由于经溶壁酶处理后,细胞外层仅有一层细胞膜,细胞膜外层不再有细胞壁的存在,使细胞的形态不再受细胞壁的限制,因此细胞形态在适当范围内变大,呈圆球状。由于细胞失去细胞壁,这就意味着细胞同时也失去了细胞壁中折光性较强的成分,使之在显微镜下表现为细胞折光性降低。
2.2桑黄原生质体的产量
桑黄原生质体的产量为5个重复所获原生质体产量的平均值,即4 576万个·mL-1,见表1。
由表1可以看出,标准差(SD)为47.79,数值较小,说明5个重复桑黄原生质体的产量比较稳定,相对标准差(RSD)为1.04%,表示5个重复桑黄原生质体产量精密度较高。
2.3桑黄原生质体紫外线诱变后的致死率
诱变结束后,用移液枪吸取少量诱变后菌液于血球计数板上,计数中方格平均活性原生质体数(0.01%美兰∶原生质体悬液=9∶1,染色5 min,对无色或淡蓝色的活性原生质体进行计数),其结果见表2、图2。
由图2可以看出,桑黄原生质体经紫外线诱变10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s、90 s后,致死率随着时间的延长而增大,在40 s~50 s诱变时间内,曲线的变化最为剧烈,当诱变时间达到50 s以后,曲线变化趋于平稳,并于90 s达到100%。
根据试验结果,40 s~50 s诱变时间内,致死率由54%增加到87.3%,跨过了诱变育种的最佳致死率70%~75%的范畴;诱变90 s时,致死率达到100%。由于不能确认是否恰好达到100%,又设计了45 s和85 s两个诱变时间进行诱变。诱变结果是45 s时,致死率达到73%;85 s时,致死率为98.4%。所以可以确定用于诱变育种的最佳诱变时间为45 s[25-26],用于原生质体致死处理后进行融合育种的诱变时间以90 s为宜[27]。

表1 桑黄原生质体产量Tab.1Yield of Phellinus igniarius protoplast

表2 桑黄原生质体紫外线诱变后的致死率Tab.2Fatality rate of Phellinus igniarius protoplast after being mutagenized by UV
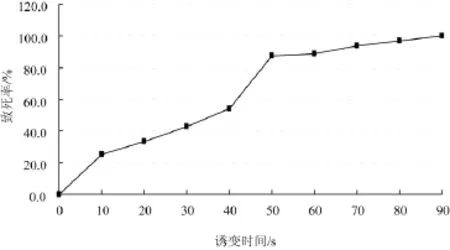
图2 桑黄原生质体致死率变化曲线Fig.2Phellinus igniarius protoplast fatality rate curve
3 讨论
原生质体诱变是一种有效的育种方式。丁兴红等[13]利用离子注入对桑黄原生质体进行诱变,获得了高产黄酮、多糖的菌株。El-Bondkly AM[17]曾用紫外线和NTG对木聚糖酶产生菌曲霉菌sp.NRCF5进行复合诱变,然后用于原生质体融合。Wang M[18]曾用紫外线和NTG对红豆杉内生菌Tubercularia sp.TF5的原生质体进行诱变,产生了新的代谢产物。祝子坪[8]利用紫外线与He-Ne激光对桑黄原生质体进行诱变,获得了新性状菌株。陈敏等[19]利用紫外线和γ射线对刺芹侧耳(Pleurotus eryngii GIM 5.280)原生质体进行复合诱变获得了木质素酶高产菌株,酶产量可达110 U·mL-1。李恒等[20]对亚麻刺盘孢ST的原生质体进行诱变,获得高产7α,15α-diOH-DHEA菌株,摩尔得率可达36.9%,比出发菌株提高了50%。梅凡等[21]对漆酶产生菌原生质体进行紫外诱变,获得诱变菌株UV-56,漆酶酶活比出发菌株提高56%。宋细忠等[22]采用紫外诱变方法对蝙蝠蛾拟青霉原生质体进行选育,选出l株菌丝体得率和腺苷含量明显高于原始菌株的诱变株,经过10代继代培养、摇瓶试验,结果表明该诱变株发酵性状稳定。Hou X[23]通过诱变和原生质体融合对木糖发酵酵母菌抑制剂耐受性能进行了改善。刘新星等[24]采用原生质体紫外诱变、DES(硫酸二乙酯)诱变、紫外等常规诱变技术结合高通量筛选的方法,筛选出可利霉素高产菌株。El-Bondkly AM[17]利用紫外线照射和NTG结合诱变的方法,对木聚糖酶产生菌曲霉菌sp.NRCF5进行复合诱变,获得高木聚糖酶产生菌。
本试验是在前期工作的基础上[1],对桑黄原生质体的制备及诱变进行了研究。研究发现,利用优化的原生质体制备方法可以获得高质量桑黄原生质体,取1 mL浓度为1.58×106个·mL-1的原生质体悬液于直径6 cm的培养皿里,在15 W紫外光灯(预热30 min)下30 cm处进行紫外诱变,诱变致死率随着时间的延长而增大,在40 s~50 s诱变时间内,曲线的变化最为剧烈,在45 s时达到73%,当诱变时间达到50 s以后,曲线变化趋于平稳,并在90 s时达到100%。
以上结果与祝子坪等[8]把桑黄原生质体(1 mL于直径6 cm的培养皿中)于15 W紫外灯(预热20 min)、灯距30 cm处诱变,0~20 s照射时间内,曲线变化剧烈,20 s后趋于平稳的结果不同。原因可能与诱变时原生质体悬液浓度不同有关。
另外,对于原生质体紫外致死的记载,有郭成金等[27]对蛹虫草原生质体致死的记载,认为距离30 W紫外光灯10 cm处,垂直照射13 min,能使原生质体致死率达到100%;有朱蕴兰等[28]对冬虫夏草原生质体诱变致死的记载,认为取3 mL浓度为105个·mL-1的原生质体悬液于直径9 cm的培养皿里,15 W紫外灯、灯距30 cm,诱变30 s,致死率达到80%,诱变40 s后,致死率达到90%;有吴强等[29]对莲花菌原生质体诱变致死的记载,认为取5 mL浓度为108个·mL-1的原生质体悬液于直径9 cm的培养皿里,15 W紫外灯、灯距30 cm,紫外诱变120 s时,原生质体的致死率为87.3%,300 s时,接近100%;有陈建中[30]对草菇原生质体诱变致死的记载,认为取0.1 mL浓度为105/mL的原生质体悬液涂布在培养基上,15 W紫外灯,灯距30 cm,原生质体致死时间为110 s;有刘海英[31]对杏鲍菇原生质体诱变致死的记载,认为取0.1 mL浓度为105/mL的原生质体悬液涂布在半固体培养基上,20 W紫外灯(245 nm,预热20 min),灯距30 cm,原生质体致死时间为120 s以上。造成紫外致死时间不同的原因可能与菌种不同、起始原生质体浓度不同、诱变的原生质体悬液量不同有关。
原生质体致死是原生质体融合有效实施的准备条件之一。紫外致死与热致死、离子注入致死相比,紫外致死用时较短,一般为1 min左右即完成灭活,处理迅速。热致死则需要较多时间,陈建忠[30]报道的草菇热致死条件为50℃,3 min,耗时较长;丁兴红[13]报道的离子注入的致死方式,对设施要求较高,准备工作较繁琐。所以,原生质体紫外致死具有省时、操作简单方便的优势。
4 结论
利用溶壁酶高效制备的桑黄原生质体在15 W紫外灯下30 cm处进行紫外诱变,诱变时间为45 s时,诱变致死率为73%,诱变时间为90 s时,诱变致死率为100%。
原生质体诱变后,其致死率达到70%~75%的诱变效果最好[25-26];致死率刚刚达到100%时利于进行致死后原生质体间的融合育种[27]。所以本试验结果对于进行桑黄原生质体的诱变育种及桑黄种间、桑黄与其他种间的原生质体融合的实施提供了理想的实验基础。
[1]许谦.桑黄菌原生质体的高效分离探究[J].核农学报,2014,28(11):1993-2000.
[2]胡启明.桑黄菌丝体多糖的分离纯化、结构鉴定及生物活性研究[D].武汉:华中农业大学,2013:51-52.
[3]Kim GY,Park SK,Lee MK,et al.Proteoglycan isolated from Phellinus linteus activates murine B lymphocytes via protein kinase C and protein tyrosin kinase[J].International immunopharmacology,2003,3(9):1281-1292
[4]王钦博.桑黄抗氧化活性成分的筛选及其分离纯化[D].上海:上海师范大学,2011:80-84
[5]Sangmoo Lee,Jin Il Kim,Jun Heo,et al.The Anti-influenza virus effect of Phellinus igniarius extract[J].Journal of Microbiology,2013,51(5):676-681
[6]曾念开.“桑黄”的鉴定、人工培养及优良菌株的选育[D].北京:中国协和医科大学,2007:3.
[7]许谦.桑黄菌丝体黄酮液体发酵培养基的优化[J].食品与机械,2015,31(1):190-193
[8]祝子坪,李娜,曲文娟,等.桑黄菌原生质体诱变及发酵菌株选育[J].食品科学,2008,29(11):473-476
[9]王宏媛.桑黄菌原生质体诱变育种及发酵工艺条件的研究[D].南京:江苏大学,2013:24-26.
[10]邱文娜,王秋颖,曾念开,等.桑黄原生质体融合菌株及其亲本生物学特性的比较研究[J].中国农学通报,2010,26(15):58-61.
[11]JunWei C.Ultraviolet mutagensis of the cellulose producer Aspergillus niger using industrial strain improvement[J]. FEMS Microbiol Letters,1988,50(1):1-4.
[12]祝子坪,马海乐,曲文娟.He-Ne激光与紫外线复合诱变桑黄菌原生质体的研究[J].应用激光,2007,27(3):220-223
[13]丁兴红,温成平,丁志山,等.低能离子射线诱变桑黄菌株SH009的初步研究[J].食用菌学报,2010,17(2):15-18
[14]祝子坪,马海乐.桑黄菌原生质体紫外线诱变及高产菌株选育[J].食用菌,2007(5):13-15
[15]张银萍,张舒,汪洋,等.灵芝原生质体的高效制备及诱变[J].安徽农业科学,2012,40(25):12379-12381.
[16]金志华,林建平,梅乐和.工业微生物遗传育种学原理与应用[M].北京:化学工业出版社,2007:52-58.
[17]El-Bondkly AM.Molecular identification using ITS sequences and genome shuffling to improve 2-deoxyglucose tolerance and xylanase activity of marine-derived fungus, Aspergillus sp.NRCF5[J].Applied Biochemistry Biotechnology,2012,167(8):2160-2173.
[18]Wang M,Liu S,Li Y,et al.Protoplast mutation and genome shuffling induce the endophytic fungus Tubercularia sp.TF5 to produce new compounds[J].Current Microbiology,2010, 61(4):254-60.
[19]陈敏,姚善泾.原生质体复合诱变选育剌芹侧耳木质素降解酶高产菌株[J].高校化学工程学报,2010,24(3):462-467.
[20]李恒,吴燕,魏利莎,等.原生质体诱变提高亚麻刺盘孢ST对底物DHEA的耐受性和转化率[J].化工进展,2014,33(9):2415-2420.
[21]梅凡,江义,赵超,等.漆酶高产菌株的筛选及诱变育种[J].贵州农业科学,2014,42(2):128-131.
[22]宋细忠,龚伯梁,徐长豪,等.蝙蝠蛾拟青霉原生质体紫外诱变育种[J].食用菌学报,2010,17(4):15-17.
[23]Hou X,Yao S.Improved inhibitor tolerance in xylose-fer- 2005(6):654-658.
[5]暴增海,马桂珍,吴智艳.鸡腿蘑对基质的降解及有关酶活性变化特点研究[J].北方园艺,2002(3):54-55.
[6]宋安东,周利霞,胡渝,等.产木质素降解酶类香菇菌株的筛选[J].河南农业大学学报,2006(3):307-310.
[7]李红,肖千明,刘娜,等.食用菌菌种退化原因分析及复壮方法的探讨[J].辽宁农业科学,2010(5):53-55.
[8]姚自奇,兰进.杏鲍菇研究进展[J].食用菌学报,2004(1):52-58.
[9]张志鸿.杏鲍菇工厂化高效栽培关键技术研究[D].福州:福建农林大学,2013.
[10]郑雪平,冀宏,尹永刚,等.中国杏鲍菇工厂化生产实践及问题分析与展望[J].食用菌,2014(1):7-11.
[11]谢玉荣,何桥兰.苏北杏7菇工厂化栽培技术研究[J].农业科技通讯,2015(12):161-162.
[12]郭艳艳,阮玲云,冯宏昌,等.不同营养条件下斑玉蕈菌丝生长及产酶特性[J].菌物学报,2014(3):697-705.
[13]刘红,黄建军,许丽娟等.谈食用菌菌种的保藏[J].现代农业科技,2008,(18):122-123.
[14]孔维丽,袁瑞奇,孔维威等.食用菌菌种保藏历史、现状及研究进展概述[J].中国食用菌,2015(5):1-5. menting yeast Spathaspora passalidarum by mutagenesis and protoplast fusion[J].Appllied Microbiology Biotechnology, 2012,93(6):2591-2601.
[24]刘新星,李萍,赵小峰,等.常规诱变结合高通量筛选选育可利霉素高产菌株[J].微生物学报,2013,53(7):758-765.
[25]诸葛健.工业微生物育种[M].北京:化学工业出版社,2006:87-88.
[26]田泱源,李瑞芳.响应面法在生物过程优化中的应用[J].食品工程,2010(2):8-11.
[27]郭成金,赵润,朱文碧.冬虫夏草与蛹虫草原生质体融合初探[J].食品科学,2010,31(1):165-171.
[28]朱蕴兰,陈安徽,王陶,等.冬虫夏草原生质体诱变育种研究[J].食品科学,2010,3(5):256-260.
[29]吴强,胡宝坤.原生质体紫外诱变选育莲花菌深层发酵多糖高产菌株[J].食用菌,2014(5):20-21.
[30]陈建中.基因组重排技术在草菇耐低温菌株选育上的应用[D].上海:上海海洋大学,2013:29.
[31]刘海英,张运峰,范永山,等.紫外线对杏鲍菇原生质体的诱变作用[J].核农学报,2011,25(4):719-723.
Preparation and Mutagenesis of Protoplast from Medicinal Mushroom Phellinus igniarius
XU Qian
(Department of Life Science,Heze University,Heze 274015,China)
In order to facilitate the reasonable implementation of Phellinus igniarius protoplasts mutagenesis and fusion,protoplast of Phellinus igniarius mycelia was obtained through the method of enzymolysis and mutagenized by UN,and the fatality rate was determined after mutagenesis.Protoplast was gained under the condition of strain age 10 d,1.5%lywallzyme solution, 100 r·min-1,30℃,3 h,and mutagenized by UV for 10 s,20 s,30 s,40 s,50 s,60 s,70 s,80 s,90 s respectively,active protoplasts after meilan dyeing were counted by using blood count slabs after mutagenesis,then the fatality rate was determined.Results showed that protoplast fatality rate increased with the extension of over time,in the 40 s and 50 s mutagenesis time,the shape of the curve varied sharply.When the mutagenesis time was 45 s,the fatality rate was 73%.When mutagenesis time was 90 s,the fatality rate reached 100%.The results will provide practical theory basis for the implementation of protoplast mutation breeding and the fusion breeding.
Phellinus igniarius;protoplast;preparation;mutagenesis
〈贮运加工〉
S646.9
A
1003-8310(2016)04-0067-06
10.13629/j.cnki.53-1054.2016.04.017
菏泽市科技发展计划项目(2012N002)。
许谦(1971-),女,硕士,副教授,主要从事食(药)用菌开发应用、微生物遗传育种研究。E-mail:xq710301@163.com
2016-06-02
