骨组织支架的计算机辅助设计方法综述
2016-11-29姚亚洲谢劲松范树迁
姚亚洲, 谢劲松, 范树迁
(1. 长春理工大学机电工程学院,吉林 长春 130022;2. 中国科学院重庆绿色智能技术研究院,重庆 400714;3. 智能增材制造技术与系统重庆市重点实验室,重庆 400714)
骨组织支架的计算机辅助设计方法综述
姚亚洲1,2, 谢劲松1, 范树迁2,3
(1. 长春理工大学机电工程学院,吉林 长春 130022;2. 中国科学院重庆绿色智能技术研究院,重庆 400714;3. 智能增材制造技术与系统重庆市重点实验室,重庆 400714)
随着先进的计算机辅助设计和增材制造技术的快速发展,使得制造具有复杂几何结构的骨组织支架成为可能。根据骨组织支架功能设计要求,从几何形态的角度出发将其结构分为规则性多孔结构和不规则多孔结构两大类,并综述了骨组织支架的设计方法,特别强调了两种适合增材制造的设计方法,即三周期极小曲面(TPMS)和拓扑优化。针对骨组织支架结构设计面临的技术挑战,展望了骨组织支架设计方法的可能发展趋势。
组织工程;骨组织支架;多孔结构;计算机辅助设计;增材制造
目前,对于大面积骨缺损问题,主要采取自体移植、异体移植,或采用金属合金、聚合物等各种人工骨替代物。虽然自体骨移植是治疗骨缺损最可靠的方法,但自体骨供应有限并且伴随新的创伤。异体骨经过处理可使其免疫原性降低,但同时也会造成骨传导、骨诱导能力的降低。而广泛应用的人工骨替代物由于在生物相容性和力学性能方面不匹配,并且不能参与正常的新陈代谢活动,有时还会产生异物反应。为此,人们正在探索新的途径和技术来破解骨缺损治疗的难题。而组织工程和增材制造技术的出现,为骨缺损的修复提供了新的方法。
近年来随着组织工程的发展,采用组织工程的原理和方法,制备有生物活性的人工骨,为修复骨缺损问题提供了一种有效的方法。组织工程研究涉及到支架、细胞和生长因子3个方面内容,其中骨组织支架的研究是组织工程中重要组成部分。骨组织支架不仅提供细胞生长的三维环境和新陈代谢的场所,而且还要起到支撑的作用,因而如何构建满足要求的支架是骨组织支架研究重点之一。理想的骨支架不仅要满足生物和机械性能要求,而且骨组织支架还需要具有个性化的外部形状,以符合取代部位的解剖学形态。然而制备骨组织支架的传统方法,如粒子洗出法、静电纺丝法、相分离/冻干法和气体成孔法[1-2],不能精确控制支架孔隙的尺寸而且孔的连通性不能得到保证,其结构形状也不能与骨缺损部位的解剖形态相吻合,不能实现个性化骨组织支架的制备,传统制备技术严重限制了个性化和功能化设计。
过去几年,组织工程受益于增材制造技术的发展。不像传统的减材制造是通过去除材料得到成型模型,增材制造是通过计算机辅助设计(computer aided design,CAD)数据采用材料逐层累加的方法制造实体零件,通过一层层的逐层制造,可以完成几乎任意复杂形状几何体的制造。增材制造技术可以实现对支架几何参数的精确控制,包括孔隙率、孔隙大小、形状和互连性;可以制造出符合功能要求的组织支架结构。能够制备组织支架的增材制造技术包括[3]:选择性激光烧结(selective laser sintering,SLS)、立体光固化成型(stereo lithography appearance,SLA)、熔融沉积成型(fused deposition modeling,FDM)、三维打印技术(three-dimensional printing,3DP)、电子束熔融(electron beam melting,EBM)和选择性激光熔化成型(selective laser melting,SLM)。
增材制造技术的出现,最大程度地解放设计者,使得设计自由化、功能化、个性化、结构仿生最大化。结合先进的CAD和增材制造技术的优势,人们对探索新颖的支架设计越来越感兴趣。为了更好地模仿自然骨结构的功能,人们提出了多种骨组织支架设计方法。然而在骨组织支架这一研究领域,更多的综述文章集中在组织支架的应用、材料和制备方法上,而系统性介绍组织支架设计方法的相对很少。本文的主要目的是综述现有的计算机辅助组织支架设计方法和策略,结合当前支架设计面临的问题给出了未来组织支架的发展趋势。
1 组织支架设计要求
骨组织支架设计要求在宏观结构方面,为了更好地与人体缺损部位相匹配,支架必须与患者自体骨表面轮廓相一致;在微观结构方面,骨组织支架应具有极其复杂的孔隙结构,提供一种有利于细胞的附着、繁殖和骨组织功能发挥的环境。骨组织支架除了其材料应具有生物相容性或降解性,其结构还要具有较高的孔隙率、良好的连通性和一定的机械强度。具体如下[4-5]:
(1) 生物性能方面:①良好的生物相容性,材料对宿主骨及组织无毒性、无致敏性和无排异性。能与骨质组织形成紧密结合,或者容易被降解并诱导新生组织的再生;②较高的比表面积和合适的表面化学性质,以利于细胞的附着、增殖及分化。
(2) 结构形态方面:①具有三维连贯的孔隙结构、合适的孔径大小和高的孔隙率,利于营养物质的吸收及代谢废物的排出,为组织生长提供空间和环境;②支架外部形态特征需符合缺损区的形态特征以获得所需的组织形状。
(3) 机械性能方面:具有良好的可塑性与一定的机械强度和刚度以匹配组织的应力环境,对于可降解材料,可通过对降解速度的控制,来保证在新生组织替代支架之前支架能起支撑作用。
(4) 可制造性方面:易于加工成各种所需形状和尺寸,并且适应增材制造加工工艺。
2 组织支架结构设计方法
虽然骨组织支架的设计方法有很多种,但现有文献中缺乏较全面的综述性介绍。本文从支架设计的几何形态的角度出发,将骨组织支架设计方法分为规则性多孔结构和不规则多孔结构2大类介绍与分析。
2.1 规则性多孔结构
虽然增材制造技术能够很容易控制支架内部结构,但由于生物组织的结构本质上是非均质而且很复杂。因此,很难准确地设计出接近自然骨组织的微观多孔结构。由于这些原因,多孔支架设计的研究工作大多集中在创建简单的多孔单元,在功能上等同于要修复的组织中的孔隙度和生物特性方面。为满足设计的支架具有特定的外部形状和可控的内部结构,不同的支架设计方法被提了出来。大多数依赖于使用具有良好机械性能和生物性能的单元结构,根据应用需要组装在一起形成复杂的支架结构。通过所需缺损部位的外表形状和周期性排列的多孔单元之间的布尔操作得到符合要求的组织支架。不同的多孔单元可以通过CAD软件或基于图像设计方法获得。另外最近几年基于三周期极小曲面(triply periodic m inimal surfaces,TPMS)和拓扑优化的方法也常常用来构造多孔单元。下面将规则性多孔支架的设计方法进行分类介绍。
2.1.1 基于CAD的设计方法
目前大多数商用CAD软件主要是基于实体或曲面建模,常用的几何设计方法包括构造实体几何法(constructive solid geometry,CSG)和边界表示法(boundary representation,B-Rep)。CSG是一种传统的CAD技术,在构造实体几何中,可以使用逻辑运算将不同实体组合成复杂的曲面或者实体。由CSG构造的复杂模型,通常可以由非常简单的体元组合形成,比如球体、立方体、圆柱体、棱柱等,通过布尔逻辑组合在一起。如果构造实体几何是参数化或者程序化构建的,则可以通过修改逻辑运算符或者对象的位置来对复杂对象进行修改。例如一个多孔单元可以通过图1所示的运算来构建。由于只能通过这些简单的体元表示,在设计复杂的支架内部孔隙结构常常会受到限制。B-Rep是通过实体的边界来描述,由点、线和面的集合组成,其之间不存在明确的关系[6],和构造几何实体法相比,所得到的模型要求更大的存储空间。因而,随着模型变大或者具有更详细的内部结构,B-Rep的模型文件大小会急剧增加,很难可视化和操作。基于上述建模方法的商业CAD软件有 UG、CATIA、Pro/Engineer、SolidWorks、M IM ICS等。

图1 CSG法构建多孔单元
基于CAD的支架设计方法分为2个步骤:①利用CAD软件构建多孔结构体;②将构建的多孔结构体与骨组织支架外轮廓进行布尔运算[7]。另一种方法是先构建多孔的负模型,然后用外部轮廓模型减去多孔负模型,从而到的多孔骨组织支架[8]。虽然有很多关于使用商用CAD软件创建多孔单元库的研究,由于可用的原有实体造型功能的局限性,大多数提出的多孔单元由相对简单的几何形状组成,如球、梁、杆等。另外,一些多面体形状,包括正多面体和阿基米德多面体,通过构建近似的线框模型来作为基础的多孔单元[9-10]。
由于利用CAD软件直接设计多孔支架模型是费时而且繁琐的,并且会随着支架结构的复杂程度而增加。为了提高设计效率,Chua等[11-12]设计和开发一个标准的参数化多面体模型库,用户可以从模型库里选择支架单元的几何形状和大小,以适应特定骨组织支架的应用。通过一个专门开发的算法[13]将选择的多孔单元组装在一起与外部轮廓模型进行布尔运算得到组织支架模型。这种设计和制造组织支架的方法被称为组织支架计算机辅助系统(computer-aided system for tissue scaffolds, CASTS)[14-15]。通过该方法可以自动计算出支架的基本参数包括孔径大小、孔隙率和表面积和体积比。该方法虽然实现了组织支架的自动化设计,但是被提出的单元库都是由简单单元构成,例如八面体、四面体、六棱柱等。
为了克服大多数基于CAD法设计的单元库都是由简单单元构成的限制,更为复杂而且具有仿生特点的多孔单元得到应用[16-17]。例如 Sun等[18]利用计算机断层扫描或磁共振成像(computed tomography/ magnetic-resonance imaging,CT/MRI)技术,将来自人骨的不同部分的骨小梁结构转换成CAD模型,利用仿生特点开发了3种不同类型的骨小梁结构,如针对肱骨的盘状结构、针对脊柱的棒状结构和针对髂嵴的混合结构,用于设计非均质的骨支架结构,如图2所示。
基于CAD的方法作为多孔支架最广泛采用的设计方法,虽然为多孔支架的设计提供了一个强大工具,但在多孔结构设计的时候,无法对其结构性能和力学参数进行有效地控制及评估,使得设计过程没有依据和标准可参考。另外,在基于CAD的设计方法中,大多数CAD软件都支持布尔运算,也是目前支架设计的常用方法。然而在布尔运算后,在几何形态的外轮廓往往会出现阶梯现象(如图3所示),阶梯现象会导致几何轮廓失真,机械性能不稳定。

图2 所设计的单元体结构[18]
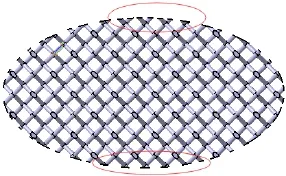
图3 骨支架外部轮廓的阶梯现象
2.1.2 基于图像的设计方法
基于图像的设计方法可以分为直接设计法和间接设计法。直接设计法的原理为:通过分析医学图像切片每层上所反映的信息,进行图像处理,得到层面的信息,然后对组织的二维模型重建,转化为增材制造设备支持的文件,一层一层堆积成三维支架,而不用将得到的二维点组成整个组织的三维数据点集,利用三维重建算法构建维组织模型[19]。直接利用模型的二维图像信息堆积成型,而不需要对模型进行三维重建,提高了成型的速度。但这种方法的缺点是模型的成型精度对图像获取设备的分辨率具有很高的依赖性。
间接设计法是对CT/MRI图像进行分析处理,对处理后的图像进行分析并且提取关键特征进行重建。Hollister等[20]通过对CT获取的图像进行截取和处理,二值化后得到实体体素“1”和孔隙体素“0”的信息,然后将预先定义好的多孔单元映射到实体体素来构造多孔植入体。该方法联合当前可用的图像处理和增材制造技术,可以实现对具有复杂的外部形态和内部孔隙结构快速设计和构建。Podshivalov等[21]利用基于Micro-CT图像处理技术生成具有微观尺度的支架,然后重建和优化得到高度精确的几何模型,该支架模型在微观尺度和自然骨组织非常相似。李祥等[22]对人体骨组织切片样本进行分析,获取骨组织微观结构数据并对图像进行三维重建,然后设计出具有跟样本相似具有一定仿生性的骨支架微管道。
基于图像的设计是表达骨支架设计的一种实用方法,这种方法虽然可以得到跟骨组织结构基本吻合的多孔结构,但是其缺点是对分辨率有很高的依赖性,需要大量的计算资源和存储,并且实现过程较复杂,对软件开发和软件使用者的要求较高,所以没有被广泛采纳。
2.1.3 基于TPMS的设计方法
近几年来,为了克服在骨组织支架构建中,多孔单元几何形状的限制,很多研究者开始利用TPMS来设计骨组织支架。TPMS[23]是一种在三维空间中3个独立的方向上均具有周期性的曲面,更是一种极小化曲面(曲面上任意一点的平均曲率为零)。极小曲面几何形状的结构存在于自然界,如甲虫壳、象鼻虫、蝴蝶羽翼和甲壳类动物的骨骼等[24],这进一步暗示了其作为仿生支架的设计是有优势的。TPMS支架结构是通过数学函数来描述,通过改变其参数可以实调整孔隙率甚至实现梯度变化。因而和传统基于CAD手动设计多孔支架相比,TPMS最大的优势是既精确又容易的控制内部孔隙结构参数,例如孔隙大小、孔隙形状、孔隙率等。表1列举了一些TPMS单元的数学表达和三维模型。
Rajagopalan和Robb[25]首次提出了基于TPMS的方法设计组织支架,设计了一种简单的Schwartz P类型(一种TPMS单元)支架并对其力学性能进行分析,通过增材制造技术制备出来。其他类型的TPMS单元例如Schwartz Diamond(D类型)和Schoen Gyroid (G 类型)也被用来制备组织支架[26-28]。Melchels等[29-30]提出了一种使用TPMS设计支架的方法,使用K3DSurf软件生成了Gyroid和Diamond类型的TPMS结构并生成CAD文件,通过增加一个关于z变量的线性方程可以实现Gyroid结构在孔隙大小和孔隙率的梯度变化。研究表明,通过增材制造技术得到的Gyroid组织工程支架具有10倍以上的渗透率和由盐浸得到的传统支架相比,由于基于TPMS的支架孔隙具有很好的互通性。通过实验还发现 Gyriod型支架有大量的细胞分布在支架的中心,而盐浸得到的组织支架细胞大多分布在支架 外表面且中心没有分布。
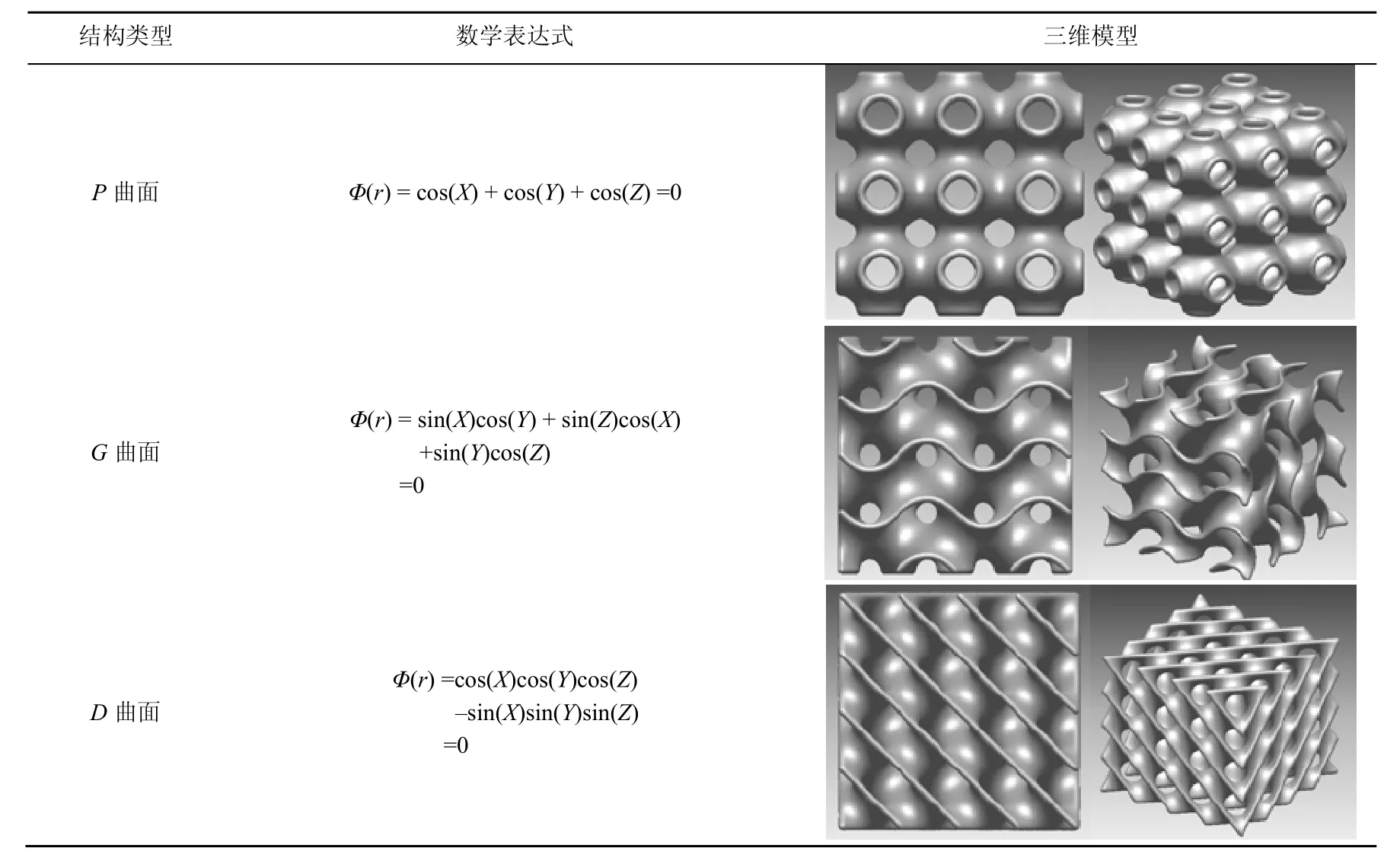
表1 TPMS结构举例
在对TPMS支架结构的优化设计方面,Kapfer 等[24]分析了2种基于TPMS生物形态的支架结构:①人们广泛研究的network型实体结构;②通过对极小曲面添加空间均匀性厚度得到的 sheet型实体结构,如图4所示。通过分析表明在相同的体积分数下,和传统的network型实体相比,sheet型实体具有更良好的机械性能和更大的表面积。A lmeida和Bártolo[31]研究了2个不同类型的TPMS,Schwarz 和 Schoen型,为了设计出更好的仿生支架具有较高的孔隙率和良好的机械性能,利用商用软件SolidWorks得到2种单元的实体模型,通过等距偏移和加厚的操作定义了2个重要的建模参数:厚度和表面半径,其孔隙率和机械性能关系通过有限元软件Abaqus进行评估。

图4 两种不同的TPMS结构[24]
为了更好地满足组织支架的仿生性能,Yang 等[32]通过给定的过渡边界结合基于 TPMS不同的结构提出了2种非均质多孔组织支架设计方法:①是S形函数(sigmoid function)方法,可以有效地应用于简单的过渡边界情况;②是高斯径向基函数(Gaussian radial basis function,GRBF)方法,可以应用到更普遍的情况下。其提出的数学方法可以在Mathematica软件里执行,结果模型可以保存为STL文件。通过进一步研究,还提出了基于给定的子结构和边界的组合操作。利用此方法,具有多尺度结构的复杂功能梯度多孔支架可以很容易地生成[33]。
然而,所有上述方法设计和制造的骨组织支架样品是简单的立方体或规则形状。Yoo[23]采用有限元中六面体单元对实体模型进行网格划分,利用形函数法将TPMS单元映射到划分的六面体单元方法生成多孔支架,并通过自适应的全六面体网格加密算法来实现对孔隙大小的控制,最后给出了不同人类骨支架模型的应用,如股骨、胫骨和髂骨。通过进一步研究,Yoo[34]提出了一个有效的三维多孔支架设计方法基于距离场(distance field)和TPMS。通过传统距离场算法在解剖模型的布尔操作和基于TPMS的单元库中的创造性应用,可以很容易得到各种多孔支架模型具有复杂的内部结构和精确的外轮廓。为了更好地模仿自然骨组织结构,Yoo[35-36]还提出了多种方法来得到具有功能梯度和非均质结构的组织支架。
2.1.4 基于拓扑优化的设计方法
理想的组织支架应该能够提供足够的机械支持和促进细胞增殖和分化,以及氧气和养分的扩散,因而组织支架的微观结构设计和控制一直是组织工程发展的一个重大挑战。由于大的孔隙率可以提高物质运输能力但会对组织支架的机械性能产生负面影响,为此设计的组织支架应该权衡两个相互冲突的性能要求。拓扑优化是“形状”优化的一种形式,通常简称为“布局”优化,拓扑优化的方法是寻找一个结构在受到单一载荷或多个载荷的作用下最佳材料分配方案[37]。因此,利用拓扑优化方法设计支架的单元结构可以实现给定约束下所需的性能。该方法通常应用到具有一定孔隙率[38]或最大渗透率[39-40]约束的机械性能优化。
基于拓扑优化法设计支架微结构的想法得到了很多研究人员的探索。Hollister[39]设计的微孔结构具有优化的渗透率为细胞迁移和物质运输以及优化的机械性能以匹配自然骨组织。Lin等[38]通过引入拓扑优化算法来设计具有所需的弹性性质和孔隙率的支架微结构。Hollister和 Lin[41]进一步扩展该方法通过引入有效渗透率的优化方案来设计具有最大渗透率的支架结构。Guest和Prévost[42]提出了三维微结构的设计方案利用拓扑优化方法来实现体积弹性模量和各向同性渗透率的最大化,但是没有提到在组织支架上的应用。最近,Kang等[43]探讨了可能的结构设计与有效体积模量及扩散系数的各种结合。为了设计出多孔微结构在机械和物质运输性能的范围内,一种基于数值均匀化方法的拓扑优化方法应用于组织支架的三维单元结构设计。结果表明设计的微结构孔隙率从30%到60%不等,如图5所示。
A lmeida和 Bártolo[37,44]提出了一种结合 CAD建模和拓扑优化的优化策略,以获得孔隙率和机械性能最大化的支架结构。该方法通过对具有实体材料的立方体结构施加不同的约束和载荷条件以寻求满足孔隙率和机械性能要求下的材料最优分布。Xiao等[45-46]利用拓扑优化的方法,在体积分数约束下寻求微结构材料的最优分布,以实现刚度最大。通过建立的算法,得到了不同体积分数的2D和3D最优微结构,并提取3D拓扑优化结果转化为CAD模型。Dias等[47]将拓扑优化算法作为一种优化技术来设计组织支架以满足物质运输和机械承载要求。所设计的的支架通过选择性激光烧结得到,并对所制备支架的实际特征和设计值进行了测量和比较。结果表明这种方法具有得到骨组织工程支架的潜力。

图5 拓扑优化得到的不同类型和不同孔隙率的微结构((a)~(c) 结构孔隙率为30%;(d)~(f) 结构孔隙率为50%;(g)~(h) 结构孔隙率为60%)[43]
随着支架优化设计的不断发展,Rainer等[48]提出负载自适应支架结构(load-adaptive scaffold architecturing,LASA)算法用于支架结构的设计,该方法不同于现有的方法,因为其不是通过微孔单元的填充和试图优化多孔单元得到组织支架,而是从一个由支架外部形状确定的连续实体模型开始,在所考虑的设计域内通过拓扑优化方法找到最佳的骨小梁结构分布以承受施加的生理负荷系统,图6是LASA算法示意图。

图6 利用负载自适应支架结构算法进行拓扑优化的例子[6]
2.2 不规则多孔结构
大多数组织支架的设计方法是针对规则性周期结构的单元去填充内部支架的几何设计,这种周期性多孔结构的优点在于其更容易建模和制造,以及对其结构性能的预测。然而,骨组织的微观结构是非常复杂的、非均质的。因而不规则多孔结构建模方法可以更好地模拟自然骨组织的内部结构。
利用基于CAD的方法也可以得到具有不规则结构的多孔支架,但是由于数以百计的不同几何参数通过手动建模是非常耗时的。为了克服这些限制,Ram in和Harris[49]提出了一个自动设计方法来提高设计效率。利用面向对象编程和CAD软件结合,可实现成千上万个不同的几何元素快速生成。每一个几何元素都有一组不同的参数,无论是随机的还是根据给定的数学公式都可以由软件更改,使其适应不同孔隙尺寸和孔隙互连性等几何元素的分布。Lai和Sun[50]基于CAD实体建模布尔运算原理,提出了利用微球随机堆积的支架建模方法。分析了两种极端堆积模型:最小密度和最大密度堆积模型,并采用参数化法研究了微球直径对微球数量的影响,而组织支架中微球的数量是由随机函数来决定的。虽然这种方法得到的支架模型孔隙率低,但对组织支架孔隙结构研究有借鉴意义,而且运算简单。
Sogutlu和 Koc[51]提出了一种随机建模的方法得到孔隙率可控的组织支架,支架的内部结构由给定的分布和孔隙率水平函数决定。由于孔隙的随机分布,重叠的孔隙影响孔隙率计算的精确性,提出了一种新的基于模拟计算的方法来预测重叠的体积从而确保得到的所需的孔隙率。Kou和Tan[52]提出了基于随机维诺图(Voronoi diagram)和B样条曲线的方法来设计具有孔形和孔隙分布可控的不规则多孔结构,但未考虑孔隙之间的连通性问题,同时该方法目前仅限于二维孔隙结构的研究。
Cai和Xi[53]采用有限元中六面体单元对实体模型进行网格剖分;利用有限元中的八结点六面体形函数将参数域中的基本孔隙单元映射为空间域中各种不规则孔隙几何单元,最后通过布尔运算得到骨组织支架模型。根据自然骨中孔隙分布并非是均匀度的,而是具有梯度分布的,提出了基于自适应全六面体网格加密算法的孔隙大小分布控制方法。Schroeder等[54]从地质界对沙石多质结构建模方法[55]中得到启发,将随机几何理论引入到组织支架孔隙结构的建模过程中来,通过随机函数和孔隙最小距离来控制孔隙大小和分布。但骨组织支架与地质砂石结构存在明显不同,利用全局均匀随机分布函数,构建的骨组织支架明显与实际不符,而且对计算机资源消耗很大。连芩等[56]通过精确的数学模型分析和建立微观结构和宏观孔隙率之间的数值关系,提出了就有渐变性孔隙率特性的同心圆骨支架结构,并开发了相应的结构设计和仿真软件。虽然该方法实现了模仿自然骨孔隙率的渐变规律,但该结构是否具有良好的机械和生物性能还需大量的试验研究。
陈作炳等[57-59]提出将分形理论运用于人体骨微观结构建模之中,提出了基于分形理论和蒙特卡洛(Monte Carlo)方法的人体骨仿生微观结构设计的算法。此方法的基础是支架微孔虽然形状、大小各不相同,但却具有相似的结构,即在统计上具有分形性。将几种经典的轮廓图作为种子,利用蒙特卡洛撒点法,在模型的二维轮廓内进行播种,最后构建成具有孔隙结构的二维支架模型,再利用层层堆积的原则将其堆积成三维模型,如图7所示。这种方法得到的支架内部孔隙分布比较散乱,孔隙率无法按照实际的要求进行控制,而且孔与孔之间的连通性也较差。为了更好地模拟人工骨结构,王月波等[60]利用分形理论和知识库思想来设计人工骨支架结构,建立了一种人工骨支架的设计方法,该方法能对微孔的大小、形状和数量进行控制,使骨支架结构和人体骨微观结构具有一定的相似性。尤飞等[61]基于多约束背包问题模型的结构,以椭圆球作为构造微孔结构负模型的单元体,利用混合遗传算法求解微观孔结构的负模型,并将微孔的孔隙率和连通性作为约束条件,通过不含微孔的支架模型和负模型之间的布尔运算,得到含有微观孔结构的骨支架模型。

图7 利用分形理论得到的骨支架三维实体模型
3 结论及展望
随着CAD的不断发展,越来越多的组织支架设计方法被提了出来。基于CAD的方法设计组织支架往往过程复杂、设计繁琐、耗费时间,即便有研究人员提出参数化建模和自动化组装的算法来提高设计效率,但是建立的模型仅具有形态特征,与真正的物理模型、生理模型还有很大的距离,还需进一步研究。基于图像的设计方法可以得到具有复杂结构的组织支架,但对分辨率有很高的依赖性。然而不规则的多孔支架设计方法,虽然看起来更好地匹配自然组织的复杂性,但是还没有被彻底验证。通过最近的研究发现基于 TPMS的组织支架设计方法取得了令人鼓舞的结果。因为许多孔隙结构的参数是很容易且准确地调节,以满足组织支架的机械和生物性能。另外,基于拓扑优化的方法在这一领域的研究取得了很大的进展,通过拓扑优化技术可以确保支架微观结构拥有最佳的机械性能和生物性能,实现组织支架结构的最优设计。
虽然在骨组织支架设计这一领域,提出了许多设计和优化方法并且取得了很大的进展,但是与理想的骨组织支架结构还有一定的距离。因为一些关键性问题仍然面临着很大的挑战:①支架结构的机械性能应该匹配自然骨的刚度和疲劳强度;②骨组织支架应该具有梯度结构以实现功能化;③传统的CAD设计软件不足以支持具有复杂几何特征的多孔支架建模。
为了满足组织支架骨再生的最佳孔隙大小和孔隙率,支架结构的机械性能和生物性能,实现支架的功能梯度结构,克服现有的建模软件在多孔支架建模的局限性。该领域下一阶段将聚焦在以下几方面开展工作:
(1) 到目前为止,虽然骨组织支架设计还没有确切的设计标准可以参考,但骨组织支架要同时满足弹性模量、孔隙率、渗透率等要求。所以应用CAE技术对支架结构的多目标优化分析研究将成为未来骨组织支架研究的重点。
(2) 拓扑优化的方法在支架微结构的设计取得了很大的进展,通过拓扑优化我们可以更好地优化支架的机械性能和生物性能,实现支架结构综合性能最优。然而通过拓扑优化方法实现多孔支架的宏微观一体化设计有待进一步研究。
(3) 为了更好的模拟自然骨组织支架结构,还需探索更为先进的设计方法,有待开发一种专门针对组织支架建模的设计软件,以实现对骨组织支架的快速精确设计。
[1] 何 进, 郭云珠, 曹慧玲, 等. 组织工程支架研究进展[J]. 材料导报, 2012, 26(3): 73-77.
[2] 贵浩然, 李 澎, 张卫国. 制备软骨组织工程支架的材料和方法[J]. 中国组织工程研究, 2013, 17(3): 509-516.
[3] Abdelaal O A M, Darw ish S M H. Review of rapid prototyping techniques for tissue engineering scaffolds fabrication [M]//Characterization and Development of Biosystems and Biomaterials. Berlin:Springer Berlin Heidelberg, 2013: 33-54.
[4] Bártolo P J, Dom ingos M, Patrício T, et al. Biofabrication strategies for tissue engineering [M]// Advances on Modeling in Tissue Engineering. Netherlands: Springer Netherlands, 2011: 137-176.
[5] 吴任东, 杨 辉, 张 磊, 等. 组织工程支架快速成形技术研究现状[J]. 机械工程学报, 2011, 47(5): 170-176.
[6] Giannitelli S M, Accoto D, Trombetta M, et al. Current trends in the design of scaffolds for computer-aided tissue engineering [J]. Acta Biomaterialia, 2014, 10(2): 580-594.
[7] 李莉敏, 郭桂芳, 胡庆夕, 等. 面向骨组织工程的三维仿生支架的微观结构研究[J]. 中国制造业信息化:学术版, 2005, 34(4): 86-88.
[8] 吴懋亮, 刘廷章, 石钢生. 仿生支架微孔结构CAD设计方法[J]. 机械科学与技术, 2006, 25(11): 1285-1287.
[9] Wettergreen M A, Bucklen B S, Starly B, et al. Creation of a unit block library of architectures for use in assembled scaffold engineering [J]. Computer Aided Design, 2005, 37(11): 1141-1149.
[10] Chantarapanich N, Puttaw ibul P, Sucharitpwatskul S, et al. Scaffold library for tissue engineering: a geometric evaluation [J]. Computational & Mathematical Methods in Medicine, 2012, 2012(3): 565-569.
[11] Chua C K, Leong K F, Cheah C M , et al. Development of a tissue engineering scaffold structure library for rapid prototyping. part 1: investigation and classification [J]. International Journal of Advanced Manufacturing Technology, 2003, 21(4): 291-301.
[12] Chua C K, Leong K F, Cheah C M, et al. Development of a tissue engineering scaffold structure library for rapid prototyping. part 2: parametric library and assembly program [J]. The International Journal of Advanced Manufacturing Technology, 2003, 21(4): 302-312.
[13] Cheah C M, Chua C K, Leong K F, et al. Automatic algorithm for generating complex polyhedral scaffold structures for tissue engineering [J]. Tissue Engineering Part A, 2004, 10(3/4): 595-610.
[14] Naing M W, Chua C K, Leong K F, et al. Fabrication of custom ised scaffolds using computer-aided design and rapid prototyping techniques [J]. Rapid Prototyping Journal, 2005, 11(4): 249-259.
[15] Naing M W, Chua C K, Leong K F. Computer aided tissue engineering scaffold fabrication [M]//Virtual prototyping & bio manufacturing in medical applications. New York: Springer US, 2008: 67-85.
[16] Sun W, Starly B, Nam J, et al. Bio-CAD modeling and its applications in computer-aided tissue engineering [J]. Computer Aided Design, 2005, 37(11): 1097-1114.
[17] Bucklen B S, Wettergreen W A, Yuksel E, et al. Bone-derived CAD library for assembly of scaffolds in computer Aided tissue engineering [J]. Virtual & Physical Prototyping, 2008, 3(1): 13-23.
[18] Sun W, Starly B, Darling A, et al. Computer-aided tissue engineering: application to biom imetic modelling and design of tissue scaffolds [J]. Biotechnology & Applied Biochem istry, 2004, 39(1): 49-58.
[19] Yoo D J. Rapid surface reconstruction from a point cloud using the least-squares projection [J]. International Journal of Precision Engineering and Manufacturing, 2010, 11(2): 273-283.
[20] Hollister S J, Levy R A, Chu T M, et al. An image- based approach for designing and manufacturing craniofacial scaffolds [J]. International Journal of Oral & Maxillofacial Surgery, 2000, 29(1): 67-71.
[21] Podshivalov L, Gomes C M, Zocca A, et al. Design, analysis and additive manufacturing of porous structures for biocompatible m icro-scale scaffolds [J]. Procedia CIRP, 2013, 5: 247-252.
[22] 李 祥, 李涤尘, 张彦东, 等. 骨组织微结构观察分析及仿生支架立体光固化间接制造[J]. 北京生物医学工程, 2006, 25(2): 164-167.
[23] Yoo D J. Computer-aided porous scaffold design for tissue engineering using triply periodic minimal surfaces [J]. International Journal of Precision Engineering & Manufacturing, 2012, 12(1): 61-71.
[24] Kapfer S C, Hyde S T, Mecke K, et al. Minimal surface scaffold designs for tissue engineering [J]. Biomaterials, 2011, 32(29): 6875-6882.
[25] Rajagopalan S, Robb R A. Schwarz meets Schwann: design and fabrication of biomorphic and durataxic tissue engineering scaffolds [J]. Medical Image Analysis, 2006, 10(5): 693-712.
[26] Elomaa L, Teixeira S, Hakala R, et al. Preparation of poly (ε-caprolactone)-based tissue engineering scaffolds by stereolithography [J]. Acta Biomaterialia, 2011, 7(11): 3850-3856.
[27] Melchels F P W, Feijen J, Grijpma D W. A poly(D,L-lactide) resin for the preparation of tissue engineering scaffolds by stereolithography [J]. Biomaterials, 2009, 30(23/24): 3801-3809.
[28] Gabbrielli R, Turner I G, Bowen C R. Development of modelling methods for materials to be used as bone substitutes [J]. Key Engineering Materials, 2008, 361: 903-906.
[29] Melchels F P W, Bertoldi K, Gabbrielli R, et al. Mathematically defined tissue engineering scaffold architectures prepared by stereolithography [J]. Biomaterials, 2010, 31(27): 6909-6916.
[30] Melchels F P W, Barradas A M C, van Blittersw ijk C A, et al. Effects of the architecture of tissue engineering scaffolds on cell seeding and culturing [J]. Acta Biomaterialia, 2010, 6(11): 4208-4217.
[31] A lmeida H A, Bártolo P J. Design of tissue engineering scaffolds based on hyperbolic surfaces: Structural numerical evaluation [J]. Medical Engineering & Physics, 2014, 36: 1033-1040.
[32] Yang N, Quan Z, Zhang D W, et al. Multi-morphology transition hybridization CAD design of m inimal surface porous structures for use in tissue engineering [J]. Computer Aided Design, 2014, 56(11): 11-21.
[33] Yang N, Zhou K T. Effective method for multi-scale gradient porous scaffold design and fabrication [J].Materials Science & Engineering C Materials for Biological Applications, 2014, 43: 502-505.
[34] Yoo D J. Porous scaffold design using the distance field and triply periodic m inimal surface models [J]. Biomaterials, 2011, 32(31): 7741-7754.
[35] Yoo D J. Heterogeneous porous scaffold design using the continuous transformations of triply periodic minimal surface models [J]. International Journal of Precision Engineering and Manufacturing, 2013, 14(10): 1743-1753.
[36] Yoo D J. Heterogeneous m inimal surface porous scaffold design using the distance field and radial basis functions [J]. Medical Engineering & Physics, 2012, 34(5): 625-639.
[37] A lmeida H A, Bártolo P J. Topological optim isation of scaffolds for tissue engineering [J]. Procedia Engineering, 2013, 59: 298-306.
[38] Lin C Y, Kikuchi N, Hollister S j. A novel method for biomaterial scaffold internal architecture design to match bone elastic properties with desired porosity [J]. Journal of Biomechanics, 2004, 37(5): 623-636.
[39] Hollister S J. Porous scaffold design for tissue engineering [J]. Nature Materials, 2005, 4(7): 518-524.
[40] Challis V J, Roberts A P, Grotow ski J F, et al. Prototypes for bone implant scaffolds designed via topology optimization and manufactured by solid freeform fabrication [J]. Advanced Engineering Materials, 2010, 12(11): 1106-1110.
[41] Hollister S J, Lin C Y. Computational design of tissue engineering scaffolds [J]. Computer Methods in Applied Mechanics & Engineering, 2007, 196: 2991-2998.
[42] Guest J K, Prévost J H. Optim izing multifunctional materials: design of m icrostructures for maxim ized stiffness and fluid permeability [J]. International Journal of Solids and Structures, 2006, 43(22): 7028-7047.
[43] Kang H, Lin C Y, Hollister S J. Topology optimization of three dimensional tissue engineering scaffold architectures for prescribed bulk modulus and diffusivity [J]. Structural & Multidisciplinary Optim ization, 2010, 42(4): 633-644.
[44] A lmeida H A, Bártolo P J. Virtual topological optimisation of scaffolds for rapid prototyping [J]. Medical Engineering & Physics, 2010, 32(7): 775-782.
[45] Xiao D M, Yang Y Q, Su X B, et al. Topology optimization of m icrostructure and selective laser melting fabrication for metallic biomaterial scaffolds [J]. Transactions of Nonferrous Metals Society of China, 2012, 22(10): 2554-2561.
[46] Xiao D M, Yang Y Q, Su X B, et al. An integrated approach of topology optim ized design and selective laser melting process for titanium implants materials [J]. Biomed Mater Eng, 2013, 23(5): 433-445.
[47] Dias M R, Guedes J M, Flanagan C L, et al. Optim ization of scaffold design for bone tissue engineering: A computational and experimental study [J]. Medical Engineering & Physics, 2014, 36(4): 448-457.
[48] Rainer A, Giannitelli S M, Accoto D, et al. Load-adaptive scaffold architecturing: a bioinspired approach to the design of porous additively manufactured scaffolds with optimized mechanical properties [J]. Annals of Biomedical Engineering, 2012, 40(4): 966-975.
[49] Ram in E, Harris R A. Advanced computer-aided design for bone tissue-engineering scaffolds [J]. Proceedings of the Institution of Mechanical Engineers Part H Journal of Engineering in Medicine, 2009, 223(3): 289-301.
[50] Lai P, Sun W. Computer modeling approach for m icrosphere-packed bone scaffold [J]. Computer Aided Design, 2004, 36(5): 487-497.
[51] Sogutlu S, Koc B. Stochastic modeling of tissue engineering scaffolds with varying porosity levels [J]. Computer-Aided Design and Applications, 2007, 4(5): 661-670.
[52] Kou X Y, Tan S T. A simple and effective geometric representation for irregular porous structure modeling [J]. Computer-Aided Design, 2010, 42(10): 930-941.
[53] Cai S Y, Xi J T. A control approach for pore size distribution in the bone scaffold based on the hexahedral mesh refinement [J]. Computer Aided Design, 2008, 40(10): 1040-1050.
[54] Schroeder C, Regli W C, Shokoufandeh A, et al. Computer-aided design of porous artifacts [J]. Computer Aided Design, 2005, 37(3): 339-353.
[55] Manwart C, Torquato S, Hilfer R. Stochastic reconstruction of sandstones [J]. Physical Review E, 2000, 62(1): 893.
[56] 连 芩, 李涤尘, 张永睿. 新型人工骨支架结构及其功能[J]. 机械工程学报, 2006, 42(1): 121-125.
[57] 陈作炳, 饶 嵩, 李世普, 等. 基于分形理论的人体骨微观结构仿生设计[J]. 武汉理工大学学报, 2004, 26(4): 49-51.
[58] 毛 娅, 陈作炳, 余新明, 等. 基于医学图像的人工骨三维仿生设计[J]. 中国体视学与图像分析, 2004, 9(3): 160-172.
[59] 杨 楠, 魏生民. 基于知识的人工骨三维结构仿生设计研究[J]. 机电一体化, 2007, 12(6): 36-39.
[60] 王月波, 汪焰恩, 魏生民, 等. 人工骨支架结构设计与实现[J]. 西安工业大学学报, 2012, 32(4): 282-286.
[61] 尤 飞, 姚 远, 胡庆夕. 仿生骨支架微观孔结构的构建与评价[J]. 机械工程学报, 2011, 47(1): 138-144.
A Review of Computer Aided Design for Bone Tissue Scaffolds
Yao Yazhou1,2, Xie Jingsong1, Fan Shuqian2,3
(1. College of Mechanical and Electrical Engineering, Changchun University of Science and Technology, Changchun Jilin 130022, China; 2. Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 400714, China; 3. Chongqing Key Laboratory of Additive Manufacturing Technology and System, Chongqing 400714, China)
The new and emerging additive manufacturing technologies in recent years make it possible to fabricate bone tissue scaffolds with highly complex geometry structure. Based on the versatile functionality requirements, the structures of bone tissue scaffolds are firstly categorized into two groups, more precisely, the regular porous structure and the irregular ones, according to their geometries. Then the design methods for above classified structures are reviewed respectively. The triply periodic minimal surfaces (TPMS) based and topology optim ization based design methods, which are very suitable for additive manufacturing, are especially emphasized. Finally, technical challenges for the design methods of bone tissue scaffolds are analyzed, and the possible developing trend in this field is prospected.
tissue engineering; bone tissue scaffold; porous structure; computer-aided design; additive manufacturing
TH 122
10.11996/JG.j.2095-302X.2016030367
A
2095-302X(2016)03-0367-10
2015-07-24;定稿日期:2015-09-09
中国科学院重点部署项目(KGZD-EW-T04);重庆市科技攻关重点项目(cstc2012ggB40003);重庆市应用开发计划项目(cstc2013yykfC00006)
姚亚洲(1990–),河北邯郸人,硕士研究生。主要研究方向为CAGD/CAD。E-mail:yaoyazhouyyz@126.com
范树迁(1974–),四川遂宁人,研究员,博士。主要研究方向为几何设计与计算在先进制造技术中的应用。E-mail:fansq@cigit.ac.cn
