小剂量多次注射链脲佐菌素建立糖尿病早期视网膜病变动物模型
2016-11-29朱华李彦红徐艳峰徐玉环许庆刚尹红霞秦川
朱华,李彦红,徐艳峰,徐玉环,许庆刚,尹红霞,秦川*
(1.卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021;2.首都医科大学附属同仁医院,北京 100730)
小剂量多次注射链脲佐菌素建立糖尿病早期视网膜病变动物模型
朱华1,李彦红1,徐艳峰1,徐玉环1,许庆刚2,尹红霞2,秦川1*
(1.卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021;2.首都医科大学附属同仁医院,北京 100730)
目的 多次小剂量注射链脲佐菌素(STZ)制作糖尿病(DM)早期大鼠视网膜病变(DR)动物模型。方法 雄性SD大鼠75只,体重(180±15)g。随机分为对照组(CON组,n=30)和模型组(DM组,n=45)。DM组按30mg/kg体重腹腔注射3%的STZ,连续5 d。成模后每周测量体重、血糖等指标。分别在成模后第4、8、12周各组随机安乐死10只动物,对视网膜组织进行H.E染色、免疫组化、消化铺片及透射电镜超微结构观察。 结果 模型成立后第 2 周,动物表现出多食、多饮、多尿的糖尿病症状。与对照组比较,模型大鼠4周时仅见视网膜变薄,8周时视网膜内皮细胞增生,毛细血管基底膜增厚,内皮细胞指状突起,吞饮泡增多。12周时毛细血管膨大,毛细血管细胞凋亡,核固缩、深染。视网膜变薄,神经节细胞数量减少。视网膜周细胞线粒体肿胀,嵴脱落空泡样变。模型组大鼠视网膜GFAP阳性细胞主要分布在节细胞层和神经纤维层,呈条索状连续排列,阳性细胞数明显减少。结论 小剂量多次注射STZ 诱导的大鼠DR模型表现出人类早期视网膜病变相似的特征,可用于发病机理、药效学等方面的研究。
糖尿病;糖尿病视网膜病;动物模型;链脲佐菌素;大鼠
糖尿病视网膜病变( diabetic retinopathy,DR)是糖尿病患者的常见并发症,是造成视力损伤甚至失明的主要原因。其病理机制尚未完全阐明。长期以来,人们对DR的诊断治疗和实验研究大多集中在糖尿病长期病程后视网膜的血管变化上,对早期视网膜神经组织功能及形态变化研究较少。而文献显示[1,2],糖尿病大鼠视网膜的神经组织在发病早期已发生病理改变。为更加透彻的了解糖尿病大鼠在发病早期视网膜病理变化特点,本研究采用小剂量多次注射方法复制了链脲佐菌素 (STZ)诱导的糖尿病大鼠早期视网膜病变动物模型,使用组织病理学、免疫组织化学和透射电镜技术方法,动态观察糖尿病大鼠在建模后1~10周视网膜神经细胞的形态变化,为DR的研究提供参考。
1 材料与方法
1.1 实验动物及模型建立
SPF级SD大鼠 75 只,雄性,体重 180~ 210 g,由中国食品药品检定研究院实验动物资源中心提供【SCXK(京)2012-0001】。实验在中国医学科学院医学实验动物研究所进行【SYXK(京)2013-0019】。动物随机分为对照组(CON)30只、模型组(DM)45只。动物禁食12 h后,腹腔注射STZ(Sigma 公司,货号S0130)30 mg/ kg,连续注射5 d。STZ溶于0.1 mol/L pH 4.2 柠檬酸钠缓冲液中,配成3%溶液,现配现用。对照组动物注射等体积的柠檬酸缓冲液。最后一次注射3 d后取尾静脉监测尿糖及血糖,以尿糖++++以上,空腹血糖 16.5 mmol/L 以上, 尿量及饮水明显增多者视为糖尿病模型成立。模型成立后将模型组45只动物随机分为DM1、DM2、DM3 3组。
1.2 检测指标
实验期间大鼠正常饮食水, 成模后每月测1次血糖、尿糖和体重。血糖监测使用德国罗氏公司优越微量血糖测定仪和血糖试纸。
1.3 组织学处理
1.3.1 石蜡切片
模型建立后4、8、12周时,对照组和模型组分别随机选择10只动物,腹腔注射过量戊巴比妥钠后,腹主动脉放血安乐死。摘除双侧眼球,用眼科剪沿角巩膜缘剪去角膜,去除前节和玻璃体,制成视杯。制备石蜡切片的视杯固定于4%中性甲醛中,4℃ 24 h后梯度酒精脱水,二甲苯透明,石蜡包埋,制成4 μm的石蜡切片,用于HE、GFAP和S100的免疫组化染色。步骤:玻片脱蜡入水,滴加3%过氧化氢溶液消除内源性过氧化物酶,室温15 min;微波中火修复10 min,加山羊血清室温孵育30 min。吸去多余血清,加一抗(GFAP,Millipore公司,货号MAB360,稀释度1∶500;S100,Abcam公司,货号ab52642,稀释度1∶200)。0.01 mmol/L的PBS为阴性对照,4℃过夜,PBS洗3次。加生物素化二抗(北京中杉金桥,货号PV-9002),室温30 min。DAB显色(北京中杉金桥,货号ZLI-0001),苏木素复染细胞核,中性树胶封片。
1.3.2 毛细血管消化铺片
制成视杯的眼球在预冷的中性甲醛中固定 48 h 后取出,流水冲洗5 min,以眼杯-视盘为中心剪成橘瓣样3块,分离出内壁的视网膜层。置入用0.01 mol/ L,pH 7.4 的PBS中漂洗10 min。0.15 mol/ L,pH 7.4 的甘氨酸缓冲液浸泡过夜。3%胰蛋白酶37℃消化 2 h。视网膜溶解后移入蒸馏水中,轻轻振荡,洗掉内界膜及残留的视网膜神经组织,仅剩一层透明的视网膜血管网,将其漂取并移至载玻片上展平, 自然干燥,进行PAS染色。
1.3.3 超薄切片制备及扫描电镜观察
每组随机选择 3 只大鼠,按照1.3.1的方法制成视杯, 放入2.5%戊二醛溶液固定 2 h。在显微镜下取颞上、颞下部位视网膜,PBS 冲洗后四氧化锇固定 2 h。 梯度乙醇脱水,丙酮浸透,环氧树脂EPON 812 包埋。先制成半薄片进行光镜定位,然后制备超薄切片,厚度60 nm。醋酸双氧铀、枸橼酸铅染色后JEOL JEM-1400 透射电镜观察视网膜超微结构变化。
1.4 统计学处理
2 结果
2.1 模型制备及一般症状观察
45只DM组大鼠在最后一次腹腔注射 STZ 72 h 后,尾静脉血糖16.5 mmol/L,达到成模标准。DM大鼠成模后 2周开始出现饮水、饮食增多、尿量明显增加。体重逐渐减轻,精神萎靡,蜷缩弓背,毛色枯黄,尾部苍白温度降低。部分动物在造模后2个月眼底开始变浑浊,到取材之日有3只动物的眼底变为白色(图1)。DM3组大鼠在70 d时死亡一只动物。对照组大鼠体重平稳增长,饮食饮水及尿量正常,毛色光滑,实验过程中无死亡。

图1 造模后3个月动物晶状体变浑浊Fig.1 Lens opacification in a rat at 3 months after diabetes modelling.
2.2 体重、血糖的变化
对照组大鼠尿糖均阴性, 实验组大鼠尿糖>+++。注射前对照组、实验组大鼠平均体重差异无显著性。腹腔注射STZ后,模型组动物体重增加不明显,到后期反而有所减轻。对照组动物体重稳步增长。4周时实验组大鼠体重比对照组显著降低(P< 0. 05)。8周、12周时实验组动物体重减轻,与对照组比较差异极显著(P< 0. 01)。注射前对照组、实验组动物的平均血糖差异无显著性。4、 8、12周时实验组大鼠血糖比对照组显著升高,与对照组比较差异极显著(P< 0. 01)。见表1、2。

表1 注射链脲佐菌素后对照组大鼠与糖尿病大鼠体重 ±s)
注:注射后,模型组与对照组比较,*P<0.05,**P<0.01
Note:*P<0.05,**P<0.01, A.I.: after STZ injection.
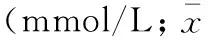
表2 注射链脲佐菌素后对照组大鼠与糖尿病大鼠血糖 ±s)
注:注射后,模型组与对照组比较,*P<0.05,**P<0.01, A.I: after injection,
Note.*P<0.05,**P<0.01, A.I.: after STZ injection.
2.3 组织学改变
2.3.1 HE染色
对照组大鼠视网膜组织形态未见异常,各层细胞排列规则,结构清晰。外颗粒层、内颗粒层、神经节细胞层细胞核染色清晰。DM1,DM2组糖尿病大鼠视网膜结构与对照组相比无明显区别,DM3组糖尿病大鼠视网膜组织厚度变薄,神经节细胞数量减少(图2)。

注:A. 对照组大鼠视网膜GFAP染色(×200); B.模型组大鼠视网膜GFAP染色,可见阳性细胞着色变浅,数量减少 (×400); C.对照组S100染色 (×200); D. 模型组S100染色,与对照组比较未见明显差异 (×200)。图3 STZ 诱导糖尿病SD大鼠视网膜病变(免疫组化染色)(bar=100 μm)Note:A. A normal rat (×200); B. GFAP staining of a diabetic retina. The number of positive cells was decreased and with lighter color (×400); C. S100 staining of a normal rat retina (×200); D. S100 staining of a diabetic rat retina. There are no significant differences between the two groups.Fig.3 Histopathological changes in the retina of STZ-induced diabetic SD rats (IHC staining)
2.3.2 免疫组化染色
对照组大鼠视网膜GFAP阳性细胞主要分布在节细胞层和神经纤维层,其中在神经纤维层阳性表达呈条索状连续排列、致密、深染。内、外丛状层有少量散在阳性细胞分布,着色较浅(图3A,B)。糖尿病组大鼠视网膜GFAP阳性细胞主要分布在节细胞层和神经纤维层,呈不连续散在分布,阳性细胞数明显减少。对照组S100阳性细胞主要分布在内、界膜层、外丛状层、内核层(图3C,D)。模型组S100阳性细胞表达部位与对照组相同,阳性细胞数未见明显改变。

注:A. 正常对照(×100);B. 造模后3个月,模型组动物视网膜变薄,神经节细胞数量减少(×100)图2 STZ 诱导糖尿病SD大鼠视网膜病变(H.E染色)Note:A. A normal rat;B. Retina thinning and decreased number of ganglion cells in a rat at 3 months after diabetes modeling.Fig.2 Histopathological changes in the retina of STZ-induced diabetic SD rats (HE staining, ×100)
2.3.3 消化铺片
对照组大鼠视网膜血管管径均匀一致,分支自然流畅呈“树枝状”,周细胞、内皮细胞分布规则均匀。DM1组大鼠未见明显形态学改变。DM2组大鼠内皮细胞增生,细胞核边缘卷曲,核中央细长,两端膨大、核肥胖等形态各异。DM3组大鼠毛细血管膨大,毛细血管细胞凋亡核固缩、深染。(图4)。
2.3.4 超微结构观察
对照组视网膜超微结构未见明显异常改变:光感受器细胞外节盘膜完整,排列整齐,外核层、内核层及节细胞层的细胞核大而圆,核仁清晰,核膜光滑,核质均匀,胞质内细胞器排列整齐。DM 1组仅观察到毛细血管内皮细胞、周细胞核膜的轻微凹陷, 异染色质聚集边缘化, 管腔未发生变形。DM2组视网膜毛细血管基底膜增厚,内皮细胞指状突起,吞饮泡增多。DM3组大鼠视网膜周细胞内线粒体肿胀,嵴脱落并可见空泡样变。感光细胞外节膜盘排列不整齐,疏松变形。外节膜盘间隙增宽,有局灶性断裂、解体现象。节细胞变性,胞质内线粒体、内质网扩张,细胞核溶解扩散;外核层光感受器细胞有凋亡发生,胞核内染色质浓缩,胞质空泡化,细胞器消失(图5)。

A. 正常对照组大鼠视网膜血管(×400); B. 造模2个月,模型组大鼠血管内皮细胞增生(×200); C. 造模3个月,模型组大鼠周细胞凋亡,核固缩、深染(×200); D. 造模3个月,模型组大鼠毛细血管膨大,内皮细胞核肥胖(×200)。图4 STZ 诱导糖尿病SD大鼠视网膜病变消化铺片结果A. A normal rat (×400); B. Vascular endothelial cell hyperplasia in a rat of the model group at 2 months after modelling (×200); C. Pericyte cell apoptosis, karyopyknosis and dark staining in the retina of a model rat at 3 months after modeling (×200); D. Enlarged capillary and endothelial nuclei in the retina of model group at 3 months after diabetic modeling.Fig.4 Vascular digest preparation of the retina of STZ-induced diabetic SD rats
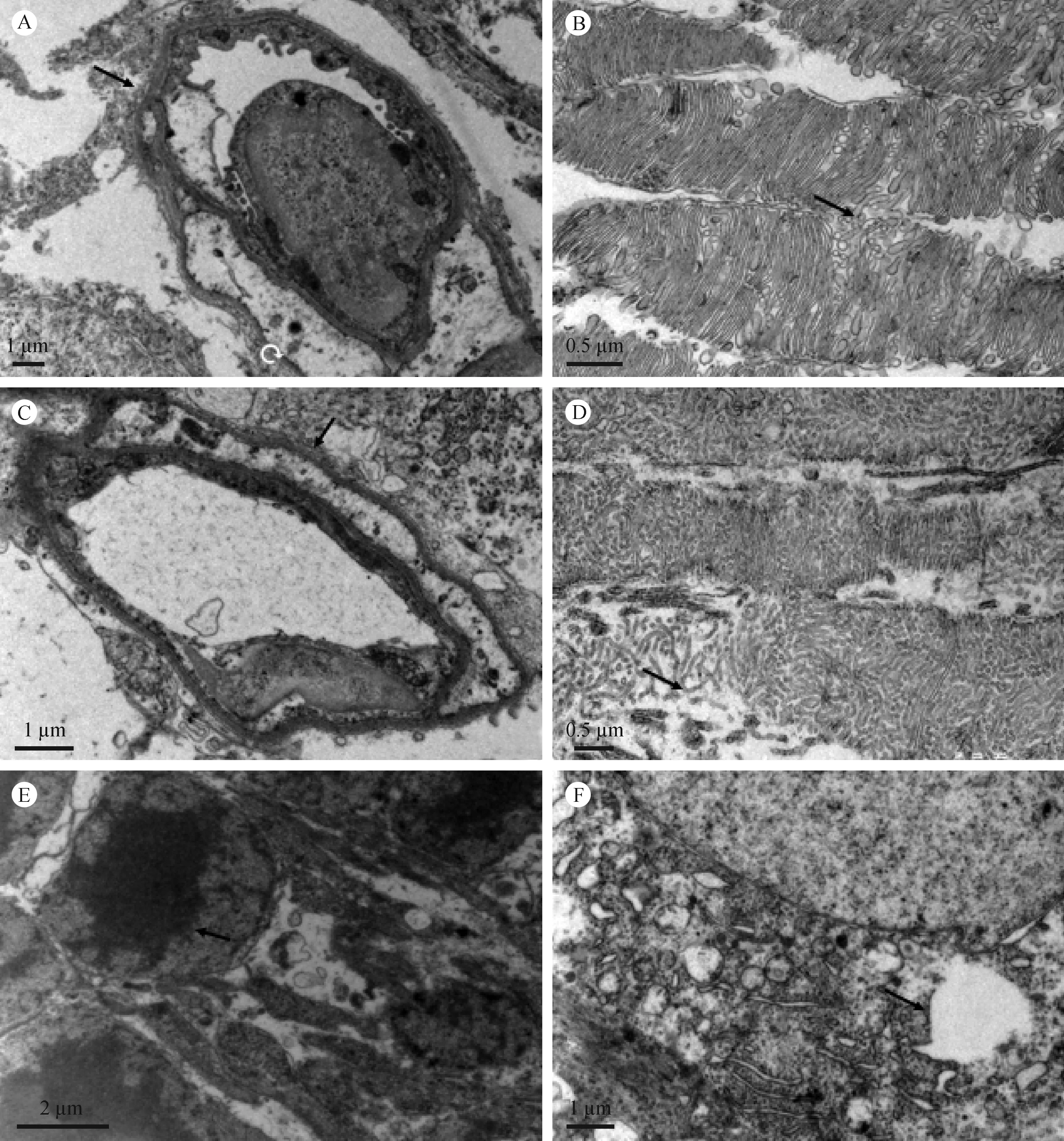
注:A. 造模1个月,模型组大鼠周细胞核膜轻微凹陷; B. 造模2个月,模型组大鼠线粒体轻微肿胀; C.造模2个月,模型组大鼠毛细血管基底膜增厚; D. 造模3个月,线粒体肿胀,嵴脱落空泡样变; 造模3个月,胞核内染色质浓缩; E. 造模3个月,核染色质浓聚。F. 造模3个月,出现胞质空泡,细胞器减少。图5 STZ 诱导糖尿病SD大鼠视网膜病变透射电镜结果Note. A. Slight invagination of the nuclear membrane of a pericyte cell in the retina of a diabetic model rat at 1 month after modeling. B. Mild swelling of mitochondria in the retina of a model rat at 2 months after diabetes modeling. C. Basement membrane of capillary is thickened in the retina of a model rat at 2 months after modeling. D. mitochondria swelling and vacuoloid changes of mitochondrial cristae in the retina of a model rat at 3 months after modeling. E. Nuclear chromatin condensation in the retina of a model rat at 3 months after modeling. F. Cytoplasmic vacuolization, loss of organelles in the retina of a model rat at 3 months after modeling.Fig.5 Ultrastructural changes in the retina of STZ-induced diabetic SD rats
3 讨论
DR 动物模型是在糖尿病模型上建立起来的,国内糖尿病研究多应用一次性化学药物损伤胰岛细胞诱发糖尿病动物模型[3]。这种方法建立较早,并已有一定的实验基础。STZ是一种含亚硝基的化合物,进人体内能特异性地破坏胰岛β细胞。机制之一是通过诱导NO的合成,增加对胰岛β细胞的氧化侵袭。胰腺细胞损伤程度取决于STZ的量:低剂量诱导β细胞调亡,高剂量致β细胞坏死。小剂量注射STZ可破坏少量胰岛细胞,死亡胰岛细胞作为抗原被巨噬细胞吞噬,产生TH1刺激因子,使TH1细胞系占优势而产生IL-2及IFN-γ,在胰岛局部促使炎性细胞浸润,并活化释放IL-1、TNF-α、IFN-γ及NO、H2O2等物质杀伤细胞[4]。死亡胰岛细胞作为自身抗原,再次递呈给抗原递呈细胞进行处理,释放细胞因子,放大细胞损伤效应,最终导致糖尿病。本研究采用小剂量(30 mg/kg)多次(连续5 d)腹腔注射造模,在发病机理上更接近人类糖尿病。在实验过程中,仅DM3组糖尿病大鼠在第3个月组死亡1只, 死亡原因为极度消瘦、不能正常进食饮水,死亡率为 6. 67%,低于单次注射造模[5]。因此小剂量多次造模方法在发病机理及造模成功率上较单次大剂量在DR的研究中更具有优势。
视网膜毛细血管主要由内皮细胞和周细胞组成。周细胞的主要作用是调节视网膜毛细血管局部的血流量和血管通透性,从而起到对内皮细胞的支持作用,并通过接触抑制对内皮细胞的增殖起抑制作用。缺血缺氧是糖尿病视网膜病变的发病基础,早期表现为毛细血管周细胞减少,内皮细胞增生,毛细血管瘤形成。在以往的大剂量STZ诱发DR模型中,3个月时形态学改变不明显,一般要到造模后6个月才会出现上述病理变化[6-11]。本研究采用小剂量多次注射STZ诱发的DR模型,在造模后3个月就已出现视网膜组织变薄,神经节细胞数量减少。消化铺片在2个月时就已出现周细胞形态上的异常。电镜结果进一步对上述改变进行了验证:毛细血管基底膜增厚,感光细胞外节膜盘排列不整齐,疏松变形。嵴细胞、周细胞线粒体肿胀,胞核内染色质浓缩,胞质空泡化,细胞器消失。周细胞损伤破坏了毛细血管的完整性,引起毛细血管内皮细胞增生,基底膜增厚,使视网膜毛细血管管腔变窄,血流改变。随着时间进展,到DR后期出现视网膜缺血、缺氧和新生血管形成症状,最终可导致病人失明。
视网膜是由血管和神经构成的,视网膜屏障被破坏以后,视网膜的神经细胞也会因微环境的改变而发生病理变化[12,13]。视网膜的胶质细胞处于神经元与血管之间,在传递微环境信息方面有非常重要的作用[14,15]。视网膜内三类胶质细胞:小胶质细胞、星形胶质细胞和Muller细胞。GAFP和S100分别为星形胶质细胞和Muller细胞的标记物。本实验结果显示,糖尿病组大鼠视网膜星形胶质细胞GFAP表达的总面积明显减少, Muller细胞S100的表达没有明显变化,提示星形胶质细胞对高血糖的反应可能更加敏感。
综上所述,本研究使用小剂量多次注射STZ建立糖尿病大鼠DR模型,与单次大剂量造模方法相比,不仅造模成功率高,视网膜和微血管的形态学及超微结构变化出现得更早。在模型成立后3个月即表现出与病人相似的早期临床症状和组织病理学改变,为DR早期病变的发病机理、药效学等的研究提供了可供选择的研究工具。
[1] Barber AJ, Lieth E, Khin SA, et al. Neural apoptosis in the retina during experimental and human diabetes. Early onset and effect of insulin [J]. J Clin Invest,1998;102(4): 783-791
[2] Roufail E, Soulis T, Boel E, et al. Depletion of nitric oxide synthase-containing neurons in the diabetic retina: reversal by aminoguanidine [J]. Diabetologia,1998; 41(12): 1419-1425.
[3] Zhang M, Lv XY, Li J, et al. The characterization of high-fat diet and multiple low-dose streptozotocin induce type 2 diabetes rat model [J]. Exp Diabetes Res, 2008, 2008: 704045.
[4] Cefalu WT, Wagner JD, Bell-Farrow AD. Old world nonhuman primate models of type 2 diabetes mellitus [J]. ILAR J. 2006; 47(3): 259-271.
[5] 江志坚, 董健鸿, 王惠英, 等.链脲佐菌素诱导建立Sprague-Dawley大鼠糖尿病视网膜病变模型的评价 [J]. 上海医学, 2010, 33(1): 85-86.
[6] 宋鄂, 吕成芳, 齐晓同, 等. 糖尿病大鼠视网膜病理模型的建立 [J].吉林大学学报: 医学版,2003, 29(3) : 286-288.
[7] 庞东渤, 符丽娟, 刘学政.链脲佐菌素-糖尿病大鼠视网膜微血管病理改变 [J].眼视光学杂志2005, 7(1): 47-49.
[8] Anderson HR, Stitt AW, Gardiner TA, et al. Diabetic retinopathy: morphometric analysis of basement membrane thickening of capillaries in different retinal layers within arterial and venous environment [J]. Br J Ophthlmol. 1995, 79: 1120-1123.
[9] 卢艳, 姬志娟, 吴航, 等. 电镜观察糖尿病模型大鼠神经网膜的超微结构 [J].首都医科大学学报. 2002, 23: 45-48.
[10] Zeng XX, Ng YK, Ling EA. Neuronal and microglial response in the retina of streptozotocin-induced diabetic rats [J]. Vis Neurosci 2000; 17(3): 463-471.
[11] Barber A J, Antonetti DA, Mapping the blood vessels with paracellular permeability in the retinas of diabetic rats [J]. Invest Ophthalmol Vis Sci, 2003, 44: 5410-5416.
[12] Scott TM, Foote J, Peat B, et al. Vascular and neural changes in the rat optic nerve following induction of diabetes with streptozotocin [J]. J Anat 1986; 144: 145-152.
[13] Kusari J, Zhou S, Padillo E, et al. Effect of memantine on neuroretinal function and retinal vascular changes of streptozotocin-induced diabetic rats [J]. Invest Ophthalmol Vis Sci 2007; 48(11): 5152-5159.
[14] Aizu Y, Oyanagi K, Hu J, et al. Degeneration of retinal neuronal processes and pigment epithelium in the early stage of the streptozotocin-diabetic rats [J]. Neuropathology 2002; 22(3):161-170.
[15] Martin PM, Roon P, Van Ells TK, et al. Death of retinal neurons in streptozotocin-induced diabetic mice [J]. Invest Ophthalmol Vis Sci. 2004; 45(9): 3330-3306.
Establishment of a rat model of early diabetic retinopathy induced by multiple low-dose streptozotocin injection
ZHU Hua1,LI Yan-hong1, XU Yan-feng1,XU Yu-huan1,XU Qing-gang2,YIN Hong-xia, QIN Chuan1*
(1. Key Laboratory of Human Disease Comparative Medicine, Ministry of Health; Key Laboratory of Human Diseases Animal Model, State Administration of Traditional Chinese Medicine; Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences (CAMS) & Comparative Medical Center, Peking Union Medical College (PUMC),Beijing 100021, China; 2. Beijing Tongren Hospital, Capital Medical University, Beijing 100730))
Objective The aim of this study was to observe the morphological changes of the retina at early stage of diabetes in SD rat induced by multiple injections of low-dose (multi-low-dose) streptozotocin (STZ). Methods Seventy-five male SD rats were randomly divided into control (CON)(n=30) and diabetes mellitus (DM)(n=45) groups. Rats in the DM group received multiple low-dose STZ i.v. injection for 5 consecutive days (30 mg/kg). The blood glucose, body weight, and other parameters were observed once a week after injection. In the 4, 8 and 12 w, the morphological changes in the retina were observed using HE and immunohistochemical (IHC) staining, vasculature digest preparation and transmission electron microscopy (TEM). Results The body weight of animals in the DM group was decreased from 2 w. The average body weight of the DM group was significantly lower than that of CON group (P<0.01). The average blood glucose of DM group was significantly higher than that of the CON group (P<0.01). TEM examination revealed thickened capillary basement membrane and dilatation of capillary at 4 w. trypsin digest preparation showed endothelial cell hyperplasia, mitochondrial swelling, cristae disruption, and vacuolar degeneration in capillary endothelial cells at 8 w. Retina HE staining showed retinal capillary dilatation and interstitial edema, capillary intumescence, apoptosis in endothelial cells in the DM group at 12 w. The control group had no obvious abnormalities. Staining of GAFP in the retina indicated decreased expression in the ganglion cell layer and nerve fiber layer, bipolar cells and ganglion cells, mitochondrial swelling and cristae disruption in pericytes, decreased membranous disc, and widened gap between membranous discs at 12 w. Conclusions Our findings indicate that an early stage diabetic retinopathy (DR) can be induced in rats by multiple low-dose streptozotocin injection. This may serve as a valuable preclinical model for studying the pathogenesis, pharmacodynamics and potential therapies for DR and its complications.
Diabetes mellitus; Diabetic retinopathy; Animal model; Streptozotocin; Rat
QIN Chuan. E-mail: chuanqin@vip.sina.com
国家自然科学基金青年项目(编号:81201075),国家自然基金面上项目(编号:81371546)。
朱华(1971-),主任技师,研究方向:病理与病理生理学。E-mail: zhuhua0226@vip.sina.com
秦川,教授,博士生导师。研究方向:病理与病理生理学。 E-mail: chuanqin@vip.sina.com
研究报告
Q95-33
A
1005-4847(2016)05-0487-07
10.3969/j.issn.1005-4847.2016.05.009
2016-02-29
