Noggin基因沉默对BMP和Wnt信号通路表达的影响
2016-11-29马雨楠游颖沈欢欢孙兆增曾林法云智
马雨楠,游颖,沈欢欢,孙兆增,曾林,法云智
(军事医学科学院实验动物中心,北京 100071)
Noggin基因沉默对BMP和Wnt信号通路表达的影响
马雨楠,游颖,沈欢欢,孙兆增,曾林*,法云智*
(军事医学科学院实验动物中心,北京 100071)
目的 检测分析Noggin基因沉默对毛囊发育中BMP和Wnt信号通路的影响。方法 采用实时荧光定量PCR和western blot技术对Noggin基因沉默的MC3T3-E1稳转细胞系中BMP-2、BMP-4、BMPR-IA、BMP-6、BMP-7、LEF-1、β-catenin的表达情况进行检测分析。 结果 实时荧光定量PCR结果显示,BMP信号通路中的五个基因的表达都受到Noggin基因沉默的显著的影响,其中BMP-2(P<0.001)、BMP-4(P<0.01)、BMP-6(P<0.001)、BMP-7(P<0.001)表达量均升高;BMPR-IA(P<0.01)表达量降低。同时Wnt信号通路中的两个基因LEF-1(P<0.001)、β-catenin(P<0.001)的表达也都显著降低。Western blot结果显示,两条信号通路中这几种蛋白的表达也都受到影响,其中显著升高的有BMP-2(P<0.05)、BMP-4(P<0.05)、BMP-6(P<0.05)和BMP-7(P<0.05);显著降低的是β-catenin(P<0.05)、BMPR-IA(P<0.01)和LEF-1(P<0.001)。结论 在体外Noggin基因对BMP信号通路可能存在反馈性抑制机制,而对Wnt信号通路存在反馈性激活机制,为下一步探究在体内Noggin基因对BMP和Wnt信号通路表达的作用提供一定的依据。
Noggin基因;BMP信号通路;Wnt信号通路;毛囊
毛囊(hair follicle,HF)被认为是一种由外胚层中胚层相互作用形成的微型器官[1]。HF形态发生是在早期胚胎阶段开始的。Uncv无毛小鼠是由于常染色体基因突变导致其HF发育缺陷而产生的无毛性状。Uncv突变引起的小鼠毛囊发育缺陷是有助于研究HF发育调控的关键因素。HF形态的正常发育和规律周期取决于Wnt信号通路[2,3]、BMP信号通路[4-6]、Shh信号通路[7]、Notch信号通路[8]以及最近发现的mTOR信号通路[9]在上皮和间充质细胞之间的相互作用[10]。其中Wnt在诱导HF形成的过程中起着至关重要的作用,BMP主要参与细胞的分化,Shh参与形态发生及后期的分化,Notch决定干细胞的命运,而mTOR信号通路在毛发再生过程中能够促进干细胞的活化[11]。
已有研究资料表明Noggin基因在HF的发育过程中发挥了重要作用[12]。本实验借助之前构造的Noggin基因沉默表达载体,对影响HF发育信号通路中BMP和Wnt两条信号通路中相关因子进行分析,探索研究Noggin基因对HF形态发育相关信号通路的影响,以便于研究Uncv无毛小鼠毛囊发育信号通路的调控,分析其在毛囊发育调控中的作用和机理。
1 材料与方法
1.1 材料
1.1.1 主要试剂
EZgeneTMtissue RNA Kit(R6311-01)购自Biomiga公司(美国),PrimeScript RT reagent kit(RR047A)购自Takara公司(中国),AP(0486)、四甲基乙二胺(0761)、Tween-20(0777)购自Amresco公司(美国),FBS(SH30370.03)、0.05% EDTA胰酶(SH30042.01B)购自Hyclone公司(美国),DMEM高糖培养基(11965-118)、DMSO(D2650)购自Invitrogen公司(美国),SYBR® Premix Ex TaqTMⅡ(DRR081A)、4× SDS上样缓冲液(P1016)、1× PBS缓冲液(P1022)、1 M Tris-Cl(T1020)、1.5 M Tris-Cl(T1010)购自Solarbio公司(中国),BCA蛋白定量试剂盒(CW0014)购自Cwbiotech公司(中国)。1.1.2 主要抗体
抗BMP-2兔多克隆抗体(ab82511)、抗BMP-4兔多克隆抗体(ab137743)、抗BMPR-IA兔多克隆抗体(ab38560)、抗BMP-6兔单克隆抗体(ab155963)、抗BMP-7兔单克隆抗体(ab129156)、抗LEF-1兔单克隆抗体(ab137872)、抗β-catenin兔单克隆抗体(ab32572)、抗GAPDH兔单克隆抗体(ab181602)购自Abcam公司(英国),HRP标记山羊抗兔二抗(CW0103)为Cwbiotech公司(中国)。
1.2 实验方法
1.2.1 实时荧光定量PCR检测Noggin基因沉默对BMP和Wnt信号通路的影响
首先设计两个组别:shNoggin-1组和shMock组,前者为之前实验建立的Noggin基因沉默表达组,后者为对照组。根据GenBank中BMP-2、BMP-4、BMPR-IA、BMP-6、BMP-7、LEF-1、β-catenin和β-actin基因编码区序列,通过Primer Premier 5.0软件进行引物的设计,和NCBI中Blast序列比对功能,初步检测引物的特异性。引物序列见表1。用EzgeneTMTissue RNA Kit试剂盒分别提取两组样本中总RNA,测定RNA浓度后,用PrimeScript RT reagent Kit试剂盒进行反转录。按照SYBR® Premix Ex TaqTMII试剂说明书进行扩增。扩增程序为95℃ 180 s,(95℃ 7 s, 57℃ 10 s,72℃ 15 s)×40个循环,每组样本均设3次重复。通过溶解曲线确定反应的特异性,并根据标准曲线和荧光曲线的Ct值进行结果的定量计算。使用SAS统计软件处理实验数据,得到Noggin基因沉默对目的基因mRNA的影响效果。
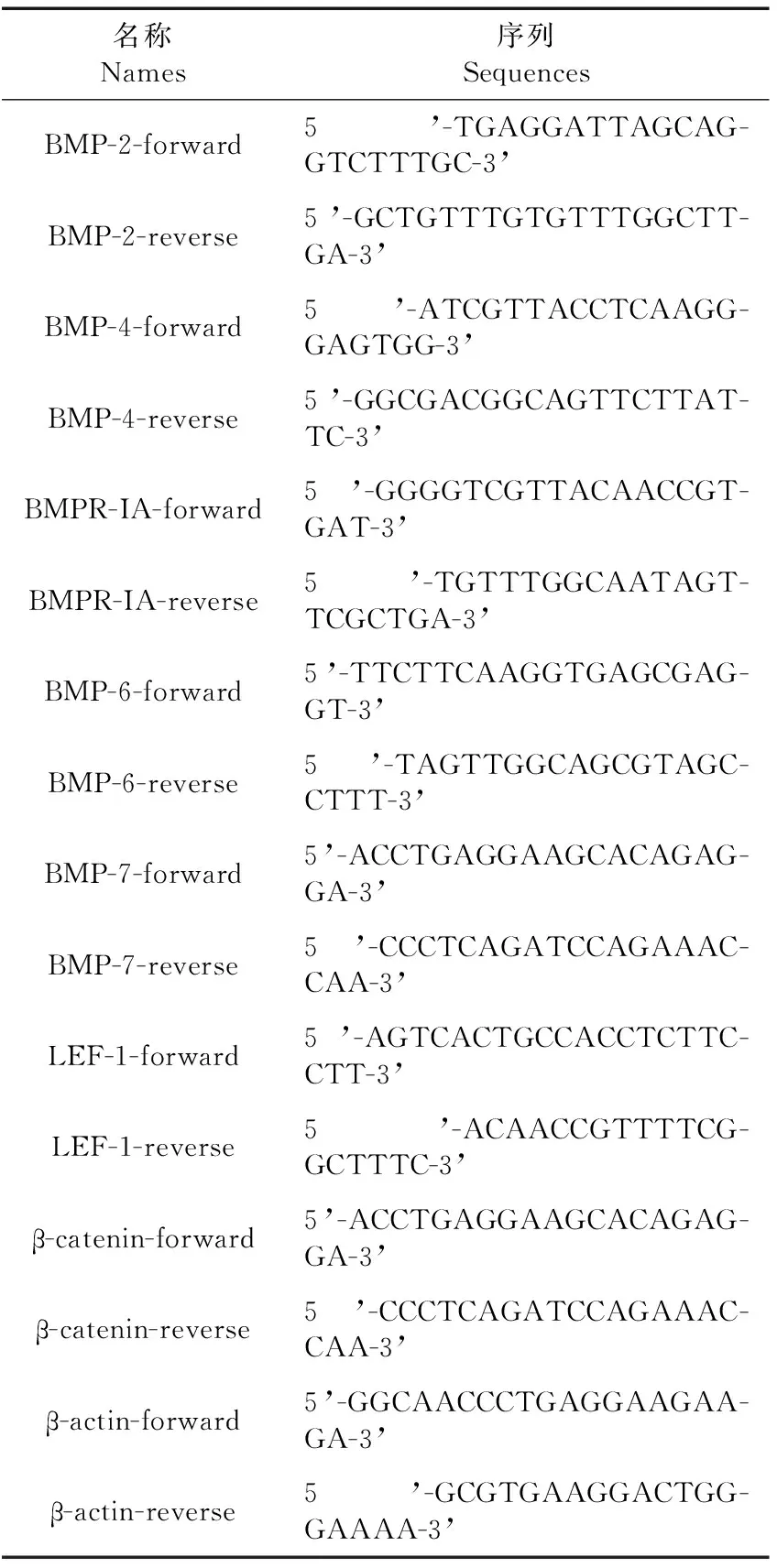
表1 引物序列表
1.2.2 Western blot检测Noggin基因沉默对BMP和Wnt信号通路的影响
向两组收取的细胞沉淀中分别加入混合蛋白酶抑制剂的RIPA裂解液,充分吹打混匀,置于冰上裂解20 min,14 000 r/min 4℃离心10 min,吸取上清液。用BCA蛋白定量试剂盒测定蛋白浓度,加适量RIPA调整蛋白浓度,加4× SDS上样缓冲液,煮沸10 min。待配制好的12% SDS-PAGE凝胶干后,每孔加入等质量蛋白,最左侧加入彩色预染蛋白marker,恒压100 V电泳后,恒流250 mA转膜。封闭1 h(封闭液用5%脱脂奶粉),按需要裁膜,目的蛋白膜分别加入1∶1000稀释的抗BMP-2兔多克隆抗体、1∶500稀释的抗BMP-4兔多克隆抗体、1∶1000稀释的抗BMPR-IA兔多克隆抗体、1∶1000稀释的抗BMP-6兔单克隆抗体、1∶1000稀释的抗BMP-7兔单克隆抗体、1∶1000稀释的抗LEF-1兔多克隆抗体、1∶5000稀释的抗β-catenin兔多克隆抗体,内参蛋白膜加入1∶10 000稀释的抗GAPDH鼠单克隆抗体,4℃孵育过夜。用TBST洗膜三次,每次10 min。分别加入对应的1∶10 000稀释的二抗,室温孵育40 min。同样用TBST洗膜三次,每次8 min。将膜拼好后,逐滴加混合好的发光AB液,反应1 min后去除即可显影。
2 结果
2.1 实时荧光定量PCR检测Noggin基因沉默对BMP和Wnt信号通路的影响
通过IQ5荧光定量PCR仪自带软件的数据以β-actin为内参,用2-△△Ct的方法处理数据和GraphPad Prism 5软件作图,结合SAS 9.2分析软件得到以下数据(图1),表明同对照组相比,BMP-2(P<0.001)、BMP-4(P<0.01)、BMP-6(P<0.001)、BMP-7(P<0.001)表达量均升高,且差异具有显著性;BMPR-IA(P<0.01)、LEF-1(P<0.001)、β-catenin(P<0.001)表达量均降低,且差异具有显著性。
2.2 Western blot检测Noggin基因沉默对BMP和Wnt信号通路的影响
为了确定干涉后蛋白表达变化是否与mRNA表达相似,选择与目的蛋白相对应的抗体,用Western blot的方法分析蛋白表达水平的变化(图2 A),并通过Photoshop 7.0灰度分析软件,结合SAS 9.2分析软件得到以下数据(图2 B)。Western blot结果显示,BMP-2(P<0.05)、BMP-4(P<0.05)、BMP-6(P<0.05)和BMP-7(P<0.05)表达量升高,差异有显著性;β-catenin(P<0.05)表达量降低,差异有显著性;BMPR-IA(P<0.01)和LEF-1(P<0.001)表达量降低,差异有显著性。与实时定量PCR的结果变化趋势一致。
3 讨论
Wnt是HF诱导中的第一个重要信号。Wnt信号通路对HF发育的调控主要体现在对细胞的增殖、分化以及细胞周期的调节。β-catenin是Wnt信号激活的关键转录因子[13,14]。有力的遗传证据表明,位于肠隐窝底部的祖细胞积聚形成核β-catenin标志着Wnt信号的激活[15],从而在肠道表皮干细胞的调节中起到重要作用[16,17];类似的证据也在HF中被发现[18]。通过移除β-catenin来阻止Wnt信号的传导会导致细胞增殖的完全消失[19]。β-catenin的缺乏会导致新生儿HF形态发育的不完全[20]和毛囊干细胞生态位的缺失[21]。β-catenin的伙伴LEF-1,不仅是毛胚早期诱导的需要[22,23],也是毛干分化所不可缺的。缺乏LEF-1的小鼠不能发育形成HF[22]。本实验选取Wnt信号通路中β-catenin和LEF-1两个相关因子进行检测具有一定的代表性,并从其变化量中分析对Wnt信号通路可能的影响。
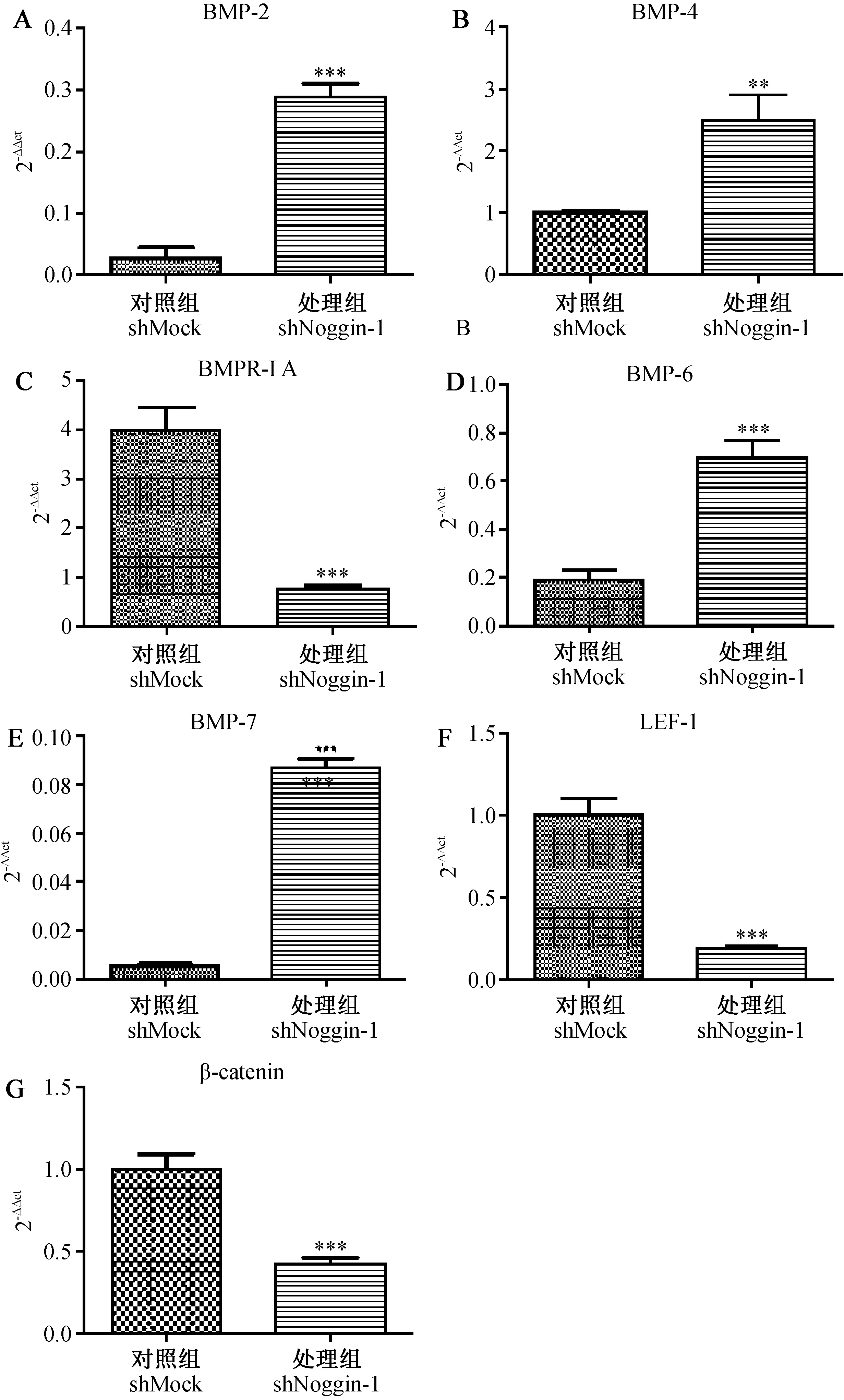
注:A:BMP-2分析结果;B:BMP-4分析结果;C:BMPR-IA分析结果;D:BMP-6分析结果;E:BMP-7分析结果;F:LEF-1分析结果;G:β-catenin分析结果;**:与shMock对照组相比P<0.01;***:表示与shMock对照组相比P<0.001。图1 qPCR检测Noggin基因沉默对BMP和Wnt信号通路的影响结果Note. A-G: Analysis of different genes ( A: BMP-2; B: BMP-4; C: BMPR-IA; D: BMP-6; E: BMP-7; F: LEF-1;G: β-catenin); **: Compared with the negative control, P<0.01; ***: Compared with the negative control, P<0.001.Fig.1 qPCR detection of the effect of Noggin silencing on BMP and Wnt signaling pathways

注:A:BMP-2;B:BMP-4;C:BMPR-IA;D:BMP-6;E:BMP-7;F:LEF-1;G:β-catenin;M:为shMock对照组;N:为shNoggin-1处理组即Noggin基因沉默表达组;*:与shMock对照组相比P<0.05;**:与shMock对照组相比P<0.01;***:表示与shMock对照组相比P<0.001。图2 Western Blot检测Noggin基因沉默对BMP和Wnt信号通路的影响结果Note. A-G: Results and analysis of different proteins (A: BMP-2; B: BMP-4; C: BMPR-IA; D: BMP-6;E: BMP-7; F: LEF-1; G: β-catenin); M: Negative control; N: Noggin silencing expression group.*: Compared with the negative control, P<0.05; **: Compared with the negative control, P<0.01; ***: Compared with the negative control, P<0.001.Fig.2 Western blot detection of the effect of Noggin silencing on BMP and Wnt signaling pathways
BMP信号通路在HF形态发生、发生后再生和HF循环的控制中起重要作用[24]。BMP是属于TGF-β超家族的分泌信号分子,并通过与特定的BMP受体相互作用发挥其生物活性[25-28]。BMP充当脊椎动物发育的多功能调节剂,能够控制包括皮肤在内的多种器官的细胞增殖、分化和凋亡[24,29,30]。BMP通过其受体BMPR-IA发挥作用,这是之前很长时间一致认定的唯一BMP受体[31]。BMPR-IA是内根鞘和毛干祖细胞分化所必不可少的。在成体HF中敲除BMP受体BMPR-IA导致毛囊干细胞被过早激活[32]。Noggin是BMP信号的一种蛋白抑制剂,它是由间质表达的,而已有研究资料表明Noggin基因在毛囊的发育过程中发挥了重要作用[12]。Noggin敲除小鼠HF诱导出现明显的延迟。Botchkarev等[31]在1999年研究发现BMP-4异位过表达以及BMP抑制剂Noggin的靶向干扰会扰乱HF诱导并引起脱发。能够有助于对抗BMP引起的β-catenin抑制。本研究在先前构建的小鼠Noggin基因沉默表达载体[33]的基础上,研究Noggin基因对毛囊形态发育的Wnt和BMP两条信号通路的影响,分析其在毛囊发育和调控中的作用和机理提供依据。
作为一个刺激HF诱导的关键信号分子,Noggin发挥功能主要通过两种途径,一是通过与BMP-4拮抗相互作用,二是通过75×103神经营养因子受体的下调。前者会导致LEF-1以及细胞粘附因子NCAM上调。Noggin诱导胚胎HF的形态发生并且促进新HF的增长(即生长期)[31,34]。我们的研究发现,在Noggin基因沉默的MC3T3-E1稳转细胞系中不仅对BMP-4的拮抗作用减弱,对BMP家族中BMP-2、BMP-6和BMP-7的拮抗作用也明显减弱。而BMP受体BMPR-IA的表达是受到抑制的,进一步表明Noggin对BMP信号的抑制作用减弱,逐渐恢复BMP受体的原有功能,从而证实了Noggin对BMP信号通路的反馈性抑制作用。
BMP介导的信号通路以及Wnt通路均对HF发育起到一定的调控作用,并且两条信号通路间可能存在交互作用。有研究表明,在发生Noggin缺失突变时,LEF-1/β-catenin介导的转录也随着失效了;相反的,在BMPR-IA缺失或者过量表达Noggin时,转录提高了[4,34]。LEF-1的直接靶点Dlx3位于Wnt的下游,对其进行直接的抑制会导致BMP信号的丢失[35]。反过来BMP信号通路可通过其受体BMPR-ⅠA作用,增强PTEN活性,进而抑制β-catenin的活性,达到抑制Wnt信号的目的[36]。Noggin抑制细胞中的BMP信号,引起LEF-1的表达从而恢复Wnt信号。我们研究结果显示,在Noggin基因沉默的MC3T3-E1稳转细胞系中,在BMP信号均明显上升的同时,LEF-1、β-catenin两者的mRNA水平和蛋白水平均有明显的下降,这为Noggin对Wnt信号通路的正反馈调节提供了依据。提示Noggin对Wnt通路之调控很有可能是通过BMP通路发挥作用的。
调控HF发育的几条信号通路间均存在一定的交互联系。刺猬因子(Sonic Hedgehog,Shh)是在HF基板产生的一种至关重要的HF诱导信号[37,38]。Wnt和BMP两条信号通路均对其表达有一定的影响。Wnt信号通路通过LEF-1介导上皮细胞钙粘蛋白的下调,进而提高Shh信号的表达水平[39]。BMP信号通路则是通过其抑制剂Noggin介导的BMP表达的抑制作用引起Shh信号的表达[40]。Notch信号通路有助于隆起部分滤泡结构的维持[8]。Wnt信号诱导对Notch通路产生正向作用,同时有证据表明Notch对Wnt信号具有对抗作用[41,42]。另一条信号通路mTOR可以作为BMP信号的上游调节剂对BMP信号产生反向调节作用[7],同时能够激活Notch信号[43],并能够被Wnt信号通路的拮抗剂GCK-3激活[44]。本实验中沉默Noggin基因体现出来的对BMP的反馈性抑制作用和对Wnt的反馈性激活作用是否同其它相关信号通路有关联,以及Noggin基因在体内又是如何对BMP和Wnt信号通路发挥功能进行调控从而影响HF发育的,相关分子机制仍需进一步实验证明。
[1] Schmidt-Ullrich R, Paus R. Molecular principles of hair follicle induction and morphogenesis [J]. Bioessays, 2005, 27: 247-261.
[2] Lien WH, Polak L, Lin M, et al. In vivo transcriptional governance of hair follicle stem cells by canonical Wnt regulators [J]. Nat Cell Biol, 2014, 16(2): 179-190.
[3] Andl T, Reddy ST, Gaddapara T, et al. WNT signals are required for the initiation of hair follicle development [J]. Dev Cell, 2002, 2(5): 643-653.
[4] Kobielak K, Pasolli HA, Alonso L, et al. Defining BMP functions in the hair follicle by conditional ablation of BMP receptor IA [J]. J Cell Biol, 2003, 163(3): 609-623.
[5] Kulessa H, Turk G, Hogan BL. Inhibition of Bmp signaling affects growth and differentiation in the anagen hair follicle [J]. EMBO J, 2000, 19(24): 6664-6674.
[6] Genander M, Cook PJ, Ramsköld D, et al. BMP signaling and its pSMAD1/5 target genes differentially regulate hair follicle stem cell lineages [J]. Cell Stem Cell, 2014, 15(5): 619-633.
[7] Jiang J, Hui CC. Hedgehog signaling in development and cancer [J]. Dev. Cell. 2008, 15: 801-812.
[8] Pan Y, Lin MH, Tian X, et al. Gamma-secretase functions through Notch signaling to maintain skin appendages but is not required for their patterning or initial morphogenesis [J]. Dev Cell, 2004, 7: 731-743.
[9] Deng ZL, Lei XH, Zhang XD, et al. mTOR signaling promotes stem cell activation via counterbalancing BMP-mediated suppression during hair regeneration [J]. J Mol Cell Biol, 2015, 7(1): 62-72.
[10] Sennett R, Rendl M. Mesenchymal-epithelial interactions during hair follicle morphogenesis and cycling [J]. Semin Cell Dev Biol, 2012, 23: 917-927.
[11] Rishikaysh P, Dev K, Diaz D, et al. Signaling involved in hair follicle morphogenesis and development[J]. Int J Mol Sci, 2014, 15(1): 1647-1670.
[12] Song K, Krause C, Shi S, et al. Identification of a key residue mediating bone morphogenetic protein (BMP)-6 resistance to noggin inhibition allows for engineered BMPs with superior agonist activity[J]. J Biol Chem, 2010, 285(16): 12169-12180.
[13] Nusse R, Samos CH, Brink M, et al. Cell culture and whole animal approaches to understanding signaling by Wnt proteins in Drosophila [J]. Cold Spring Harb Symp Quant Biol, 1997, 62: 185-190.
[14] Povelones M, Nusse R. Wnt signalling sees spots [J]. Nat Cell Biol, 2002, 4: E249-E250.
[15] Van de Wetering M, Sancho E, Verweij C, et al. The beta-catenin/TCF-4 complex imposes a crypt progenitor phenotype on colorectal cancer cells [J]. Cell, 2002, 111: 241-250.
[16] Shackleton M, Vaillant F, Simpson KJ, et al. Generation of a functional mammary gland from a single stem cell [J]. Nature, 2006, 439: 84-88.
[17] Korinek V, Barker N, Moerer P, et al. Depletion of epithelial stem-cell compartments in the small intestine of mice lacking Tcf-4 [J]. Nat Genet, 1998, 19: 379-383.
[18] Blanpain C, Fuchs E. Epidermal stem cells of the skin[J]. Annu Rev Cell Dev Biol, 2006, 22: 339-373.
[19] Pinto D, Gregorieff A, Begthel H, et al. Canonical Wnt signals are essential for homeostasis of the intestinal epithelium [J]. Genes Dev, 2003, 17: 1709-1713.
[20] Huelsken J, Vogel R, Erdmann B, et al. Beta-catenin controls hair follicle morphogenesis and stem cell differentiation in the skin [J]. Cell, 2001, 105: 533-545.
[21] Lowry WE, Blanpain C, Nowak JA, et al. Defining the impact of beta-catenin/Tcf transactivation on epithelial stem cells [J]. Genes Dev, 2005, 19: 1596-1611.
[22] Van GC, Okamura RM, Farinas I, et al. Development of several organs that require inductive epithelial-mesenchymal interactions is impaired in LEF-1-deficient mice [J]. Genes Dev, 1994, 8: 2691-2703.
[23] Zhou P, Byrne C, Jacobs J, et al. Lymphoid enhancer factor 1 directs hair follicle patterning and epithelial cell fate [J]. Genes Dev, 1995, 9: 700-713.
[24] Botchkarev VA, Kishimoto J. Molecular control of epithelial-mesenchymal interactions during hair follicle cycling [J]. J Investig Dermatol Symp Proc, 2003, 8: 46-55.
[25] Massague J, Chen YG. Controlling TGF-beta signaling [J]. Genes Dev, 2000, 14: 627-644.
[26] Miyazawa K, Shinozaki M, Hara T, et al. Two major Smad pathways in TGF-beta superfamily signaling [J]. Genes Cells, 2002, 7: 1191-1204.
[27] Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signaling [J]. Nature, 2003, 425: 577-584.
[28] Ten DP, Hill CS. New insights into TGF-beta-Smad signaling [J]. Trends Biochem Sci, 2004, 29: 265-273.
[29] Li AG, Koster MI, Wang XJ. Roles of TGF beta signaling in epidermal/appendage development [J]. Cytokine Growth Factor Rev, 2003, 14: 99-111.
[30] Hogan BL. Bone morphogenetic proteins: Multifunctional regulators of vertebrate development [J]. Genes Dev, 1996, 10: 1580-1594.
[31] Botchkarev VA, Botchkareva NV, Roth W, et al. Noggin is a mesenchymally derived stimulator of hair-follicle induction [J]. Nat Cell Biol, 1999, 1: 158-164.
[32] Kobielak K, Stokes N, de la Cruz J, et al. Loss of a quiescent niche but not follicle stem cells in the absence of bone morphogenetic protein signaling [J]. Proc Natl Acad Sci U S A, 2007, 104: 10063-10068.
[33] 马雨楠, 游颖, 孙兆增, 等. Noggin基因沉默表达载体的构建及筛选 [J]. 中国实验动物学报, 2016, 24(1): 38-42.
[34] Jamora C, DasGupta R, Kocieniewski P, et al. Links between signal transduction, transcription and adhesion in epithelial bud development [J]. Nature, 2003, 422(6929): 317-322.
[35] Hwang J, Mehrani T, Millar SE, et al. Dlx3 is a crucial regulator of hair follicle differentiation and cycling [J]. Development, 2008, 135: 3149-3159.
[36] Zhang J, He XC, Tong WG, et al. Bone morphogenetic protein signaling inhibits hair follicle anagen induction by restricting epithelial stem/progenitor cell activation and expansion [J]. Stem Cells, 2006, 24(12): 2826-2839.
[37] Millar SE. Molecular mechanisms regulating hair follicle development [J]. J Investig Dermatol, 2002, 118: 216-225.
[38] Fuchs E, Horsley V. More than one way to skin … [J]. Genes Dev, 2008, 22: 976-985.
[39] St-Jacques B, Dassule H R, Karavanova I, et al. Sonic hedgehog signaling is essential for hair development [J]. Curr Biol, 1998, 8: 1058-1068.
[40] Gao J, DeRouen MC, Chen CH, et al. Laminin-511 is an epithelial message promoting dermal papilla development and function during early hair morphogenesis [J]. Genes Dev, 2008, 22: 2111-2124.
[41] Proweller A, Tu L, Lepore JJ, et al. Impaired notch signaling promotes de novo squamous cell carcinoma formation [J]. Cancer Res, 2006, 66: 7438-7444.
[42] Hayward P, Brennan K, Sanders P, et al. Notch modulates Wnt signaling by associating with Armadillo/beta-catenin and regulating its transcriptional activity [J]. Development, 2005, 132: 1819-1830.
[43] Demitrack ES, Gifford GB, Keeley TM, et al. Notch signaling regulates gastric antral LGR5 stem cell function [J]. EMBO J, 2015, 34(20): 2522-2536.
[44] Alexander JV, Peter SK. GSK-3 and Wnt signaling in neurogenesis and bipolar disorder[J]. Front Mol Neurosci, 2012, 5(1): 1-13.
Effect ofNogginsilencing on the BMP and Wnt signaling pathways
MA Yu-nan, YOU Ying, SHEN Huan-huan, SUN Zhao-zeng,ZENG Lin*, FA Yun-zhi*
(Laboratory Animal Center of the Academy of Military Medical Sciences, Beijing 100071, China)
Objective To analyze the effect ofNogginsilencing on the BMP and Wnt signaling pathways in hair follicle development. Methods The expression of BMP-2, BMP-4, BMPR-IA, BMP-6, BMP-7, LEF-1 and β-catenin inNogginsilencing MC3T3-E1 stable cell line was detected by RT-PCR and western blot. Results RT-PCR results showed that the expressions of five genes in BMP signaling pathway were all significantly influenced byNogginsilencing, the expressions of BMP-2 (P<0.001), BMP-4 (P<0.01), BMP-6 (P<0.001) and BMP-7 (P<0.001) were all increased and the expression of BMPR-IA (P<0.01) was decreased. While the expressions of the two genes LEF-1 (P<0.001) and β-catenin (P<0.001) in Wnt signaling pathway were significantly decreased. Western blot results showed that the expressions of these proteins in the two signaling pathways were also affected. The expressions of BMP-2 (P<0.05), BMP-4 (P<0.05), BMP-6 (P<0.05) and BMP-7 (P<0.05) were all increased, while the expressions of BMPR-IA (P<0.05), LEF-1 (P<0.01) and β-catenin (P<0.001) were decreased. Conclusions There may be a negative feedback regulation ofNogginon the BMP signaling pathway in vitro, but a positive feedback regulation on the Wnt signaling pathway in vitro. It provides certain evidence for studies on the effect ofNoggingene on BMP and Wnt signaling pathways in vivo. There may be an interaction between hair follicle development-related signaling pathways, which still needs further experiments to prove.
Noggin; BMP signaling pathway; Wnt signaling pathway; Hair follicle
ZENG Lin, E-mail: zenglin1965@126.com; FA Yun-zhi, fyzc2004@126.com
国家自然科学基金重点项目(31030058);“十二五”科技重大专项(2012ZX10004-502)。
马雨楠(1989-),女,硕士研究生,研究方向:实验动物学。E-mail: mynrr324@126.com
曾林(1965-),男,研究员,研究方向:实验动物科学,E-mail: zenglin1965@126.com;法云智(1974-),男,副研究员,研究方向:实验动物学,E-mail: fyzc2004@126.com
研究报告
Q95-33
A
1005-4847(2016)05-0475-06
10.3969/j.issn.1005-4847.2016.05.007
2016-04-15
