脊髓灰质炎疫苗脑内法猴体神经毒力试验病理学评价方法的探讨
2016-11-29徐艳峰徐玉环韩云林乔红伟
徐艳峰,邓 巍,于 品,朱 华,黄 澜,徐玉环,韩云林,乔红伟,秦 川
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
研究报告
脊髓灰质炎疫苗脑内法猴体神经毒力试验病理学评价方法的探讨
徐艳峰,邓 巍,于 品,朱 华,黄 澜,徐玉环,韩云林,乔红伟,秦 川
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
目的 探讨脊髓灰质炎疫苗脑内法猴体神经毒力试验病理评价方法。方法 采用恒河猴双侧丘脑内注射给药,观察21 d后进行解剖,完整取出脑和脊髓,经修切后脱水包埋,切片经HE染色和没食子蓝染色后在光镜下观察,对神经组织病变进行评分,根据分值对病变严重程度进行判定。本研究涉及12批实验中的240动物。结果 本方法对左右大脑包括针迹在内的不同部位、中脑、小脑、脑桥、延髓、颈膨大、腰膨大进行取材,参照脊髓法神经毒力试验病理学评价的半切面评分方法,对双侧脑干、颈髓和腰髓的病变进行评价并计分,根据平均分值并结合具体病变情况分别判定此3个部位的病变程度。本研究中特异性的神经系统病变的发生率15%。各型疫苗病变发生率相似,轻微病变出现的比例最高。较严重的病变主要见于Ⅲ型疫苗。结论 在脑内法神经毒力试验中,用半切面评分方法对病变进行评分,较客观地反映了神经系统病变的情况,方法简便易行,实用性较强,利于判断标准的统一,可作为脊髓灰质炎疫苗脑内法神经毒力试验病理学评价方法的参考。
脑内法神经毒力试验; 脊髓灰质炎疫苗;病理学评价
脊髓灰质炎是一种急性传染病,传播广泛,病原为脊髓灰质炎病毒。此病毒常侵犯中枢神经系统,损害脊髓前角运动神经细胞,导致肢体松弛性麻痹,多见于儿童,故又名小儿麻痹症。多数人感染后为轻症,少数重症患者可发生瘫痪,甚至因呼吸、循环衰竭而死亡。目前随着疫苗的广泛接种,人类在根除脊髓灰质炎方面已经取得很大进展,大多数国家已消除这种疾病。但最近报道此疾病在叙利亚、乌克兰、以色列等国家重新流行[1],在我国也有死灰复燃的现象。目前包括我国在内的140多个国家仍以口服脊髓灰质炎减毒活疫苗作为主要预防措施,因疫苗可能会在某些情况下恢复神经毒性而引起脊髓灰质炎病变,对其安全性进行恰当评价是非常重要的工作。
根据《中华人民共和国药典( 三部)》(2010年版) 及 WHO 的相关规定,目前脊髓灰质炎疫苗的神经毒性评价需通过猴体神经毒力试验进行,主要有两种方法: 脊髓法和脑内法。脊髓法需要将供试品组的病变与同型参考品的病变进行比较;脑内法不需与参考品的病变进行比较,但对手术操作要求较高,结果判定中单只猴病变的影响较大。两种方法对于疫苗安全性评价的敏感性基本是一致的[2],也有报道认为脑内法比脊髓法更敏感[3]。目前根据药典规定的方法,脑内法只需要总体判定每只动物的病变程度,而未详细规定具体的判定标准,因此在不同的机构和人员之间易造成偏差。此试验借鉴脊髓法中的半切面计分法,对脑内法的脑干、颈髓及腰髓等部位的病变进行评分,并根据此三个部位的各自的平均分值对单只动物的病变程度进行判定,旨在提高病变判断的准确性和一致性。
1 材料和方法
1.1 实验动物
普通级健康恒河猴,购自中国医学科学院医学实验动物研究所北方资源中心【SCXK(京)2014-0011】。年龄1~3周岁,体重1.7 kg~4.5 kg。猴血清经1∶4稀释后证明不含同型别病毒中和抗体,猴血清用间接免疫荧光(DIA)抗体检查法检查排除潜在的猴B病毒(BV)和无泡沫病毒病(SFV)。猴结核菌素试验为阴性。动物实验在中国医学科学院医学实验动物新药安全研究评价中心进行【SYXK ( 京 ) 2010-0030】。本文所涉及的动物数量为12批实验中的240只动物。
1.2 实验仪器及试剂
Stoelting 51600型脑立体定位仪(美国Stoelting公司),Leica ASP300全自动组织脱水机,IVS-410推拉式切片机(日本樱花),ST5010自动染色机(德国徕卡),EG1150H+C石蜡包埋机(德国徕卡),BX51光学显微镜(日本奥林巴斯公司)。苏木素及伊红染色液购自北京利精细化学品有限公司,没食子蓝染料购自上海源叶生物科技有限公司。
1.3 动物实验
使用脑立体定位仪将微量注射器针头插入丘脑,在两侧丘脑分别注入0.5 mL脊髓灰质炎疫苗样品,原倍浓度及10-1浓度各10只。注射后48 h内死亡或出现非特异性麻痹症状者剔除不计,中途死亡及到期处死动物,做中枢神经系统病理组织学检查。
1.4 动物解剖及取材
动物在给药21 d后,进行安乐死并解剖。完整取出脑组织及脊髓,10%甲醛溶液充分固定后,进行取材。取材时首先寻找脑顶叶区注射点,在注射点前后各取一个切面,以确保取材部位包含针迹。取材部位包括: 额叶、顶叶、注射点、颞叶、枕叶、海马、基底节、丘脑(以上部位左右大脑双侧取材)、中脑、小脑、脑桥、延髓、颈膨大、腰膨大。
1.5 切片制作及观察
组织块经梯度酒精脱水,石蜡包埋,切片厚度8 μm~15 μm,进行HE染色及没食子蓝染色,光镜下检查。
2 结果
2.1 病变发生情况及评价

注: A.轻微病变;B.轻度病变;C.中度病变;D.重度病变图1 脊髓病变,HE染色Fig.1 Histopathological lesions of the spinal cord. A. Minimal lesion;B. Mild lesion;C. Moderately severe lesion;D. Severe lesion.HE staining.
在12批实验240只动物中,36只动物出现特异性的神经系统病变,发生率15%。大部分动物病变轻微,仅表现为胶质细胞增生、炎细胞浸润,未见神经元损伤,且病变多局限于脑干。小部分表现为不同程度运动神经元的损伤,病变部位主要位于脑干(中脑、脑桥、延髓)、颈膨大、腰膨大。出现神经元变性、坏死、噬神经细胞现象和卫星现象,伴有轻重不一的炎性反应如散在的炎细胞浸润、血管周围炎细胞袖套状浸润、胶质细胞增生。脑干及脊髓左右两侧的病变可有较大差别。病变严重的病例在大脑顶叶、丘脑注射针迹周围也出现血管袖套及少数神经元变性坏死,但病变程度较脑干、颈髓及腰髓等部位为轻,海马、基底节区域因距丘脑针迹较近,亦偶有累及,病变均较轻。额叶、枕叶、颞叶未见特异性病变。参照《中华人民共和国药典( 三部)》(2010 年版)中脊髓病变的半切面计分法,对病变进行分级和评分。评分标准如下: 0分,未见病变;1分,轻微病变,仅有炎细胞浸润,未见神经元损害;2分,轻度病变,炎细胞浸润伴有少量的神经元损害;3分,中度病变,炎细胞浸润伴有广泛的神经元损害;4分,重度病变,大量的神经元损害,伴或不伴有炎细胞浸润(图1,2)。对脑组织的针迹附近病变进行评价时,只对高倍镜下(40×)距离针迹反应两个视野范围以外的病变进行评分,距针迹反应两个高倍视野范围内的病变计为“0”分。分值计算方法: 脑干(中脑、脑桥、延髓)、颈膨大和腰膨大各个切面左右两侧分别计分;脑干、颈膨大和腰膨大三个部位分别取各切面双侧的病变平均值作为这三个部位的病变分值。
部分动物出现脑膜及脊髓膜血管周围少量炎细胞浸润,此类病变均较轻,且局限于脑膜和脊髓膜的部分血管周围,未累及实质区,其是否出现及出现的范围、严重程度与脑和脊髓出现脊髓灰质炎病变的情况无关,未对此种病变计分。部分动物出现注射部位附近脑膜出血,亦未计分。
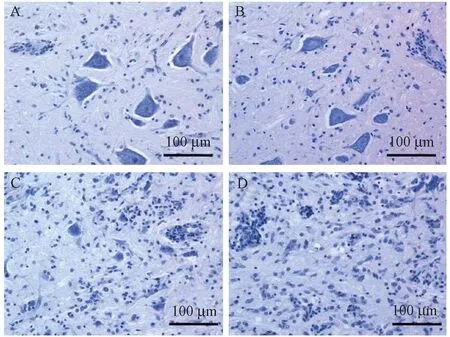
注: A.轻微病变;B.轻度病变;C.中度病变;D.重度病变图2 脊髓病变,没食子蓝染色Fig.2 Histopathological lesions of the spinal cord. A. Minimal lesion;B. Mild lesion;C. Moderately severe lesion;D. Severe lesion. Gallocyanin staining.
2.2 动物病变程度的判断
每只动物总的病变程度判断主要依据脑干、颈髓及腰髓各自的平均分值,以其中较高的分值,结合每个切面较重病变的出现情况,作为病变严重程度的指标[4]。本研究发现各型疫苗病变发生率相似,轻微病变出现的比例最高。较严重的病变主要见于Ⅲ型疫苗。病变发生率和严重程度与给予病毒的滴度无关,有些病毒株在以10-1倍浓度注射时出现病变,而以原倍浓度注射时则未见病变,此结果与文献报道一致[5]。
3 讨论
目前世界卫生组织虽制定计划用灭活脊髓灰质炎疫苗取代口服脊髓灰质炎疫苗,但因受到多种因素的限制只能逐步进行实施[6]。口服脊髓灰质炎疫苗为减毒活疫苗,病毒可在特定环境下发生突变,恢复神经毒性,引起脊髓灰质炎疫苗相关病例(vaccine-associated paralytic poliomyelitis,VAPP),并可能在人群中扩散,成为脊髓灰质炎传播的重要危险因素,世界范围内每年有超过200例VAPP,因此对于脊髓灰质炎减毒活疫苗需进行猴体神经毒力试验检测其神经毒性。目前脊髓灰质炎疫苗猴体神经毒力实验可采用脊髓法和脑内法两种方法。脊髓法是把待检疫苗和参考品直接注射于脊髓,比较待检疫苗和参考品神经系统损伤的差异而判断疫苗减毒的情况,而脑内法将疫苗注射于丘脑,通过观察神经系统的病变,特别脑干及脊髓的运动神经元损伤情况,判断疫苗的神经毒性。
药典中对于脊髓法病理评价方法的规定较为明确,对于脑内法只规定了神经毒力试验中疫苗是否合格的判断标准,但对于取材的部位和具体的病变程度的判定并未做详细规定,因此不同人员在操作中可能出现诊断标准的差异。本文探讨了将脊髓法中的半切面评分法用于脑内法病理改变的评价方法,分别对脑组织、脊髓颈膨大和腰膨大的半切面病变进行评分,并对这三个部位的平均病变分值进行计算,根据分值并参考具体情况进行病变程度的判定。在本试验中,发现脑内法出现较明显中枢神经系统病变的动物其病变部位主要位于脑干、颈膨大和腰膨大,而其他部位如丘脑虽可出现病变,但病变程度与脑干及脊髓相比较轻微,可能是由于缺乏对脊髓灰质炎病毒敏感的运动神经核团所致[5]。因此,在判定动物病变程度的时候,建议脑部的病变程度主要考虑中脑、脑桥和延髓的平均病变。颈髓和胸髓出现病变时,提示病毒已远途扩散至此部位,因此建议将脑干、颈髓和腰髓的三个部位病变中的最大值作为判断动物病变严重程度的标准。
在对脑干、颈膨大及腰膨大三个部位的多个半切面进行平均值计算时,因不同切面病变程度差异较大,可能会掩盖个别较重的病变区,而此区出现的病变因有神经元的损伤已可能引起脊髓灰质炎的症状。因此对于这三个部位的病变程度的判断,除主要参考平均分值外,需慎重考虑个别切面较大的值。
本研究发现各型疫苗出现病变的总比例相似。轻微病变出现比例最高,病变位置多在脑干,很少向脊髓扩散。中度及以上病变主要见于Ⅲ型疫苗,病变在脑干、颈髓和腰髓均较明显,与此前报道的结果一致[7]。少数动物出现注射部位附近脑膜出血,考虑与手术操作引起的损伤有关。部分动物出现脑膜及脊髓膜血管周围少量炎细胞浸润等病变,考虑为疫苗引起的固有反应,并非疫苗的神经毒性所致[8]。
本文探讨了脑内法脊髓灰质炎疫苗的猴体神经毒力试验中,对神经系统病变进行评分并判定病变程度的方法,操作简便易行,实用性较强,有利于统一病理学评价标准,提高诊断的一致性,可作为脊髓灰质炎疫苗脑内法神经毒力试验病理学评价方法的参考。
[1] Bencsk6 G, Ferenci T. Effective case/infection ratio of poliomyelitis in vaccinated populations [J]. Epidemiol Infect, 2016, Feb 2:1-10.
[2] 谢忠平, 陈瀚博, 沈冬, 等. 口服脊髓灰质炎减毒活疫苗猴体神经毒力试验病理结果分析 [J]. 中国生物制品学杂志, 2007, 20(3): 206-208, 218.
[3] 罗其胜, 王庆玲, 李艳梅, 等. 口服脊髓灰质炎活疫苗(OPV) 猴体神经毒力试验国内外病理学检定结果分析 [J]. 中国生物制品学杂志, 1998, 11(2): 84-86
[4] Nathanson N, Horn SD. Neurovirulence tests of type 3 oral poliovirus vaccine manufactured by Lederle Laboratories, 1964-1988 [J]. Vaccine, 1992, 10(7): 469-474.
[5] Contreras G, Fzlresz J, Karpinski K, et al. Experience in Canada with the new revised monkey neurovirulence test for oral poliovirus vaccine [J]. J Biol Stand, 1988, 16(3): 195-205.
[6] Sutter RW, Platt L, Mach O, et al. The new polio eradication end game: rationale and supporting evidence [J]. J Infect Dis, 2014, 210(S1): S434-438.
[7] 杨建勇, 王红燕, 柯为华, 等. 口服脊髓灰质炎减毒活疫苗猴体神经毒力试验参考品合格标准的统计分析 [J]. 微生物学免疫学进展, 2005, 33(4): 7-12.
[8] 罗其胜, 罗国祥, 陈淑范, 等. 口服脊髓灰质炎减毒活疫苗猴体神经毒力试验病理检定分析 [J]. 生物制品学杂志, 1990, 3(2): 73-77.
Pathological evaluation of the intrathalamic neurovirulence test of poliomyelitis vaccine in monkeys
XU Yan-feng, DENG Wei, YU Pin, ZHU Hua, HUANG Lan, XU Yu-huan, HAN Yun-lin, QIAO Hong-wei, QIN Chuan
(Institute of Laboratory Animal Sciences, Key Laboratory of Human Disease Comparative Medicine, Ministry of Health, Key Laboratory of Human Disease Animal Models, State Administration of Traditional Chinese Medicine, Beijing Key Laboratory for Animal Models of Emerging and Reemerging Infectious Diseases, Beijing 100021, China)
Objective To investigate the pathological evaluation method of intrathalamic neurovirulence test of poliomyelitis vaccine in monkeys. Methods Two hundred and forty healthy rhesus monkeys age 1-3 years, body weight 1.7-4.5 kg, in 12 lots, were used in this study. The monkeys were injected with poliomyelitis vaccine into bilateral thalamus. The animals were sacrificed after observation for 21 days and specimens of the brain and spinal cord were collected. After dehydration, embedding and sectioning, HE and gallocyanin staining were used for pathological observation. The pathological changes were scored, and the severity of the pathological changes were determined by scoring. Results The sections were taken from bilateral cerebellum (needle tracts included), midbrain, pons, medulla oblongata, cervical enlargement and the lumbar enlargement. The pathological changes were evaluated referring to the hemisection scoring method of intraspinal neurovirulence test. Lesions on both sides of the brain stem, cervical enlargement and lumbar enlargement were scored, and the severity of the lesions at these three regions were determined according to the average score. The total incidence rate of specific neuronal pathological changes was 15%. The incidence rates of lesions caused by different types of vaccines were similar. Most of the lesions were minimal, and severe lesions were seen mainly in the type III vaccine tests. Conclusions In intrathalamic neurovirulence test, scoring of the lesions of nervous system by hemisections can objectively reflect the pathological changes in the nervous system. This method is simple and easy to apply, practical, and can facilitate the unification of diagnostic criteria. We would recommend this method to be used in pathological evaluation in intrathalamic neurovirulence test of poliomyelitis vaccine.
Intrathalamic neurovirulence test; Poliomyelitis vaccine; Pathological evaluation; Rhesus monkeys
卫计委行业基金(201302006);国际科技专项项目(2015DFG32230)。
徐艳峰( 1972-),女,助理研究员,研究方向: 毒性病理学。E-mail: xuyanf2009@163.com。
秦川(1959-),女,教授,博士生导师,研究方向: 病理与病理生理学。E-mail: chuanqin@vip.sina.com。
R-33
A
1671-7856(2016)10-0001-04
10.3969.j.issn.1671-7856.2016.10.001
2016-04-10
