家兔支气管败血波氏杆菌灭活疫苗菌种筛选
2016-11-29马增晖河北省迁安市农业畜牧水产局064400
马增晖 (河北省迁安市农业畜牧水产局 064400)
家兔支气管败血波氏杆菌灭活疫苗菌种筛选
马增晖 (河北省迁安市农业畜牧水产局 064400)
兔波氏杆菌病是一种严重危害养兔业的细菌性疾病。兔波氏杆菌病可引起家兔的传染性鼻炎,特别是在规模化养兔场,波氏杆菌与巴氏杆菌、葡萄球菌混合感染相当普遍,已成为兔病防治的一大难题。接种疫苗是目前预防这两种疾病的最有效的措施。本研究从Bb分离株中筛选得到制苗用兔波氏杆菌1株,为研制Bb灭活疫苗打下了坚实的基础。现将菌种的筛选及生物学特性的试验结果报告如下。
1 材料与方法
1.1 材料
1.1.1 试验用菌株
Bb分离株6株;沙门氏菌、魏氏梭菌、大肠杆菌、金黄色葡萄球菌、巴氏杆菌,均购自中国兽药监察所。
1.1.2 试验动物
16~18g的清洁级小鼠;30日龄左右的健康家兔。
1.1.3 常规培养基
血清血红素平板、TSA平板、胆硫乳 (DHL)平板、麦康凯平板、马丁肉汤等 (按常规方法配制)。
1.1.4 生化培养基及试剂
蛋白胨水、硝酸盐还原培养基、葡萄糖磷酸盐胨水、枸椽酸盐培养基、糖类发酵管、尿素培养基、三糖铁培养基均购自杭州天和微生物试剂有限公司。3%H2O2按照常规方法配制。
1.1.5 血清
Bb标准阳性血清和阴性血清。
1.2 方法
1.2.1 对小鼠的毒力测定
将6株Bb纯培养物接种马丁肉汤,置37℃摇动 (120r/min)培养24h。选择16~18g小鼠分为6组,每组4只。以0.2ml/只腹腔注射,观察3~5d,记录小鼠死亡时间,死亡者剖检,以分离到接种菌为标准。
1.2.2 最小致死剂量 (MLD)的测定
(1)对小鼠最小致死剂量测定。将3株Bb强毒株纯培养物接种马丁肉汤,置37℃摇动 (120r/min)培养24h。用平板培养法进行菌落计数,据结果将菌体浓度调整为1×109CFU/ml。将小鼠随机分3批,每批3组,每组2只,分别腹腔注射上述活菌1ml,0.1ml,0.01ml,另取6只小鼠分3批作对照,每批注射等量灭菌生理盐水。观察3~5d。详细记录小鼠死亡时间,并对死亡小鼠无菌取心血、肺,划麦康凯平板于37℃温箱培养。
(2)对家兔的最小致死剂量测定。将3株Bb强毒株纯培养物分别用接种环挑取菌落划满血清血红素平板,置37℃培养24h,用马丁肉汤洗下,计数,把菌液浓度调整为2×1010CFU/ml。将家兔随机分3批,每批4组,每组4只,分别静脉注射上述活菌2ml,1ml,0.5ml,0.25ml,另取6只家兔分3批作对照,每批注射等量灭菌生理盐水。接种后,各组隔离饲养,观察7d。详细记录家兔死亡时间,并对死亡家兔无菌取心血、肺划麦康凯平板,置37℃温箱培养观察。
1.2.3 血清学交互试验
(1)细菌的培养与计数。将3株Bb强毒株分别接种到血清血红素平板上,在37℃恒温箱中培养24h,纯检,用接种环挑取菌落划满血清血红素平板,37℃培养24h,纯检,用马丁肉汤洗下,计数,把菌液浓度调整为2.5×1010CFU/ml,加入0.2%的甲醛溶液灭活24h,灭活检验合格后分为两份备用。
(2)免疫原制备。取检验合格的菌悬液1份,加20%的灭活铝胶佐剂,调整菌液最终浓度为2×1010CFU/ml,4℃冰箱中保存,作为免疫原使用。
(3)微量凝集抗原制备。取另1份菌悬液,先用生理盐水洗涤3次。每次用生理盐水混匀,10000r/min离心20min,直至上清液清澈为止,弃去上清液。取沉淀用生理盐水稀释至1.2×1010CFU/ml,在悬浊液内添加甲醛,使其最终浓度为0.3%。在4℃环境下慢慢振荡,灭活4h。按1/10000比例添加硫柳汞后,在4℃冰箱中冷藏保存,作为微量凝集抗原原液使用。使用时,用生理盐水稀释至3×109CFU/ml。
(4)兔Bb高免血清的制备:经血清平板凝集试验检查为Bb抗体阴性的健康家兔6只,分别用上述抗原免疫,每株细菌免疫2只家兔,共免疫3次,每次间隔1周,免疫菌体的量依次为0.5ml、1ml、1ml。末次免疫后7d试血,待兔血清微量凝集价高于1:256时心脏采血、分离血清。分别用接种环挑取沙门氏菌、大肠杆菌、巴氏杆菌、葡萄球菌、魏氏梭菌平板培养物各1环,与血清进行平板凝集试验,检测特异性,合格者分装置-20℃保存。
(5)微量凝集试验:Bb强毒菌株抗原分别与上述高免血清进行微量凝集试验,选取交叉反应性最好的菌株作为制苗用菌株。试验设阳性血清和阴性血清对照。
1.2.4 3株Bb强毒株对小鼠交互免疫保护试验
(1)交互免疫保护试验免疫原的制备。参照1.2.3中免疫原的制备。
(2)交互免疫保护试验方法。试验组小鼠腹腔注射上述免疫原0.3ml,对照组小鼠腹腔注射等量灭菌生理盐水。15d后以24h内致死小鼠剂量攻毒,记录结果,选取保护率最高的Bb疫苗菌株作为制苗用菌株。
1.2.5 对制苗用兔支气管败血波氏杆菌菌株进行生物学特性鉴定。
2 结果与分析
2.1 对小鼠的毒力测定
将分离菌马丁肉汤培养物腹腔注射小鼠后,3d内小鼠几乎全部死亡。据具体死亡时间 (见表1),从6株Bb中筛选出3株最强菌株,菌种编号分别为 AH0702,HN0701,SD0612。从死亡小鼠心脏、肺脏均能分离到与接种菌一致的病原菌。
2.2 最小致死剂量 (MLD)的测定
3株Bb强毒株对小鼠及家兔的最小致死剂量 (见表2)。3株Bb强毒株对小鼠的最小致死剂量都是0.01ml(菌液浓度1×109CFU/ml),对家兔的最小致死剂量分别为0.25ml,0.5ml,0.25ml(菌液浓度2×1010CFU/ml)。 其中SD0612和AH0702株MLD最低,再通过对SD0612和AH0702株MLD致死小鼠、家兔死亡时间上进行比较,SD0612株Bb毒力最强 (见表3、4)。从死亡小鼠、家兔心脏、肺脏均能分离到接种菌。
2.3 血清学交互试验
试验中制备的上述3株Bb的高免血清与对照菌株均无凝集反应,因此,这3株血清均具有种属特异性。用这些血清对Bb的3株强毒株进行血清学交叉反应时,如表5所示,3个菌株都可发生交互凝集。SD0612株的交叉反应性最好,其高免血清与3个毒株发生的凝集反应凝集效价都非常高;AH0702、HN0701株次之。
2.4 3株Bb强毒株对小鼠交互免疫保护试验
在用这3个菌株进行小鼠的交互免疫保护试验时,SD0612株抗原对3株Bb强毒攻击的总保护率最高 (见表6),与血清学交互试验完全符合,故将其作为制苗用菌株。
2.5 兔支气管败血波氏杆菌SD0612株的生物学特性
2.5.1 形态及生化特性
本菌为革兰氏阴性,球杆菌,两端钝圆,散在,少数成双存在,两极染色不明显。生化试验结果为不发酵葡萄糖等碳水化合物,不产生靛基质、硫化氢;M-R试验为阴性;V-P试验阳性;分解尿素;不能利用枸椽酸钠,还原硝酸盐。
2.5.2 血清型
与SD0612株的高免血清进行玻片凝集试验,结果均呈阳性反应;在血平板上生长呈β溶血且致死小鼠,说明SD0612株是I相菌。
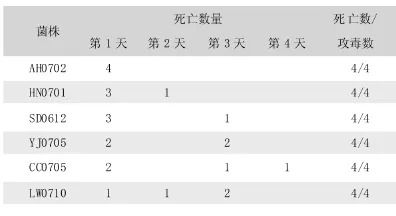
表1 分离菌对小鼠的毒力试验结果
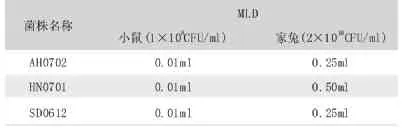
表2 3株Bb对小鼠、家兔的MLD测定结果
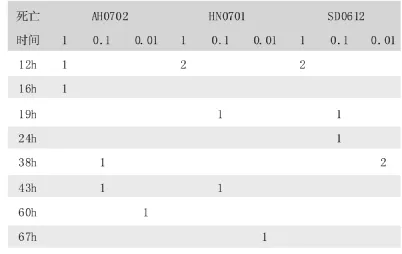
表3 对小鼠的最小致死剂量 (MLD)测定结果

表4 对家兔的最小致死剂量 (MLD)测定结果
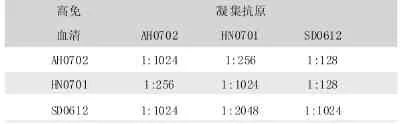
表5 血清学交叉反应结果
2.5.3 菌落型
将菌种接种于TSA平板上培养24h,菌落呈淡黄色、直径0.5~1mm、表面隆起、湿润、光滑、透明、有光泽。在胆硫乳 (DHL)平板上则形成直径为2mm左右,无色,表面湿润、光滑,边缘整齐的菌落;在麦康凯培养基上培养30h,菌落呈茶黄色、直径1~2mm,表面隆起、湿润、光滑、透明、有光泽,培养基颜色由红色变为黄色。鲜血平板上24h形成1mm左右乳白色菌落,菌落周围有β溶血圈,菌落湿润,中心隆起,边缘整齐。
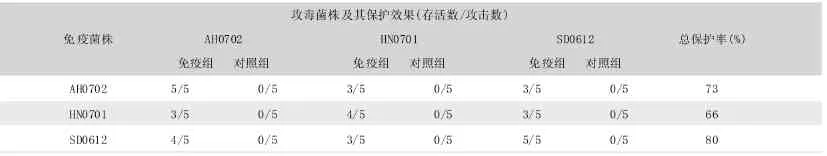
表6 3株Bb强毒株交互免疫保护试验
2.5.4 菌株毒力
SD0612株0.01ml(菌液浓度1×109CFU/ml)活菌腹腔注射16~18g的小鼠,小鼠于3d内死亡。
2.5.5 免疫原性
用16~18g小鼠10只,腹腔注射以20%铝胶生理盐水稀释的SD0612株灭活菌液0.3ml(含活菌60亿),15d后,连同条件相同的对照鼠10只,腹腔注射SD0612株3MLD,观察7d。结果,注射3MLD的对照小鼠全部死亡,免疫鼠有8只获得保护。
3 讨论与小结
Ⅰ相菌有不耐热的荚膜和短鞭毛,具有强坏死毒素,对小鼠和家兔有高度的致病性。而Ⅱ相菌和Ⅲ相菌则无致病性。据此,通过对小鼠的毒力测定,对小鼠,家兔的最小致死剂量的测定,血清学交互反应和小鼠交互免疫保护试验,并对SD0612株进行生物学特性的鉴定,结果表明,该菌株毒力较强,免疫原性好。故选择SD0612株作为制苗用菌种。
