基于人工掩蔽物法的若尔盖湿地中华蟾蜍种群生态研究
2016-11-28韩金锋江建平
王 刚, 李 成, 吴 军, 韩金锋, 江建平, 谢 锋,*
1 中国科学院成都生物研究所, 成都 610041 2 中国科学院大学, 北京 100049 3 环境保护部南京环境科学研究所, 南京 210042 4 若尔盖湿地国家级自然保护区管理局, 若尔盖 624500
基于人工掩蔽物法的若尔盖湿地中华蟾蜍种群生态研究
王 刚1,2, 李 成1, 吴 军3, 韩金锋4, 江建平1, 谢 锋1,*
1 中国科学院成都生物研究所, 成都 610041 2 中国科学院大学, 北京 100049 3 环境保护部南京环境科学研究所, 南京 210042 4 若尔盖湿地国家级自然保护区管理局, 若尔盖 624500
近几十年来,全球两栖动物种群衰减显著,两栖动物的生存现状引起了越来越多的生态学家和保护生物学家的关注。若尔盖湿地不仅是世界上最大的一块高原泥炭沼泽湿地,也是我国生物多样性保护的热点地区之一。该地区分布有 3 种两栖类: 高原林蛙(Ranakukunoris) 、倭蛙(Naroranapleskei) 和中华蟾蜍岷山亚种(Bufogargarizansminshanica)。已有研究发现该3种两栖动物种群数量均有不同程度的下降。采用人工掩蔽物法,在2011—2014年对该地区中华蟾蜍种群生态做了连续追踪。结果表明:该区域中华蟾蜍种群数量逐年波动较大,年龄结构数据显示该种群处于增长期;中华蟾蜍为聚集分布,且发现率与水体距离呈显著的线形关系(P<0.01),在样地范围内离水体越远,发现的个体越多;线形样方比方形样方捕获动物的效率更高(P=0.018);中华蟾蜍亚成体的肥满度季节间无明显差异;中华蟾蜍具有较强的迁徙能力,可能沿着固定的线路周而复始的迁徙。对于家域范围大,迁徙距离远的中华蟾蜍这类物种,应加强最适栖息地的保护并防止栖息地破碎化。
人工掩蔽物;中华蟾蜍;种群生态;若尔盖湿地
全球两栖动物种群衰退已经受到了全世界范围的广泛关注[1- 4]。有41%的两栖动物受到灭绝的威胁[5],是脊椎动物受威胁最高的类群[6- 7]。两栖动物复杂的生活史以及独特的生理结构,使其对环境变化十分敏感,被认为是理想的环境指示动物[8- 10]。对两栖动物的种群数量和健康状态进行长期监测,不仅能反应当地环境状态的变化,还能为制定长期的保护策略提供科学依据。
若尔盖湿地地处青藏高原东缘,是全球最大的高寒泥炭沼泽湿地之一。该湿地分布有3种两栖类,高原林蛙(Ranakukunoris)、倭蛙(Naroranapleskei)和中华蟾蜍岷山亚种(Bufogargarizansminshanica)(以下简称中华蟾蜍),3物种种群均有不同程度的下降[11]。2011—2014年,运用人工掩蔽物法并辅以电子芯片标记重捕法对该地区中华蟾蜍种群生态进行了连续多年的研究,对该物种的种群动态、分布和迁徙特点等有了进一步的认识,同时对其监测技术与方法进行了全面的讨论,为该区域两栖动物的保育和动态监测提供了新的思路。
1 研究区域及方法
1.1 研究区域
若尔盖湿地国家级自然保护区位于四川省阿坝藏族羌族自治州若尔盖县境内,33°25′—34°00′N,102°29′—102°59′E,平均海拔3500 m,其主要保护对象为黑颈鹤等珍稀野生动物及高原沼泽湿地生态系统[12]。保护区东西宽47km,南北长63km,总面积1666 km2。该地气候属于高原寒温带湿润季风气候,区内年平均气温0.7℃, 最热月(7月)平均为10.7℃,最冷月(1月)平均为-10.7℃,年平均降雨量为656.8mm,湿度为78%。年日照时间为2573h[13]。
1.2 样地设置与监测方法
监测样地位于典型的湿地草甸上,33°34.843′N,102°57.133′E。考虑到两栖动物对水环境的要求,样地选择在一条小溪旁边,该样地没有发现中华蟾蜍繁殖和越冬,不属于繁殖场或越冬场,而是中华蟾蜍的觅食场地。样地内以莎草科、禾本科草本植物为主,主要物种有羊茅(Festucanivina)、四川嵩草(Kobresiasetchuanensis)、垂穗披碱草(Elymusnutans)等。采用人工掩蔽物法监测两栖动物种群动态[14],在样地中布设10个小样方,5个为方形样方,5个为线形样方,每个样方均由25张瓦片组成,瓦片长35.5cm,宽20cm,厚度为2cm,每张瓦片间隔1m(图1)。

图1 样地位置及样方布设方式Fig.1 Sample arrangement of quadrats
采用基于射频识别技术(radio frequency identification, RFID)的标志重捕法探索中华蟾蜍的迁徙特点。即在动物的胯部注射电子标签,运用读取器来进行个体识别[15]。
根据高原的气候特点和两栖动物的年活动节律,2011—2014年的6月和8月各监测10d。6月是若尔盖地区的初夏,两栖动物刚好繁殖完毕,8月为夏末,也是两栖动物的育肥期。考虑到两栖动物在上午的活动相对较弱,所有检查取样均在上午进行。检查时迅速翻开瓦片,捕获匿藏在瓦片下的动物,记录样方编号、动物种名、性别、年龄阶段(成体或亚成体,具有第二性征或不具有第二性征且头体长大于53mm的个体均视为成体[16]),测量动物的头体长(snout-vent length, SVL,0.1mm)、体重(0.1g)。对头体长大于35mm的个体植入电子标签(SVL小于35mm的个体不宜植入)。测量标志完成后,将动物放回原来的发现点。
1.3 数据处理及分析
种群的空间分布特征分析采用David和Moore方法,公式为:I=V/M-1,式中V为方差,M为平均密度,I为聚集指标。I=0为随机分布,I<0均匀分布,I>0聚集分布[17]。
蟾蜍个体肥满度(relative fatness)用Fulton状态指数判定,计算公式为:K=100W/L3(g/cm3),式中W为体重,L为体长,100为人为规定的固定系数[18- 19]。
运用K-Means Cluster Analysis对种群SVL进行聚类分析:两栖动物在性成熟之前生长较为迅速,个体的头体长(SVL)与年龄之间具有显著的相关关系,且中华蟾蜍性成熟年龄为3岁[20- 22]。据此对该种群的中华蟾蜍SVL分不同季节(6月分2组,8月当年的蝌蚪已经变态登陆,分3组)进行快速聚类,得到各组SVL的阈值,再通过这个阈值对各年的种群进行年龄结构初步分析。
以每个样方4a发现的蟾蜍总数作为该样方发现的蟾蜍个体数,用二元变量的相关分析分析样方发现的蟾蜍个体数与样方距水体距离是否具有相关性,如果存在线性相关,则用一元线形回归分析得出相关方程。

图2 中华蟾蜍数量的年度变化Fig.2 The population of Asiatic toad annually
用单样本K-S检验来分析数据的正态性。当数据呈正态分布时,用T检验或One-Way ANOVA对不同组数据的均值进行比较,若不服从正态分布,则采用Mann-Whitney U检验。所有分析均在SPSS 21软件包上进行。
2 结果
2.1 种群数量和年龄结构
2011—2014年共监测到中华蟾蜍581只,其中成体57只,亚成体524只,各年份与季节之间的数量波动较大(图2)。
按不同季节对中华蟾蜍SVL进行聚类分析,得到6月中华蟾蜍1龄个体的SVL为21.58—37.18cm,2龄为39.14—52.44cm。8月3个年龄阶段的SVL范围分别为14.86—29.3cm,30.93—39.89cm,40.32—51.04cm。由此将各年中华蟾蜍进行分组,得到中华蟾蜍各时期的种群年龄结构(表1)。

表1 中华蟾蜍的种群年龄结构

图3 中华蟾蜍的年龄椎体Fig.3 The age pyramid of Asiatic toad
结果显示中华蟾蜍种群年龄结构在各年之间有所差异,但是总体看来处于一个较稳定的状态。6月1龄个体为159只,2龄个体为64只,3龄及以上个体为10只;8月新登陆的幼体为63,1龄为52只,2龄为46只,3龄及以上为15只(图3)。
2.2 中华蟾蜍的空间分布特点
对样地中方形和线形样方的比较分析发现,中华蟾蜍个体出现在每个样方的频次平均数小于方差,说明中华蟾蜍在空间上的呈聚集分布(表2)。
线型样方中中华蟾蜍出现率与水体距离呈显著地线形正相关关系,其关系式为y=2.853x+2(n=5,r=0.994,P<0.01),而方型样方不具有相关性(n=5,r=0.265,P>0.05)(图4)。线形样方中中华蟾蜍的出现率随着远离水体而逐渐增加,方形样方出现率峰值在距水体22.5m的样方中。

表2 中华蟾蜍分布模型
M:平均密度 Average density of toads in the sample area;V:方差 Variance of toads in the sample area;I:聚集指标 Aggregation index
线形样方一共捕获到331只,方形样方捕获到250只。两种形状的样方捕获到的蟾蜍数量存在显著差异(Mann-Whitney U test,P=0.018),即线形样方捕获的个体数量更多。
2.3 中华蟾蜍在非繁殖和越冬场的迁徙
4年来,运用基于射频识别技术的电子标签对体长超过35mm的117只个体进行了标志(表3)。监测期当月重捕率(Ai)平均值为51%,2011年8月重捕率最高(Ai=66.7%),2012年6月重捕率最低(Ai=28.6%)。所有重捕个体中,有83.6%的个体是当次监测标记到的个体(Ri/∑(Ri+Si+Yi))。每年月度间只重捕到4只个体,平均重捕率为5.73%,年度间重捕到8只个体,平均重捕率为3.25%。
2.4 中华蟾蜍肥满度
运用Fulton状态指数评判个体的肥满度,得出蟾蜍亚成体肥满度的季节及年度变化(由于4年来捕获的成体个体太少,故没有做此分析)。中华蟾蜍亚成体的肥满度在季节间(6月和8月)差异不显著(Mann-Whitney UP=0.519)。中华蟾蜍亚成体肥满度的年度变化较为明显,6月波动更为剧烈(图5)。
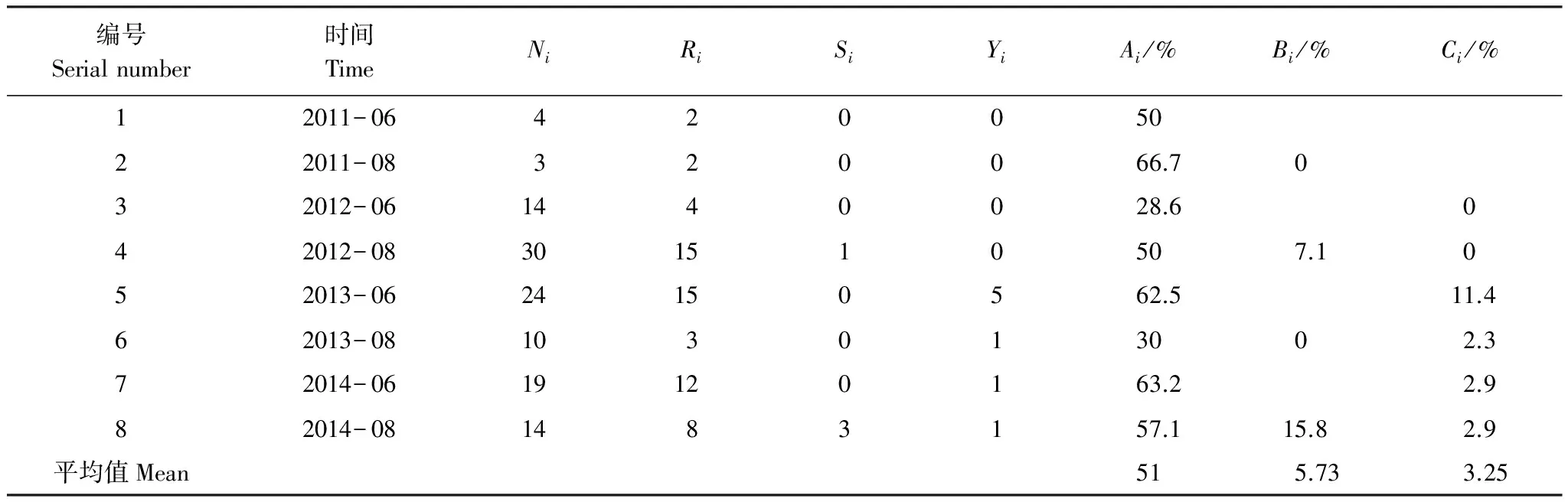
表3 中华蟾蜍标志重捕
Ni:每次调查新标记的个体数 Number of new marked toads in each survey;Ri:重捕个体中当次标记的个体数 Number of recaptured toads marked in this survey;Si:重捕个体中同年非当次标记个体数 Number of recaptured toads marked in another survey the same year;Yi:重捕个体中非同年标记个体数 Number of recaptured toads marked in other years;Ai:当次调查的重捕率 Rate of recapture in one survey;Bi:6到8月间的重捕率 Rate of recapture in one year;Ci:年度间的重捕率 Rate of recaptured toads marked last years
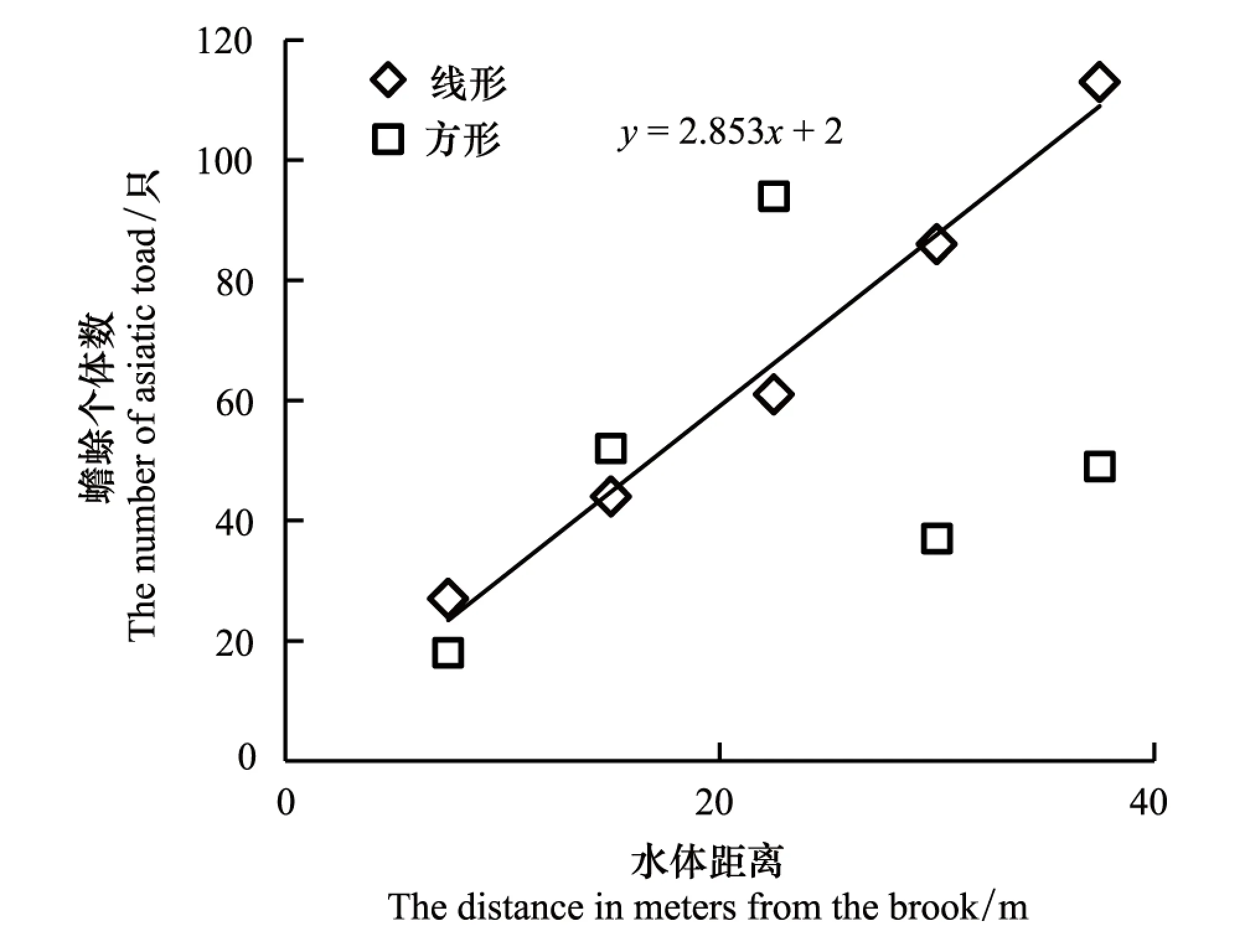
图4 中华蟾蜍数量与水体距离的关系Fig.4 The number of Asiatic toad in relation to the distance in meters from the brook
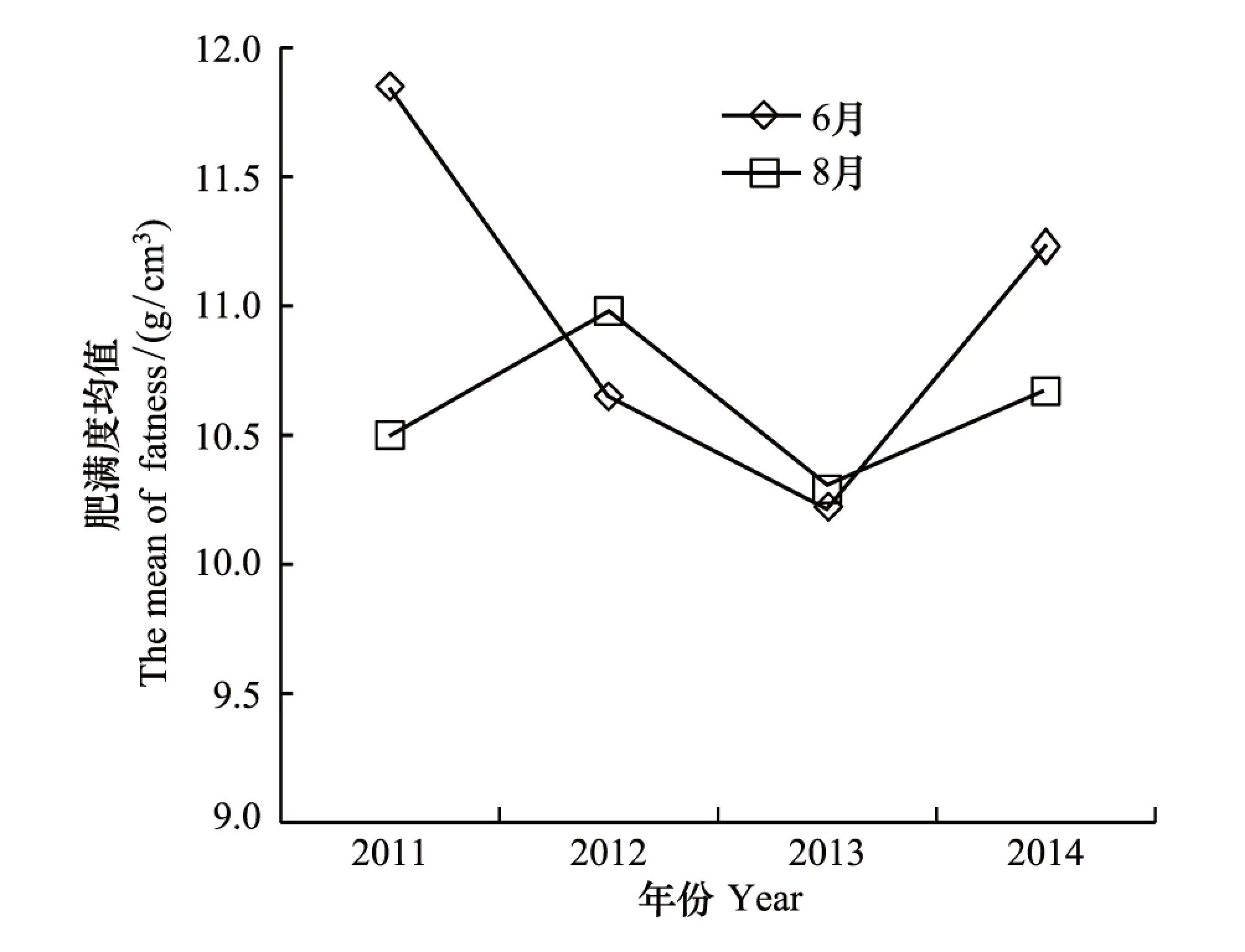
图5 中华蟾蜍亚成体肥满度的年度变化Fig.5 The fatness of sub-adult Asiatic toad annually
3 讨论
3.1 种群数量和年龄结构
野生动物的种群数量与气候因子紧密相关,如温度和降水[23]。2011—2014年,研究区域的中华蟾蜍种群数量波动较大(图2),也是受到气候因子影响。结合该区域的气象数据分析,温度对中华蟾蜍遇见率影响较小,降水对种群观测结果影响巨大。例如,2013年8月,发现的蟾蜍数量最少,是由于8月27日,该区域出现了强降水天气,当日降水量达到了52.6mm。可能是暴雨导致了中华蟾蜍藏匿起来,从而造成后面几天发现个体数量较少。MacArthur和Wilson根据生物寿命的长短与繁殖力的大小将生活史对策归纳为r对策和k对策[24- 25]。中华蟾蜍采取的是r策略,即具有较高的繁殖率,性成熟前的死亡率也很高。繁殖率高,表明蟾蜍产生的后代数量很多,但随着不断生长,在性成熟前各阶段都表现出较高的死亡率,所以每次研究发现的中华蟾蜍成体数量都远远小于亚成体。对于r策略的物种,具有繁殖能力的个体对种群的延续具有至关重要的作用,在今后的保育工作中,应该优先保护性成熟个体。研究区域的中华蟾蜍种群年龄椎体基本符合金字塔结构,即幼体和繁殖前期的个体偏多,由此推断,该区域的中华蟾蜍种群处于一个健康状况,种群数量在未来一段时间比较稳定。
3.2 中华蟾蜍的空间分布特点
从研究结果看,中华蟾蜍为聚集型分布。聚集分布在自然界最为常见,聚集分布的种群对不良环境条件的抗性可能比单独的个体要强,但也会增加个体间的竞争[26]。推测中华蟾蜍聚集分布可能与空间异质性以及食物分布模式紧密相关。因此,保护这一物种的核心就是保护其适宜的生境。
蟾蜍发现率与水体距离呈显著的线形关系,在样地范围内,蟾蜍发现个数随着水体距离不断增加。齐银等[27]对若尔盖地区高原林蛙夏秋季节活动特征进行了研究,得出夏季高原林蛙遇见率与水塘距离呈显著的负相关,且90%的个体在距离水塘110m的范围类活动。然而,中华蟾蜍和高原林蛙生态位研究得出:在与水塘距离这个维度上,高原林蛙生态位宽度很小,成体为0.27,亚成体为0.14,而中华蟾蜍成体和亚成体生态位宽度分别为0.67和0.51,显然中华蟾蜍对低湿度的耐受能力强于高原林蛙[28]。这与“蟾蜍类对生境湿度的要求低于蛙类”的结论一致[29- 30]。中华蟾蜍对水体的依赖较小,选择栖息地时是对各种生境因子综合利用的结果。在以后的研究中,布设样方时,应该考虑到不同物种对不同干旱程度耐受性的差异,对像中华蟾蜍这类陆栖性耐旱能力强的两栖类进行监测时,布设样方可以适当远离水体,这样才能达到最佳的监测效果。
研究结果发现,线形样方捕获的动物个数要显著高于方形样方。已有研究表明如果采食点没有适合繁殖和越冬的生境,两栖动物每年就会在取食点、繁殖点和越冬点之间迁移[31]。中华蟾蜍的家域范围大,迁徙特征明显,线形的样方,实际上具有更大的拦截面积,中华蟾蜍在迁徙过程中遇见线形掩蔽物的几率更大,所以捕获的动物数量更多。研究中华蟾蜍这类游走性摄食,家域范围较大的物种时,在相同数量的掩蔽物下,把样方布设为线形更为高效。
3.3 中华蟾蜍的迁徙
许多两栖动物生命周期具有水陆两相性[32]。为了完成它们的生命周期,成体必须冒着被捕食和水分散失的风险在觅食地与越冬场和繁殖场间迁徙[33-34]。目前对两栖动物的迁徙的研究报道还较少。针对一个开放性的种群,标志重捕是研究个体迁入迁出的重要方法。本文标志重捕结果显示当季监测的重捕率较高,而季节间和年度间的标志重捕率很低,表明中华蟾蜍在非繁殖期或越冬期,具有游走性特点,其家域范围较大,不会长期在一个固定的空间内觅食。年度间的重捕在某种程度上显示中华蟾蜍可能是沿着一个比较稳定的路线进行周而复始的迁徙,所以保护这一物种,防止生境破碎化对其十分重要。在开放性的非繁殖场和非越冬场,对于陆栖性迁徙能力较强的中华蟾蜍而言,标志重捕法仅适合用于短时间的种群研究。要想对蟾蜍的生长速率进行计算以及长期的个体跟踪监测,还需要更加先进的技术(如无线电追踪技术),或者布设更多的样点(如繁殖场或越冬场)。
3.4 中华蟾蜍肥满度
肥满度是一种表征动物的生理或营养状态的形态生理指标,广泛运用于脊椎动物各大类群[35- 40]。本研究结果显示中华蟾蜍亚成体肥满度在季节间无明显差异,且年度间波动明显,6月波动更为剧烈。戴建洪等[41]研究若尔盖地区高原林蛙肥满度的季节变化发现,食物丰度的季节变化的原因导致高原林蛙亚成体8月的肥满度显著高于6月。而本研究表明,6月和8月中华蟾蜍亚成体的肥满度没有显著差异。张晋东[42]研究了若尔盖湿地3种两栖类的食性,春季(5—6月),中华蟾蜍以蚂蚁为主要食物。在蟾蜍春季食物中,蚁科食物重要性指数为85.34,而高原林蛙食物中主要是蜉金龟科(Aphodiidae)昆虫,重要性指数为35.28。两种两栖类食性的不同,可能是造成同一地区分布的不同物种在季节间肥满度表现不同规律的原因。此外,中华蟾蜍亚成体肥满度在不同年份波动较为明显(图5),高原林蛙可能也存在相同的波动,单次采样分析的结果准确性较低。用肥满度指数评估一个种群的健康状况,需要做长期的监测。
致谢:感谢四川省若尔盖国家级自然保护区管理局俄尕,李华,措科,索朗,祝伟对本工作给予大力协助。
[1] Wake D B. Declining amphibian populations. Science, 1991, 253(5022): 860- 860.
[2] Blaustein A R, Wake D B. Declining amphibian populations: A global phenomenon. Trends in Ecology & Evolution, 1990, 5(7): 203- 204.
[3] Blaustein A R, Wake D B, Sousa W P. Amphibian declines: judging stability, persistence, and susceptibility of populations to local and global extinctions. Conservation Biology, 1994, 8(4): 60- 71.
[4] Alford R A, Richards S J. Global amphibian declines: a problem in applied ecology. Annual Review of Ecology and Systematics, 1999, 30: 133- 165.
[5] Hoffmann M, Hilton-Taylor C, Angulo A, Böhm M, Brooks T M, Butchart S H, Carpenter K E, Chanson J, Collen B, Cox N A, Darwall W R, Dulvy N K, Harrison L R, Katariya V, Pollock C M, Quader S, Richman N I, Rodrigues A S, Tognelli M F, Vié J C, Aguiar J M, Allen D J, Allen G R, Amori G, Ananjeva N B, Andreone F, Andrew P, Aquino Ortiz A L, Baillie J E, Baldi R, Bell B D, Biju S D, Bird J P, Black-Decima P, Blanc J J, Bolaos F, Bolivar-G W, Burfield I J, Burton J A, Capper D R, Castro F, Catullo G, Cavanagh R D, Channing A, Chao N L, Chenery A M, Chiozza F, Clausnitzer V, Collar N J, Collett L C, Collette B B, Cortez Fernandez C F, Craig M T, Crosby M J, Cumberlidge N, Cuttelod A, Derocher A E, Diesmos A C, Donaldson J S, Duckworth J W, Dutson G, Dutta S K, Emslie R H, Farjon A, Fowler S, Freyhof J, Garshelis D L, Gerlach J, Gower D J, Grant T D, Hammerson G A, Harris R B, Heaney L R, Hedges S B, Hero J M, Hughes B, Hussain S A, Icochea M J, Inger R F, Ishii N, Iskandar D T, Jenkins R K, Kaneko Y, Kottelat M, Kovacs K M, Kuzmin S L, La Marca E, Lamoreux J F, Lau M W, Lavilla E O, Leus K, Lewison R L, Lichtenstein G, Livingstone S R, Lukoschek V, Mallon D P, McGowan P J, McIvor A, Moehlman P D, Molur S, Muoz Alonso A, Musick J A, Nowell K, Nussbaum R A, Olech W, Orlov N L, Papenfuss T J, Parra-Olea G, Perrin W F, Polidoro B A, Pourkazemi M, Racey P A, Ragle J S, Ram M, Rathbun G, Reynolds R P, Rhodin A G, Richards S J, Rodríguez L O, Ron S R, Rondinini C, Rylands A B, de Mitcheson S Y, Sanciangco J C, Sanders K L, Santos-Barrera G, Schipper J, Self-Sullivan C, Shi Y, Shoemaker A, Short F T, Sillero-Zubiri C, Silvano D L, Smith K G, Smith A T, Snoeks J, Stattersfield A J, Symes A J, Taber A B, Talukdar B K, Temple H J, Timmins R, Tobias J A, Tsytsulina K, Tweddle D, Ubeda C, Valenti S V, van Dijk P P, Veiga L M, Veloso A, Wege D C, Wilkinson M, Williamson E A, Xie F, Young B E, Akçakaya H R, Bennun L, Blackburn T M, Boitani L, Dublin H T, da Fonseca G A, Gascon C, Lacher T E, Mace G M, Mainka S A, McNeely J A, Mittermeier R A, Reid G M, Rodriguez J P, Rosenberg A A, Samways M J, Smart J, Stein B A, Stuart S N. The impact of conservation on the status of the world′s vertebrates. Science, 2010, 330(6010): 1503- 1509.
[6] Stuart S N, Chanson J S, Cox N A, Young B E, Rodrigues A S L, Fischman D L, Waller R W. Status and trends of amphibian declines and extinctions worldwide. Science, 2004, 306(5702): 1783- 1786.
[7] Wake D B, Vredenburg V T. Are we in the midst of the sixth mass extinction? A view from the world of amphibians. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105: 11466- 11473.
[8] Verrell P. Methoxychlor increases susceptibility to predation in the salamanderAmbystomamacrodactylum. Bulletin of Environmental Contamination and Toxicology, 2000, 64(1): 85- 92.
[9] Mann R M, Bidwell J R, Tyler M J. Toxicity of herbicide formulations to frogs and the implications for product registration: A case study from Western Australia. Applied Herpetology, 2003, 1(1): 13- 22.
[10] Dohm M R, Mautz W J, Doratt R E, Stevens J R. Ozone exposure affects feeding and locomotor behavior of adultBufomarinus. Environmental Toxicology and Chemistry, 2008, 27(5): 1209- 1216.
[11] Fellers G M, Wang Y Z, Liu S Y. Status of amphibians at the Zoige wetlands, Sichuan Province, China. Froglog, 2003, 58: 1- 1.
[12] 柴岫, 郎惠卿, 金树仁. 若尔盖高原沼泽. 北京: 科学出版社, 1965: 51- 63.
[13] 何池全, 赵魁义. 若尔盖高原湿地生物多样性保护及其可持续利用. 自然资源学报, 1999, 14(3): 238- 244.
[14] 王刚, 李成, 谢锋, 江建平. 应用人工掩蔽物法监测两栖动物种群动态. 动物学杂志, 2012, 47(3): 53- 58.
[15] Want R. RFID: A key to automating everything. Scientific American, 2004, 290(1): 56- 65.
[16] 费梁, 叶昌媛, 江建平. 中国两栖动物及其分布彩色图鉴. 成都: 四川科学技术出版社, 2012.
[17] David F N, Moore P G. Notes on contagious distributions in plant populations. Annals of Botany, 1954, 18(1): 47- 53.
[18] 戴强, 戴建洪, 李成, 刘志君, 王跃招. 关于肥满度指数的讨论. 应用与环境生物学报, 2006, 12(5): 715- 718.
[19] Fulton T W. The Sovereignty of the Sea. London and Edinburgh: William Blackwood and Sons, 1911.
[20] Hemelaar A. Age, growth and other population characteristics ofBufobufofrom different latitudes and altitudes. Journal of Herpetology, 1988, 22(4): 369- 388.
[21] Miaud C, Guyétant R, Elmberg J. Variations in life-history traits in the common frogRanatemporaria(Amphibia: Anura): a literature review and new data from the French Alps. Journal of Zoology, 1999, 24(1): 61- 73.
[22] Duellman W E, Trueb L. Biology of Amphibians. New York: McGraw-Hill, 1986.
[23] 孙儒泳. 动物生态学原理(第三版). 北京: 北京师范大学出版社, 2001.
[24] MacArthur R H. Wilson E O. The Theory of Island Biogeography. Princeton: Princeton University Press, 1967.
[25] MacArthur R H. Geographical Ecology. Princeton, NJ: Princeton University Press, 1972.
[26] 李博. 生态学. 北京: 高等教育出版社, 2000.
[27] 齐银, Felix Z, 戴强, 王勇, 刘莉, 张强, 王跃招. 四川省若尔盖季节性水塘周边高原林蛙夏秋季活动特征. 动物学研究, 2007, 28(5): 526- 530.
[28] 张晋东, 戴建洪, 戴强, 张明, 熊晔, 李成, 刘志军, 王跃招. 若尔盖湿地3种无尾两栖类不同发育阶段的生态位宽度. 应用与环境生物学报, 2006, 12(5): 665- 668.
[29] Heatwole H, Torres F, De Austin S B, Heatwole A. Studies on anuran water balance—I. Dynamics of evaporative water loss by the coquí,eleutherodactylusportoricensis. Comparative Biochemistry and Physiology, 1969, 28(1): 245- 269.
[30] 周立志, 宋榆钧, 田蕴. 长春市南湖公园两栖类的生境选择和营养生态的初步研究. 淮北煤师院学报, 1998, 19(1): 64- 70.
[31] Russell A P, Bauer A M, Johnson M K. Migration in amphibians and reptiles: An overview of patterns and orientation mechanisms in relation to life history strategies // Elewa A M T, ed. Migration of Organisms. Berlin Heidelberg: Springer, 2005: 151- 203.
[32] Altig R, McDiarmid R W. Body plan: Development and morphology// McDiarmid R W, Altig R, eds. Tadpoles: The Biology of Anuran Larvae. Chicago: The University of Chicago Press, 1999: 24- 51.
[33] Semlitsch R D. Analysis of climatic factors influencing migrations of the salamanderAmbystomatalpoideum. Copeia, 1985, 1985(2): 477- 489.
[34] Todd B D, Luhring T M, Rothermel B B, Gibbons J W. Effects of forest removal on amphibian migrations: implications for habitat and landscape connectivity. Journal of Applied Ecology, 2009, 46(3): 554- 561.
[35] Hsia W P, Sun C L. On the relative fatness of the red-backed vole,ClethrionomysrutilusPallas. Acta Zoologica Sinica, 1963, 15(1): 33- 43.
[36] Wahbe T R, Bunnell F L, Bury R B. Terrestrial movements of juvenile and adult tailed frogs in relation to timber harvest in coastal British Columbia. Canadian Journal of Forest Research, 2004, 34(12): 2455- 2466.
[37] Jones R E, Petrell R J, Pauly D. Using modified length-weight relationships to assess the condition of fish. Aquacultural Engineering, 1999, 20(4): 261- 276.
[38] Dickinson H C, Fa J E. Abundance, demographics and body condition of a translocated population of St Lucia whiptail lizards(Cnemidophorusvanzoi). Journal of Zoology, 2000, 251(2): 187- 197.
[39] Jensen H, S☞ther B E, Ringsby T H, Tufto J, Griffith S C, Ellegren H. Lifetime reproductive success in relation to morphology in the house sparrowPasserdomesticus. Journal of Animal Ecology, 2004, 73(4): 599- 611.
[40] Murray D L. Differential body condition and vulnerability to predation in snowshoe hares. Journal of Animal Ecology, 2002, 71(4): 614- 625.
[41] 戴建洪, 戴强, 张明, 李成, 张晋东, 王跃招. 四川若尔盖湿地中国林蛙肥满度的初步研究. 四川动物, 2005, 24(3): 351- 354.
[42] 张晋东. 若尔盖湿地3种两栖类的种间竞争及畜牧业对其食性的影响[D]. 成都: 中国科学院研究生院, 2006: 1- 88.
Population ecology of Bufo gargarizans in zoige wetland based on artificial cover
WANG Gang1,2, LI Cheng1, WU Jun3, HAN Jinfeng4, JIANG Jianping1, XIE Feng1,*
1 Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China 2UniversityofChineseAcademyofSciences,Beijing100049,China3NanjingInstituteofEnvironmentalSciences,MinistryofEnvironmentalProtectionofthePeople′sRepublicofChina,Nanjing210042,China4TheManagementBureauofZoigeWetlandNationalNatureReserve,Zoige624500,China
In recent decades, as the population size of amphibians has significantly declined, the survival status of amphibians has been studied by a growing number of ecologists and conservationists. Zoige wetland is not only the largest plateau peat bog in the world but also one of the biodiversity conservation hotspots in China. Three species of amphibians inhabit this region,Ranakukunoris,Nanoranapleskei, andBufogargarizansminshanica. Previous studies showed that the populations of the three species have decreased at different rates. In the present study, we monitored the population ecology of the Asiatic toad (B.gargarizansminshanica) in Zoige wetland using artificial cover from 2011 to 2014. The results showed that: the population fluctuated significantly at the sampling sites; the analysis of age structure showed that the population has been increasing; the number of individuals had an apparent positive linear relationship with the distance from the brook (P< 0.01); the number of individuals increased with the distance from the brook; and the line shape was more effective than the square shape in monitoring this species (P= 0.018). We also found that the fatness of sub-adults of Asiatic toad did not exhibit significant difference among the seasons. We hypothesize that the Asiatic toad has high migratory capacity, as it may migrate along fixed routes circularly. For those species that have a broad home range and move long distances, such as the Asiatic toad, we should protect the optimal habitats of the species and prevent their fragmentation.
artificial cover; asiatic toad; population ecology; Zoige wetland
环境保护部项目(生物多样性示范监测)
2015- 03- 18;
日期:2015- 12- 14
10.5846/stxb201503180518
*通讯作者Corresponding author.E-mail: xiefeng@cib.ac.cn
王刚, 李成, 吴军, 韩金锋, 江建平, 谢锋.基于人工掩蔽物法的若尔盖湿地中华蟾蜍种群生态研究.生态学报,2016,36(17):5556- 5563.
Wang G, Li C, Wu J, Han J F, Jiang J P, Xie F.Population ecology ofBufogargarizansin zoige wetland based on artificial cover.Acta Ecologica Sinica,2016,36(17):5556- 5563.
