利用酶法制备菲律宾蛤仔抗肿瘤肽的研究
2016-11-28蔡康鹏吴靖娜蔡水淋苏永昌刘智禹肖美添
蔡康鹏, 吴靖娜, 蔡水淋, 潘 南, 苏永昌, 刘智禹, 肖美添
(1华侨大学生物化工学院,福建 厦门,361021;2福建省水产研究所,国家海水鱼类加工技术研发分中心,福建省海洋生物增养殖与高值化利用重点实验室,福建省海洋生物资源开发利用协同创新中心,福建 厦门,361013)
利用酶法制备菲律宾蛤仔抗肿瘤肽的研究
蔡康鹏1, 吴靖娜2, 蔡水淋2, 潘 南2, 苏永昌2, 刘智禹2, 肖美添1
(1华侨大学生物化工学院,福建 厦门,361021;2福建省水产研究所,国家海水鱼类加工技术研发分中心,福建省海洋生物增养殖与高值化利用重点实验室,福建省海洋生物资源开发利用协同创新中心,福建 厦门,361013)
为确定酶解法提取菲律宾蛤仔(Ruditapesphilippinarum)抗肿瘤活性多肽的最佳工艺条件,选用5种蛋白酶在相同的料液比、酶解时间和酶添加量、各自最适温度和pH的条件下酶解菲律宾蛤仔。通过甲醛电位滴定法和Cell counting kit-8(CCK-8)方法分别测定了菲律宾蛤仔酶解液氨基态氮含量和酶解多肽的抗肿瘤活性,分析了氨基态氮含量与A549抑制率之间的相关性。在单因素试验的基础上,以人非小细胞肺癌A549抑制率为指标,正交分析优化酶解工艺条件。结果显示,菲律宾蛤仔的5种酶解产物中,风味蛋白酶的酶解液中氨基态氮含量最高,而胃蛋白酶获得的酶解多肽抗肿瘤活性最高。胃蛋白酶酶解菲律宾蛤仔正交实验确定酶解最佳工艺条件为:料液比(w/w)1∶1,pH 2.0,酶解时间1 h,酶添加量2 000 U/g,酶解温度37 ℃。当设定最佳酶解工艺获得的酶解多肽浓度为20 mg/mL时,其对A549的抑制率为99.83%。研究表明,酶的种类对菲律宾蛤仔酶解液氨基态氮含量和酶解多肽的抗肿瘤活性有较大影响,菲律宾蛤仔酶解液中氨基态氮含量与A549抑制率没有直接的正相关性。
菲律宾蛤仔;酶解多肽;A549;抗肿瘤活性
非小肺癌目前的发病率较高[1-4]。近年来,随着生物分离纯化技术的发展,人们不断发现具有抑制非小肺癌增殖的天然化合物。如:黄大川等[5]从僧帽牡蛎中提取出一种具有抑制A549细胞增殖作用的低分子活性肽BPO-L;孟翠丽等[6]发现雷氏大疣蛛毒素具有较强的细胞毒性,可直接杀死A549细胞而发挥抗癌作用。
菲律宾蛤仔(Ruditapesphilippinarum),俗称杂色蛤,广泛分布于我国沿海地区,是我国四大养殖贝类之一[7],富含蛋白质、脂肪、多糖和人体必需的微量元素,是一种经济价值极高的海洋贝类[8-10]。研究表明,菲律宾蛤仔提取物具有多种生物活性[11]。近年来有关菲律宾蛤仔提取物的研究主要集中于抗氧化、增强免疫力和降血压等方面[12-15],而对抗肿瘤的研究较少。因此,本研究采用酶解技术获取菲律宾蛤仔酶解多肽,研究其体外抑制A549细胞增殖的作用,以期为菲律宾蛤仔抗肿瘤活性多肽制备研究提供试验依据。
1 材料与方法
1.1 材料与试剂
菲律宾蛤仔购于厦门某超市,吐沙1 d,洗净、去壳、取肉、匀浆,-20 ℃保存备用。人非小细胞肺癌(A549)细胞株购自中国医学科学院基础医学研究所基础医学细胞中心。试剂及其来源:中性蛋白酶(5万U/g)、风味蛋白酶(1.5万U/g)、胰蛋白酶(5万U/g)和碱性蛋白酶(20万U/g),南宁庞博生物工程有限公司;Trypsin-EDTA,美国BBI Life Sciences公司;胃蛋白酶(250万U/g)、磷酸盐缓冲液(PBS),北京索莱宝科技有限公司;McCoy’s 5A培养基,美国Gibco公司;胎牛血清(FBS),德国PAN Biotech公司;青霉素-链霉素溶液,美国HyClone公司;CCK-8试剂盒,日本同仁化学研究所;其余试剂均为分析纯。
1.2 仪器与设备
5804R高速冷冻离心机,德国Eppendorf公司;HH-6数显恒温水浴锅,常州国华电器有限公司;PB-10 pH计、电子分析天平,德国Sartorius公司;Gl54DWS高压灭菌锅,美国Zealway公司;Class II Type B2型生物安全柜,德国ESCO公司;BPN-80CRH二氧化碳培养箱,昆山一恒仪器有限公司;Infinite M200 PRQ酶标仪,瑞士NanoQuant公司;XDS-IA倒置生物显微镜,上海精密仪器仪表有限公司。
1.3 方法
1.3.1 酶解法制备菲律宾蛤仔多肽
选用胃蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶和碱性蛋白酶,以料液比(w/w)1∶1、酶添加量1 000 U/g、酶解时间8 h、在最适温度和pH的条件下酶解菲律宾蛤仔。酶解结束后,沸水浴10 min灭酶;冷却至4 ℃,8 000 r/min离心10 min;取上清液测定氨基态氮(ANN)含量,并将上清液冷冻干燥;以无血清培养基溶解干燥粉末,配置成浓度20 mg/mL的溶液,过0.22 μm滤膜除菌后,测定其对A549的抑制率。
1.3.2 菲律宾蛤仔基本成分及氨基态氮含量测定
菲律宾蛤仔蛤肉中的水分、粗蛋白、灰分和粗脂肪含量均参考食品安全国家标准 GB5009系列[16]中的测定方法。氨基态氮(ANN)含量测定采用甲醛电位滴定法[17]。
1.3.3 细胞增殖抑制试验
采用CCK-8法检测药物对A549细胞增殖抑制作用[18]。选用处于对数生长期的A549细胞,按照2.5×104mL密度接种于96孔板,每孔100 μL,5% CO2,37 ℃条件下培养24 h后弃培养基,加入100 μL无血清培养基,培养17 h后弃培养基。设置对照组(无血清培养基+细胞)、加药组(20 mg/mL药物+细胞)和空白组(无血清培养基,无细胞)。每孔100 μL,5% CO2,37 ℃条件下培养24 h后弃96孔板中液体,加入PBS清洗两次,弃PBS。加入100 μLCCK-8溶液(CCK-8原液:无血清培养基=1∶10),5% CO2,37 ℃条件下孵育3 h,采用酶标仪在450 nm处测定吸光度(OD值),计算药物对A549细胞增殖抑制率(简称A549抑制率),每组试验设6个平行复孔。
B=(A1-A2)/ (A1-A3)×100
式中:B—为A549抑制率,%;A1—为对照组的OD值;A2—为加药组的OD值;A3—为空白组的OD值。
1.3.4 正交分析优化酶解条件
在初步确定酶解条件的基础上,以A549抑制率为指标,通过L9(34)正交试验确定最佳酶解条件。各因素水平见表1。表中:A—酶解时间;B—酶添加量;C—酶解温度。
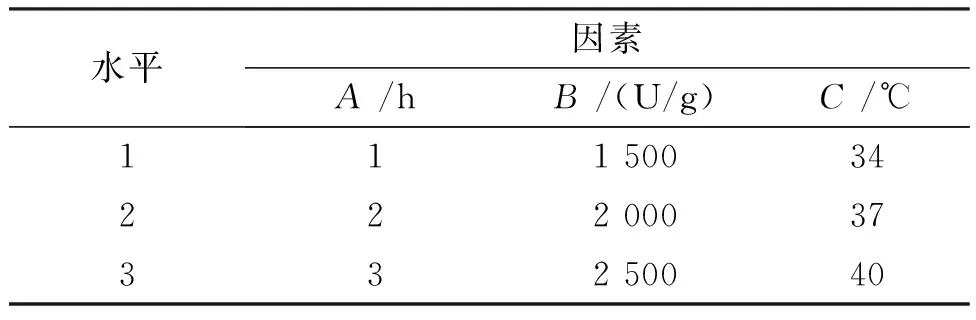
表1 菲律宾蛤仔酶解L9(34)正交试验因素水平表Tab.1 The level of L9 (34) orthogonal test for the enzymatic hydrolysis of Manila clam
1.3.5 数据处理
2 结果与分析
2.1 菲律宾蛤仔基本成分
通过对菲律宾蛤仔蛤肉(湿样)基本成分的测定可知,其水分含量(83.93±0.25)%,粗蛋白含量(9.44±0.05)%,灰分含量(1.73±0.01)%,粗脂肪含量(0.44±0.01)%。徐律等[19]测得浙江菲律宾蛤仔蛤肉(湿样)中水分含量84.5%,粗蛋白含量10.7%,灰分含量2.1%,粗脂肪含量0.5%。董辉等[8]测得山东菲律宾蛤仔蛤肉(湿样)中水分含量82.7%,粗蛋白含量9.63%,灰分含量2.63%,粗脂肪含量0.54%。造成菲律宾蛤仔蛤肉中水分、粗蛋白、灰分和粗脂肪含量差异的可能原因是产地及捕捞月份的不同。菲律宾蛤仔蛤肉湿样中粗蛋白含量9%~11%,由此可见,菲律宾蛤仔是一种高蛋白的海洋贝类,可作为获取生物活性肽的重要资源。
2.2 不同蛋白酶酶解菲律宾蛤仔效果的比较
根据表2,不同蛋白酶水解菲律宾蛤仔所获得的酶解液中ANN含量不同(风味蛋白酶>胰蛋白酶>中性蛋白酶>碱性蛋白酶>胃蛋白酶)。其中,胰蛋白酶、中性蛋白酶和碱性蛋白酶酶解能力顺序与徐律等[18]的试验结果相同;风味蛋白酶酶解液中的ANN含量最高,胃蛋白酶最低。由此推测,菲律宾蛤仔中可能含有较多的风味蛋白酶酶切位点,含有较少的胃蛋白酶酶切位点,也可能是由于风味酶专一性不强,其可从蛋白质的N端或C端进行随机酶切,因此,风味蛋白酶酶解菲律宾蛤仔酶解液中含有较多的游离氨基酸[20]。同时,5种蛋白酶所获得的酶解多肽对A549细胞增殖均具有抑制作用。在20mg/mL浓度下,胃蛋白酶酶解多肽对A549抑制率高达99.22%,胰蛋白酶最低,抑制率仅51.39%。虽然中性蛋白酶、风味蛋白酶、胰蛋白酶和碱性蛋白酶的酶解液中ANN含量均比胃蛋白酶高,但其对A549抑制率远低于胃蛋白酶(P<0.05)。综合考虑ANN含量和A549抑制率,最终选用胃蛋白酶进行下一步试验研究。
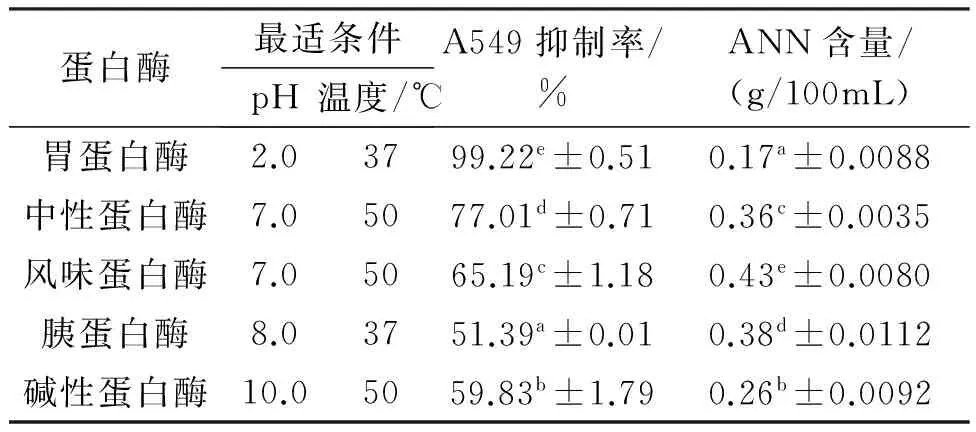
表2 不同蛋白酶对菲律宾蛤仔酶解效果的比较Tab.2 Comparison of the effects of different proteaseson the enzymatic hydrolysis of Manila clam
注:同列不同小写字母数值间差异显著(P<0.05),下同。
2.3 胃蛋白酶单因素试验
2.3.1 时间因素
在胃蛋白酶添加量1 000 U/g、酶解温度37 ℃、料液比(w/w)1∶1、pH 2.0的条件下考察不同的酶解时间对菲律宾蛤仔的酶解效果的影响(图1)。
由图1可知,随着时间的延长,酶解液中ANN含量逐渐升高,且这6个时间段的酶解多肽对A549均有明显抑制作用,抑制率均高于95%。经方差分析,当酶解时间为4 h和8 h时,酶解多肽的A549抑制率具有显著差异(P<0.05)。菲律宾蛤仔酶解液对A549的抑制作用并不是随ANN含量升高而逐渐增大,酶解液中ANN含量与A549抑制率没有直接的正相关性。杨咏芳[21]等通过研究紫贻贝酶解多肽体外抗肿瘤活性亦证明了这一点。考虑蛋白自身营养特性,酶解时间过长容易滋生有害微生物,因此选用2 h作为最佳酶解时间。
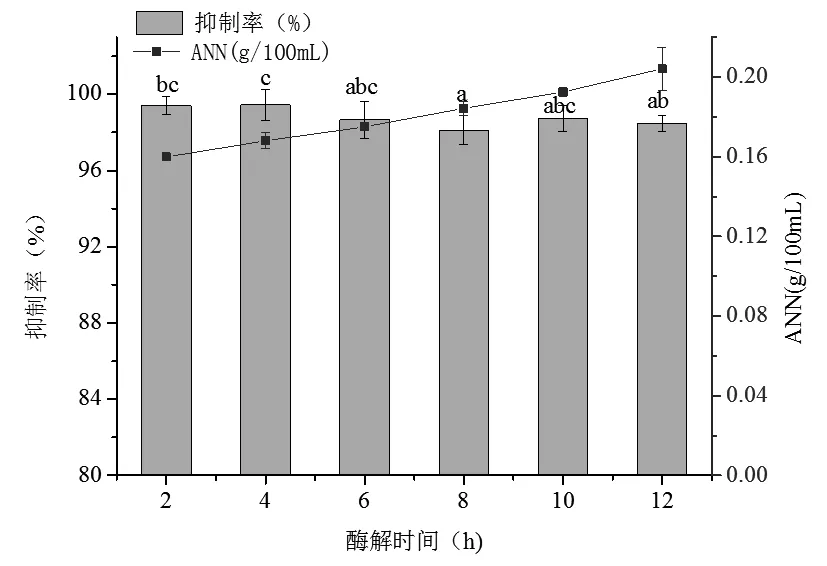
图1 酶解时间对菲律宾蛤仔酶解效果的影响Fig.1 Effect of enzymatic hydrolysis time on the enzymatic hydrolysis of Manila clam
2.3.2 加酶量因素
当酶解时间2 h、酶解温度37 ℃、料液比(w/w)1∶1、pH 2.0时,考察不同胃蛋白酶添加量对菲律宾蛤仔的酶解效果的影响(图2)。
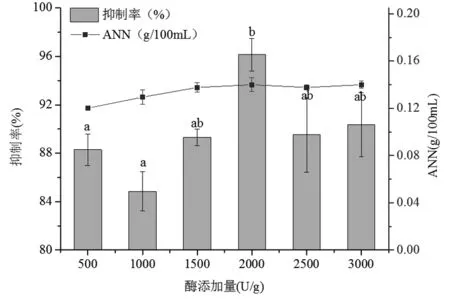
图2 酶添加量对菲律宾蛤仔酶解效果的影响Fig.2 Effect of enzyme addition on the enzymatic hydrolysis of Manila clam
由图可知,酶添加量在500~2 000 U/g范围时,ANN含量随酶添加量的增加而迅速增长;酶添加量高于2 000 U/g时,ANN含量增长随酶添加量的增加而缓慢增长。这是因为随着酶解反应的进行,底物浓度不断降低,蛋白酶与底物的碰撞机率降低,使得酶解液中ANN 含量增长缓慢[22]。酶添加量为2 000 U/g时,酶解多肽对A549的抑制率最高,达到96.14%,与500 U/g、1 000 U/g酶添加量水平下酶解多肽的A549抑制率具有显著差异(P<0.05)。综合考虑两个因素,选择酶添加量2 000 U/g进行下一步研究。
2.3.3 温度因素
当酶解时间2 h、酶添加量2 000 U/g、料液比(w/w)1∶1、pH 2.0时,考察不同酶解温度对菲律宾蛤仔的酶解效果的影响(图3)。
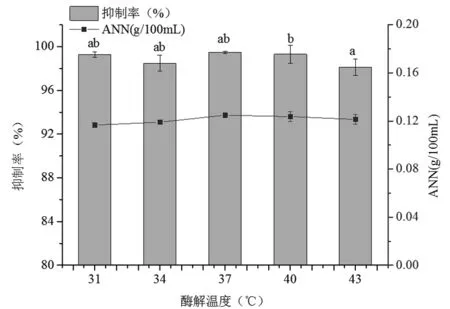
图3 酶解温度对菲律宾蛤仔酶解效果的影响Fig.3 Effect of hydrolysis temperature on the enzymatic hydrolysis of Manila clam
酶解温度是影响蛋白酶活性最主要的因素之一。由于蛋白酶分子具有特定的空间结构,如果酶解温度过高,蛋白酶分子的空间结构会遭到破环,使蛋白酶活性降低或失活;温度过低,分子运动不够剧烈,会降低酶解反应速度[23]。由图3可知,酶解液中的ANN含量先增后减,在37 ℃时达到最高。这可能是温度超过37 ℃后,胃蛋白酶分子结构遭到破坏,致使其活性降低,使得胃蛋白酶与底物的反应程度降低。这5个酶解温度条件下的酶解多肽对A549均有明显的抑制作用,且抑制率均高于95%。经方差分析,酶解温度为40 ℃和43 ℃时,酶解多肽的A549抑制率具有显著差异(P<0.05)。综合考虑ANN含量和A549抑制率,最终选用37 ℃作为最佳酶解温度。
2.4 正交试验
在单因素试验基础上,选择酶解时间(A)、酶添加量(B)和酶解温度(C)这3个因素进行正交试验。L9(34)正交试验设计及结果见表3。由极差分析结果发现,A、B和C对A549抑制作用的影响大小依次为B>C>A,其中误差列的Rj值较小,说明这3个因素之外的其他因素对A549抑制作用的影响较小,因素的最佳组合为A1B2C2。
对菲律宾蛤仔酶解正交试验结果进行方差分析(表4),结果表明,在对A549抑制作用的影响中,酶添加量对A549抑制率影响最显著。在料液比和pH固定的情况下,最终确定菲律宾蛤仔酶解最佳工艺为:料液比(w/w)1∶1,pH 2.0,酶解时间1 h,酶添加量2 000 U/g,酶解温度37 ℃。此时,菲律宾蛤仔酶解多肽对A549的抑制率达99.83%,ANN含量为0.147 0 g/100 mL。
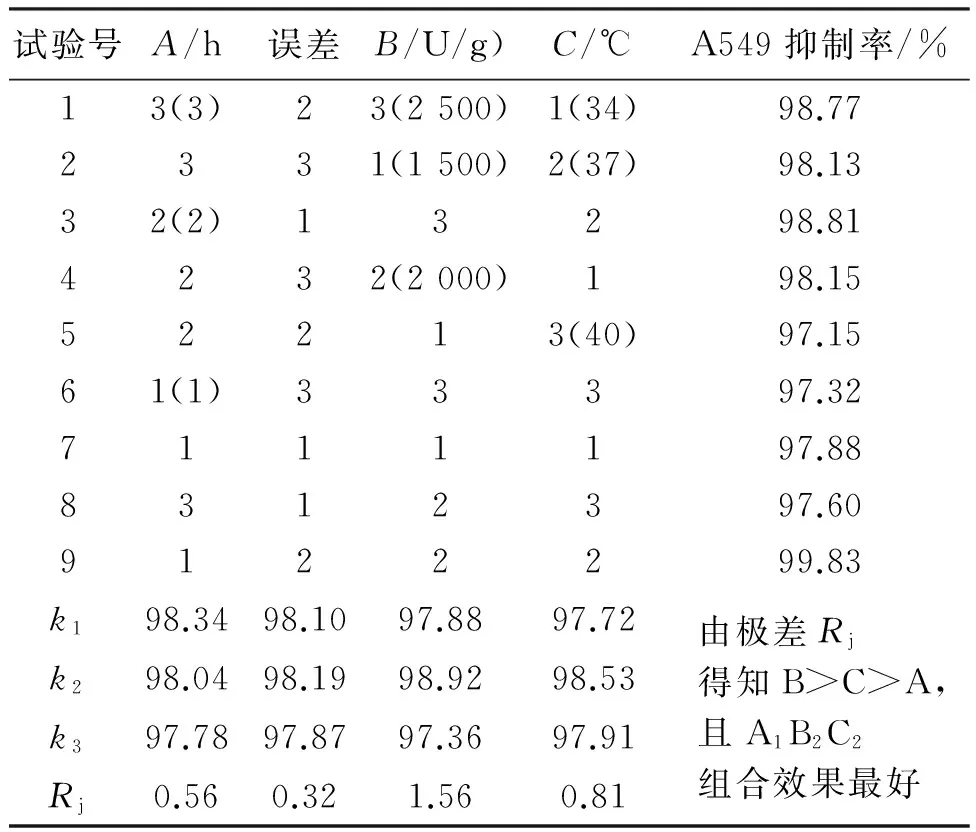
表3 菲律宾蛤仔酶解正交试验结果Tab.3 Results of orthogonal test of the enzymatic hydrolysis of Manila clam
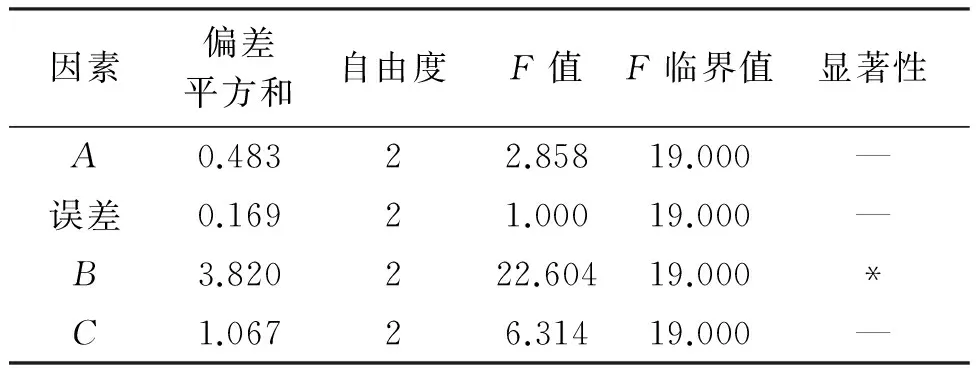
表4 菲律宾蛤仔酶解正交试验结果方差分析Tab.4 Variance analysis of the orthogonal test results of the enzymatic hydrolysis of Manila clam
3 结论
菲律宾蛤仔的5种酶解产物中,风味蛋白酶酶解菲律宾蛤仔酶解液中氨基态氮含量最高;而当设定酶解多肽浓度为20 mg/mL时,胃蛋白酶获得的酶解多肽抗肿瘤活性最高,其A549抑制率高达99.22%,表明酶的种类对菲律宾蛤仔酶解液ANN含量和酶解多肽的抗肿瘤活性有较大影响。在考察胃蛋白酶酶解时间对菲律宾蛤仔的酶解效果的影响中,酶解液对A549的抑制作用并不是随ANN含量升高而逐渐增大或先增后减。其原因可能是菲律宾蛤仔酶解液中ANN含量与A549抑制率没有直接的正相关性。在单因素试验的基础上,采用正交分析法优化菲律宾蛤仔抗肿瘤活性多肽制备工艺,从而确定最佳酶解条件为:胃蛋白酶添加量2 000 U/g,料液比(w/w)1∶1,pH 2.0,酶解时间1 h,酶解温度37 ℃,此时,菲律宾蛤仔酶解多肽对A549的抑制率达99.83%。研究表明,胃蛋白酶酶解菲律宾蛤仔获得的酶解多肽对A549细胞增殖具有显著的抑制作用。
□
[1] CHEN W,ZHENG R,BAADE P D,etal.Cancer statistics in China,2015 [J].CA:a cancer journal for clinicians,2016,66(2):115-132.
[2] 郑春燕.COX-2介导川芎嗪抑制肺癌A549侵袭转移的作用研究[D].济南:山东大学,2012.
[3] 李文军.大蒜素和辛伐他汀对肺癌A549凋亡和增殖抑制的研究[D].济南:山东大学,2013.
[4] ANNA BARESCHINO M,SCHETTINO C,ROSSI A,etal.Treatment of advanced non small cell lung cancer[J].Journal of thoracic disease,2011,3(2):122-133.
[5] 黄大川.僧帽牡蛎低分子活性肽组分BPO-L对人肺腺癌A549的诱导分化作用研究[D].厦门:厦门大学,2002.
[6] 孟翠丽.雷氏大疣蛛毒素对人肺癌A549细胞株增殖的抑制作用[D].保定:河北大学,2007.
[7] 焉翠蔚,徐睿,孙妍,等.菲律宾蛤仔提取物抑制酪氨酸酶活性的研究[J].中国海洋大学学报(自然科学版),2009,39(6):1233-1236.
[8] 董辉,王颉,刘亚琼,等.杂色蛤软体部营养成分分析及评价[J].水产学报,2011,35(2):276-282.
[9] 雷晓凌,吴晓萍,张海花,等.南海八种贝类营养成分和限量元素含量的研究[J].中国海洋药物,2001,20(2):48-50.
[10]迟淑艳,周歧存,周健斌,等.华南沿海5种养殖贝类营养成分的比较分析[J].水产科学,2007,26(2):79-83.
[11]徐律,李连军,杨最素等.菲律宾蛤仔提取物及生物活性的研究进展[J].浙江海洋学院学报(自然科学版),2013(4):357-361.
[12]付金霞,赵隽,李智博,等.杂色蛤酶解制备ACE抑制肽的工艺优化[J].农产品加工(学刊),2014,1(21):36-38.
[13]杨永芳,杨最素,丁国芳,等.菲律宾蛤仔酶解寡肽的分离及体外抗氧化作用研究[J].中华中医药学刊,2011,29(5):1069-1072.
[14]范秀萍,吴红棉,王娅楠,等.菲律宾蛤仔糖胺聚糖的免疫活性研究[J].食品科学,2008,29(4):370-372.
[15]范秀萍,吴红棉,王娅楠,等.4种贝类糖胺聚糖体外清除自由基活性的比较 [J].食品科技,2008,33(2):165-167.
[16]中华人民共和国卫生部.食品安全国家标准GB5009系列[M].北京:中国标准出版社,2010.
[17]陈钧辉.生物化学实验[M].北京:科学出版社,2003,57-58.
[18]XIONG S,ZHENG Y,JIANG P,etal.MicroRNA-7 inhibits the growth of human non-small cell lung cancer A549 cells through targeting BCL-2 [J].Int J Biol Sci,2011,7(6):805-814.
[19]徐律.菲律宾蛤仔酶解寡肽抗癌活性研究[D].舟山:浙江海洋学院,2013.
[20]宋茹,冯婷立,谢超.海产小杂鱼抗氧化肽制备工艺[J].食品科学,2011,32(12):29-33.
[21]杨永芳,丁国芳,杨最素,等.紫贻贝酶解多肽体外抗肿瘤活性研究[J].浙江海洋学院学报(自然科学版),2011,30(2):113-118.
[22]孟凡莉.花生肽的酶法制备、分离纯化及其抗氧化活性研究[D].合肥:合肥工业大学,2010.
[23]GONZàLEZ‐TELLO P,CAMACHO F,JURADO E,etal.Enzymatic hydrolysis of whey proteins:I.Kinetic models[J].Biotechnology and Bioengineering,1994,44(4):523-528.
Study on preparation of antitumor peptides fromRuditapesphilippinarumby enzymatic method
CAI Kangpeng1,WU Jingna2,CAI Shuilin2,PAN Nan2,SU Yongchang2,LIU Zhiyu2,XIAO Meitian1
(1CollegeofChemicalEngineering,HuaqiaoUniversity,Xiamen361021,China;2FisheriesResearchInstituteofFujian,NationalResearchandDevelopmentCenterforMarineFishProcessing,KeyLaboratoryofCultivationandHigh-valueUtilizationofMarineOrganismsinFujianProvince,FujianCollaborativeInnovationCenterforExploitationandUtilizationofMarineBiologicalResources,Xiamen361013,China)
In order to develop the optimum process of anti-cancer peptides preparation from Ruditapes philippinarum,five proteases were selected to hydrolyze the clams under the same solid-liquid ratio,reaction time,enzyme dosage,optimum temperature and pH conditions.The amino nitrogen content and antitumor activity were measured using formaldehyde potentiometric titration and Cell counting kit-8(CCK-8) methods,respectively,and the correlation between the two indexes was analyzed.Enzymolysis conditions were optimized using single factor experiment and orthogonal design.The results showed that the enzymatic peptides of flavored protease had the highest content of amino nitrogen; whereas the enzymatic peptides of pepsin had the highest antitumor activity.Optimal hydrolysis conditions of pepsin were confirmed as:solid-liquid ratio 1∶1(w/w),pH value 2.0,reaction time 1 h,enzyme in solid matter 2 000 U/g,and,enzymolysis temperature 37 ℃.At the dose of 20 mg/mL,the enzymatic peptides that were obtained under the optimal conditions had an inhibition rate of 99.83% on A549.Thus the types of enzymes exert significant influence on the antitumor activity of enzymatic peptides,and there was no direct positive correlation between the content of amino nitrogen and the inhibition rate on A549 in the enzymolysis solution ofRuditapesphilippinarum.
Ruditapesphilippinarum; enzymolysis polypeptides; A549; anticancer activity
10.3969/j.issn.1007-9580.2016.05.009
2016-08-26
2016-09-28
福建省科技重大专项(2014NZ0001-1);福建省海洋高新产业发展专项([2013] 014);依托平台福建省海洋经济创新发展区域示范项目 (2014FJPT01);厦门南方海洋研究中心项目(14PZY017NF17):海洋经济创新发展区域示范项目(12PYY001SF08)
蔡康鹏(1992—),男,硕士研究生,研究方向:生物化学工程。E-mail:1360116792@qq.com
刘智禹(1972—),男,教授级高工,博士,研究方向:水产品加工与综合利用。E-mail:negr@163.com
肖美添(1968—),男,教授,博士,研究方向:天然产物化学。E-mail:mtxiao@hqu.edu.cn
R965;R282.74
A
1007-9580(2016)05-047-06
