水相[Rh(COD)Cl]2/BINAP催化二炔与腈[2+2+2]环加成反应合成吡啶衍生物∗
2016-11-28徐粉康位粉孟彦羽张立朝方少明
徐粉,康位粉,孟彦羽,张立朝,方少明
(1.郑州轻工业学院材料与化学工程学院,河南郑州450002;2.河南农业大学理学院,河南郑州450002)
吡啶类杂环化合物是一类重要的含氮杂环化合物,可以被广泛地应用于药物、食品添加剂、农药、天然产物、染料、功能材料的制备中,并且表现出了良好的性能.早期对于吡啶类化合物的合成主要集中在汉森酯合成法,这种方法通过缩合反应构建吡啶环,但是原子利用率较低.之后人们发现了腈和炔的[2+2+2]环加成方法构建吡啶衍生物[1,2],此法可以一步构建两个C-C键、一个C-N键,原子利用率可达100%.其中过渡金属催化的环加成方法可以提高反应的选择性,缩短反应时间,并且底物适用范围广.研究较多的过渡金属催化剂主要集中在Co、Ru、Rh、Fe、Ni等配合物[3,4].Co类催化剂发展的比较早,针对芳基腈和带有给电子基团的芳基腈能高收率的得到产物,而Rh与Ru催化剂对带有吸电子取代基的芳基腈和脂肪腈能起到很好的催化效果.
从绿色化学的角度考虑,水相的化学反应越来越受到科研工作者的重视.但是由于催化剂本身对水的敏感性,水相过渡金属催化炔和腈的[2+2+2]环加成反应研究相对减少.Parsons小组[5]与Yamazaki[6,7]等人以钴配合物为催化剂分别实现了超临界水体系与高温高压条件下的炔和腈的环加成反应,但是只能低收率的得到吡啶,并且仍然伴随着大量炔三聚副产物的生成.Heller小组[8,9]设计了一系列钴催化剂,在光照的条件下实现了水相的环加成反应,对应的吡啶衍生物产率高达75%.Butenschön[10]与Eaton[11]等人分别合成了带有亲水基团的钴配合物及带有边臂基团的钴配合物,完成了水/有机溶剂双相体系的炔和腈的环加成反应.万小组[12]首次研究了完全水相的Cp*Ru(COD)Cl催化腈和炔的环加成反应.他们研究发现tppts的引入能生成水溶性的活性催化剂成分,中等收率的得到吡啶衍生物.遗憾的是腈都是α位带有卤素的腈,因此我们试图发展其他的过渡金属催化剂,用于催化水相的环加成反应.本文以[Rh(COD)Cl]2为金属盐,BINAP为配体,实现了双相二炔和腈的[2+2+2]环加成反应,合成了带有环状取代基的吡啶衍生物,其结构经1H NMR和13C NMR表征,分别测试了温度、添加剂、溶剂对催化反应的影响.
1 实验部分
1.1 仪器与试剂
核磁仪:BRUKER DRX 400(500)液相色谱仪:Agilent 1200高分辨质谱:HPLC–Q–TOF mass spectrometer(大连理工大学分析测试中心);H2O经过蒸馏,并进行除气操作,最后进行氮气保护;柱色谱硅胶及薄层色谱硅胶板(青岛海洋化工厂);Rh催化剂(阿拉丁试剂公司),膦配体(百灵威公司),未经处理直接用于环加成反应;二炔按照文献方法合成[8].
1.2 合成
(1)NTs-二炔的合成
在250 mL反应瓶中加入NaH(1.800 g,45 mmol),氮气置换三次,加入干燥的DMF(30 mL).氮气保护下,滴加对甲苯磺酰胺(3.420 g,20 mmol)的DMF(30 mL)溶液,室温下搅拌1 h,向反应体系中滴加炔丙基溴(3.7 mL,42 mmol),TLC检测反应结束后,加入氯化铵饱和水溶液淬灭反应,然后用乙醚萃取,合并有机相,再依次用水、饱和食盐水洗涤2次,无水硫酸钠干燥,旋转蒸发除去溶剂,经柱层析得到产物白色固体4.100 g,产率75%.
(2)基于水相的铑催化腈和炔[2+2+2]环加成反应
取25 mL反应管,依次加入[RhCl(COD)]2(0.012 5 mmol,6.2 mg),BINAP(0.012 5 mmol,7.8 mg),SDS(1 mmol,272.4 mg),H2O(1 mL),饱和NH4Cl水溶液(1 mL),75oC搅拌1 h.之后加入羟基乙腈(0.5 mL),再加入NTs二炔的乙醚溶液(0.5 mmol,123.6 mg),再补加羟基乙腈(1 mL),75oC反应48 h.停止加热,乙酸乙酯提取,无水硫酸钠干燥,旋转蒸发除去溶剂,经柱层析得到产物(Petroleum ether/ethyl acetate=2:1.1H NMR(400 MHz,CDCl3)δ8.39(s,1H),7.76(d,J=8.3 Hz,2H),7.33(d,2H),7.14(m,1H),4.72(s,2H),4.63(m,4H),2.41(s,3H).13C NMR(100 MHz,CDCl3)δ156.1,147.2,144.2,143.8,133.6,132.3,130.2,127.7,117.1,53.4,51.8,63.0,21.5).
2 结果与讨论
2.1 辅助水溶性膦配体对反应效果的影响
为了优化出最佳的反应条件,选择NTs-二炔1a与羟基乙腈1b的反应为模板反应.为了生成水溶性的活性催化剂,试图引入水溶性的膦配体,因此首先选择5 mol%[RhCl(COD)]2为催化剂,5 mol%BINAP为配体,在反应体系中引入辅助的_水溶性膦配体,并对辅助的水溶性配体进行筛选,结果如表1所示.

[a]取25 mL反应管,依次加入[RhCl(COD)]2(0.012 5 mmol,6.2 mg),BINAP(0.012 5 mmol,7.8 mg),L(0.025 mmol),H2O(0.5 mL),室温搅拌15min,之后于75˚C下加热20 min,降至室温加入SDS(1 mmol,272.4 mg),NTs-二炔、羟基乙腈,H2O(0.5 mL),100˚C反应48 h.[b]分离收率.

从表1的结果中可以看出,辅助膦配体对反应的影响并不是很大,无论是水溶性的双膦配体还是单膦配体都不能有效地促进反应的进行(entry 1,3-5),其中位阻相对较大的TXPTS效果最差,不仅不能促进反应,反倒是产率出现了下降现象(entry 2).
2.2 催化剂类型对反应的影响
在炔和腈的[2+2+2]环加成反应中,催化剂的选择对反应至关重要,经过对辅助配体的筛选发现,不加入额外的配体反应没有明显的下降,于是我们进一步对催化剂的类型进行了筛选.主要考察了常用于催化环加成反应的铑与钴催化剂,结果见表2.

表2 不同金属催化剂对反应的影响
从表2可以看出,钴催化剂可以用于催化水相的环加成反应,在筛选的过程中发现,共溶剂的存在会对反应效果产生一定的影响,其中以二氯甲烷作为共溶剂时能获得较好的结果.整体来看,铑催化剂能给出相对较好的结果,因此我们选择[RhCl(COD)]2为最优的催化剂.
2.3 共溶剂对反应的影响
在对催化剂进行筛选的过程中,我们发现共溶剂可以影响反应效果,因此我们以[RhCl(COD)]2为最优的催化剂,BINAP为配体,NTs-二炔与羟基乙腈的反应为模型反应,对共溶剂进行了筛选,研究不同溶剂对反应的影响,结果见表3.
从表3的结果可以看出:乙醚、二氯甲烷、甲苯作为共溶剂时反应效果都很差(entry1-3),即便是加入相转移催化剂也不能有效的改善反应情况(entry 7).研究发现DCE与叔戊醇都能得到相对较好的结果,考虑到叔戊醇水溶性较好,于是对一系列的水溶性溶剂进行了筛选,但是结果仍旧不是很理想,只有乙二醇收率超过了20%.叔戊醇作为共溶剂时,在室温下反应几乎不能发生(entry 12).[a]取25 ml反应管,依次加入[RhCl(COD)]2(0.012 5 mmol,6.2 mg),BINAP(0.012 5 mmol,7.8 mg),SDS(1 mmol,272.4 mg),NaCl(116.8 mg),H2O(1 mL),共溶剂(1 mL),搅拌30 min,依次加入NTs-二炔、羟基乙腈,室温反应48 h.[b]先加入羟基乙腈,再加入二炔.[c]室温反应12 h后,升温至90oC反应36 h.[d]加入相转移催化剂nBu4NBr.[e]90oC反应48 h.[f]室温反应.

表3 共溶剂对反应的影响
2.4 改变加料顺序对反应的影响
在确定了最佳的金属盐和溶剂之后,我们对催化剂的用量及加料顺序进行了考察结果如表4所示:
依据表4的结果,我们可以看出增加催化剂和配体的用量至20%,产率明显提高,但是并不能高区域选择性地得到吡啶产物,仍伴随二聚体的产生.
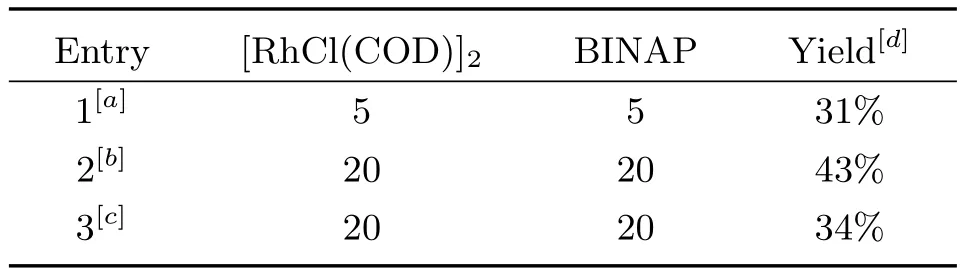
表4 催化剂用量对反应的影响
3 结论
以[Rh(COD)Cl]2作为金属前体,BINAP为配体,实现了炔和羟基乙腈在H2O/叔戊醇共溶剂条件下的[2+2+2]环加成反应,成功地获得了相应的双环吡啶衍生物.这种方法原子利用率可达100%,操作简单,一步构建两个C-C键及一个C-N键,经过对催化剂类型、溶剂、辅助配体、相转移催化剂等条件的筛选,初步实现了中等收率的双环吡啶产物,为水相的环加成方法构建吡啶化合物提供了参考与前期的研究基础.
