油莎草实时荧光定量PCR内参基因的选择∗
2016-11-28敬思群于红郭改涂亦娴普燕
敬思群,于红,郭改,涂亦娴,普燕
(新疆大学生命科学与技术学院,新疆乌鲁木齐830046)
油莎豆(CyperusesculentusL.)为莎草科莎草属多年生草本植物[1],油莎豆起源于非洲东北部,有着非常悠久的栽培历史,在世界各地热带到温带地区均有种植[2].又称人参豆、老虎豆、铁荸荠、地下板栗、地下核桃等,是营养最丰富的坚果之一[3,4],并有“油料作物之王”[5]之称.根据《新华本草纲要》记录,油莎豆块茎性辛、甘、温,疏肝、健胃及健脾,可以治疗消化不良等症状[6].油莎豆中含有很多种保健成分和药效活性成分,具有非常高的营养价值和药效价值,越来越被研究者们高度重视.
目前,关于油莎豆的研究主要集中于栽培技术[7]、油莎豆油提取工艺[8]、油莎豆成分分析[9]及油莎豆饮料的开发[10],而对油莎豆基因方面的研究较少,赵永国等人[11]利用SRAP分子标记构建了14份不同地理来源、表型具有差异的油莎豆品系的分子指纹图谱并进行了遗传多样性分析;程超等人[12]通过RACE技术,从油莎豆叶片中克隆到WRI1编码基因的cDNA序列及编码AGPase小亚基编码基因的cDNA序列,同时构建了35S启动子介导的油莎豆WRl1过表达载体及APSRNA干扰载体;敬思群等人[13]成功克隆得到PEPCase编码基因ppc的两个片段S1和S2,国外研究未见报道.
实时荧光定量PCR(Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法.通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法.实时荧光定量技术具有高度的灵敏性、特异性及精确性,广泛应用于生物体基因功能的研究[14].通过植物基因工程进行相关功能基因调控,以提高油莎豆油的产量.但是,目前油莎豆缺乏功能基因qRT-PCR分析中稳定表达的内参基因.本研究以油莎豆地上茎为材料,采用qRT-PCR分析2个常用内参基因18S rRNA、GAPDH的表达稳定性,筛选出合适的内参基因,从而为利用qRT-PCR探讨油莎豆的基因表达分析奠定理论基础.
1 材料与方法
1.1 实验材料
植物材料:油莎豆,来源于河南.将其处理后播种于逸夫楼前试验地,自然光照下采中间第一至第三片的幼嫩叶片(从里往外数).经采样后用锡箔纸包住,置于液氮中备用.
试剂与酶:植物总RNA提取试剂盒(Omega),DNA小提质粒试剂盒及凝胶回收试剂盒购自Omega公司;M-MLV Reverse Transcriptase、RNase Inhibitor(40U/µL)、pMD18-T Vector、Oligo(dT)18 Primer、dNTP Mixture(各10 mM)、rTaq等购自TaKaRa公司;液氮购买自乌鲁木齐西山;荧光定量试剂盒购自Promega公司,基因合成和测序于上海生工.
1.2 油莎豆处理
选取生长40 d的油莎豆幼苗,从早上10:00开始,每2 h(即10:00,12:00,14:00,16:00,18:00,20:00)以及生长天数为20,30,40,50,55,65,75,85,95,105,115,125,135,145 d的油莎豆地上茎采一次样(4个重复),取样后保存在-80◦C冰箱备用.
1.3 引物设计与RT-PCR扩增
依据实时荧光定量引物设计原则[15],应用DNAMAN设计引物,普通PCR摸索扩增条件,检测引物特异性,引物序列见表1,引物由上海生工合成.

表1 qPCR引物
1.4 总RNA提取和反转录
1.4.1 实验材料的处理
待油莎豆幼苗生长至有5∼6叶子时(出苗后40 d左右),取其中间三片叶子进行采样,分别称取0.1 g油莎豆叶片,迅速冻于液氮中备用.
1.4.2 地上茎总RNA提取和cDNA的合成
将地上茎在盛有液氮的研钵中快速碾磨成粉末状,取50∼100 mg转入1.5 mL离心管中,具体步骤按植物总RNA提取试剂盒(Omega公司)操作手册进行,货号为R6827-01[16].
提取完毕后取10µL RNA用浓度为1%的琼脂糖凝胶电泳检测条带,用NanoDrop检测RNA的浓度和质量,每份组织三个生物学重复.按照1µg总RNA为模板进行反转录(20µL体系),以Oligo(dT)18Primer作为引物,后用M-MLV Reverse Transcriptase合成cDNA.程序如下:反转录反应液RNA,H2O,Oligo(dT)1870◦C孵育10 min;冰浴2 min,M-MLV Buffer,dNTP,RRI,M-MLV,H2O 混合后42◦C孵育1 h,70◦C孵育15 min,取出放置在-20◦C备用,将该cDNA作为PCR扩增的模板.
1.5 内参基因的qRT-PCR分析
采用三步法进行定量反应,参照Promega试剂盒说明书进行qRT-PCR,使用ABI PRISM 7500实时定量PCR仪进行检测,SYBR作为染料,4个生物学重复,2个技术重复,试验同时设置阴性对照:以RNase-free ddH2O为模板.参照Qing Wang等人的方法经过改进并按照试剂盒说明进行操作[17],实验数据采用相对定量法分析.在每个PCR反应结束后得到熔解曲线,其用来证实设计的引物扩增和检测PCR产物的唯一性.qPCR的引物见表1.
先用普通PCR进行扩增判断引物的特异性,再进行实时荧光定量,PCR产物经过电泳检测,选取条带单一,无引物二聚体的退火温度进行实时荧光定量PCR扩增.用Omega纯化回收试剂盒纯化PCR产物,用pMD18-T试剂盒连接,操作均按照试剂盒说明书进行,连接产物转化DH5α感受态细胞,鉴定阳性克隆,用Omega质粒快速提取试剂盒提取质粒,测定质粒浓度,以质粒为模板用Elution Buffer将质粒进行10倍倍比稀释,质粒依次稀释为:1,10−1,10−2,10−3,10−4,10−5,10−6,10−7ng/µL,以此为模板进行定量PCR反应,绘制各基因的标准曲线.
2 结果与分析
2.1 RNA的提取
选用Omega植物总RNA提取试剂盒,获得含量较高、纯度较好的油莎豆RNA.取0.1 g油莎豆幼苗叶片在液氮中充分研磨,采用试剂盒提取油莎豆地上茎总RNA,接着进行定量和电泳检测.采用Revert Aid First SttrandcDNA Synthesis Kit(大连TaKaRa公司)试剂盒合成cDNA.电泳结果表明,RNA分子保持完整,见图1.

图1 不同采样时间下油莎豆总RNA电泳图
2.2 RT-PCR扩增
根据设计的荧光定量引物18S rRNA,GAPDH可知扩增条带大小大约分别为117bp,143bp.PCR扩增进行梯度试验,进行梯度PCR,PCR反应扩增体系为94◦C预变性5 min;94◦C变性30 s,中间温度退火30 s,72◦C延伸60 s,35个循环;72◦C延伸10 min,反应产物进行琼脂糖凝胶电泳检测.根据梯度PCR结果可知,18S rRNA,GAPDH,退火温度分别为60◦C,52◦C.结果如图2所示.
结果证明与预期片段大小一致.扩大体系进行胶回收,扩大体系至100µL,按PCR产物纯化试剂盒(Omega)说明书进行PCR产物的回收.回收的片段与pMD18-T(北京全式金公司)连接,转化至Trans5α中,挑取单克隆,利用菌液PCR进行鉴定.挑取阳性克隆,送上海生工测序.
2.3 质粒提取
从2对引物扩增出的阳性克隆各选择一个摇菌5 mL,1%接菌,过夜摇菌,提取质粒,定量结果如下:1,2,3,4,6分别为126,138.1,145.4,150.5,140.1 ng/µL.放置在-20◦C冰箱中备用.
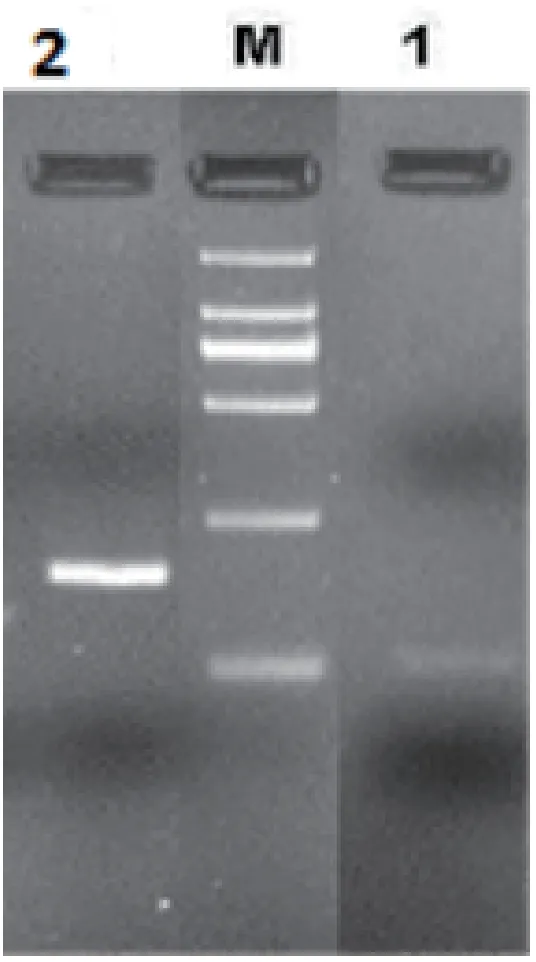
图2 目的基因部分序列的PCR扩增
2.4 标准曲线的建立
依据表1列出的2对引物对各标准质粒(上述质粒)分别进行8次10n倍系列稀释(1,10−1,10−2,10−3,10−4,10−5,10−6,10−7ng/µL),对引物的特异性进行检验,每一个基因得到最佳退火温度和扩增效率的标准曲线,如图3所示.
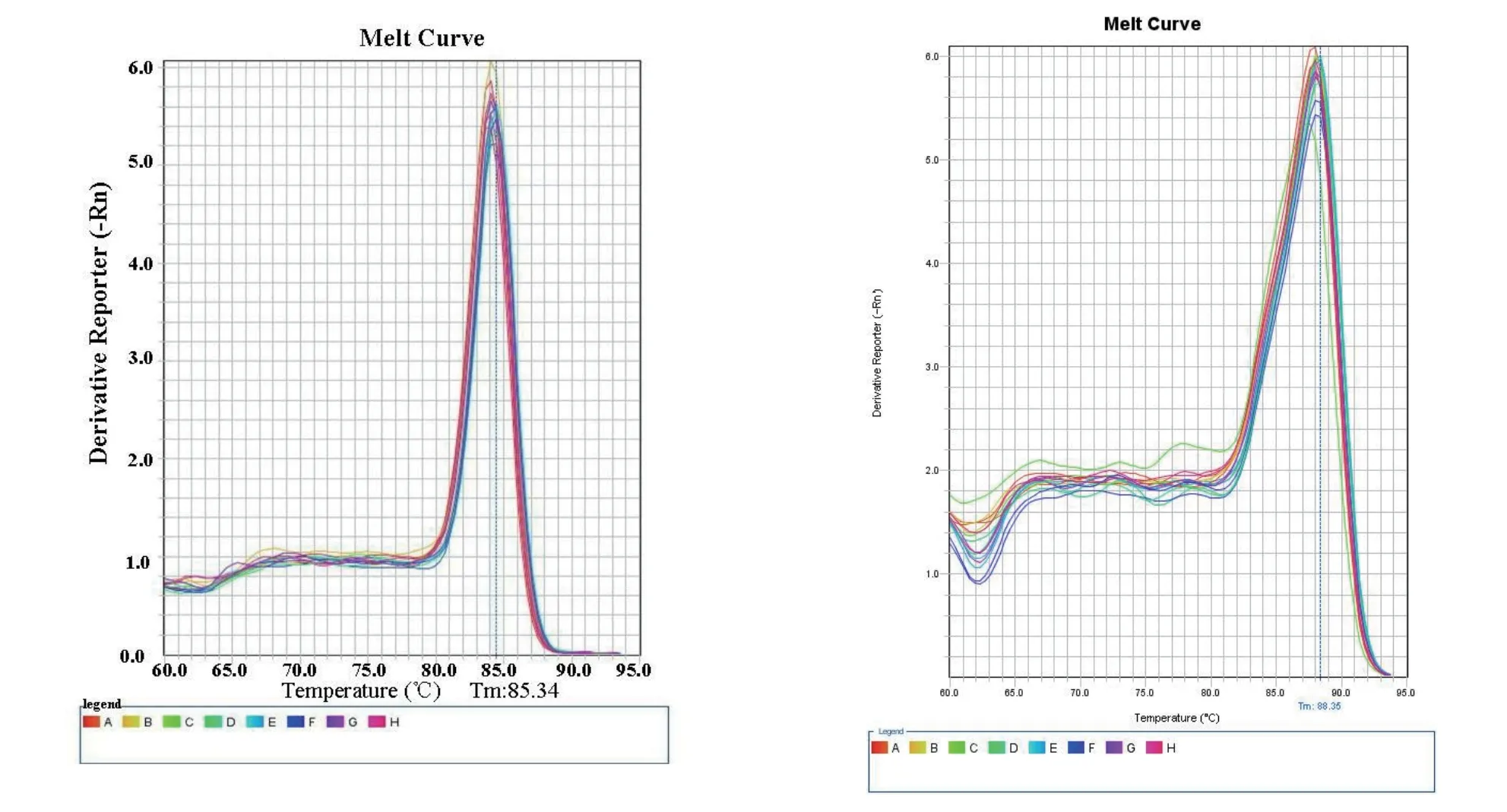
图3 18S rRNA,GAPDH熔解曲线

表2 目的基因片段扩增标准曲线相关数据
对两个内参基因的熔解曲线(图3)进行分析,结果发现熔解曲线均为单峰,反应过程中无非特异性扩增和引物二聚体,说明引物特异性较好.由表2可知,两个候选基因片段的相关系数R2的大小依次为18S rRNA>GAPDH;扩增效率依次为:18S rRNA>GAPDH;熔解温度依次为18S rRNA 实时荧光定量PCR广泛用于各个领域,在基因表达研究、疾病的快速检测、定量分析、食品安全检测、基因分型、以及疫苗效力测定中发挥重要作用.获得准确可靠的实时荧光定量PCR结果,不仅需要正确的试验与引物设计之外,选择合适的内参基因也至关重要.合适的内参基因应该是在任何试验条件下及不同的细胞或组织中表达量均恒定,不受任何外因和内因的影响.常用的内参基因有GAPDH、Actin2、βtublin、18S rRNA等.其中GAPDH是参与糖酵解的一种关键酶;Actin2是编码肌动蛋白的基因;β-tublin是骨架蛋白;18S rRNA是真核生物体内含量最多的核糖体RNA.秦晓艺等人[18]研究了不同贮藏时期杏鲍菇内参基因的筛选,结果表明β-actin的表达稳定性最高,为最佳内参基因;张德辉等人[19]进行了天蓝苜蓿锌胁迫下实时定量PCR内参基因的筛选,研究结果显示不同的Zn2+浓度所对应的最适内参基因不同;温志斌等人[20]研究干旱胁迫下松叶猪毛菜实时定量PCR内参基因的筛选,β-actin为松叶猪毛菜干旱胁迫下基因表达最合适的内参基因.孙美莲等人[21]研究认为比较不同成熟度的叶片和愈伤组织时,GAPDH可以作为校正内参基因;苏晓娟等人[22]研究了毛果杨内参基因,结果表明18S rRNA为不同组织基因表达的合适内参基因,与本研究结果一致.本文利用实时荧光定量PCR技术,探讨了两个候选基因,结果表明18S rRNA可以作为qRT-PCR合适的内参基因.本研究为开展其功能基因的表达分析奠定了基础,同时也可以为其他植物筛选内参基因提供参考.3 结论与讨论
猜你喜欢
杂志排行
新疆大学学报(自然科学版)(中英文)的其它文章
- 住宅空间体量利用效率量化分析及其应用∗
- 低能氮离子注入三孢布拉氏霉诱变育种方法研究∗
- 全离子型纳米复合水凝胶聚(2-丙烯酰胺-2-甲基丙磺酸-丙烯酸-N-(3-二甲氨基)丙基甲基丙烯酰胺)/Laponite的合成及性能研究∗
- Paired Domination Number of Outerplanar Graphs∗
- Synchronization of Competitive Neural Networks with Time-varying Delays and Impulses Effects∗
- Boundedness of Littlewood-Paley Functions on Anisotropic Weak Hardy Spaces of Musielak-Orlicz Type∗
