腹腔镜辅助胃癌D 2端根治术治疗胃癌合并2型糖尿病的效果及其对炎症因子和免疫功能的影响
2016-11-28李海游红勇陈智敏李兵徐建明四川省崇州市人民医院胃肠外科四川崇州611230
李海 游红勇 陈智敏 李兵 徐建明四川省崇州市人民医院胃肠外科,四川崇州 611230
腹腔镜辅助胃癌D 2端根治术治疗胃癌合并2型糖尿病的效果及其对炎症因子和免疫功能的影响
李海游红勇陈智敏李兵徐建明
四川省崇州市人民医院胃肠外科,四川崇州611230
目的 探讨腹腔镜辅助胃癌D2端根治术对胃癌合并2型糖尿病患者的疗效及其对炎症因子和免疫功能的影响。方法 选取2006年3月~2013年2月崇州市人民医院诊治的68例胃癌合并2型糖尿病患者,按照手术方式的不同分为开腹胃癌D2根治术(开腹组)和腹腔镜辅助胃癌D2根治术(腹腔镜组),每组各34例。分别观察两组患者的临床治疗效果、炎症因子和免疫功能的变化。结果 腹腔镜组的治疗有效率为88.24%,略高于开腹组的70.59%,但两组间比较差异无统计学意义(P>0.05);开腹组患者平均腹腔引流时间、肛门排气时间均明显长于腹腔镜组(P<0.05),术中平均出血量和并发症发生率较腹腔镜组显著增加(P<0.05),但平均手术时间却明显少于腹腔镜组(P<0.05);两组患者在中位生存时间和清扫淋巴结数量的比较,差异无统计学意义(P> 0.05)。腹腔镜术式对患者空腹血糖和餐后2 h血糖的影响更小(P<0.05);两组患者术后白介素(IL)-6、IL-8、IL-12、IL-16、肿瘤坏死因子-α(TNF-α)的水平均较术前显著升高(P<0.05),而且开腹组患者上述炎症因子的增加幅度较腹腔镜组更为明显(P<0.05);腹腔镜组患者IgA、IgM水平和补体C3含量的改善幅度显著优于开腹组(P< 0.05)。结论 腹腔镜辅助胃癌D2端根治术对胃癌合并2型糖尿病患者具有良好的效果,对血糖和免疫功能影响较小且可减轻炎性反应。
2型糖尿病;胃癌D2端根治术;腹腔镜;炎症因子;免疫功能
我国每年约有20万例新发胃癌患者,高居各类恶性肿瘤之首[1]。胃癌合并2型糖尿病患者持续的高血糖不仅降低了患者对外科手术的耐受能力,也极易诱发术后多种并发症,甚至危及患者生命[2-3]。腹腔镜微创手术具有创伤小、手术时间短、术后恢复快等诸多优点[4],本研究拟探讨腹腔镜辅助胃癌D2端根治术对胃癌合并2型糖尿病患者的临床疗效及其对患者炎症因子水平和免疫功能指标的影响,现报道如下:
1 资料与方法
1.1一般资料
选取2006年3月~2013年2月崇州市人民医院胃肠外科诊治的68例胃癌合并2型糖尿病患者为研究对象,其中男38例,女30例,年龄42~78岁,平均年龄(57.21±8.85)岁,体重指数21.74~25.95 kg/m2,平均(23.58±1.65)kg/m2。所有患者均符合《胃癌诊疗规范》诊断标准[5],且均术前胃镜病理学活检及CT检查确诊为胃癌:胃底癌10例,胃体癌13例,胃窦癌9例,腺癌32例,未分化癌3例,印戒细胞癌1例;临床分期[6]:Ⅰb期4例,Ⅱ期14例,Ⅲa期26例,Ⅲb期19例,Ⅳ期5例。65例患者在入院前已诊断为2型糖尿病,病史3个月~18年,平均病程(6.28±2.49)年,另有3例入院检查诊断为2型糖尿病。糖尿病的诊断标准:空腹血糖≥7.0 mmol/L,随机血糖≥11.1 mmol/L,或口服葡萄糖耐受实验2 h后血糖≥11.1 mmol/L。将所有患者按照手术方式分为开腹胃癌D2根治术(开腹组)和腹腔镜辅助胃癌D2根治术(腹腔镜组),每组各34例。两组患者一般临床资料差异无统计学意义(P>0.05),具有可比性。本研究方案经医院伦理委员会批准,所有患者及家属均知情同意参与本项目并签署知情同意书。
1.2手术方法
1.2.1腹腔镜辅助胃癌D2根治术采用气管内插管全身麻醉,脐孔处放置镜头,左侧腋前线肋缘下行切孔为主操作孔,于脐左侧偏上行切孔为辅助操作孔;在腹腔镜的直视下,探查肿瘤的部位,并在横结肠上缘用超声刀切开胃结肠韧带,分离肠系膜前叶,结扎离断胃网膜左血管,清扫右血管淋巴结,淋巴结清扫顺序为:14v→6→4sb→5→12a→8a→7/9→1→3;于上腹部行5 cm切口,将游离的大网膜和胃拉至切口外,行胃大部切除术和毕Ⅰ式胃十二指肠吻合术,留置腹腔引流管。
1.2.2开腹胃癌D2根治术气管内插管全身麻醉,于上腹部正中处作切口,观察肿瘤病灶的部位、大小及侵袭情况,手术步骤和术后处理均与腹腔镜组相同。
1.3临床疗效指标
根据实体瘤疗效评价标准予以评价,①完全缓解(CR):肿瘤完全消失>4周;②部分缓解(PR):肿瘤最大直径和最大垂直直径乘积缩小>50%并持续4周以上且无明显加重;③稳定(SD):肿瘤最大直径和最大垂直直径乘积缩小<50%且增大≥25%;④稳定(SD)(PD):肿瘤最大直径和最大垂直直径乘积增大>25%。治疗有效率(%)=(CR+PR)/总例数×100%。分别记录术后两组患者空腹血糖和餐后2 h血糖值、平均手术时间、术中出血量、肛门排气时间、腹腔引流时间、清扫淋巴结的数量和并发症发生情况;随访追踪随访24个月,计算两组患者的生存时间及1、2年生存率。
1.4炎症因子水平检测
采用酶联免疫吸附试验分别检测白细胞介素(IL)-6、IL-8、IL-12、IL-16和肿瘤坏死因子-α(TNF-α)的水平,检测试剂盒购于上海瓦兰生物科技有限公司。
1.5免疫功能指标检测
采用速率散射免疫比浊法测定两组患者血清IgA、IgM、IgG和补体C3、C4的含量,配套试剂由上海荣盛生物技术有限公司提供,所有样品均由专职检验人员于日立7600-020型生化分析仪上操作完成。
1.6统计学方法
采用统计软件SPSS 17.0对数据进行分析,正态分布的计量资料以均数±标准差()表示,两组间比较采用t检验;计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1两组患者近期疗效及手术相关指标比较
结果显示,腹腔镜组的治疗有效率略高于开腹组,但差异无统计学意义(P>0.05);开腹组患者腹腔引流时间、肛门排气时间均明显长于腹腔镜组(P<0.05),手术时间明显短于腹腔镜组(P<0.05);开腹组患者术中出血量较腹腔镜组明显增加(P<0.05);两组患者清扫淋巴结数量的比较差异无统计学意义(P>0.05);腹腔镜组对患者空腹血糖和餐后2 h血糖的影响较腹腔镜组更小(P<0.05),而且腹腔镜组患者并发症发生率明显低于开腹组(P<0.05)。见表1~3。

表1 两组患者近期临床疗效指标比较(例)
2.2两组患者炎症因子水平比较
术后,两组IL-6、IL-8、IL-12、IL-16和TNF-α的水平均较术前显著升高(P<0.05);且与腹腔镜组患者比较,开腹组患者上述炎症因子改善更为显著 (P<0.05)。见表4。
表2 两组患者血糖及手术相关指标比较()
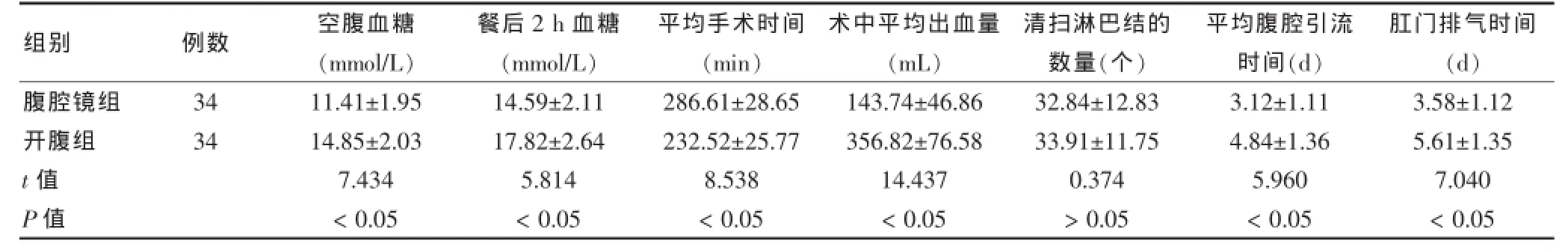
表2 两组患者血糖及手术相关指标比较()
组别 例数 空腹血糖(mmol/L)餐后2 h血糖(mmol/L)平均手术时间(min)术中平均出血量(mL)清扫淋巴结的数量(个)平均腹腔引流时间(d)肛门排气时间(d)腹腔镜组开腹组34 34 t值 P值11.41±1.95 14.85±2.03 7.434<0.05 14.59±2.11 17.82±2.64 5.814<0.05 286.61±28.65 232.52±25.77 8.538<0.05 143.74±46.86 356.82±76.58 14.437<0.05 32.84±12.83 33.91±11.75 0.374>0.05 3.12±1.11 4.84±1.36 5.960<0.05 3.58±1.12 5.61±1.35 7.040<0.05

表3 两组患者术后不良反应发生情况比较(例)
2.3两者患者免疫功能指标变化比较
术后腹腔镜组患者的补体C3水平较术前显著升高(P<0.05),其余指标变化差异无统计学意义(P>0.05);开腹组中,术后患者IgA、IgM和IgG含量较术前明显降低(P<0.05),补体C3水平明显升高(P<0.05)。开腹组患者术后IgA、IgM下降幅度显著高于腹腔镜组(P<0.05),补体C3含量的增加程度也则较腹腔镜组更为明显(P<0.05)。见表5。
2.4两者患者远期疗效比较
腹腔镜组患者的中位生存时间见图1,1、2年生存率虽然都略高于开腹组,但两组间比较均无显著差别(χ2=0.041,P=0.840)。
表4 两组患者炎症因子水平比较()
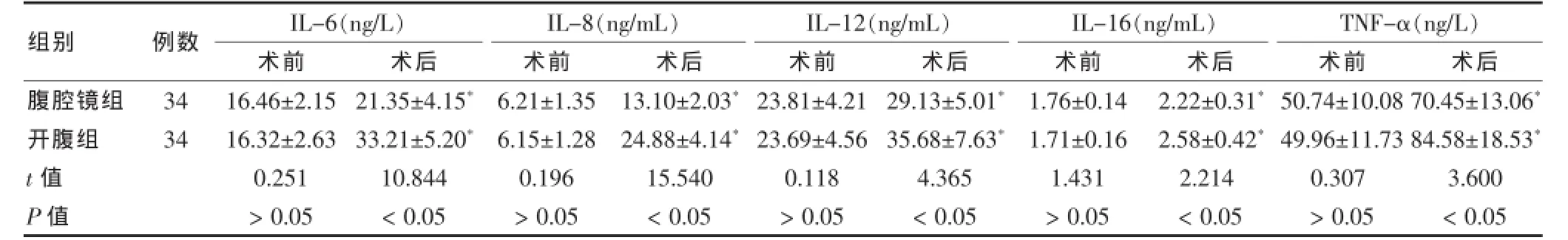
表4 两组患者炎症因子水平比较()
注:与同组术前比较,*P<0.05;IL:白介素;TNF-α:肿瘤坏死因子-α
组别 例数 IL-6(ng/L)术前 术后IL-8(ng/m L)术前 术后IL-12(ng/mL)术前 术后IL-16(ng/m L)术前 术后TNF-α(ng/L)术前 术后腹腔镜组开腹组34 34 t值 P值16.46±2.15 16.32±2.63 0.251>0.05 21.35±4.15*33.21±5.20*10.844<0.05 6.21±1.35 6.15±1.28 0.196>0.05 13.10±2.03*24.88±4.14*15.540<0.05 23.81±4.21 23.69±4.56 0.118>0.05 29.13±5.01*35.68±7.63*4.365<0.05 1.76±0.14 1.71±0.16 1.431>0.05 2.22±0.31*2.58±0.42*2.214<0.05 50.74±10.08 49.96±11.73 0.307>0.05 70.45±13.06*84.58±18.53*3.600<0.05
表5 两者患者免疫功能指标变化比较()
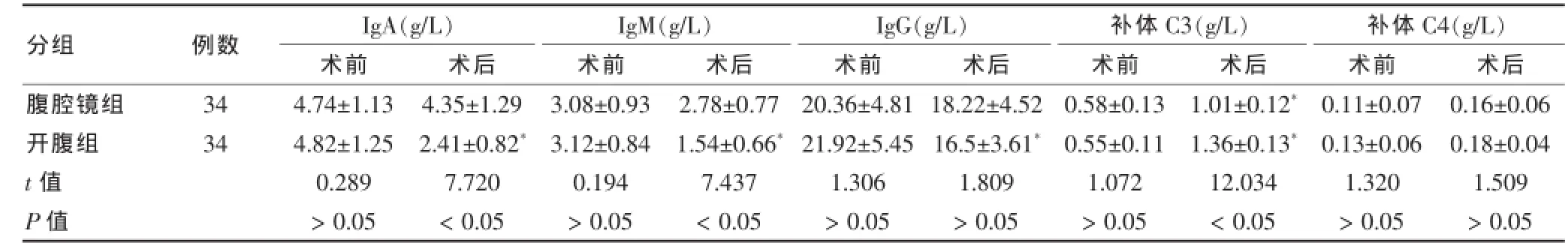
表5 两者患者免疫功能指标变化比较()
注:与同组术前比较,*P<0.05
分组 例数 IgA(g/L)术前 术后IgM(g/L)术前 术后IgG(g/L)术前 术后补体C3(g/L)术前 术后补体C4(g/L)术前 术后腹腔镜组开腹组34 34 t值 P值4.74±1.13 4.82±1.25 0.289>0.05 4.35±1.29 2.41±0.82*7.720<0.05 3.08±0.93 3.12±0.84 0.194>0.05 2.78±0.77 1.54±0.66*7.437<0.05 20.36±4.81 21.92±5.45 1.306>0.05 18.22±4.52 16.5±3.61*1.809>0.05 0.58±0.13 0.55±0.11 1.072>0.05 1.01±0.12*1.36±0.13*12.034<0.05 0.11±0.07 0.13±0.06 1.320>0.05 0.16±0.06 0.18±0.04 1.509>0.05
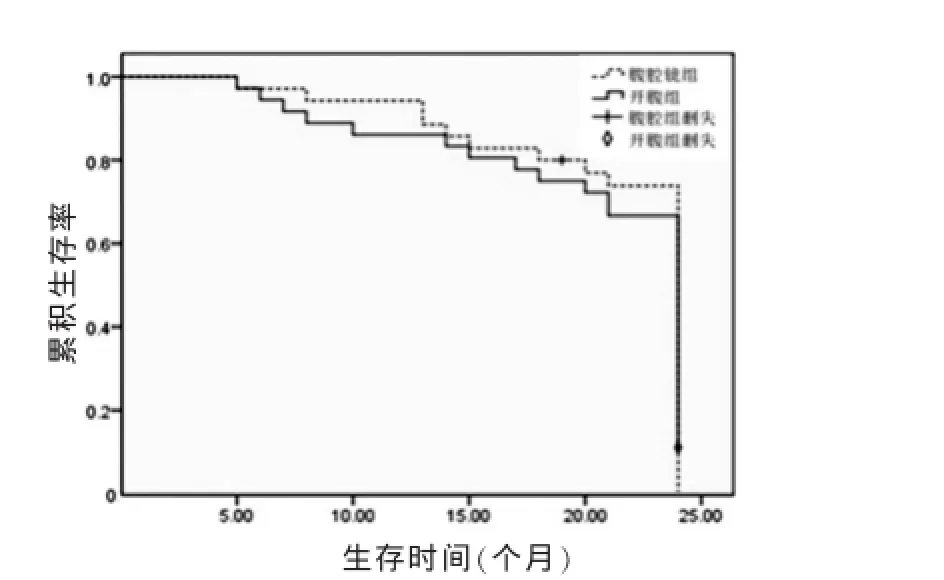
图1 两组患者生存时间比较
3 讨论
腹腔镜微创手术具有创伤小、术后恢复快、疼痛程度轻等诸多优点,已广泛应用于多种恶性肿瘤的手术治疗[7-8]。但是,腹腔镜辅助胃癌D2根治术因解剖结构复杂,淋巴结清扫范围广及胃肠道重建难度高等原因制约,发展相对滞后,其安全性和有效性也存在争议[9-10]。由于合并2型糖尿病患者的胃癌患者常存在内分泌代谢紊乱、免疫功能低下和耐受手术能力差等特点,疗效差且并发症的发生率高[11-13]。本研究结果显示,腹腔镜组患者的平均腹腔引流时间、肛门排气时间明显缩短(P<0.05),术中平均出血量和并发症的发生率显著减少(P<0.05),对血糖的影响也较开腹组小(P<0.05),表明腹腔镜手术方式能够明显改善围术期指标,降低并发症的发生率,且更有利于维持糖尿病患者血糖值的稳定,该结果与国内外报道基本一致[14-17]。但是,两组患者的治疗有效率和生存时间比较并无明显差别(P>0.05),这可能与研究纳入的样本量较少有关。
研究显示,手术创伤可刺激机体产生炎性反应,引起多种炎性细胞释放炎症因子和生长因子,其中最常见的细胞炎症因子便是白细胞介素、TNF-α和hs-CRP[18-22]。本研究结果显示,两组患者术后IL-6、IL-8、IL-12、IL-16和TNF-α的水平均较术前显著升高(P<0.05),表明术后患者出现了应激性炎症反应。与腹腔镜组患者相比,开腹组患者上述炎症因子增加的幅度更为显著(P<0.05)。该结果充分表明,腹腔镜辅助胃癌D2根治术对患者的创伤更小,更有利于患者术后的康复。本研究还发现,开腹组患者免疫功能指标IgA、IgM和IgG在术后均出现显著的降低,并且伴随补体C3含量的急剧升高,提示患者的免疫功能受损,抵抗外界感染的能力下降。而且腹腔镜组患者IgA、IgM和IgG的含量未出现明显的改变,表明腹腔镜术式对患者的免疫功能的影响相对较小。
[1]季加孚.我国胃癌防治研究三十年回顾[J].中国肿瘤临床,2013,40(22):1345-1351.
[2]郑朝旭,郑荣寿,张思维,等.中国2010年胃癌发病与死亡分析[J].中国肿瘤,2014,23(10):795-800.
[3]苏杰,冯祯声,邱光庭,等.胃癌合并糖尿病行不同手术方案对术后血糖改变的影响[J].中国综合临床,2013,29(5):536-538.
[4]Parisi A,Nguyen NT,Reim D,et al.Current status of minimally invasive surgery for gastric cancer:A literature review to highlight studies limits[J].Int J Surg,2015,17(1):34-40.
[5]徐惠绵,朱志.卫生部《胃癌诊疗规范》解读[J].浙江医学,2012,34(16):1319-1321.
[6]Yeh CN,Wang SY,Hsu JT,et al.N3 subclassification incorporated into the final pathologic staging of gastric cancer:a modified system based on current AJCC staging[J]. Medicine(Baltimore),2015,94(8):e575.
[7]胡军红,杨德生,王晨宇,等.腹腔镜辅助胃癌根治术在老年肥胖患者的应用[J].中国普通外科杂志,2013,22(10):1261-1265.
[8]桂林.腹腔镜辅助胃癌D2根治术学习曲线研究[J].中国实用外科杂志,2013,33(2):146-149.
[9]滕达,李松岩,宁宁,等.胃癌合并 2型糖尿病患者行腹腔镜与开腹全胃切除术的疗效比较[J].解放军医学院学报,2013,34(3):208-210.
[10]刘乃青,孙淑香,孙钦立,等.腹腔镜辅助下胃转流术对胃癌合并2型糖尿病患者血糖,血脂,血压的影响[J].中国现代普通外科进展,2015,18(9):746-748.
[11]周俊峰,何庆良,王家兴,等.腹腔镜胃癌术后重建方式对合并2型糖尿病患者血糖的影响[J].广东医学,2013,33(24):3722-3725.
[12]Sultan S,Gupta D,Parikh M,et al.Five-year outcomes of patients with type 2 diabetes who underwent laparoscopic adjustable gastric banding[J].Surg Obes Relat Dis,2010,6(4):373-376.
[13]周祥,熊竹娟,唐令超,等.根治性胃癌切除术中不同吻合术式对胃癌合并2型糖尿病患者术后血糖的影响[J].肿瘤预防与治疗,2015,28(4):200-203.
[14]宫庆,丁印鲁,纪志鹏,等.胃癌合并2型糖尿病消化道重建后血糖变化观察[J].中国现代普通外科进展,2011,14(5):380-383.
[15]Kim JW,Cheong JH,Hyung WJ,et al.Outcome after gastrectomy in gastric cancer patients with type 2 diabetes[J]. World J Gastroenterol,2012,18(1):49.
[16]尹作文,喻军,王永,等.腹腔镜辅助下胃癌D2根治术对患者血清炎症因子的影响[J].中国普通外科杂志,2014,23(3):383-385.
[17]黄灵,杜义安,俞鹏飞.腹腔镜胃癌根治术与开腹胃癌根治术对机体炎性反应和免疫功能的影响[J].中国现代医生,2015,53(17):25-28.
[18]尹鹏,石彦,余佩武,等.腹腔镜与开腹胃癌D2根治术影响IL-6和IL-10表达的前瞻性研究[J].中华消化外科杂志,2013,12(5):358-361.
[19]鲁力,谢敏,熊治国.腹腔镜胃癌根治术后患者炎症因子及凝血功能变化的研究[J].天津医药,2015,43(3):274-277.
[20]沈乃营,何盟国,刘昌,等.完全腹腔镜远端胃癌D2根治术在进展期胃癌中的临床应用价值[J].中国医药导报,2015,12(29):13-16.
[21]黄河,刘建.腹腔镜辅助远端胃癌 D2根治术手术时间对手术创伤程度及术后并发症的影响研究[J].河北医学,2014,20(11):1835-1837,1838.
[22]余伯成.腹腔镜胃癌D2根治术和开腹胃癌D2根治术中患者炎症反应比较[J].临床与病理杂志,2015,35(7):1298-1303.
Clinical curative effects of laparoscopic assisted D2 radical resection on patients w ith gastric cancer and type 2 diabetes and its influence on inflammation factors and immune function
LI Hai YOU HongyongCHEN ZhiminLI BingXU Jianming
Department of Gastrointestinal Surgery,People's Hospital of Chongzhou,Sichuan Province,Chongzhou611230,China
Objective To explore the clinical curative effects of laparoscopic assisted D2 radical resection on the patients with gastric cancer and type 2 diabetes and its influence on the inflammation factors and immune function. M ethods The 68 cases of gastric cancer and type 2 diabetes from March 2006 to February 2013 in People's Hospital of Chongzhou were selected,and they were divided into D2 radicalgastrectomy(gastrectomy group)and laparoscopic assisted D2 radical resection(laparoscopic group)according to the different operation methods,with 34 cases in each group. The clinical curative effects and the levels of inflammatory factors and immune function were observed in the two groups.Results The total effective rate of laparoscopic group was 88.24%,it was slightly higher than that of gastrectomy group(70.59%),but the difference was not statistically significant(P>0.05);the average abdominal laparotomy drainage time anal exhaust time of gastrectomy group were significantly longer than those of laparoscopic group(P< 0.05),and the average intraoperative bleeding volume and incidence of complication were significantly increased than those of laparoscopic group(P<0.05),but the average operation time was significantly shorter than the laparoscopic group(P<0.05);there were no significant difference on the survival time and the number of lymph node dissection between two groups(P>0.05);moreover,the changes on blood glucose and 2 h blood glucose after intake in laparoscopic group were less than gastrectomy group(P<0.05);After postoperative,the levels of IL-6,IL-8,IL-12,IL-16,TNF-α and hs-CRP were all significantly increased in both two groups(P<0.05),while the inflammatory factors of the gastrectomy group increased more significantly than that in the laparoscopic group(P<0.05).Moreover,the changed levels of IgA,IgM and complement C3 in the laparoscopic group were significantly better than those in the gastrectomy group(P<0.05).Conclusion Laparoscopic assisted D2 radical resection has a good curative effect on the gastric cancer and type 2 diabetes,and has litter influence on the blood glucose and immune function,it also can reduce the level of inflammation.
Type 2 diabetes;Gastric cancer D2 radical resection;Laparoscopy;Inflammation factor;Immune function
R735.2
A
1673-7210(2016)04(b)-0100-04
四川省成都市卫生局青年基金课题(2013053)。
游红勇(1970.10-),男,副主任医师;研究方向:胃癌治疗对合并2型糖尿病患者血糖的影响。
(2016-01-12本文编辑:苏畅)
