鼠源乳腺癌多药耐药细胞株的建立及耐药机制的初步研究
2016-11-28邓印根张志杰卢敏莹贾小婷贺智敏广州医科大学附属肿瘤医院肿瘤研究所广州市恶性肿瘤治疗转化医学重点实验室广东广州510095
邓印根 张志杰 卢敏莹 贾小婷 彭 聪 贺智敏广州医科大学附属肿瘤医院肿瘤研究所 广州市恶性肿瘤治疗转化医学重点实验室,广东广州 510095
鼠源乳腺癌多药耐药细胞株的建立及耐药机制的初步研究
邓印根张志杰▲卢敏莹贾小婷彭聪贺智敏
广州医科大学附属肿瘤医院肿瘤研究所广州市恶性肿瘤治疗转化医学重点实验室,广东广州510095
目的 构建鼠源性乳腺癌5-氟尿嘧啶(5-Fu)耐药细胞株,为研究乳腺癌耐药与体内免疫微环境的关系提供细胞模型。方法 通过体外以浓度递增的方法诱导小鼠乳腺癌4T1细胞对5-Fu产生耐药,MTS法确定其耐药性,平板克隆检测其增殖活性,实时定量和半定量PCR检测其中5-Fu代谢相关酶TS、MTHFR、TK、OPRT、DPD及药泵蛋白MDR1、MRP1的表达,通过流式细胞术检测其周期及CD44+CD24-干细胞亚群的比例。 结果 耐药细胞4T1/5-Fu与4T1细胞相比,4T1/5-Fu细胞对5-Fu、吉西他滨和顺铂耐药的耐药指数(RI)明显升高;5-Fu合成代谢相关酶TK、OPRT表达明显降低 (P<0.05),代谢抑制性相关酶TS、MTHFR明显升高 (P<0.05),药泵蛋白MDR1、MRP1表达明显升高(P<0.05);流式细胞术结果显示,CD44表达明显升高,肿瘤干细胞群增多。结论 成功构建小鼠乳腺癌多药耐药细胞株,耐药发生可能与5-Fu代谢酶类、药泵蛋白表达以及干细胞比例改变相关。
肿瘤耐药;4T1细胞;5-氟尿嘧啶;肿瘤干细胞
乳腺癌是严重危害女性健康和生命的重大疾病,化学治疗是乳腺癌综合治疗中不可或缺的治疗方法,而不可避免的化疗耐受是严重影响乳腺癌治疗效果的瓶颈问题。乳腺癌化疗耐受机制至今尚不十分明确,近年研究显示肿瘤微环境可能在其中发挥重要作用,尤其是肿瘤的免疫微环境[1]。鉴于探讨乳腺癌耐药与微环境关系依赖于体内研究,而长期以来采用的人源乳腺癌细胞系建立的免疫缺陷小鼠荷瘤体内研究模型,因小鼠本身免疫缺陷的限制,无法评价免疫系统对耐药的影响。因此,本研究拟建立鼠源乳腺癌细胞系(4T1)多药耐药模型,并体外对耐药机制进行初步分析,为进一步体内研究免疫微环境对化疗敏感性的影响奠定基础。
1 材料与方法
1.1材料
小鼠乳腺癌细胞系4T1为广州医科大学附属肿瘤医院肿瘤研究所冻存保存,购自上海生命科学院细胞库。培养基RPMI-1640、0.25%胰酶、胎牛血清和TRizol购自美国Invitrogen公司。MTS、逆转录试剂盒及Taq酶购自美国Thermo公司,SYBR Green qPCRMaster Mix购自美国Fermentas生物公司,引物由中国上海Invitrogen合成。PI染料购自美国BD公司。抗鼠FITC-CD44、APC-CD24单克隆抗体购自美国Ebioscience公司。
1.2方法
1.2.1细胞培养及5-Fu耐药细胞株建立4T1乳腺癌细胞采用RPMI-1640(含有10%胎牛血清)培养液,在37℃、5%CO2条件下于培养箱中培养,每2~3天更换培养液,用0.25%胰蛋白酶消化传代。实验时取对数生长期细胞。以浓度递增的方法建立4T1/5-Fu耐药细胞株。5-Fu起始浓度为1 ng/mL,最后直到细胞在含5-Fu 100 ng/mL培养基中呈指数生长,历时12个月,得到耐药细胞系命名为4T1/5-Fu。
1.2.2细胞药物敏感性实验(MTS)收集对数生长期细胞,计数,接种于96孔培养板中,于37℃、5%CO2培养箱中培养过夜。24 h后加入不同浓度的药物处理细胞,置于培养箱中孵育48 h后,每孔加入MTS(5 g/L)20μL,混匀后在培养箱中孵育2 h,最后在酶标仪上测定波长490 nm吸光度值(A490)。根据所测吸光度值计算出药物各浓度处理组的生存率及抑制率,并通过药物浓度和其抑制率的直线回归方程,得出耐药细胞系和亲本细胞系对药物的IC50值,计算细胞耐药指数(RI)=耐药细胞IC50/亲本细胞IC50。
1.2.3半定量PCR与实时荧光定量PCR提取细胞总RNA,参照Thermo的逆转录试剂盒和PCR扩增操作说明进行逆转录和PCR扩增。PCR条件为:98°C预变性2 min;98°C变性10 s,60°C退火10 s,72°C延伸50 s,循环28次;72°C再次延伸7 min,4°C无限循环。Real-time PCR:反应条件为:95℃预变性5 min;94℃变性1 min,58℃退火30 s,68℃延伸90 s,循环42次;72℃再次延伸10 min。依据2-△△Ct算法分析荧光定量PCR结果。各基因引物序列见表1。

表1 各基因引物序列
1.2.4细胞平板克隆实验取对数生长期的细胞,消化悬浮成单个细胞,分别以每孔200、400、600个细胞的数目接种到6孔板中,于细胞培养箱中培养1~2周,当出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗3次,再用甲醇固定30 min,去掉固定液,加1 mL结晶紫,染色15 min,然后吸去结晶紫,用流水缓慢洗,空气干燥。将6孔板置于一张带网格的白纸上,用肉眼直接计数克隆,计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%
1.2.5流式细胞仪检测细胞周期在对数生长期的细胞中加无血清1640培养基,培养过夜,同步化。消化并收集细胞,先用PBS漂洗3次,再用预冷的70%乙醇重悬细胞,置于-20℃冰箱固定过夜。离心弃固定液,PBS漂洗2次,加500μL细胞周期PI染色溶液,常温下避光孵育30 min,300目尼龙网过滤细胞后,上流式细胞仪分析。
1.2.6流式细胞仪检测CD44+CD24-亚群细胞 取对数生长期细胞,离心收集细胞,以PBS调整细胞浓度为1×106/mL。充分悬浮细胞后平均分为4管,一管加入CD24-APC和CD44-FITC抗体双染,一管加入CD24-FITC抗体,一管加入CD44-PE抗体单染,最后一管加入FITC及APC标记同型对照抗体,每106个细胞加入约10μL抗体,于冰上避光孵育30 min,离心后,用含1%胎牛血清预冷的PBS漂洗后重悬,上流式细胞仪检测。
1.3统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,两组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1细胞形态镜下观察
显微镜下观察乳腺癌4T1细胞及耐药细胞系4T1/5-Fu,可见耐药细胞变得狭长,细胞之间连接松散,并可见伪足形成(图1)。
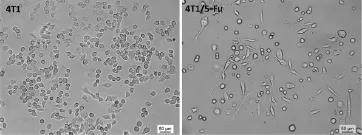
图1 显微镜观察细胞形态(40×)
2.2MTS检测4T1和4T1/5-Fu的药物敏感性
将4T1和4T1/5-Fu细胞经不同浓度的5-Fu、吉西他滨(GEM)、奥沙利铂(Oxaliplatin)、顺铂(cDDP)、平阳霉素(PYM)和多西紫杉醇(Pacilitaxel)作用48 h后,绘制剂量细胞存活曲线(图2),发现4T1/5-Fu相对亲本细胞4T1对5-Fu、GEM和cDDP耐药,RI分别为73.38、5.16和2.11,而对奥沙利铂、PYM和多西紫杉醇无明显耐药,RI分别为1.12、1.12和0.70。见表2。
2.3流式细胞术检测4T1和耐药细胞4T1/5-Fu细胞周期变化
采用流式细胞术分析4T1、4T1/5-Fu的细胞周期(图3),可见与亲本4T1细胞相比,耐药细胞4T1/5-Fu G0/G1期细胞数明显增多 (P<0.01),S期明显减少(P<0.01),G2/M期明显减少(P<0.01),提示耐药细胞4T1/5-Fu的增殖变慢,见表3。另外,在耐药细胞4T1/5-Fu中出现非整倍体细胞占14.19%。
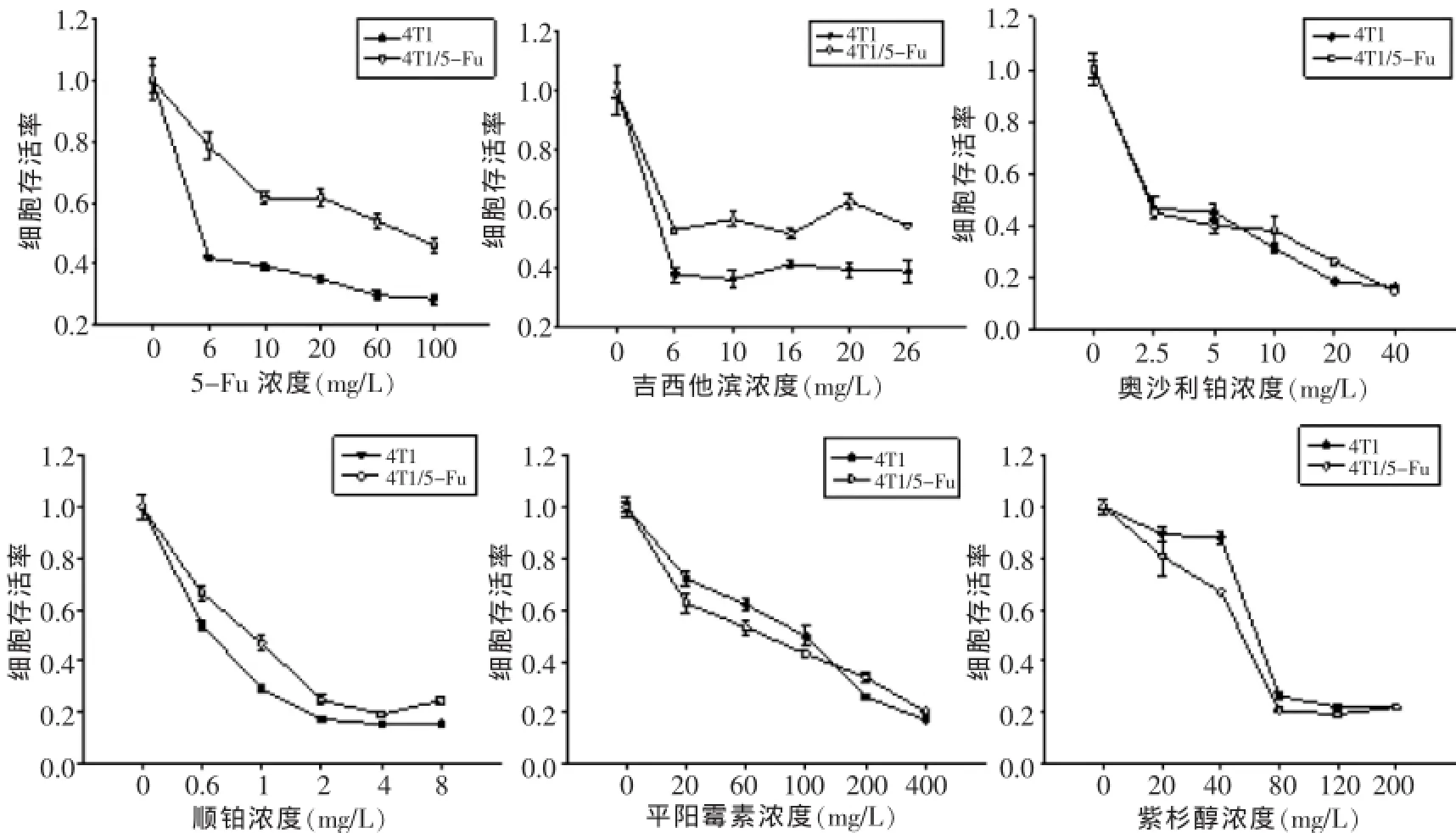
图2 4T1和4T1/5-Fu细胞对不同药物的生存曲线
表2 4T1和4T1/5-Fu细胞对不同药物的IC50值(mg/L,)

表2 4T1和4T1/5-Fu细胞对不同药物的IC50值(mg/L,)
?
2.4平板克隆实验检测4T1和耐药细胞4T1/5-Fu细胞增殖变化
平板克隆实验结果显示,4T1细胞的克隆数目明显多于4T1/5-Fu细胞,并且克隆的大小明显大于4T1/5-Fu细胞(图4),4T1/5-Fu细胞在获得耐药性后增殖能力和细胞群体依赖性较4T1细胞明显下降(P<0.01)。见表4。
2.5半定量和定量PCR检测5-Fu代谢相关酶类及药泵蛋白的变化
通过半定量PCR及实时荧光定量PCR检测4T1/ 5-Fu耐药细胞与4T1细胞5-Fu代谢相关酶类:二氢吡啶脱氢酶(dihydropyridine dehydrogenase,DPD)、胸苷激酶(thymidine kinase,TK)、乳清酸磷酸核糖转移酶(orotatephosphoribosyltransferase,OPRT)、胸腺嘧啶合成酶(thymidylate synthase,TS)、亚甲基四氢叶酸还原酶(methylenetetrahydrofolatereductase,MTHFR)及药泵蛋白多药耐药蛋白 1(multidrug resistance protein 1,MDR1)、多药耐药相关蛋白1(multidrug resistance-associated protein 1,MRP1)的表达变化,发现与4T1细胞相比,5-Fu合成代谢相关酶TK和OPRT在4T1/5-Fu细胞中表达水平明显下降(P<0.05),抑制合成代谢相关酶TS和MTHFR在4T1/5-Fu细胞中表达水平上升(P<0.05),而分解代谢相关酶DPD在4T1/5-Fu细胞与4T1细胞中都无表达;此外,药泵蛋白MDR1与MRP1在耐药细胞4T1/5-Fu中表达水平上升(P<0.05),提示长期5-Fu诱导导致的5-Fu体内合成代谢抑制,胞内药物浓度降低等改变参与了耐药的产生,见图5、表5。
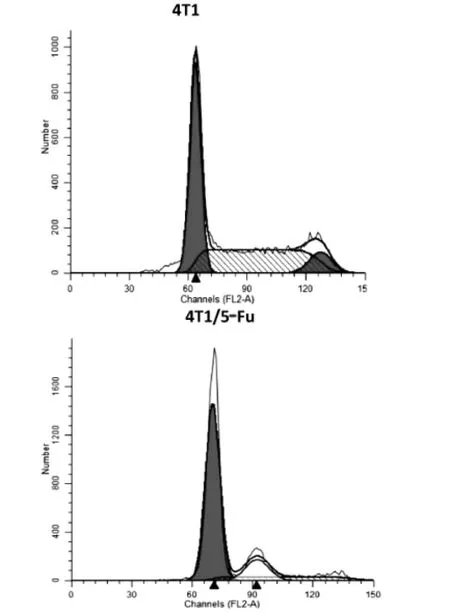
图3 流式细胞仪检测细胞周期的变化
表3 4T1和4T1/5-Fu细胞周期分布比较(%,)

表3 4T1和4T1/5-Fu细胞周期分布比较(%,)
细胞 G0/G1期 S期 G2/M期4T1 4T1/5-Fu P值45.36±0.93 85.31±0.64 <0.01 45.48±0.92 14.27±0.49 <0.01 9.16±0.08 0.42±0.26 <0.01

图4 平板克隆实验检测细胞增殖
表4 4T1和4T1/5-Fu细胞克隆数比较()

表4 4T1和4T1/5-Fu细胞克隆数比较()
细胞 接种细胞数200 400 600 4T1 4T1/5-Fu P值199±15 159±14 <0.01 359±16 243±13 <0.01 562±27 401±23 <0.01

图5 半定量和实时荧光定量PCR检测5-Fu代谢相关酶类及药泵蛋白表达情况

表5 4T1和4T1/5-Fu细胞5-Fu代谢相关酶类及药泵蛋白表达相对值
2.64T1和4T1/5-Fu细胞中CD44+CD24-乳腺癌干细胞亚群比例变化情况
运用流式细胞术检测4T1细胞与耐药细胞4T1/ 5FU中CD44+/CD24-干细胞亚群比例,结果显示,4T1/ 5-Fu细胞中CD44+/CD24-干细胞亚群比例高于4T1细胞,并且CD44分子表达量也明显高于4T1细胞,表明4T1/5-Fu中肿瘤干细胞比例增加(图6)。
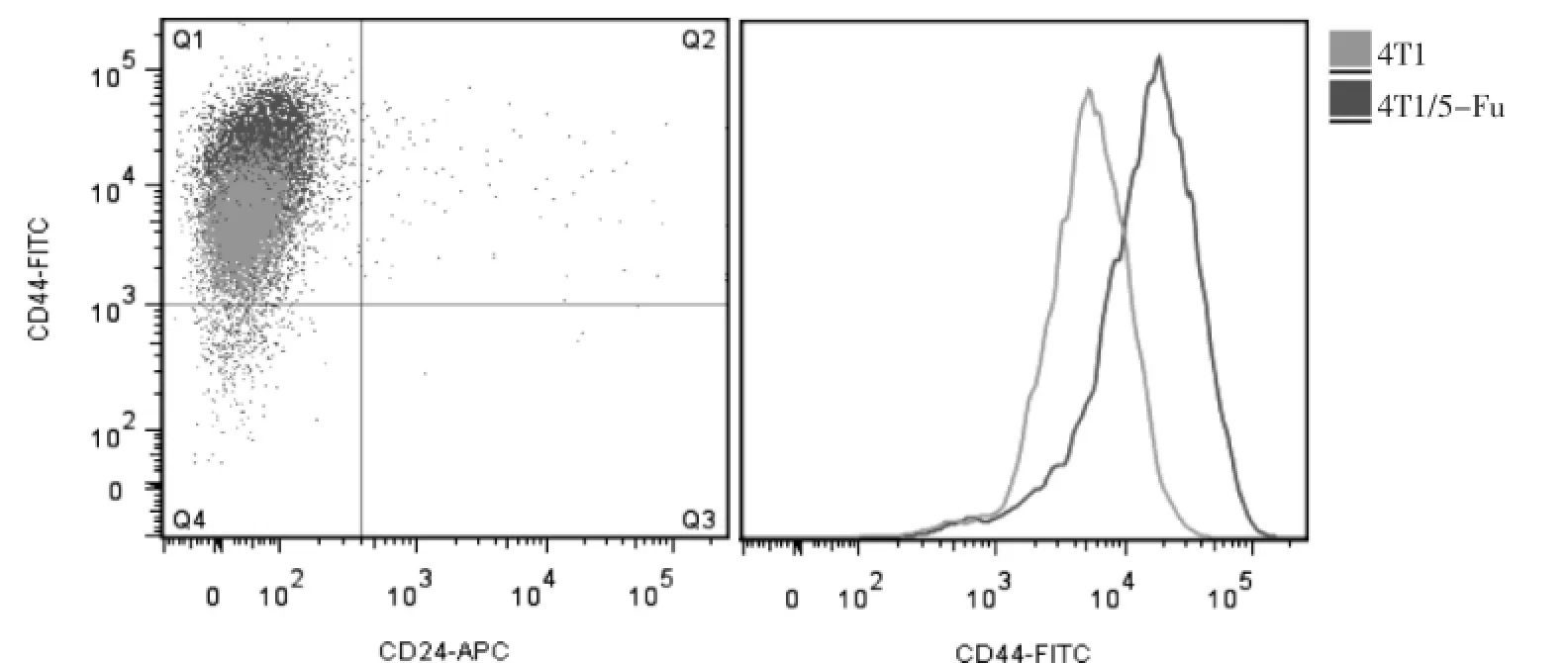
图6 流式细胞仪分析乳腺癌干细胞亚群比例
3 讨论
越来越多的研究提示肿瘤在机体中耐药的产生,不仅需要肿瘤细胞自身改变产生的耐药机制,也需要克服机体的抗肿瘤免疫效应机制[2-7],两者缺一不可,尤其是继发性耐药,化疗药物作用下肿瘤细胞与免疫微环境发生怎样的相互作用,导致耐药产生,是当前肿瘤学研究的前沿和热点。而目前广泛应用的裸鼠荷瘤模型,因本身小鼠的免疫系统缺陷,影响了体内研究免疫微环境与耐药产生关系的研究,而解决此问题亟需鼠源性的肿瘤耐药细胞模型。
5-Fu作为化疗常用药物,常用来体外筛选多药耐药细胞系。5-Fu进入细胞内一方面通过TK、OPRT等限速酶,即通过一系列的酶促反应形成活性代谢产物干扰DNA和RNA的合成,促进细胞凋亡[8-9]。另一方面通过体内多种酶,如DPD等产生分解代谢,抑制其毒性[10-11]。另外,在细胞内 5-Fu代谢活性产物FdUMP可与dUMP竞争性结合TS,使的TS失活,抑制了 DNA的合成,从而抑制肿瘤细胞的生长和增殖。此外MTHFR是叶酸代谢过程中的关键酶[12-13],其功能包括将还原型叶酸转变为5-甲基四氢叶酸(5-MTHF),从而使FdUMP、TS与还原型叶酸组成的三元复合物减少,削弱5-Fu的抗肿瘤作用,已有报道这两种基因与化疗的敏感性密切相关[14-16]。本研究中耐药细胞系 4T1/5-Fu中5-Fu合成代谢限速酶TK、OPRT明显降低,而TS和MTHFR表达升高,这些减弱了5-Fu对核酸合成的影响,可能是耐药产生的重要机制之一[17-18]。而对于在4T1/5-Fu细胞和4T1细胞中都未检测到5-Fu分解代谢关键酶DPD的表达,提示可能在4T1细胞中存在新的分解代谢途径。另外,本研究发现细胞药泵蛋白MDR1、MRP1表达在耐药细胞系中明显升高,这提示药泵蛋白也参与了耐药的产生。
值得注意的是,与敏感细胞4T1相比,耐药的4T1/5-Fu细胞在发生耐药的同时,流式细胞仪检测发现4T1/5-Fu细胞中肿瘤干细胞样群细胞增多。多个研究证明,肿瘤干细胞是肿瘤耐药产生的重要机制[19-20],因此在体外长期药物的筛选下,存活的多是具有干细胞特性的细胞群,其表现为增殖减慢,这与本研究观察到的耐药细胞系的细胞周期中G0/G1期细胞增多、G2/M期细胞明显减少、细胞增殖明显减慢等现象相符。而在体内肿瘤干细胞是怎样与免疫系统相互作用,躲避免疫系统的杀伤,亟需进一步研究,对于提高肿瘤的临床治疗效果有重要意义。
[1]Bruchard M,Mignot G,DerangèreV,et al.Chemotherapytriggered cathepsin B release in myeloid-derived suppressor cells activates the Nlrp3 inflammasome and promotes tumor growth[J].Nat Med,2013,19(1):57-64.
[2]Fridman WH,Pagès F,Sautès-Fridman C,et al.The immune contexture in human tumours:impact on clinical outcome[J].Nat Rev Cancer,2012,12(4):298-306.
[3]Vivier E,Ugolini S,Blaise D,et al.Targeting natural killer cells and natural killer T cells in cancer[J].Nat Rev Immunol,2012,12(4):239-252.
[4]Seton-Rogers S.Tumour immunology:dendritic cellswitch[J]. Nat Rev Cancer,2012,12(4):230.
[5]Ko JS,Bukowski RM,Fincke JH.Myeloid-derived suppressor cells:a novel therapeutic target[J].Current Oncology Reports,2009,11(2):87-93
[6]Almand B,Clark JI,Nikitina E,et al.Increased production of immature myeloid cells in cancer patients:a mechanism of immunosuppression in cancer[J].J Immunol,2001,166(1):678-689.
[7]Bruchard M,Mignot G,DerangèreV,et al.Chemotherapytriggered cathepsin B release in myeloid-derived suppressor cells activates the Nlrp3 inflammasome and promotes tumor growth[J].Nat Med,2013,19(1):57-64.
[8]Mattison LK,Soong R,Diasio RB.Implications ofdihydropyrimidine dehydrogenase on 5-fluorouracil pharmacogenetics and pharmacogenomics[J].Pharmacogenomics,2002,3(4):485-492.
[9]Gardiner SJ,Begg EJ,Robinson BA.The effect of dihydropyrimidine dehydrogenase deficiency on outcomes with fluorouracil[J].Adverse Drug Reactions&Toxicological Reviews,2002,21(1-2):1-16
[10]邢洪存.5-FU代谢相关酶检测及临床意义[D].长春:吉林大学,2006.
[11]Longley DB,Harkin DP,Johnston PG.5-fluorouracil:mechanisms of action and clinical strategies[J].Nat Rev Cancer,2003,3(5):330-338.
[12]Hosokawa A,Yamada Y,Shimada Y,et al.Prognostic significanceof thymidylate synthase in patients with metastatic colorectal cancer who receive protracted venous infusions of5-fluorouracil[J].Int JClin Oncol,2004,9(5):388-392.
[13]余之刚,甄军辉,贾红英,等.胸苷酸合成酶,胸腺嘧啶脱氧核苷磷酸化酶及二氟嘧啶脱氢酶的表达与乳腺癌预后的相关性[J].中华医学杂志,2006,86(22):1558-1563.
[14]姜超,孙正,许哲,等.5-FU相关代谢酶表达与胃癌化疗敏感性的关系[J].南京医科大学学报:自然科学版,2011,31(12):1815-1819.
[15]张为家.TGFβ2经Snail介导的上皮-间质转化(EMT)在乳腺癌5-FU耐药中的作用及机制[D].长沙:中南大学,2012.
[16]Salonga D,Danenberg KD,Johnson M.Colorectal tumors responding to 5-fluorouracil have low gene expression levels of dihydropyrimidine dehydrogenase,thymidylate synthase,and thymidine phosphorylase[J].Clin Cancer Res,2000,6(4):1322-1327.
[17]金川,张永晖,彭美芳,等.MTHFR基因多态性与肺癌的相关性研究[J].中华肿瘤防治杂志,2007,14(12):888-891.
[18]Sohn KJ,Cmxford R,Yates Z,et al.Effect of the methylenetetrahydrofolate reductase C677T polymorphism on chemosensitivity of colon and breast cancer cells to 5-fluorouracil and methotrexate[J].Journal of the National Cancer Institute,2004,96(2):134-144.
[19]Calcagno AM,Salcido CD,Gillet JP,et al.Prolonged drug selection of breast cancer cells and enrichment of cancer stem cell characteristics[J].Natl Cancer Inst,2010,102(21):1637-1652.
[20]Dean M.ABC transporters,drug resistance,and cancer stem cells[J].Mammary Gland BiolNeoplasia,2009,14(1):3-9.
Establishment of mouse breast cancer multidrug resistant cell line and prelim inary study on the resistant mechanism
DENG YingenZHANG Zhijie▲LU MinyingJIA XiaotingPENG CongHE Zhimin
Cancer Center and Cancer Research Institute,Cancer Hospital,Guangzhou Medical University Guangzhou Cancer Treatment Key Laboratory of Translational Medicine,Guangdong Province,Guangzhou510095,China
Objective To construct 5-fluorouracil(5-Fu)resistant murine breast cancer cell line,in order to provide cell model for study of relationship between breast cancer multidrug resistant and immune microenvironment in vitro. M ethods 4T1 cells were exposed in stepwise escalatingconcentration of 5-Fu to develop the resistant cell line 4T1/5-Fu. And the chemosensitivity and proliferation of 4T1/5-Fu were determined by MTS and colony forming experiments,respectively.Furthermore,real-time RT-PCR and semi quantitative PCR were used to measure expression levels of 5-Fu related genes,such as TS,MTHFR,TK,OPRT,DPD,MDR1,MRP1.In addition,cell cycle and the proportion of CD44+CD24-stem cell subsets were evaluated by flow cytometry.Results Comparing to 4T1 cells,the resistance index of 4T1/5-Fu cells to 5-Fu,GEM,cDDP was increased.The results showed that compared with 4T1 cells,the expression levels of TK and OPRT were significantly decreased(P<0.05),while TS,MTHFR,MDR1 and MRP1 were remarkably increased in 4T1/5-Fu cells(P<0.05).Flow cytometry assay showed that the propotion of tumor stem cells CD44+CD24-was evidently increased in 4T1/5-Fu cells than that of 4T1 cells.Conclusion This article has successfully constructed multidrug resistant cell line 4T1/5-Fu,whose resistance may be associated with up-regulation of the 5-Fu metabolic enzymes,drug pump proteins expression and tumor stem cells percentage change.
Tumor resistance;4T1 cell;5-fluorouracil;Tumor stem cells
R329.24
A
1673-7210(2016)04(b)-0009-06
国家自然科学基金资助项目(81302291)。
邓印根(1987-),男,硕士;研究方向:肿瘤治疗耐受的分子机制。
▲
(2016-01-10本文编辑:程铭)
