替米沙坦联合氨氯地平对乳鼠转化生长因子-β1及Ⅰ、Ⅲ型胶原蛋白表达的影响
2016-11-28马香芹卢泽恺赵汴霞杨红梅
马香芹 刘 芳 卢泽恺 赵汴霞 赵 娜 马 莉 杨红梅
(河南医学高等专科学校,河南 郑州 451191)
替米沙坦联合氨氯地平对乳鼠转化生长因子-β1及Ⅰ、Ⅲ型胶原蛋白表达的影响
马香芹 刘 芳 卢泽恺 赵汴霞 赵 娜 马 莉 杨红梅
(河南医学高等专科学校,河南 郑州 451191)
目的 探讨替米沙坦联合氨氯地平对血管紧张素(Ang)Ⅱ诱导的乳鼠心肌成纤维细胞增殖及细胞中转化生长因子(TGF)-β1、Ⅰ、Ⅲ型胶原蛋白表达的影响。方法 对Wistar乳鼠心肌成纤维细胞行体外原代及传代培养,将培养好的细胞分为5组:对照组(加入15%小牛血清DEME培养液)、AngⅡ组(15%小牛血清DEME培养液+1×10-6mol/L AngⅡ),替米沙坦组(TE组,在AngⅡ组基础上加入10 μmol/L替米沙坦),氨氯地平组(AM组,AngⅡ组基础上加入1 μmol/L氨氯地平)及替米沙坦+氨氯地平组(TE+AM组),在AngⅡ组基础上加入10 μmol/L替米沙坦+1 μmol/L氨氯地平),每组3份。观察各组细胞不同时期增殖情况及TGF-β1、Ⅰ、Ⅲ型胶原蛋白、p27蛋白表达情况。结果 与对照组相比,AngⅡ组心肌成纤维细胞在S期时增殖率较高,而在G0/G1期、G2/M期时增殖率下降(P<0.05),TGF-β1、Ⅰ、Ⅲ型胶原蛋白、p27蛋白表达水平显著升高(P<0.05)。与AngⅡ组相比,TE组、AM组及TE+AM组心肌成纤维细胞在S期时增殖率显著下降,而在G0/G1期、G2/M期时增殖率升高(P<0.05),TGF-β1、Ⅰ、Ⅲ型胶原蛋白、p27蛋白表达水平下降(P<0.05),其中TE+AM组心肌成纤维细胞在G0/G1期、G2/M期增殖较TE组、AM组显著,而TGF-β1、Ⅰ、Ⅲ型胶原蛋白、p27蛋白表达水平低于TE组、AM组。结论 替米沙坦联合氨氯地平能有效抑制AngⅡ诱导的心肌成纤维细胞增殖,其可能机制与抑制TGF-β1、Ⅰ、Ⅲ型胶原蛋白及p27蛋白过度表达有关。
替米沙坦;氨氯地平;血管紧张素Ⅱ;心肌成纤维细胞
心肌纤维化是心肌功能衰退的重要表现,与心源性猝死、心力衰竭及心律失常等多种终末期心脏病发生有密切的关系〔1〕。成纤维细胞活化是心肌纤维化的重要诱因,而在这过程中血管紧张素(Ang)Ⅱ起到重要的作用。Ang Ⅱ可刺激心肌胶原合成,促使成纤维细胞增殖,介导心肌纤维化〔2〕。近年有研究指出,转化生长因子(TGF)-β1异常表达是引起心肌纤维化的重要通路,在心肌纤维化中起到重要的作用〔3〕。替米沙坦属于Ang Ⅱ受体拮抗剂,能有效预防心肌纤维化;氨氯地平可有效舒张血管,改善心肌供血并抑制心肌纤维化〔4〕。本研究将探讨替米沙坦联合氨氯地平对AngⅡ诱导的乳鼠心肌成纤维细胞增殖及细胞中TGF-β1、Ⅰ、Ⅲ型胶原蛋白表达的影响。
1 材料与方法
1.1 实验动物 新生1~3 d Wistar 大鼠,雌雄不拘,由河南省实验动物中心提供。
1.2 实验试剂 新生胎牛血清(北京雅安达生物技术有限公司);DEME培养液(美国Sigma公司);AngⅡ(北京方程生物科技有限公司);胰蛋白酶消化液(北京索莱宝科技有限公司);双抗(青霉素+链霉素);Ⅰ、Ⅲ型胶原蛋白试剂盒〔卡迈舒(上海)生物科技有限公司〕;p27蛋白试剂盒(上海抚生实业有限公司);TGF-β1(美国 HyClone 公司);替米沙坦(生产日期:H201502036;北京万生药业有限责任公司);氨氯地平(批号:H201509123;苏州第壹制药有限公司)。
1.3 实验仪器 光学显微镜(型号:DMLP-MP30;日本RICOH公司);微量移液器(20、200、1 000 μl)购自DragonMed公司;台式微量离心机(型号H1650-W;美国Sigma公司);高速冷冻离心机(型号:A1330103;美国Beckman公司);台式低温高速离心机(型号:TD-35M/TD35;德国Hettich公司);CO2培养箱(型号:MCO-20AIC;德国Heraeus公司);电子天平(BP211D型;Sartorius公司);酶联免疫检测仪(型号:DG-3022型,国营华东电子管厂产品);流式细胞仪(规格型号:1401-X-20R;贝克曼库尔特有限公司)。
1.4 方法
1.4.1 心肌成纤维细胞的培养 在无菌操作条件下取30只Wistar乳鼠,将其左心室取出并剪碎成1 mm3大小,应用磷酸盐缓冲液(PBS)反复冲洗3次,依次加入0.01% Ⅱ型胶原酶、0.08%胰蛋白酶消化10 min,反复消化直至组织块消失。收集悬浮液离心过滤后留取沉淀物,并置于37℃ CO2培养箱中恒温培养。由于成纤维细胞与心肌细胞生长时间不同,采用差速贴壁2 h获得心肌成纤维细胞,待细胞生长至满瓶后应用0.25% 胰酶消化传代培养,培养2~3代后收集成纤维细胞。
1.4.2 心肌成纤维细胞鉴定 将传代成纤维细胞接种至玻片中,待细胞爬满玻片后,将玻片取出,PBS冲洗3遍,室温下加入4% 多聚甲醛固定,恒温水浴箱中孵育30 min,采用山羊血清封闭,室温下以1∶50加入鼠抗波形蛋白抗体工作液恒温孵育3 h,依次加入经生物素标记山羊抗小鼠免疫球蛋白及辣根酶标记链霉卵白素工作液于室温孵育。应用二氨基联苯胺(DAB)显色剂显色,PBS冲洗,苏木素复染,酒精梯度脱水,中性树脂封固,并于倒置显微镜下观察心肌成纤维细胞形态。
1.4.3 样本分组及处理 对照组(加入15%小牛血清DEME培养液),AngⅡ组(15%小牛血清DEME培养液+1×10-6mol/L AngⅡ),替米沙坦组(TE组,在AngⅡ组基础上加入10 μmol/L替米沙坦),氨氯地平组(AM组,AngⅡ组基础上加入1 μmol/L氨氯地平)、替米沙坦+氨氯地平组(TE+AM组,在AngⅡ组基础上加入10 μmol/L替米沙坦+1 μmol/L氨氯地平),每组3份。
1.4.4 心肌成纤维细胞增长率测定 预处理各组细胞,应用流式细胞仪测定各组在G0/G1期、S期、G2/M期细胞悬浮液,测定前以70%酒精固定细胞,加入500 μl碘化丙啶综合染色,加蒸馏水至100 ml,室温下放置30 min后上机检测,重复操作3次。
1.4.5 免疫荧光法测定TGF-β1 蛋白 每组随机抽取3张已制备好的心肌组织石蜡切片,酒精梯度脱水,PBS洗3遍,室温下加入3% H2O2,常温下孵育10 min抑制内源性过氧化物酶活性,PBS冲洗3遍,明火低温加热8 min,待水温下降至室温后采用PBS洗涤3次,依次加入10%山羊血清常温下孵育30 min,加入一抗4℃孵育过夜后PBS冲洗,加入荧光二抗,室温避光孵育30 min,PBS冲洗。样品制备完毕后于荧光分析仪下观察细胞蛋白表达情况。
1.4.6 免疫组化法测定TGF-β1蛋白 取100 mg细胞捣碎,4℃ 14 000 r/min 离心10 min,留取上清液,准确移取样液10 μl加入SDS-PAGE凝胶电泳孔中,转膜、封闭,加入兔抗鼠TGF-β1与β-actin,4℃封闭过夜,应用经辣根过氧化氢酶标记的山羊抗鼠免疫球蛋白,曝光、扫描,计算蛋白表达量。
1.4.7 酶联法测定Ⅰ、Ⅲ型胶原蛋白、p27蛋白 酶联反应板每孔中依次加入100 μl待测样品,加入100 μl一抗工作液,应用PBS反复洗涤反应板,37℃中恒温加热60 min,每孔加入100 μl酶标抗体工作液,37℃下水浴加热30 min,每孔加入100 μl终止液混匀,应用酶标仪于450 nm处测定吸光值。

2 结 果
2.1 心肌成纤维细胞鉴定 在倒置显微镜下可观察到心肌成
纤维细胞胞体较大,胞质透明,细胞呈梭形,细胞核呈椭圆形,通常含2~3个核,细胞核内出现棕黄色颗粒,细胞纯度高达98%,见图1。
2.2 各组心肌成纤维细胞不同细胞时期增殖情况 与对照组相比,AngⅡ组心肌成纤维细胞在S期时增殖率较高,而在G0/G1期、G2/M期时增殖率下降(P<0.05);与AngⅡ组相比,TE组、AM组及TE+AM组心肌成纤维细胞在S期时增殖率显著下降,而在G0/G1期、G2/M期时增殖率升高(P<0.05),见表1。
2.3 免疫荧光法检测 TGF-β1 蛋白表达 与对照组相比,AngⅡ组心肌组织中TGF-β1 蛋白荧光强度较强,而TE组、AM组及TE+AM组心肌成纤维细胞荧光强度依次减弱,见图2。

图1 倒置显微镜下观察心肌成纤维细胞(×200)

组别G0/G1期S期G2/M期对照组70.23±1.2815.33±1.2017.33±2.12AngⅡ组57.22±2.451)33.58±4.691)9.33±2.451)TE组62.33±3.251)2)23.22±2.481)2)12.25±1.781)2)AM组62.98±3.351)2)23.69±2.381)2)12.63±1.691)2)TE+AM组65.98±2.181)2)3)4)19.33±3.141)2)3)4)14.66±2.021)2)3)4)
与对照组比较:1)P<0.05;与AngⅡ组比较:2)P<0.05;与TE组比较:3)P<0.05;与AM组比较:4)P<0.05

各图右上为抗-TGF-β1免疫荧光,右下为 DAPI 染色核定位,左侧为右上与右下重叠图图2 免疫荧光法检测 TGF-β1 蛋白表达
2.4 免疫组化法测定TGF-β1 蛋白 与对照组相比,AngⅡ组心肌组织中TGF-β1 蛋白表达较强,而TE组、AM组及TE+AM组心肌成纤维细胞表达随剂量增加而减弱,条带灰度依次减弱,见图3和表2。
2.5 各组TGF-β1、Ⅰ、Ⅲ型胶原蛋白及p27蛋白定量分析 如表2所示,与对照组相比,AngⅡ组心肌成纤维细胞TGF-β1、Ⅰ、Ⅲ型胶原蛋白、p27蛋白表达水平显著升高(P<0.05)。与AngⅡ组相比,TE组、AM组及TE+AM组TGF-β1、Ⅰ、Ⅲ型胶原蛋白、p27蛋白表达水平下降(P<0.05),其中TE+AM组心肌成纤维细胞中TGF-β1、Ⅰ、Ⅲ型胶原蛋白、p27蛋白表达水平低于TE组、AM组(P<0.05),见表2。

表2 各组TGF-β1、Ⅰ、Ⅲ型胶原蛋白及p27蛋白定量分析
与对照组相比:1)P<0.05;与AngⅡ组相:2)P<0.05;与TE组相比:3)P<0.05;与AM组相比:4)P<0.05
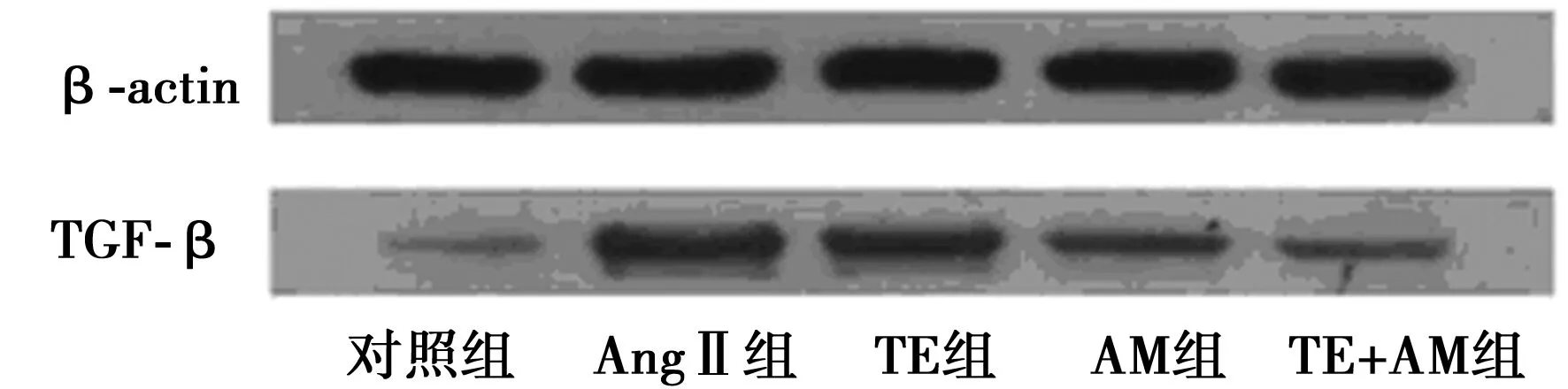
图3 免疫组化法测定TGF-β1 蛋白
3 讨 论
心肌纤维化是多种心脏病的终末期表现,在多种血管活性物质及促纤维化因子的作用下可激活多种细胞信号通路,进而引起心肌细胞过度增殖并引起胶原蛋白沉积,增加心室僵硬度,进一步促进心肌纤维化发生〔5〕。
Ang Ⅱ具有收缩血管作用,与Ang Ⅱ受体结合可促进基底细胞底物磷酸化,并可通过酪氨酸酶途径激活丝裂霉素活化蛋白酶,从而促进及介导心肌成纤维化细胞增殖及转化,在心脏病终末期病变中起到重要的作用。本研究结果进一步表明AngⅡ可破坏细胞外基质稳态,促进胶原蛋白沉积,从而诱导心肌细胞纤维化〔6〕。
相关研究指出〔7〕,TGF-β1可通过诱导纤维连接蛋白、蛋白寡糖及纤维胶原等成分从而诱导心肌细胞纤维化。本研究结果与Wang等〔8〕一致,表明TGF-β1可通过介导信号通路从而诱发心肌成纤维细胞增殖。p27是TGF-β1及其细胞外因子诱导细胞生长停滞的主要介质,在AngⅡ诱导下p27可参与血管、心脏细胞肥大,并可引起动脉粥样硬化〔9〕。张平等〔10〕研究指出,AngⅡ可通过上调p27蛋白表达使得静止期的血管平滑肌细胞从G1期进入S期,从而介导细胞平滑肌增生。
替米沙坦作为新一代非肽类AngⅡ受体拮抗剂,能与AngⅡ受体结合从而阻断肾素-血管紧张素-醛固酮系统(RAS)活性,抑制AngⅡ分泌〔11〕。宋占春等〔12〕研究认为,替米沙坦能有效降低心肌病大鼠炎症标志物及心肌蛋白的表达,并能有效降低心肌相关胶原蛋白表达,抑制心肌纤维化。氯氨地平属于钙离子抑制剂,能有效改善心肌供血,降低心脏压力负荷,抑制心肌胶原蛋白生成,进而抑制心肌纤维化〔13〕。
本研究结果显示替米沙坦联合氯氨地平能有效抑制TGF-β1表达,阻断Ⅰ、Ⅱ胶原蛋白、p27蛋白生成。这可能由于替米沙坦与氯氨地平联合应用时能起到药物协同效果,能有效抑制RAS活性,从而抑制AngⅡ分泌,进而改善心肌纤维化。
1 刘 源,唐其柱,李利娜,等.橙皮素对血管紧张素Ⅱ诱导的心肌成纤维细胞增殖及胶原蛋白合成的抑制作用〔J〕.中华医学杂志,2014;94(36):2852-6.
2 阮 滔,何学华,刘丽萍,等.黄芪对心肌成纤维细胞增殖及分泌转化生长因子-β1的影响〔J〕.临床儿科杂志,2015;33(3):284-6.
3 胡哲夫,唐其柱,刘 源,等.橙皮素对转化生长因子-β1诱导心肌成纤维细胞增殖的影响〔J〕.疑难病杂志,2015;14(4):376-9.
4 马香芹,黄显峰,卢泽恺,等.替米沙坦联合氨氯地平对肾性高血压大鼠左室重构的对比研究〔J〕.天津医药,2013;43(11):1114-6.
5 曾 翼,赵 诚,王 霏,等.二苯乙烯苷对TGF-β1诱导新生大鼠心肌成纤维细胞增殖和胶原合成的影响及其机制〔J〕.中国药科大学学报,2014;45(3):362-7.
6 Ding Y,Peng Y,Li J,etal.Gualou Xiebai Decoction prevents myocardial fibrosis by blocking TGF-beta/Smad signalling〔J〕.J Pharm Pharmac,2013;65(9):45-8.
7 Beaumont J,López B,Hermida N,etal.microRNA-122 down-regulation may play a role in severe myocardial fibrosis in human aortic stenosis through TGF-β1 up-regulation〔J〕.Clin Sci,2014;126(8):96-8.
8 Wang W,Wang B,Lu Q,etal.Inhibition of high-mobility group box 1 improves myocardial fibrosis and dysfunction in diabetic cardiomyopathy〔J〕.Int J Cardiol,2014;172(1):45-8.
9 Lu Y,Liu J,Bi X,etal.Pyridostigmine ameliorates cardiac remodeling induced by myocardial infarction via inhibition of the transforming growth factor-β1/tgf-β1- activated kinase pathway〔J〕.J Cardiovasc Pharmacol,2014;63(5):82-8.
10 张 平,张再伟,邵 靓,等.TGF-β1、CTGF对慢性心衰心肌纤维化进展的临床意义〔J〕.昆明医科大学学报,2014;35(11):45-7.
11 Krmer J,Niemann M,Liu D,etal.Two-dimensional speckle tracking as a non-invasive tool for identification of myocardial fibrosis in Fabry disease〔J〕.Eur Heart J,2013;34(21):45-8.
12 宋占春,白静慧,张丽莉,等.替米沙坦对大鼠急性心肌梗死后炎症反应及纤维化的干预机制〔J〕.中华医学杂志,2014;94(33):2628-33.
13 Li M,Jiang Y,Jing W,etal.Quercetin provides greater cardioprotective effect than its glycoside derivative rutin on isoproterenol-induced cardiac fibrosis in the rat〔J〕.Can J Physiol Pharmacol,2013;91(11):120-4.
〔2016-04-12修回〕
(编辑 李相军)
河南省2014年基础与前沿技术研究计划项目(142300410467)
杨红梅(1969-),女,硕士,教授,主要从事氧化与抗氧化研究。
马香芹(1977-),女,硕士,副教授,主要从事心血管药理学研究。
R969.4
A
1005-9202(2016)20-4963-03;
10.3969/j.issn.1005-9202.2016.20.010
