人源DNA错配修复基因和微卫星不稳定与老年结肠癌的相关性
2016-11-28郝东明杨景文
郝东明 李 丽 杨景文
(天津市人民医院肛肠外科,天津 300121)
人源DNA错配修复基因和微卫星不稳定与老年结肠癌的相关性
郝东明 李 丽 杨景文
(天津市人民医院肛肠外科,天津 300121)
目的 探讨老年结肠癌患者肿瘤组织的人源DNA错配修复基因(hMLH)1和微卫星不稳定性型情况。方法 通过甲基化特异性聚合酶链反应(PCR)检测老年结肠癌样本中基因hMLH1启动子甲基化修饰的异常;研究结肠癌样本中微卫星标志物杂合型丢失频率;确定结肠癌患者中的变异与结肠癌的相关性。结果 18.0%的老年结肠癌样本中出现hMLH1启动子高甲基化;51.2%出现微卫星标记D22S280或D22S929的杂合型缺失,25.6%出现D22S280和D22S929的杂合型缺失,并且杂合型缺失与基因hMLH1启动子高甲基化状态相互独立。基因hMLH1启动子甲基化可作为独立的变量预测肿瘤的预后。结论 根据hMLH1启动子甲基化状态对高甲基化状态结肠癌进行分类,基因 hMLH1可作为微卫星不稳定型老年结肠癌潜在预后标志物之一。
结肠癌;微卫星不稳定;人源DNA错配修复(hMLH)1;启动子甲基化;甲基化特异性聚合酶链反应(PCR)
结肠癌发展的遗传学机制主要包括以下三类:染色体不稳定性(CIN)、微卫星不稳定性(MSI)及甲基化〔1〕。但是,结肠癌遗传变异在临床表型方面尚不清楚。上述三种机制都表现为突变的积累,然而每一种机制都涉及不同的基因,从而表现出不同的临床病理特征。而且,上述三种结肠癌的发生机制可能会同时发生,从而具有不同的预后〔2〕。基因启动子区域的超甲基化可沉默基因表达,在癌症的发生中起到重要作用〔3〕。通过候选基因甲基化分析,对肿瘤进行分类,分析的效能与所选用的候选基因及候选基因的数目相关。在已有的候选基因分析中,都包括人源DNA错配修复基因(hMLH)1,其在癌症发生中主要因被表观修饰失活〔4〕。hMLH1的编码蛋白参与DNA复制复合体的组成〔4〕。hMLH1启动子甲基化异常是散发型MSI结肠癌主要发病机制〔4〕。hMLH1启动子甲基化高频出现于结肠癌样本中,与多个肿瘤分子标志物(如hMLH1表达和MSI及肿瘤临床病理表型(肿瘤患者的性别、肿瘤部位、肿瘤分期)相关〔5〕。因此,hMLH1启动子甲基化是散发型结肠癌甲基化修饰子表型的主要分子标志物。BRAF蛋白在Ras/Raf/MEK/ERK信号通路中主要介导细胞生长信号。其中,BRAF(V600E)在结肠癌中高频出现10%~20%,现已证明BRAF(V600E)与错配修复机制(MMR)缺陷相关〔6〕。此外,BRAF基因变异与MSI相关〔7〕。微卫星不稳定型肿瘤特有的临床病理特征表现为近端肿瘤、高龄、黏液样病理特征,并且侵袭性稍弱〔6〕。本研究对老年结肠癌样本尝试基因分型,并且结合临床预后的数据鉴定与预后相关的分子标志物。
1 资料与方法
1.1 一般资料 我院2010年9月至2014年6月48例结肠癌样本及5例正常样本。患者均知情同意并得到本院伦理委员会的批准。典型结肠癌20例,非典型结肠癌16例和退变型结肠癌12例。年龄≥60岁,平均(66.04 ±4.57)岁,男女性别比为2.33∶1。其中43例以血液来源的样本作为配对的正常样本。所有患者无遗传病史及其他肿瘤病史。冰冻组织及血液样本经蛋白酶K处理后抽提基因组DNA。
1.2 DNA重亚硫酸盐修饰 DNA中未甲基化的胞嘧啶经修饰变为尿嘧啶,随后用甲基化及非甲基化特异性的引物进行扩增。5 μg DNA按照CpG基因组DNA修饰试剂盒的说明书进行修饰,并溶于25 ml溶解缓冲液。
1.3 甲基化特异性聚合酶链反应(PCR)检测 用于鉴定hMLH1非甲基化的引物为5 -TTT TGA TGT AGA TGT TTT ATT AGG GTT GT-3 (正向)和5 -ACC ACC TCA TCA TAA CTA CCC ACA-3(反向);鉴定hMLH1甲基化的引物为5 -ACG TAG ACG TTT TAT TAG GGT CGC-3(正向) 和5 -CCT CAT CGT AAC TAC CCG CG-3(反向)。PCR反应体系:50 ng重亚硫酸修饰的DNA,0.3 mmol/L引物,0.2 mmol/L dNTPs,2.5 mmol/L MgCl2,1×PCR 缓冲液和0.4 U AmpliTaq Gold DNA聚合酶。反应条件:95℃ 10 min,(94℃ 30 s,55℃ 30 s,72℃ 50 s,循环34次),72℃ 10 min。5 μl样品用于电泳检测。所有PCR反应以CpGenome通用DNA为阳性对照,同时设置相应阴性对照。
1.4 微卫星分析 所选用的微卫星标志为BAT25,BAT26,D2S123,D5s346,D17S250,humAR,CTT16,D19S210和DHFRP2。MSI根据重复的核苷酸数目进行分类。目前,单核苷酸重复标志BAT25,BAT26分别位于基因MSH2的第5个内含子和癌基因c-Kit的第16个内含子;二核苷酸重复标志物D2S123(chr2:51288467-51288646),D5S346(chr5:112213624-112213748),D17S250(17:37152092-37152243)是结肠癌MSI分析中最常用到的微卫星标志。这5个微卫星标志即为Bethesda标志,已得到众多研究的验证。除此之外,为了增加微卫星检测的灵敏性,还引入几个最近鉴定出的微卫星标志物humAR、CTT16(chr11:40651848-40652024)、D19S210(chr19:57019539-57019883) 和DHFRP2。除了微卫星标记,使用两个多态性标记(D22S280和D22S929)进行杂合型丢失分析。引物5'端经过HEX和FAM荧光标记。PCR反应体系(20 μl基因组DNA 50 ng):0.3 mmol/L引物,0.2 mmol/L dNTPs,2.5 mmol/L MgCl2,1×PCR 缓冲液Ⅱ和0.4 U AmpliTaq Gold DNA聚合酶(Applied Biosystems),PCR反应条件:95℃ 10 min(94℃ 30 s,55℃ 30 s,72℃ 50 s,循环34次),72℃ 10 min。
MSI的存在与否按照已有的定义进行鉴定,LOH则通过半定量分析等位基因不稳定性QLOH =(t1/t2)/(n1/n2)、t1、t2、n1、n2分别是肿瘤样本和正常样本的两个等位基因的峰值。当QLOH远大于1时表示杂合型获得;QLOH为0和1分别表示杂合型完全丢失及杂合型保留;QLOH<0.4表示检测到杂合型丢失。
1.5 统计学方法 采用SPSS13.0统计软件进行χ2检验和Pearson相关性检验。
2 结 果
2.1 甲基化分析 正常样本未发生甲基化,但是18%的肿瘤样本表现出hMLH1启动子高甲基化。其中hMLH1启动子高甲基化在典型结肠癌、非典型结肠癌及退行性结肠癌中发生的比例分别为5.0%(1/20),12.5%(2/16),50.0%(6/12)。hMLH1启动子高甲基化与结肠癌的分型具有显著相关性(P=0.014),见图1,表1。

表1 样本甲基化特异性PCR(MSP)和微卫星分析的结果

续表1 样本甲基化特异性PCR(MSP)和微卫星分析的结果
M:甲基化;-:未甲基化;L:杂合型丢失;R:杂合型保持;NI:没有信息;ND:未分析

PCR条带的出现与否即代表这个样本中是否存在相应的等位基因;U:未甲基化修饰;M:甲基化修饰图1 结肠癌患者hMLH1甲基化特异性PCR结果
2.2 微卫星分析 对43对结肠癌样本(具有配对的血液来源的正常样本),包括典型结肠癌15例、非典型结肠癌14例和退行性结肠癌12例进行微卫星分析。选用结肠癌样本中已知的9个微卫星标记进行分析,发现样本M28在D17S250,CTT16和DHFRP2出现了MSI,但是样本M28并未发生基因hMLH1启动子甲基化;样本M31在D19s210出现MSI,并且发生了基因hMLH1启动子的甲基化,见图2,表1。部分样本的MSI独立于hMLH1启动子的甲基化,可能由于肿瘤患者群体的异质性。肿瘤的发生是多步骤多因素的,因此,这部分样本可能存在其他hMLH1功能丢失的机制,如基因突变、基因拷贝数改变等。数据挖掘发现基因hMLH1 在肿瘤中有超过20%的功能丢失性突变。同义突变并不影响hMLH1编码产物只占其突变总数的(13.04%),其他的突变类型包括无义突变11.07%、错义突变57.31%、移码插入突变3.17%、非移码插入突变1.97%、移码缺失突变9.89%及其他突变3.56%;其中移码突变和无义突变极可能导致基因功能丢失,超过突变总数20%。
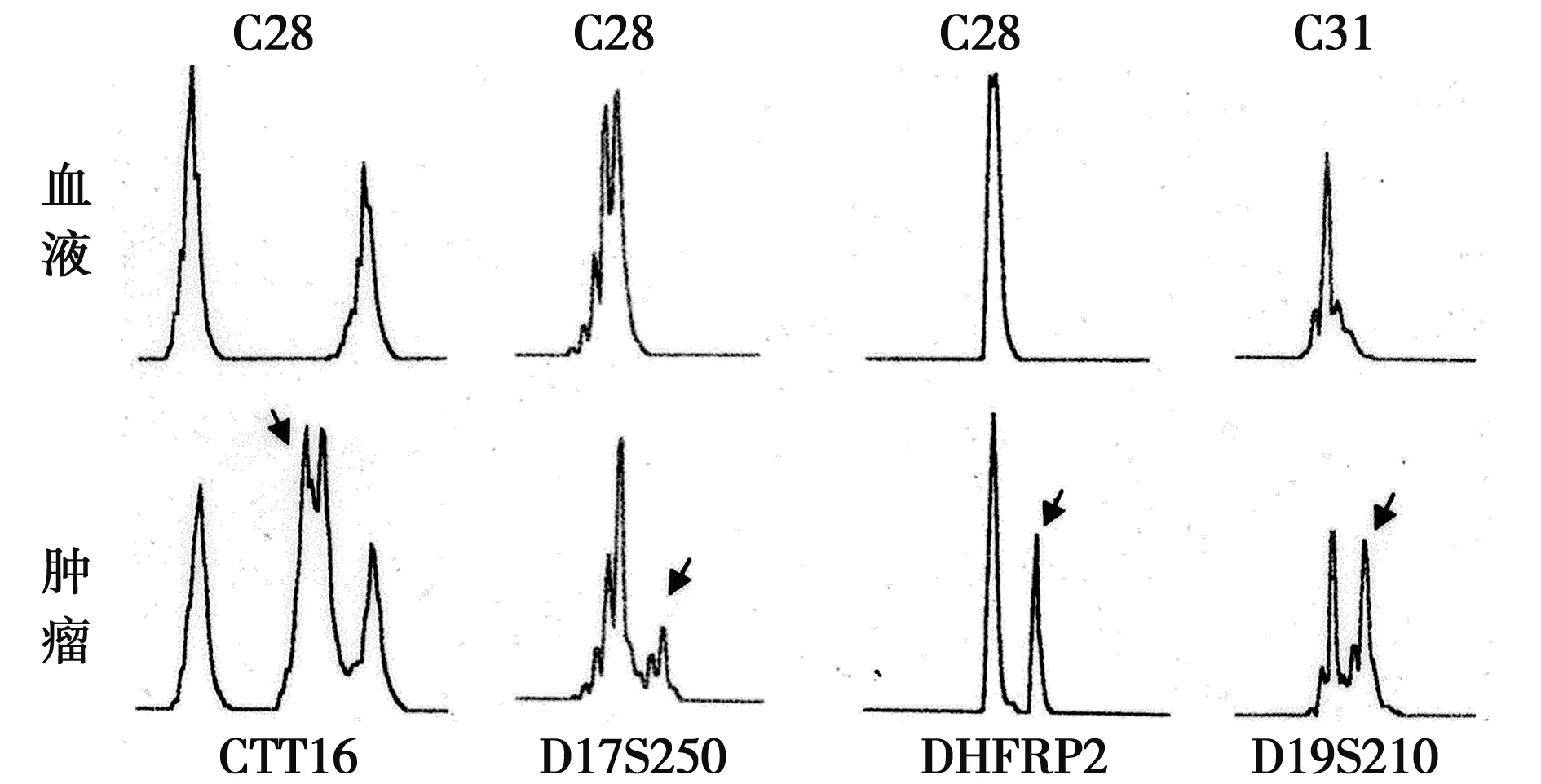
箭头所示为甲基化等位基因图2 2例结肠癌样本在4个位点出现MSI
2.3 杂合型丢失分析 肿瘤的发生中涉及癌基因突变通常会出现二次打击事件。其中杂合型丢失即为其中一种。上述43对结肠癌样本中进行D22S280和D22S929的杂合型丢失分析,结果显示D22S280和D22S929至少有一个可以有效显示杂合型状态。同时,51.2%(22/43)的样本至少出现一个标记(D22S280或 D22S929)杂合型丢失,25.6%(11/43)的样本出现标记D22S929和D22S280杂合型丢失。其中典型性结肠癌、非典型性结肠癌及退行性结肠癌出现杂合型丢失的比例分别为40.0%,50.0%,64.3%。样本M28在D22S280表现出杂合型丢失。杂合型丢失与染色体22q及结肠癌的分类没有显著相关性,并且杂合型丢失与基因hMLH1甲基化无相关性(P>0.05),见图3,表1。结肠癌患者中微卫星标志物D22S280和D22S929杂合型丢失事件是独立于基因hMLH1甲基化。

杂合型丢失箭头所示图3 染色体22q两个标记的杂合型丢失
3 讨 论
MSI最先在结肠癌中发现,在其他肿瘤中也有报道〔8〕。除此之外,染色体不稳定性及基因启动子甲基化异常也能导致结肠癌发生〔9〕。癌症基因组研究计划通过分析MSI及hMLH1启动子高甲基化结肠癌所累及的基因,发现高频突变肿瘤与MSI-H的肿瘤表型很相似,具有CIN的结肠癌与甲基化表型结肠癌表型也有部分相似,其中MMR变异主要在MSI肿瘤中发挥作用。hMLH1启动子高甲基化则表现为基因表达水平的降低,从而导致功能的缺失〔1〕。数据显示在所有结肠癌样本中,基因hMLH1发生改变的频率为25%〔3〕,而在MSI亚群中,基因hMLH1发生改变的频率上升为33%〔10〕。因此,基因hMLH1甲基化水平的改变可能早于MSI事件的发生。
本研究发现有些样本出现MSI表型可能是伴随着基因hMLH1启动子的超甲基化。然而,部分样本的MSI表型独立于基因hMLH1启动子甲基化水平的异常;这可能是由于患者之间的异质性,或是存在其他可能影响到DNA复制修复基因的功能丢失。基因hMLH1还与近端定位、低分化及基因BRAF的突变存在相关性,并且基因hMLH1的变异在年长患者中较高频出现,临床病理特征与高甲基化肿瘤临床病理特征表现出来的特征一致〔11〕,在含基因hMLH1变异的肿瘤也表现出高甲基化肿瘤的特征。因此,基因hMLH1可以作为区分高甲基化肿瘤的一个新的特征。在远端肿瘤中,基因hMLH1的变异与预后呈负相关〔12〕。另外,结肠癌甲基化方式的不同对预后的影响也不同〔13〕。已有研究表明,通过甲基化状态进行预后预测的效果随着选用甲基化标记的数目增加而增加〔14〕。hMLH1是无病生存率(DFS)的强预后因子,但是也有人发现甲基化与预后好的关联性只在结肠癌二期及三期中出现〔15〕。但是,同时具有hMLH1和MSI的肿瘤患者预后较差。根据MSI和甲基化状态对肿瘤进行分类可以有效反映细胞的遗传及表观遗传状态。因此以hMLH1状态对肿瘤进行分类,可以得到DFS预后较好的一类肿瘤。综上,MSI可以作为进一步区分基因hMLH1高甲基化肿瘤的标志。通过结合MSI及hMLH1高甲基化的特征对肿瘤进行精确分型更加有助于临床治疗和预后。
1 邢玉林,皋岚湘,高小玲.MSI-H单发性肠癌中hMLH1基因启动区甲基化测定在癌症临床诊断和早期治疗中的作用和意义〔J〕.中国现代医学杂志,2005;15(24):3730-2.
2 李 聪,王志敏,赵 江,等.结直肠癌不同发病部位的临床及分子特征差异〔J〕.中华预防医学杂志,2014;48(12):1078-82.
3 Miladi-Abdennadher I,Abdelmaksoud-Damak R,Ayadi L,etal.Aberrant methylation of hMLH1 and p16INK4a in Tunisian patients with sporadic colorectal adenocarcinoma〔J〕.Biosci Rep,2011;31(4):257-64.
4 李建华,吕 申,石先哲,等.hMLH1和hMSH2基因在胃癌易感人群中的突变〔J〕.世界华人消化杂志,2010;18(11):1121-6.
5 Li X,Yao X,Wang Y,etal.MLH1 promoter methylation frequency in colorectal cancer patients and related clinic pathological and molecular features〔J〕.PLoS One,2013;8(3):e59064.
6 谢发君,陈玮莹,温博贵.微卫星不稳定性与结肠癌的研究进展〔J〕.癌变·畸变·突变,2007;19(1):82-4.
7 Weisenberger DJ,Siegmund KD,Campan M,etal.CpG island methylator phenotype underlies sporadic microsatellite instability and is tightly associated with BRAF mutation in colorectal cancer〔J〕.Nat Genet,2006;38(7):787-93.
8 MacDonald ND,Salvesen HB,Ryan A,etal.Frequency and prognostic impact of microsatellite instability in a large population-based study of endometrial carcinomas〔J〕.Cancer Res,2000;60(6):1750-2.
9 陈 龙,李贞茂,陈和平,等.p16、hMLH1基因甲基化与结肠癌的相关性研究〔J〕.胃肠病学和肝病学杂志,2011;20(3):216-9.
10 Brim H,Abu-Asab MS,Nouraie M,etal.An integrative CGH,MSI and candidate genes methylation analysis of colorectal tumors〔J〕.PLoS One,2014;9(1):e82185.
11 Kim JH,Rhee YY,Bae JM,etal.Subsets of microsatellite-unstable colorectal cancers exhibit discordance between the CpG island methylator phenotype and MLH1 methylation status〔J〕.Mod Pathol,2013;26(7):1013-22.
12 Bae JM,Kim JH,Cho NY,etal.Prognostic implication of the CpG island methylator phenotype in colorectal cancers depends on tumour location〔J〕.Br J Cancer,2013;109(4):1004-12.
13 顾术东,张 曙,茅国新.结肠腺癌组织hMLH1和hMSH2表达与FOLFOX方案辅助化疗疗效相关性分析〔J〕.中华肿瘤防治杂志,2014;21(2):131-4.
14 An B,Kondo Y,Okamoto Y,etal.Characteristic methylation profile in CpG island methylator phenotype-negative distal colorectal cancers〔J〕.Int J Cancer,2010;127(9):2095-105.
15 Han SW,Lee HJ,Bae JM,etal.Methylation and microsatellite status and recurrence following adjuvant FOLFOX in colorectal cancer〔J〕.Int J Cancer,2013;132(9):2209-16.
〔2015-02-25修回〕
(编辑 苑云杰)
天津市卫生局科技基金(No.2012KY20)
杨景文(1981-),男,博士,主治医师,主要从事结直肠肿瘤研究。
郝东明(1978-),男,硕士,主治医师,主要从事结直肠肿瘤研究。
R735.3
A
1005-9202(2016)20-4947-04;
10.3969/j.issn.1005-9202.2016.20.004
